Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Protección Vegetal
versión On-line ISSN 2224-4697
Rev. Protección Veg. vol.31 no.2 La Habana mayo-ago. 2016
ARTÍCULO ORIGINAL
Interacción de Trichoderma harzianum Rifai y Azadirachta indica A. Juss. sobre una población de Meloidogyne spp. en plántulas de Solanum lycopersicum L.
Interaction of Trichoderma harzianum Rifai and Azadirachta indica A. Juss on a population of Meloidogyne spp. in seedlings of Solanum lycopersicum L.
Yoerlandy Santana BañosI*, Armando del Busto ConcepciónI, Mayra G. Rodríguez HernándezII, Frank L. RodríguezI, Dagoberto Maqueira HernándezI
IDepartamento de Ciencias Agropecuarias. Universidad de Pinar del Río (UPR). Calle Martí No. 300 e/ 27 de noviembre y González Alcorta, Pinar del Río, Cuba.
IILaboratorio de Nematología Agrícola. Dirección de Sanidad Vegetal. Centro Nacional de Sanidad Agropecuaria (CENSA). Apartado 10. San José de las Lajas, Mayabeque, Cuba.
RESUMEN
El experimento se desarrolló en las áreas de investigación de la Universidad de Pinar del Río, Cuba, con el objetivo de evaluar el efecto de Trichoderma harzianum Rifai (cepa A-34) y extracto acuoso de nim (Azadirachta indica A. Juss.) sobre una población de Meloidogyne spp. en plántulas de tomate (Solanum lycopersicum L.) cultivar «PR-92». Se utilizaron 50 bolsas de polietileno con capacidad de 900 g de sustrato, que se conformó mediante una mezcla de suelo Ferralítico Amarillento Lixiviado, turba y cascarilla de arroz (70:20:10). Los tratamientos estudiados fueron: plántulas + T. harzianum + nematodos, plántulas + nim + nematodos, plántulas + T. harzianum + nim + nematodos, control (plántulas + nematodos) y control absoluto (plántulas sin inoculaciones). La inoculación de nematodos se dirigió a la rizofera, a razón de 0,5 J2-huevos por gramo de sustrato. Se produjo reducción del índice de agallamiento en 53,5%; 38,5% y 61,5% para los tratamientos donde se aplicó T. harzianum, nim y su combinación, respectivamente, con diferencias significativas con relación al control. También se lograron incrementos significativos en la longitud y el diámetro del tallo y la masa seca de las plántulas de tomate con la aplicación de T. harzianum y su combinación con extracto acuoso de nim.
Palabras clave: nematodos formadores de agallas, tomate, Trichoderma, nim.
ABSTRACT
The experiment was conducted in research areas of the University of Pinar del Rio, Cuba, with the objective of evaluating the effect of Trichoderma harzianum Rifai (strain A-34) and an aqueous extract of neem (Azadirachta indica A. Juss.) on a population of Meloidogyne spp. in tomato seedlings (Solanum lycopersicum L.) cultivar «PR-92». Fifty polyethylene bags with a capacity of 900 g of substrate containing a mixture of lixiviated yellowish ferralitic soil, peat, and rice hulls (70: 20: 10) were used. The treatments were: seedlings + T. harzianum + nematodes, seedlings + neem + nematodes, seedlings + T. harzianum + neem + nematodes, control (seedlings + nematodes) and an absolute control (uninoculated seedlings). Nematode inoculation was directly in the rhizosphere at 0.5 J2-eggs per gram of substrate. Significant galling index reductions of 53.5%; 38.5% and 61.5 % in the treatments with T. harzianum, neem or their combination, respectively, were observed. Significant increases were also achieved in the length and stem diameter and the dry mass of tomato seedlings with the application of T. harzianum and its combination with aqueous neem extract.
Key words: root knot nematodes, tomato, Trichoderma, neem.
INTRODUCCIÓN
La producción y la calidad del fruto en el cultivo del tomate (Solanum lycopersicum L.) dependen del control adecuado de hongos y bacterias fitopatógenos, de los insectos que dañan follaje y frutos, de los nematodos que se alimentan de las raíces y las malezas que compiten con las plantas por la humedad y los nutrientes (1). Los nematodos fitoparásitos se encuentran en un lugar cimero entre las plagas que afectan este cultivo a escala mundial y nacional, en especial los formadores de agallas (Meloidogyne spp.). Según Moosavi (2), los fitonematodos causan pérdidas del 12,3 % en la agricultura en el mundo y, cerca del 5% de las pérdidas, se atribuye a Meloidogyne spp. Lamovšek et al. (3) los consideran como plagas importantes de muchas plantas cultivadas y Mukhtar et al. (4) refirieron que el nematodo de la raíz Meloidogyne incognita ((Kofoid y White) Chitwood) es uno de los principales factores limitantes que afectan el crecimiento y el rendimiento, porque causan un estimado de 100 mil millones dólares de pérdida por año en todo el mundo.
Lo anterior implica que, en la actualidad, la utilización de medios biológicos y los preparados botánicos deben tomar auge como alternativas no químicas en el manejo de Meloidogyne spp., pues reducen el impacto económico-ambiental y, con frecuencia, favorecen el desarrollo de las plantas.
Una de las alternativas biológicas para el manejo de Meloidogyne spp. es el uso de hongos antagonistas del género Trichoderma. Según Sharon et al. (5), se evaluaron varias especies de Trichoderma como agentes de control biológico contra los nematodos en diversos cultivos y condiciones experimentales; entre los mecanismos involucrados se destacan el parasitismo, la lisis enzimática, la antibiosis y la resistencia inducida. Preethi et al. (6) informaron que el aumento del crecimiento de la planta, el rendimiento y otros parámetros podrían atribuirse a la liberación de sustancias promotoras del crecimiento por Trichoderma spp. y otros agentes biológicos estudiados en el control de M. incognita.
La utilización de plantas con propiedades o características que favorecen la regulación de poblaciones de Meloidogyne spp. constituye una práctica muy promisoria para el manejo de esta plaga en las condiciones de Cuba, sobre todo por el desarrollo alcanzado en la agricultura urbana. Un ejemplo de planta con actividad nematicida es Azadirachta indica A. Juss., planta perteneciente a la familia Meliaceae, con actividades biológicas de amplio uso en la agricultura para el manejo de plagas de insectos (7) y nematodos (8). En Cuba, Gómez et al. (9) lograron disminuir los índices de agallamiento provocados por Meloidogyne spp. en condiciones semicontroladas mediante la biodesinfección con su follaje. Estudios recientes de Rodríguez et al. (10) arrojaron una reducción significativa de la población de M. incognita mediante la desinfección de suelo infestado con diferentes dosis de desechos de A. indica. Zareena y Vanita (11) lograron una reducción de formación de agallas y masas huevos en 70,3% y 59,3%, respectivamente, con el empleo del extracto de torta de A. indica con T. harzianum.
Teniendo en cuenta lo antes expuesto, la investigación se realizó con el objetivo de evaluar el efecto de T. harzianum (cepa A-34) y el extracto acuoso de A. indica sobre una población de Meloidogyne spp. en plántulas de tomate.
MATERIALES Y MÉTODOS
El experimento se desarrolló en el Laboratorio de Microbiología y áreas de investigación de la Universidad de Pinar del Río, en los 22°24´48´´ N y 83°41´16´´ W. Las variables meteorológicas durante la investigación se caracterizaron por temperaturas entre 18,2 y 28,9°C, con una media de 22,6°C, y humedad relativa promedio de 79%. Como planta hospedante se utilizó S. lycopersicum cv. «PR-92». Se establecieron cinco tratamientos distribuidos en un diseño completamente al azar, los cuales se muestran en la Tabla 1.
Como sustrato se empleó una mezcla de suelo Ferralítico Amarillento Lixiviado, Típico, Cuarcítico (12), turba y cascarilla de arroz para obtener una proporción de 70: 20: 10. Para la desinfección del sustrato se usó formol (4%) y se dejó tapado durante 72 horas, mientras que la turba y la paja de arroz se esterilizaron en estufa (121ºC) durante cuatro horas. Se utilizaron 50 bolsas de polietileno con capacidad de 900 g de sustrato.
La siembra se realizó de forma manual, colocando cuatro semillas por bolsa y se dejaron solo dos plántulas por bolsa después de la germinación con uniformidad en la elección de las mismas.
El biopreparado de T. harzianum (cepa A-34) se obtuvo en el Centro de Reproducción de Entomófagos y Entomopatógenos (CREE) de «La Conchita», municipio Pinar del Río. El biopreparado poseía una concentración de 1,9 x 109 esp.ml-1 (100 % de pureza y 96 % de viabilidad). La aplicación de Trichoderma se realizó tres días antes de la siembra y otras dos aplicaciones cada siete días, empleando una dosis de 10 ml x bolsa de solución conidial-1, obtenida a partir de una proporción de 25 g.l-1 del biopreparado con agua.
Para la preparación del extracto acuoso de nim se usó el follaje de la planta, que fue recolectado de árboles de los organopónicos del reparto Calero en Pinar del Río. El follaje se sometió a un proceso de secado en condiciones ambiente, a la sombra, hasta perder entre 90 y 95% de humedad. La preparación se realizó en recipiente de vidrio, se garantizó 50 g de follaje triturado por litro de agua durante 8 h; posteriormente, se filtró la solución obtenida y se aplicaron 15 ml x bolsa-1 cinco días después de la germinación y otras dos aplicaciones cada siete días.
El inóculo se obtuvo siguiendo la metodología de Hussey y Barker (13). Para obtener juveniles y huevos de nematodo agallero, se tomaron muestras de suelo y raíces de tomate infestado con nematodos procedentes de una finca próxima a las áreas de la Universidad. Para obtener el inóculo se sembraron, en ese suelo infestado, plantas indicadoras (Cucurbita spp.) y se esperó el tiempo prudencial para obtener suficiente población de nematodos. El análisis de las raíces permitió determinar la presencia de M. incognica y Meloidogyne sp. en menor medida. La aplicación del inóculo se realizó en la zona de la rizosfera cinco días después de la germinación y se garantizó 0,5 J2-huevos por gramo-1 de suelo en cada bolsa.
Las evaluaciones se realizaron 35 días después de la germinación, momento en que se extrajeron 10 plántulas de cada tratamiento y se procesaron en el Laboratorio de Microbiología de la Universidad de Pinar del Río; en ellas se cuantificaron el índice de agallamiento (IA) a través de la metodología de Taylor y Sasser (14), así como la longitud y el diámetro del tallo (cm), el número de hojas, la masa fresca total, foliar y radical (g) y la masa seca total, foliar y radical (g).
Los datos obtenidos se sometieron a un Análisis de Varianza Simple (ANOVA) y al método de comparación de rangos múltiples de Duncan; se aceptaron diferencias significativas para p£0.05. También se realizó el análisis de componentes principales. Se empleó el programa estadístico SPSS para Windows, versión 21.0.
RESULTADOS Y DISCUSIÓN
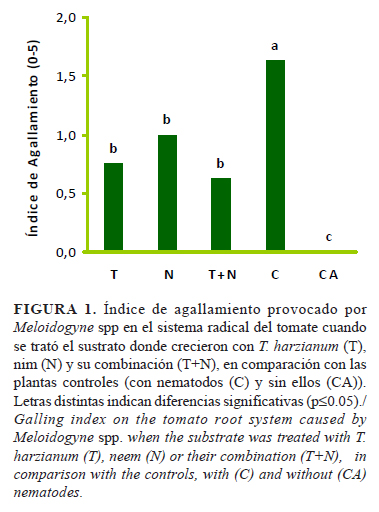
Se evidenciaron efectos supresores de T. harzianum (cepa A-34), el extracto acuoso de nim y su combinación sobre la población de Meloidogyne spp. al reducir el índice de agallamiento en 53,5%; 38,5% y 61,5%, respectivamente, con diferencias significativas respecto al control (Fig. 1). Estos resultados coinciden con los obtenidos por Zareena y Vanita (11), quienes constataron la reducción del número de agallas y masas de huevos en 70,3% y 59,3%, respectivamente, con el empleo del extracto de torta de nim y T. harzianum. Otros autores, como Kumar et al. (15), lograron reducir el número de agallas y ootecas, así como el grado de infestación en los tratamientos donde se empleó T. harzianum comparado con el control.
Moosavi (2) y Almeida et al. (16) encontraron una reducción significativa en el número de agallas provocadas por M. javanica cuando utilizaron preparados de nim.
Los tratamientos provocaron la existencia de diferencias significativas en la longitud y el diámetro del tallo para los tratamientos con T. harzianum y su combinación con nim respecto al control. El número de hojas por plantas no arrojó diferencias significativas entre los tratamientos (Tabla 2).
Con relación al empleo del extracto acuoso de nim, no se encontró interferencia sobre el crecimiento de las plántulas, incluso arrojó un incremento de 13,2 % respecto al control para el diámetro del tallo. Resultados similares obtuvieron Almeida et al. (16), pues informan un incremento en la longitud del tallo para los tratamientos con diferentes formas de utilización de preparados de nim en plantas de tomate inoculadas con M. javanica.
La reducción de la longitud del tallo en las plántulas infestadas con Meloidogyne spp. y no tratadas (C), respecto a las plantas sanas (CA), corroboraron los criterios de Jahanshahi et al. (17), quienes observaron una reducción significativa de la longitud del tallo principal en Olea europaea L., con valores de 37,6% y 10,7% en plantas que se inocularon con M. javanica y M. incognita, respectivamente, en comparación con las plantas no infestadas.
Los resultados sugieren la existencia de un efecto positivo de las aplicaciones de T. harzianum y su combinación con nim sobre el crecimiento de las plántulas de tomate, independientemente de la infestación por Meloidogyne spp., pues los índices de agallamiento alcanzados resultaron bajos para provocar consecuencias sobre el crecimiento; razón por la que solo se constataron diferencias significativas para la longitud del tallo entre los tratamientos control y control absoluto.
Los resultados coincidieron con los criterios de que M. incognita puede ser controlado mediante el uso de los agentes biológicos y botánicos que, a su vez, aumenta el rendimiento y el crecimiento de las plantas (11). Hernández-Ochandia et al. (18) informaron que la aplicación de T. asperellum cepa Ta.90 atenuó el efecto negativo de M. incognita en parámetros como son la altura, el diámetro del tallo, el número de hojas y la masa fresca aérea de plantas de tomate. Asimismo, Stewart y Hill (19) plantearon que las especies de Trichoderma pueden inducir cambios en la morfología de la planta y su desarrollo.
No se produjeron diferencias significativas para las variables masa fresca total, foliar y radical en los tratamientos con T. harzianum, su combinación con nim y control absoluto (Tabla 3), con medias superiores al nim y al control que no difieren entre ellos. La masa seca total arrojó un incremento de 14,25% y 8,18% en los tratamientos con T. harzianum y su combinación con nim, respectivamente, con relación al control absoluto. También se destaca una reducción de la masa seca total en las plantas tratadas con nim (25,8%), aunque sin diferencias significativas con el control absoluto, lo que podría descartar un efecto fitotóxico del extracto acuoso sobre el crecimiento de las plantas de tomate.
Los resultados coincidieron con los de Preethi et al. (6), quienes informaron recientemente que en los tratamientos donde se aplicó T. harzianum se produjeron incrementos en la masa fresca y seca total de las plantas al comparar el agente biológico con el control. Sin embargo, Kumar et al. (15) reportaron valores inferiores de masa fresca en tratamientos con T. harzianum respecto al control en plantas de quimbombó (Abelmoschus esculentus L.).
Stewart y Hill (19) informaron que el aumento de la raíz y/o biomasa foliar es la expresión más común de la promoción del crecimiento inducida por especies de Trichoderma, aunque también se reportaron cambios en la morfología de la planta y el desarrollo.
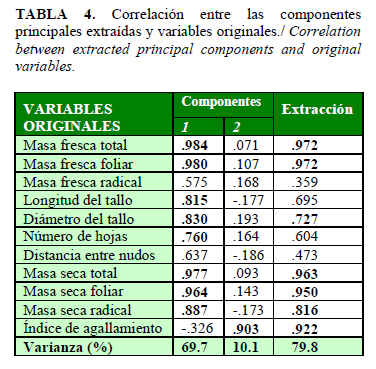
A continuación se expone el análisis de componentes principales (Tabla 4), donde se obtuvieron dos nuevas variables que explican el 79,8% de la varianza de los resultados. Se evidenció que la primera componente está determinada por las variables originales masa fresca total y foliar, masa seca, longitud y diámetro del tallo y número de hojas; con esta componente se muestran correlaciones positivas fuertes (£70%), mientras que el índice de agallamiento arrojó una correlación negativa débil (-32,6%). Lo anterior sugiere que las variables de crecimiento en las plántulas de tomate cv. PR-92 no mostraron una afectación significativa ante el índice de agallamiento, aspecto que puede estar relacionado con los bajos índices obtenidos. Por otra parte, la segunda componente está determinada por el índice de agallamiento, con una correlación positiva fuerte (90,3%).
Los resultados evidenciaron efectos positivos de T. harzianum y el extracto acuoso de nim sobre la regulación de Meloidogyne spp. y el crecimiento de las plántulas de tomate, sobre todo cuando se utilizaron de forma combinada, lo que sugiere continuar profundizando en la utilización de estos biopreparados como alternativas que ofrecen distintas bondades cuando se utilizan en el manejo de nematodos fitoparásitos.
REFERENCIAS
1. Csizinszky AA, Schuster DJ, Jones JB, Van Lenteren JC. Crop protection. En: Tomatoes. Crop production science in horticulture series. Ep Heuvelink (ed.). CABI publisher, 2005. pp. 199.
2. Moosavi MR. Efecto nematicida de algunos polvos herbales y sus extractos acuosos sobre Meloidogyne javanica. Nematropica. 2012;42(1):48-56.
3. Lamovšek J, Urek G, Trdan J. Biological control of root-knot nematodes (Meloidogyne spp.): Microbes against the Pests. Acta agriculturae Slovenica. 2013;101(2):263-275.
4. Mukhtar T, Arshad M, Zameer M, Naveed M. Evaluation of resistance to root-knot nematode (Meloidogyne incognita) in okra cultivars. Crop Protection. 2014;56(1):25-30.
5. Sharon E, Chet I, Spiegel Y. Trichoderma as Biological Control Agent. En K. Davies and Y. Speigel (Eds.). Biological Control of plant parasitic nematodes: Building coherence between microbial ecology and molecular mechanisms. Progress in Biological Control.11. DOI 10.100 7/978-1-4020-9648-8_8. Springer Science+ Business Media, 2011, pp. 183-201.
6. Preethi DM, Bommalinga S, Pavithra RS, Ravichandra NG, Reddy BMR, Syeda S. Evaluation of various bio-agents for their efficacy against Meloidogyne incognita on growth and development of tuberose (Polianthes tuberosa L.). Global Journal of Bio-science and Biotechnology. 2016;5(1):125-127.
7. Jabran K, Farooq M, Cheema ZA, Wahid A, Siddique KHM. The role of allelopathy in agricultural pest Management. Pest Manag Sci. 2011;67:493-506.
8. Salar J, Shervin H, Kamran R, Ali E. Comparing neem extract with chemical control on Fusarium oxysporum and Meloidogyne incognita complex of tomato. Advances in Environmental Biology. 2011. Code: 7IRAN Date: Jul 1.
9. Gómez L, Rodríguez MG, Díaz-Viruliche L, González E, Wagner F. Evaluación de materiales orgánicos para la biofumigación en instalaciones de cultivos protegidos para el manejo de Meloidogyne incognita. Rev Protección Veg. 2006;21(3):178-185.
10.Rodríguez MG, Gómez L, Hernández-Ochandía D, Enrique R, Miranda I, Pino O. Efecto de la biodesinfección con residuos de nim (Azadirachta indica A. Juss) sobre población de Meloidogyne spp. en suelo. Rev Protección Veg. 2012;27(3):197-201.
11.Zareena SK, Vanita V. Root-knot disease and its management in brinjal. Global Journal of Bio-science and Biotechnology. 2014;3(1):126-127.
12.Hernández A, Pérez JM, Bosch D, Rivero L. Nueva Versión de Clasificación Genética de los Suelos de Cuba. AGRINFOR, Cuba. 1999.
13.Hussey RS, Barker KB. A comparison of methods for colleting inocula of Meloidogyne spp. including a new technique. Plant Disease Report. 1973;57:1025-1028.
14.Taylor AL, Sasser JB. Biology, Identification and control of root-knot nematodes (Meloidogyne species). 111. Dept. Pl. Pathol. N. C. State Univ, Raleigh. 1978.
15.Kumar V, Singh AU, Jain RK. Comparative efficacy of bioagents as seed treatment for management of Meloidogyne incognita infecting okra. Nematol Medit. 2012;40:209-211.
16.de Almeida FA, Petter FA, Siqueira VC, Alcântara F, Alves AU, Leite MLT. Preparation methods of plant extracts on Meloidogyne javanica in tomato. Nematropica. 2012;42:9-15.
17.Jahanshahi F, Sasanelli N, Hosseininejad SA, Tanha-Maafi Z. Effects of the root-knot nematodes Meloidogyne incognita and M. javanica on olive plants growth in glasshouse conditions. Helminthologia. 2014;51(1):46-52.
18.Hernández-Ochandía D, Rodríguez MG, Peteira B, Miranda I, Arias Y, Martínez B. Potencialidades de cepas nativas de Trichoderma asperellum Samuels para el manejo de Meloidogyne incognita (Kofoid & White) Chitwood. Rev Proteccion Veg. 2015;30 (2):139-147.
19.Stewart A, Hill R. Applications of Trichoderma in plant growth promotion. En: Gupta V.; Schmoll, Monika; Herrera-Estrella, A.; Upadhyay, R.; Druzhinina, Irina; Tuohy, Maria (Editors-Elsevier). Biotechnology and Biology of Trichoderma. 2014. pp 415-428.
Recibido: 13-3-2015.
Aceptado: 8-12-2015.
*Contacto para correspondencia: Yoerlandy Santana Baños. Correo electrónico: yoerlandy@upr.edu.cu.