Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Protección Vegetal
versión On-line ISSN 2224-4697
Rev. Protección Veg. vol.33 no.1 La Habana ene.-abr. 2018
ARTÍCULO ORIGINAL
Antagonismo in vitro de cepas de Trichoderma asperellum Samuels, Lieckfeldt & Nirenbergfrente a aislados de Fusarium spp.
In vitro antagonism of Trichoderma asperellum Samuels, Lieckfeldt & Nirenberg, against Fusarium spp. isolates
Yanisia Duarte-Leal1*, Lisset Pozo-Martínez2, Benedicto Martínez-Coca1*
1Laboratorio de Micología Vegetal, Grupo de Fitopatología, Centro Nacional de Sanidad Agropecuaria (CENSA), Apartado 10, San José de las Lajas, CP 32 700, Mayabeque, Cuba.
2Universidad de la Habana, Facultad de Biología, La Habana.
RESUMEN
El objetivo del trabajo fue determinar la actividad antagónica de 13 cepas de Trichoderma asperellum Samuels, Lieckfeldt & Nirenberg frente a dos aislamientos de Fusarium (FusariumdlaminiiMarasas, Nelson & Toussoun y Fusariumsolani (Martius) Appel & Wollenweber emend. Snyder & Hansen) procedentes de frijol (Phaseolus vulgaris L.). Se determinaron la antibiosis, la competencia por espacio y el micoparasitismo por el método de cultivo dual. Todas las cepas de T. asperellum evaluadas, con excepción de Ta. 78, inhibieron el crecimiento de los fitopatógenos a partir de las 48 h. Las cepas del antagonista, excepto Ta. 3 que se ubicó en la clase 2, se ubicaron en la clase 1 de la escala de Bell. Las cepas Ta.1 y Ta. 79 presentaron los mayores porcentajes de inhibición del crecimiento de los fitopatógenos, con valores máximos de 44 - 47 % y 41- 48,72 % para F.dlaminii y F.solani, respectivamente, y la mayor cantidad de interacciones hifales. Teniendo en cuenta los resultados obtenidos de los modos de acción, se seleccionaron a las cepas Ta. 1 y Ta. 79 como promisorias para el control biológico de este fitopatógeno.
Palabras clave: cultivo dual, fitopatógeno, modo de acción.
ABSTRACT
The objective of the work was to determine the antagonistic activity of 13 strains of Trichoderma asperellum Samuels, Lieckfeldt & Nirenberg against two isolates of Fusarium (Fusarium dlaminii Marasas, Nelson & Toussoun and Fusarium solani (Martius) Appel & Wollenweber emend Snyder & Hansen) of beans (Phaseolus vulgaris L.). Antibiosis, competition for space, and mycoparasitism were determined by the dual culture method. All strains of T. asperellum evaluated, with the exception of Ta. 78, inhibited the growth of phytopathogens after 48 h. The antagonist strains, except Ta. 3 that was placed in class 2, were grouped into class 1 of Bell´s scale. The Trichoderma strains showed the highest percentages of growth inhibition of the phytopathogens with the highest number of hyphal interaction types in Ta.1 with F. dlaminii (44- 47 %) and Ta.79 with F. solani (41- 48.72 %). According to the results of their mode of action, the strains Ta. 1 and Ta. 79 were selected as promising for the biological control of these phytopathogens.
Key words: dual culture, phytopathogens, action mode.
INTRODUCCIÓN
El frijol común (Phaseolus vulgaris L.) es la leguminosa más investigada en América Latina, por ser la fuente principal de proteínas y formar parte de los hábitos alimentarios de la población (1).
El rendimiento a nivel mundial del frijol en 2014 fue de 0,83 t.ha-1 (2). En Cuba, en ese mismo año, hubo un rendimiento promedio de 1,01 t.ha-1, pero distante de las potencialidades productivas de ese cultivo (3).
La presencia de enfermedades se encuentra entre las causas principales de afectación de la producción de este cultivo. De estas, las más importantes son las ocasionadas por patógenos cuyo hábitat es el suelo, entre las que se encuentran Fusarium spp., Sclerotium sp. y Rhizoctonia sp., entre otros (4, 5).
Fusarium es uno de los géneros de fitopatógenos más diseminados en Cuba y el mundo, causante de pérdidas en los rendimientos y de la calidad del frijol. La infección por este hongo puede ocurrir durante toda la fenología del cultivo, provoca marchitez y pudriciones en la raíz y el tallo. Los síntomas son más severos cuando las condiciones del suelo son pobres, compactados, con poco drenaje y bajo contenido de materia orgánica (6).
El control de la Fusariosis del frijol es difícil, debido a la variabilidad de especies de este hongo que afectan al cultivo, la carencia de productos químicos eficientes y a que, frecuentemente, cuando aparecen los síntomas de la enfermedad, la aplicación de productos es tardía (7). Es por ello que el conocimiento de la biología del patógeno y su interacción con el hospedante, así como la selección de cepas promisorias de Trichoderma spp. por sus varios mecanismos de acción y su efecto preventivo, son aspectos importantes para el desarrollo de programas de manejo integrado de la enfermedad (8).
El Centro Nacional de Sanidad Agropecuaria (CENSA) posee cepas de Trichodermaasperellum Samuels, Lieckfeldt & Nirenberg, identificadas y caracterizadas morfofisiológica, patogénica y molecularmente, las cuales sobresalen por su elevado efecto biológico frente a diferentes patógenos (9,10).
El presente trabajo tuvo como objetivo determinar la actividad antagónica de 13 cepas de T. asperellum, frente a dos aislamientos de Fusarium [FusariumdlaminiiMarasas, Nelson & Toussoun y Fusariumsolani (Martius) Appel & Wollenweber emend. Snyder & Hansen] aislados de frijol.
MATERIALES Y MÉTODOS
Los experimentos se desarrollaron en el Laboratorio de Micología Vegetal del CENSA, situado en el municipio San José de las Lajas, provincia Mayabeque, Cuba.
Se utilizaron 13 cepas de T. asperellum registradas como: Ta. 1, Ta. 3, Ta. 12, Ta. 13, Ta. 17, Ta. 25, Ta. 28, Ta. 56, Ta. 75, Ta. 78, Ta. 79, Ta. 85 y Ta. 90, procedentes del mismo laboratorio, y dos aislados de Fusarium: F. dlaminii y F.solani, altamente virulentos en frijol.
Las cepas del antagonista se multiplicaron en medio de cultivo Agar Malta (tres días a 28±2ºC), y los aislados de Fusarium spp. en medio de cultivo Papa Dextrosa Agar (PDA) (7 días a 25±2ºC) en placas de 90 mm de Ø, ambos en oscuridad constante.De estos cultivos, se obtuvieron discos de 6 mm de diámetro de la periferia de las colonias del antagonista y del patógeno. Se sembraron diametralmente, a una separación del borde de las placas (90 mm de Ø) de 5 mm, que contenían medio de cultivo PDA, incubadas a 25±2ºC y en oscuridad constante. El antagonismo de las cepas de Trichoderma se determinó por el método de cultivo dual (CD), según lo descrito por Martínez y Solano (11).
Se emplearon tres réplicas por tratamiento y un control de cada aislamiento del fitopatógeno, sembrado e incubado en similares condiciones, pero sin el antagonista, y se realizaron dos repeticiones del ensayo.
La antibiosis se evaluó mediante la medición del crecimiento lineal (mm) con una regla graduada, comparando el desarrollo de los aislados de Fusarium en el CD con el del control (sin T. asperellum) antes del contacto hifal entre ambos hongos (Fusarium spp.-T. asperellum).
La competencia por el espacio se determinó al comparar el crecimiento de los aislamientos de Fusarium spp. en CD con el del control. Las evaluaciones se hicieron a las 24, 48, 72, 96 y 120 horas, midiendo el crecimiento lineal (mm) de ambos hongos con una regla graduada hasta que uno de los dos completara el área de la placa. El antagonismo se determinó según la Escala de Clase referida por Bell et al. (12).
Se evaluaron tres réplicas por cada tratamiento y se incluyó un control de cada aislamiento de Fusarium (sin T. asperellum). Se determinó el Porcentaje de Inhibición del Crecimiento Radial (PICR) mediante la fórmula de Samaniego et al. (13):
Donde:
r1 - Crecimiento radial de la colonia del fitopatógeno en el tratamiento control.
r2 - Crecimiento radial del aislamiento patógeno enfrentado al antagonista.
Para el estudio del micoparasitismo, se realizaron preparaciones (tres por tratamiento) de la zona de contacto entre ambos hongos a las 144 h. Se observaron al microscopio óptico, modelo N-800M (400X), para determinar el tipo de interacción hifal (vacuolización, granulación, enrollamiento, lisis o penetración) según los criterios de Chet et al. (14). Las observaciones se documentaron mediante fotos con una cámara digital (SONY).
Los datos se procesaron por un Análisis de Varianza (ANOVA), y las medias se compararon según la Dócima de Rangos Múltiples de Duncan (p≤0,05), utilizando el paquete estadístico INFOSTAT Profesional ver. 2.1.
RESULTADOS Y DISCUSIÓN
La mayoría de las cepas de T. asperellum inhibieron significativamente el crecimiento de los fitopatógenos desde las 48 h, en comparación con el control, excepto la cepa Ta. 78 que no inhibió de forma significativa el crecimiento de F. dlaminii. Las cepas Ta. 1 y Ta. 79 provocaron la mayor inhibición del desarrollo de los dos aislamientos de Fusarium (F. dlaminii y F. solani), con diferencias significativas con las restantes cepas (Fig.1).
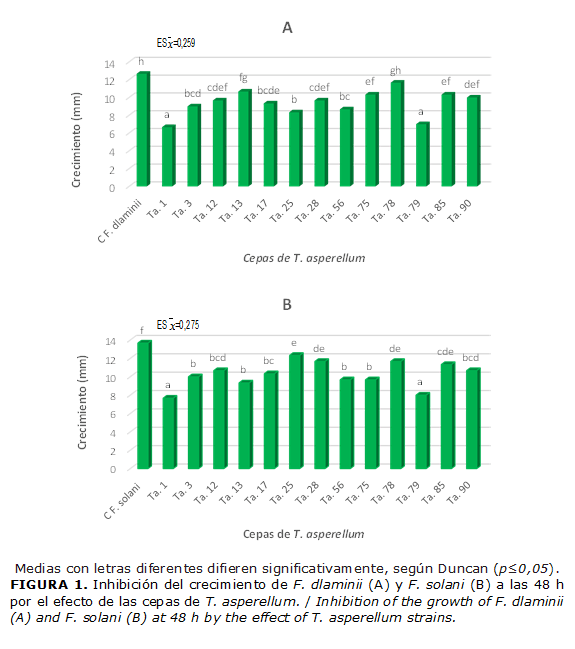
Esto es una evidencia de que la excreción de metabolitos difusibles en el entorno, por estas cepas, ocurre desde periodos muy tempranos de la interacción. La acción de estos metabolitos producidos por las cepas de Trichoderma se evidenció a partir de las 48 horas, cuando se observó una reducción del crecimiento de las colonias de los tratamientos, en comparación con el control, a medida que transcurrieron los días. (Fig. 2)

Al inicio se consideró que la actividad inhibitoria de cepas de Trichoderma sobre otros patógenos se debía a los compuestos no volátiles; no obstante, se demostró que en este mecanismo intervienen también compuestos volátiles (4,15). En el caso de las cepas de T. asperellum estudiadas, frente a los aislamientos de Fusarium spp., se desconoce el (los) tipo (s) de metabolitos involucrado (s) en el efecto de antibiosis, volátiles o no, o ambos. Aspecto que se debe esclarecer en futuras investigaciones.
Es posible que la causa de los resultados del presente trabajo se relacione con lo planteado por Reina et al. (16), quienes informaron que existen especies de Trichoderma, como Trichoderma harzianum Rifai, que produce una gama de antibióticos (trichodermina, suzukacilina, alamethicina, dermadina, trichotecenos y trichorzianina) que participan en la inhibición del crecimiento de los fitopatógenos.
Todas las cepas de T. asperellum se ubicaron en la clase 1 de la escala de Bell et al. (12), excepto Ta. 3 que se ubicó en la clase 2.
Resultados similares obtuvo Echevarria (17), quien notificó en la clase 1 a cuatro cepas de T. asperellum (Ta.13, Ta.17, Ta.78 y Ta.90) frente a Fusariumnygamai Burgess & Trimboli y Fusarium oxysporum Schlechtend.: Fr. f. sp. ciceri (Padwik) Matuo & K. Sato, respectivamente.
Las cepas de T. asperellum crecieron más rápido que los dos aislamientos del fitopatógeno. Esta superioridad competitiva por espacio, respecto a Fusarium spp., contribuyó a limitar el crecimiento del patógeno, en comparación con los controles (Fig. 3).

Los resultados tienen similitud con los informados por Sánchez et al. (18), quienes notificaron la rápida colonización del medio de cultivo por dos cepas: T. harzianum y Trichoderma koningiopsis Samuels, frente a dos aislados de Fusarium oxysporum f. sp. cepae (Hanzawa) W.C. Snydery H.N. Hansen.
Las cepas Ta. 79 y Ta. 1 produjeron los mayores PICR con valores máximos de 44- 47 % y 41- 48,72 % para F.dlaminii y F.solani, respectivamente, con diferencias significativas respecto a las demás, con excepción de Ta. 56 y Ta. 25, que no tienen diferencias con Ta. 79 (F.dlaminii), y la cepa Ta. 13 que no tiene diferencia con Ta. 1 (F. solani) (Fig. 4).

Los resultados coinciden con los informados por Fernández y Suárez (19), y Naglot et al. (20), quienes notificaron porcentajes de inhibición del crecimiento de F. oxysporum f. sp. passifloraeSchlechtendahl emend. Snyder & Hansen y F. solani con valores entre 42-76 % en enfrentamientos con cepas de T. harzianum y Trichoderma sp., respectivamente.
El crecimiento de los aislamientos de Fusarium spp. no solo se limitó durante las primeras 72 h, sino que, en la mayoría de los tratamientos, a las 120 h las cepas de T. asperellum continuaron creciendo hasta cubrir completamente la colonia del hongo patógeno y esporularon sobre este.
La colonización de los sustratos y su rápido crecimiento constituyen características significativas de Trichoderma spp., las que hacen que sea un buen competidor por espacio, fundamentalmente en condiciones in vitro (21).
Este estudio indicó que las dos mejores cepas de T. asperellum con mayores porcentajes de inhibición del crecimiento de los patógenos probados fueron Ta. 1 y Ta. 79.
Se demostró que todas las cepas de T. asperellum evaluadaspresentaron dos o más tipos de interacciones hifales, con predominio de la vacuolización y granulación del contenido citoplasmático en el micelio de los patógenos (Tabla 1).

Las cepas Ta. 1 y Ta. 79 presentaron la mayor cantidad de tipos de interacciones hifales frente a los aislamientos de F. dlaminii y F. solani, respectivamente.
En la mayoría de los tratamientos se encontraron conidios de Fusarium truncados (sin contenido citoplasmático), ruptura de septos y la presencia de granulaciones y vacuolas. Esto reafirmó la elevada capacidad micoparasítica de las cepas de Trichoderma frente a los patógenos (Fig. 5).

Los resultados corroboraron lo notificado por González et al. (22) y Hyder etal. (23), sobre la degradación enzimática de la pared celular de los hongos fitopatogénicos durante la acción micoparasítica, que causa lisis y con ello la desorganización del contenido citoplasmático que, según estos autores, está relacionada con la acción de las enzimas quitinasas, β-1,3-glucanasas, β-1,6-glucanasas, α-1,3-glucanasas y proteasas excretadas por Trichoderma spp.
León et al. (24) observaron presencia de estrangulamiento y lisis de las paredes de las hifas, seguidas de una desintegración y degradación de las paredes celulares de Fusarium sp. al enfrentarse a las cepas Tb111 y Tc241 de Trichoderma spp.
Las interacciones hifales que intervienen en el parasitismo son mediadas por la actividad enzimática del antagonista, que permite la penetración, deformación, desintegración y muerte de las hifas del patógeno (25), por lo que aquellas cepas que exhiben un alto potencial enzimático tienden a poseer un mayor efecto micoparasítico (22); de ahí la importancia de la selección de cepas con varios tipos de interacciones hifales.
La integración de los resultados de la presente investigación permitió seleccionar las cepas Ta. 1 y Ta. 79 como promisorias para continuar los estudios en condiciones en campo.
1. Vázquez Y, Batista EL. Evaluación morfológica de 8 variedades de frijol negro (Phaseolus vulgaris L.), en condiciones del municipio Río Cauto. Revista Granma Ciencia. 2016; 20(1): 8p.
2. Panorama Alimentario. Dirección de Investigación y Evaluación Económica y Sectorial. Frijol. 2016. [Consultado: 11 de mayo de 2017]. Disponible en: https://www.gob.mx/cms/uploads/attachment/file/200638/Panorama_Agroalimentario_Frijol_2016.pdf
3. Oficina Nacional de Estadística e Información (ONEI). Agricultura, ganadería, servicultura y pesca. 2015. [Consultado: 20 de marzo de 2017]. Disponible en: http://www.one.cu/aec2014/09%20Agricultura%20Ganaderia.pdf
4. Martínez de la Parte E, Cantillo Pérez T, García D. Hongos asociados a semillas de Phaseolus vulgaris L. cultivadas en Cuba. Biotecnología Vegetal. 2014; 14(2): 99-105.
5. González RM, Castellanos GL, Ramos FM, Pérez G. Efectividad de Trichoderma spp. para el control de hongos patógenos de la semilla. Fitosanidad. 2005; 9(1): 37-41.
6. Rodríguez O, Chaveco O, Ortiz R, Ponce M, Ríos H, Miranda S, et al. Evaluación del comportamiento de líneas de frijol común (Phaseolus vulgaris L.) resistentes a la sequía, en condiciones de riego y sin riego, e incidencia de enfermedades. Temas de Ciencia y Tecnología. 2009; 13(39):19-30.
7. Avendaño C, Arbeláez G, Rondón G. Control biológico del marchitamiento vascular causado por Fusarium oxysporum f. sp. phaseoli en fríjol Phaseolus vulgaris L., mediante la acción combinada de Entrophospora colombiana, Trichoderma sp. y Pseudomonas fluorescens. Agronomía Colombiana. 2006; 24(1):62-67.
8. Martínez B, Infante D, Reyes Y. Trichoderma spp. y su función en el control de plagas en los cultivos. Rev. Protección Veg. 2013; 28 (1): 1-11.
9. Infante D, Martínez B, Peteira B, Reyes Y, Herrera A. Identificación molecular y evaluación patogénica de trece aislamientos de Trichoderma spp. frente a Rhizoctoniasolani Kühn. Biotecnol Apl. 2013; 30 (1):17-22.
10. Cruz A, Rivero D, Echevarría A, Infante D, Martínez B. Trichoderma asperellum en el manejo de hongos fitopatógenos en los cultivos de arroz (Oryzasativa L.), frijol (Phaseolusvulgaris L.) y soya (Glycinemax L.). Rev. Protección Veg. 2015; 30(suppl.1):87p.
11. Martínez B, Solano T.Antagonismo de Trichoderma spp. frente a Alternaria solani (Ellis y Martin) Jones y Grout. Rev. Protección Veg. 1995; 10(3):221-225.
12. Bell DK, Wells HD, Markam CR. In vitro antagonism of Trichoderma spp. against six fungal plant pathogens. Phytopathology. 1982; 72(4): 379-382.
13. Samaniego G, Ulloa S, Herrera S. Hongos del suelo antagonistas de Phymatotrichum omnivorum. Rev. Mex. Fitopatología. 1989; 8:86-95.
14. Chet I, Harman G, Baker R. Trichodermahamatum: its hyphal interactions with Rhizoctoniasolani and Pythium spp. Microbiol Ecol. 1981; 7(1):29-38.
15. Infante D, Martínez B, González N, Reyes Y. Mecanismos de acción de Trichoderma frente a hongos fitopatógenos. Rev. Protección Veg. 2009; 24(1):14-21.
16. Reina JC, Torres-García LE, Grizalez-Méndez MA. Mechanism of action of Trichodermaharzianum as controlling agent of Fusariumsubglutinans. Momentos de Ciencias. 2013; 10(1):54-58.
17. Echevarría A. Identificación y alternativa biológica para el control de la Marchitez en el cultivo del garbanzo (Cicer arietinum L.). [Tesis en Opción al Título Académico de Máster en Sanidad Vegetal. Mención:Fitopatología]. La Habana, Cuba. 2015.
18. Sánchez AD, Barrera V, Reybet GE, Sosa MC. Biocontrol con Trichoderma spp. de Fusarium oxysporum causal del “mal de almácigos” en pre y post emergencia en cebolla. Revista de la Facultad de Agronomía, La Plata. 2015; 114 (1): 61-70.
19. Fernández RJ y Suárez CL. Antagonismo in vitro de Trichoderma harzianum Rifai sobre Fusarium oxysporum Schlecht f. sp passiflorae en maracuyá (Passiflora edulis Sims var. Flavicarpa) del municipio zona bananera colombiana. Rev. Fac. Nal. Agr. Medellín. 2009; 62(1):4743-4748.
20. Naglot A, Goswami S, Rahman I, Shrimali DD, Yadav KK, Gupta VK, Rabha AJ, Gogoi HK, Veer V. Antagonistic potential of native Trichoderma viride strain against potent tea fungal pathogens in North East India. Plant Pathol. J. 2015; 31(3):278-289.
21. Reyes Y, Martínez B, Infante D. Evaluación de la actividad antagónica de trece aislamientos de Trichoderma spp. sobre Rhizoctonia sp. Rev. Protección Veg. 2008; 23(2):112-117.
22. González I, Infante D, Martínez B, Arias Y, González N, Miranda I, Peteira B. Induction of chitinases and glucanases in Trichoderma spp. strains intended for biological control. Biotecnol Apl. 2012; 29(1): 12-16. ISSN: 1027-2852.
23. Hyder S, Inam-ul-Haq M, Bibi S, Humayun A, Ghuffar S, Iqbal S. Novel potential of Trichoderma spp. as biocontrol agent. Journal of Entomology and Zoology Studies. 2017; 5(4):214-222.
24. León RA, Pino SC, Martínez B, Liriano R, Núñez DB. Aislamiento y selección de cepas de Trichoderma y su efecto antagonista frente a Sclerotium rolfsii, Rhizoctonia sp. y Fusarium sp. Centro Agrícola. 2012; 39(2):43-48.
25. Harman GE. Myths and dogmas of biocontrol – changes in perceptions derived from research on Trichoderma harzianum T-22. Plant Dis. 2000; 84(4):377–393.
Recibido: 25/10/2017
Aceptado: 17/4/2018
*Autor para correspondencia: Yanisia Duarte-Leal. E-mail: yanisia@censa.edu.cu
*Autor para correspondencia: Benedicto Martínez-Coca. E-mail: bmcoca@censa.edu.cu














