Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Archivo Médico de Camagüey
versión On-line ISSN 1025-0255
AMC vol.18 no.2 Camagüey feb.-abr. 2014
ARTICULOS ORIGINALES
Resultados del tratamiento antimicrobiano secuencial en los niños con apendicitis aguda complicada
Results of the sequential antimicrobial treatment in children with complicated acute appendicitis
Dr. José Carlos Bueno Rodríguez; Dr.C. Elizabeth Hernández Moore; Dr. Mauro Castelló González; Dra. Dayamnelis Aguilar Atanay
Hospital Universitario Pediátrico Dr. Eduardo Agramonte Piña. Camagüey, Cuba.
RESUMEN
Fundamento: la apendicitis aguda complicada (gangrenosa o perforada) es la causa más común de peritonitis secundaria en la edad pediátrica. El tratamiento utilizado en Cuba incluye: la intervención quirúrgica urgente y la utilización de antimicrobianos de amplio espectro durante aproximadamente siete días.
Objetivo: mostrar los resultados de un nuevo esquema de tratamiento antimicrobiano secuencial (intravenoso/oral) en el periodo posoperatorio en niños con apendicitis aguda complicada.
Método: se realizó un estudio cuasi-experimental con todos los niños tratados por apendicitis aguda complicada entre el 1ro de enero de 2010 hasta el 31 de diciembre de 2012, en el Servicio de Cirugía Pediátrica del Hospital Pediátrico Provincial Docente Dr. Eduardo Agramonte Piña de Camagüey. A los casos se les sustituyó entre el tercero y el quinto día del periodo posoperatorio, el tratamiento parenteral por el cotrimoxazol y el metronidazol por vía oral. Los resultados fueron comparados con la serie de enfermos tratados en el trienio anterior (controles históricos).
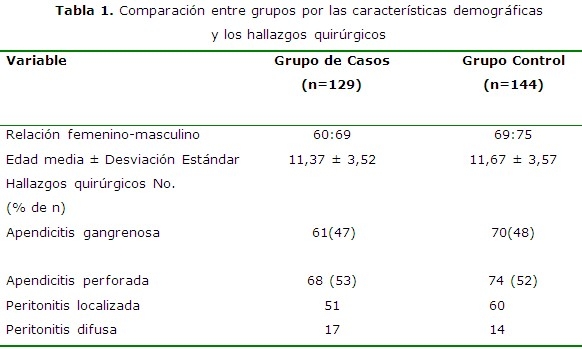
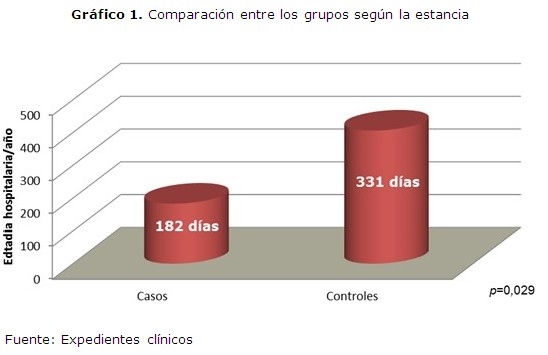
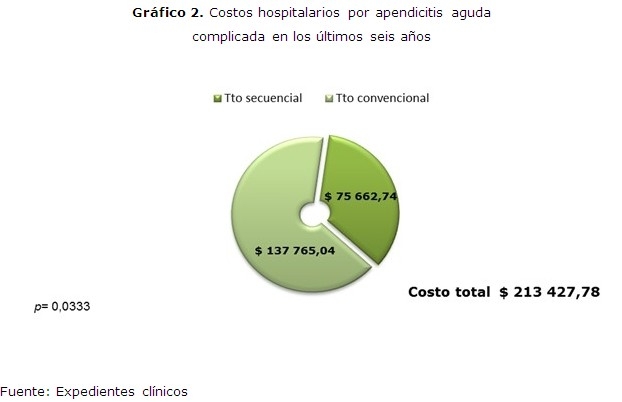
Resultados: un total de 129 niños se incluyeron en los casos. Los controles históricos sumaron 144. La estancia promedio fue de 182 días/año (4, 24 días/enfermo) para los casos y de 337 días/año (7, 02 días/enfermo) para los controles. Los costos fueron de $ 75 662,74 para los casos ($ 586, 53/enfermo) y de $137 765, 04 para los controles ($ 956, 70/enfermo).
Conclusiones: los datos obtenidos en el estudio demuestran una disminución de 2, 78 días en la estancia y de aproximadamente $ 370, 17 por enfermo al comparar ambos trienios.
DeCS: APENDICITIS/terapia; ANTINFECCIOSOS; RESULTADO DEL TRATAMIENTO; NIÑO; EPIDEMIOLOGÍA EXPERIMENTA.
ABSTRACT
Background: complicated acute appendicitis (gangrenous or perforating) is the most common cause of secondary peritonitis in pediatric age. The treatment used in Cuba includes emergency operation and the use of broad-spectrum antimicrobials for about seven days.
Objective: to show the results of a new sequential antimicrobial treatment (intravenous/orally) in the postoperative period in children with complicated acute appendicitis.
Method: a quasi-experiment was conducted with all the children treated for complicated acute appendicitis in the Department of Pediatric Surgery of the Dr. Eduardo Agramonte Piña Provincial Teaching Pediatric Hospital of Camagüey from January 1st, 2010 to December 31st, 2012. Between the third and fifth days of the postoperative period, the parental treatment was replaced for cotrimoxazole and metronidazole administered orally. The results were compared to the series of patients treated during the previous three-year period (historical controls).
Results: a total of 129 children were included in the cases. The historical controls added up to 144. The average hospital stay was of 182 days/year (4.24 days/patient) for the cases and of 337 days/year (7.02 days/patient) for the controls. The costs were of $ 75 662.74 for the cases ($ 586.53/patient) and of $137 765.04 for the controls ($ 956.70/patient).
Conclusions: the data obtained in the study show a decrease of 2.78 days in the hospital stay and of around $ 370.17 per patient, when comparing both three-year periods.
DeCS: APPENDICITIS/therapy; ANTI-INFECTIVE AGENTS; TREATMENT OUTCOME; CHILD; EPIDEMIOLOGY, EXPERIMENTAL.
INTRODUCCIÓN
La apendicitis aguda complicada (AAC), apendicitis en etapas gangrenosa o perforada, es la causa más común de peritonitis secundaria en la edad pediátrica. 1,2
En la actualidad, existen puntos de controversia en el tratamiento de las AAC relacionados con la realización de la apendicetomía inicial, la combinación de los antimicrobianos a utilizar y la duración del tratamiento antimicrobiano posoperatorio.1,3
El tratamiento utilizado en Cuba incluye: la intervención quirúrgica urgente y la utilización de antimicrobianos de amplio espectro por la vía parenteral durante siete días. 4,5
Las evidencias más recientes muestran que un tratamiento antimicrobiano diferenciado según los hallazgos intraoperatorios en las AAC, garantiza una protección adecuada, con un índice similar de complicaciones infecciosas, menor estadía hospitalaria y mejor relación costo-efectividad que los esquemas de tratamiento utilizados históricamente. 1
El presente estudio compara los resultados de la utilización de un nuevo esquema de tratamiento antimicrobiano secuencial (intravenoso/oral) en el periodo posoperatorio de los niños con AAC, con el tratamiento utilizado históricamente en el servicio de Cirugía Pediátrica de Camagüey.
MÉTODOS
Se realizó un estudio cuasi-experimental con todos los niños tratados por AAC entre el 1ro de enero del 2010 y el 31 de diciembre del 2012 en el Servicio de Cirugía Pediátrica del Hospital Pediátrico Provincial Docente Dr. Eduardo Agramonte Piña de Camagüey. Los resultados fueron comparados con los enfermos tratados por AAC en el periodo comprendido entre el 1ro de enero de 2007 y el 31 de diciembre de 2009 (controles históricos) y que presentaron corroboración clínico-patológica.
El estudio contó con la aprobación del Comité de Ética para las Investigaciones y del Consejo Científico de la institución en la cual se realizó.
Criterios diagnósticos intraoperatorios:
Los enfermos fueron diferenciados según los hallazgos intraoperatorios.
La apendicitis aguda complicada quedó establecida cuando se demostraron evidencias de gangrena o perforación del órgano Kin Wai, et al. 6
Para el diagnóstico por evidencias de apendicitis aguda gangrenosa, se utilizó la definición propuesta por Sheriff, et al 1, y St. Peter, et al, 7 quienes describen la existencia de:
- zonas de color gris o negro en la pared apendicular
- ausencia de fecalito fuera del apéndice
- ausencia de un orificio visible en la pared apendicular
- ausencia de exudado purulento o fibrina alejado del apéndice
- ausencia de vertimiento de contenido procedente del apéndice durante su extracción
Para el diagnóstico por evidencias de apendicitis aguda perforada, se utilizó la definición propuesta por St. Peter, et al, 7 quienes describen la existencia de:
- presencia de un orificio en la pared del apéndice cecal acompañado de pus libre, localizado o difuso en la cavidad abdominal.
- hallazgo de un fecalito libre en la cavidad abdominal
Criterios de inclusión
- Enfermos entre 5 y 18 años de edad, con diagnóstico por evidencias, en el quirófano, de apendicitis aguda complicada, a los que sus padres o tutores les den el consentimiento para participar en la investigación.
- Ausencia de enfermedades infecciosas asociadas con la apendicitis aguda y que requieran por sí mismas de la utilización de antimicrobianos.
- Enfermos que al valorarse entre el tercer y el quinto día del periodo posoperatorio presenten:
- tolerancia a los alimentos por vía oral
- ausencia de fiebre durante las últimas 24 horas
Criterios de exclusión
- Enfermos con antecedentes de hipersensibilidad al cotrimoxazol y al metronidazol.
- Enfermos con intolerancia para la administración de medicamentos por vía oral.
Los enfermos diagnosticados como apendicitis aguda gangrenosa, 6 recibieron tratamiento posoperatorio con ceftriaxona y metronidazol.
Los enfermos diagnosticados como apendicitis aguda perforada,7 recibieron tratamiento posoperatorio con ceftriaxona, amikacina y metronidazol.
Los niños con antecedentes de hipersensibilidad a las cefalosporinas recibieron tratamiento con la combinación de amikacina y metronidazol.
En todos los niños fueron utilizadas las formas de presentación y dosis en el Formulario Nacional de Medicamentos de Cuba. 8
En los enfermos con diagnóstico de apendicitis aguda gangrenosa 3 se valoró al tercer día del periodo posoperatorio:
- la tolerancia de la vía oral
- el estado afebril en las últimas 24 horas
En los enfermos con diagnóstico de apendicitis aguda perforada, 7 la valoración se realizó al quinto día del periodo posoperatorio e incluyó los mismos aspectos.
A los enfermos que cumplieron con los requisitos descritos con anterioridad y aceptados en la bibliografía consultada, 9-11 se les sustituyó la combinación de antimicrobianos iniciada desde el periodo posoperatorio inmediato, por la combinación:
- cotrimoxazol y metronidazol, ambos por la vía oral.
Las formas de presentación y las dosis a emplear fueron:8
- cotrimoxazol (tableta 480 mg), Imefa.
Niños de:
3-5 años 1/2 tableta por vía oral (vía oral) cada 12 horas
6-12 años 1 tableta vía oral cada 12 horas
> 12 años 2 tabletas vía oral cada 12 horas
metronidazol (tableta de 250 mg), Imefa.
Dosis: 30 mg/kg/día cada 6-8 horas
Los enfermos fueron egresados cuando se demostró la tolerancia a las combinaciones antimicrobianas orales utilizadas y cuando el estado clínico del niño lo permitió.
Análisis estadístico:
Las variables cualitativas se resumieron mediante números absolutos y porcientos y para las variables cuantitativas se utilizaron la media y la desviación estándar.
Para determinar la relación entre las variables: estadía hospitalaria, costos e índice de infecciones posoperatorias, fueron utilizados los coeficientes de correlación de Spearman y de Kendall. 11
El valor de p < 0,05 fue establecido como: estadísticamente significativo para la relación entre las variables. En el análisis de los datos fue utilizado el programa SPSS 15.0 para Windows.
RESULTADOS
Entre el 1ro de enero del 2010 y el 31 de diciembre del 2012 fueron tratados 141 niños por AAC, de ellos 129 niños fueron incluidos como casos. Los controles históricos sumaron 144 enfermos (1ro de enero de 2007 hasta el 31 de diciembre de 2009).
Se observó que no existieron diferencias entre los grupos en cuanto a la edad, el sexo, el tiempo de evolución hasta el diagnóstico y los hallazgos intraoperatorios. Es necesario comentar que los criterios diagnósticos por evidencias para las AAC, 1,6,7 fueron publicados a partir del año 2008 y se comenzaron a aplicar en el 2009. (Tabla 1)
Se mostró como la estancia promedio fue de 182 días/año para los casos (4, 24 ± 1, 89 días/enfermo) y de 337 días/año para los controles (7, 02 ± 1, 32 días/enfermo). (Gráfico 1)
Se percibieron los costos totales en los últimos seis años para los niños tratados por AAC y se constató como en el trienio 2007-2009 fue de $137 765, 04 ($ 956, 70 ± 173, 91/enfermo), mientras que el trienio 2010-2012, fueron de $ 75 662, 74 ($ 586, 53 ± 268, 73/enfermo). (Gráfico 2)
Como dato secundario fue observado un ahorro en la utilización de los antimicrobianos de 1 404 bulbos de ceftriaxona, 505 bulbos de amikacina y 2 085 frascos de metronidazol, durante los tres años en los que ha sido aplicado el tratamiento, con un ahorro total aproximado de $ 28 369, 2 por este concepto.
Se expone la comparación entre las variables: estadía, costo e índice de infecciones. Al comparar la variable estadía/paciente, se encontraron diferencias estadísticamente significativas entre los casos (4, 24 días) y los controles (6, 89 días), p= 0,017 y 0,018. Un resultado similar se encontró al comparar los costos por enfermos entre ambos grupos, casos ($ 586, 53) y controles ($ 934, 35), p= 0,020 y los índices de infección (3, 1 % en los casos y 4, 21 % en los controles) entre ambos trienios (p= 0,039). (Tabla 2)
DISCUSIÓN
Desde el año 2002 hasta la actualidad han sido publicados los estudios de Bueno, et al, 5 Obinna, et al, 9 y Gollin, et al,13 con la utilización del cotrimoxazol y el metronidazol de forma secuencial, 14 después de un período variable con la utilización de antimicrobianos intravenosos en los niños tratados por AAC. En dichos estudios han participado un total de 125 niños entre los cinco y 18 años. Este resultado general se corresponde con los enfermos tratados por AAC en el hospital durante los últimos tres años, al igual que los criterios de inclusión, con la adición del recuento leucocitario en uno de estos estudios, 9 lo que constituye para Fallon, et al, 15 un indicador de relevancia para el seguimiento posoperatorio.
Autores como Fraser, et al, 10 Rice, et al, 16, y Taylor, et al, 17 describen la utilización secuencial de la amoxicilina más un inhibidor de las betalactamasas y el metronidazol y reúnen un total de 128 niños entre cinco y 18 años con criterios de inclusión similares.
Estudios recientes de Schmitt, et al, 18 Chen, et al, 19 y Guillet-Caruba, et al, 20 han reconocido en el cotrimoxazol una baja resistencia por parte de las enterobacterias (18 %). En ellos se ha demostrado un incremento de hasta un 22 % en el cultivo de las cepas de E. coli y estreptococos en las muestras de líquido peritoneal estudiadas, de pacientes con AAC.
Los reportes de Bueno, et al, 5 Obinna, et al, 9 y Gollin, et al, 13 describen en su conjunto una estancia media 2, 8 días menor (entre 3, 6 y 5, 3 días/paciente) al compararla con los grupos control. Este resultado concuerda con el obtenido en el presente estudio, aunque se debe señalar que en el estudio de Obinna, et al, 9 fue utilizada la vía laparoscópica para el tratamiento quirúrgico de la AAC en el 91, 4 % de los niños, lo cual se asocia a menores molestias posoperatorias e índices de infección de la herida quirúrgica, entre otras ventajas. 21,22
El ahorro medio conseguido en los estudios de Bueno, et al, 5 Obinna, et al, 9 y Gollin, et al, 13 fue de aproximadamente 2 448, 5 USD por enfermo. 5,9,13 Obinna, et al, 9 reportaron el mayor contraste de costos a favor del tratamiento secuencial (4 571, 6 USD/enfermo). Estos resultados concuerdan con el obtenido en el presente estudio, con diferencias dadas por el sistema socioeconómico imperante en los países de origen de los estudios. Este hecho refuerza el criterio de que la reducción de la estadía hospitalaria es el indicador que por evidencias logra la mayor reducción en los costos institucionales.23-25
El índice de infecciones posoperatorias fue 1, 46 % menor en los estudios con el empleo secuencial del cotrimoxazol y el metronidazol. 5,9,13 La presente investigación logró un resultado similar, aunque de los indicadores que han sido comparados, este constituye el que menores diferencias presenta en la literatura revisada.3,26
A pesar de los resultados hallados, existen autores como Yu, et al, 26 y Alamili, et al, 27 quienes no consideran necesaria la utilización de los antimicrobianos orales en los niños con AAC, cuando la infección intrabadominal se encuentra clínica y humoralmente controlada con la utilización de los antimicrobianos intravenosos unido a otras medidas locales y generales.
CONCLUSIONES
Los datos obtenidos en el estudio revelan una disminución de 2, 65 días en la estancia y de aproximadamente $ 370, 17 en los costos por enfermo al comparar ambos trienios. Aunque menos significativo, el índice de infecciones posoperatorias se redujo en 1, 11 % en los niños tratados con el nuevo esquema de tratamiento secuencial.
REFERENCIAS BIBLIOGRÁFICAS
1. Sherif E, Fady G, Lo A, Laberge JM, Puligandla P, Shaw K. Gangrenous appendicitis in children: a prospective evaluation of definition, bacteriology, histopathology, and outcomes. J Surg Res. 2012 Mar;177(1):123-6.
2. Livingston EH, Woodward WA, Sarosi GA, Haley RW. Disconnect between incidence of Nonperforated and Perforated appendicitis. Implications for pathophysiology and management. Ann Surg. 2007 Jun;245(6):886-92.
3. Holcomb III GW, St Peter SD. Current management of complicated appendicitis in children. Eur J Pediatr Surg. 2012 Feb;22(3):207-12.
4. Vialat Soto V, Mena Miranda VR, Labrada Arjona E, Manresa Gómez D. Guías de Buenas Prácticas Clínicas. Peritonitis en el niño. Medisur. 2005;3(5):87-91.
5. Bueno Rodríguez JC, Hernández Moore E, Aguilar Atanay D, Castelló González M, Castro Guevara JE, Piovet Dorta Y. Tratamiento antimicrobiano secuencial en la apendicitis aguda complicada. Cir Cir. May-Jun 2012;80(3):233-8.
6. Kin Wai EC, Lee KH, Cheung Mou JW, Cheung ST, Yin Sihoe JD, Tam YH. Evidence-based adjustment of antibiotic in pediatric complicated appendicitis in the era of antibiotic resistance. Pediatr Surg Int. 2010 Feb;26(2):157-60.
7. St. Peter SD, Sharp SW, Holcomb III GW, Ostlie DJ. An evidence-based definition for perforated appendicitis derived from a prospective randomized trial. J Pediatr Surg. 2008 Dec;43(12):2242-5.
8. MINSAP. Formulario Nacional de Medicamentos [Internet]. La Habana: Ministerio de Salud Pública; 1999-2011 [citado 2 Nov 2013]. Disponible en: http://fnmedicamentos.sld.cu/index.php?P=Home-es
9. Obinna OA, Barnaby K, Dobies J, Comerford M, Drill A, Walker N, et al. Postoperative antibiotic therapy for children with perforated appendicitis: long course of intravenous antibiotics versus early conversion to an oral regimen. Am J Surg. Feb 2008;195(2):141-3.
10. Fraser JD, Aguayo P, Leys CM, Keckler SJ, Newland JG, Sharp SW, et al. A complete course of intravenous antibiotics versus a combination of intravenous and oral antibiotic for perforated appendicitis in children: a prospective randomized trial. J Pediatr Surg. 2010 Jun;45(6):1198-1202.
11. Peter SD. Appendicitis. En: Holcomb III GW, Murphy JP, editors. Ashcrafts Pediatric Surgery. 5ta ed. Philadelphia: Saunders Elsevier; 2010. p. 549-56.
12. Mamoon AA, Stephan H, Vernaz N, Kearney MP, Scott MG, Funston C, et al. Quasiexperimental study of the effects of antibiotic use, gastric acid-suppressive agents, and infection control practices on the incidence of Clostridium difficile-associated diarrhea in hospitalized patients. Antimicrob Agents Chemother. 2009 May;53(5):2082-8.
13. Gollin G, Abarbanell A, Moores D. Oral antibiotics in the management of perforated appendicitis in children. Am Surg. 2002 Dec;68(12):1072-4.
14. Bueno Rodríguez JC, Castelló González M, Aguilar Atanay D, Hernández Moore E. Uso secuencial de los antimicrobianos en los niños con apendicitis aguda complicada: estado de la cuestión. Rev Arch Med Camagüey [Internet]. Nov-Dic 2013 [citado 2 Nov 2013];17(6):[aprox. 15 p.]. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext & pid=S1025-02552013000600014 & lng=es & nrm=iso & tlng=es
15. Fallon SC, Brandt ML, Hassan SF, Wesson DE, Rodriguez JR, Lopez ME. Evaluating the effectiveness of a discharge protocol for children with advanced appendicitis. J Surg Res. 2013 May;184:347-51.
16. Rice HE, Brown RL, Gollin G. Results of a pilot trial comparing prolonged intravenous antibiotics with sequential intravenous/oral antibiotics for children with perforated appendicitis. Arch Surg. 2001 Dec;136(12):1391-5.
17. Taylor E, Berjis A, Bosch T, Hoehne F, Ozaeta M. The efficacy of postoperative oral antibiotics in appendicitis: a randomized prospective double-blinded study. Am Surg. 2004 Oct;70(10):858-62.
18. Schmitt F, Clermidi P, Dorsi M, Cocquerelle V, Gomes CF, Becmeur F. Bacterial studies of complicated appendicitis over a 20-year period and their impact on empirical antibiotic treatment. J Pediatr Surg. 2012 Nov;47(11):2055-62.
19. Chen CY, Chen YC, Pu HN, Tsai CH, Chen WT, Lin CH. Bacteriology of acute appendicitis and its implication for the use of prophylactic antibiotics. Surg Infect (Larchmt). 2012 Dec;13(6):383-90.
20. Guillet-Caruba C, Cheikhelard A, Guillet M, Bille E, Descamps P, Yin L, et al. Bacteriologic epidemiology and empirical treatment of pediatric complicated appendicitis. Diagn Microbiol Infect Dis. 2011 Apr;69(4):376-381.
21. Stylianos S, Nichols L, Ventura N, Malvezzi L, Knight C, Burnweit C. The "all-in-one" appendectomy: quick, scarless, and less costly. J Pediatr Surg. 2011 Dec;46(12):2336-41.
22. Vahdad MR, Troebs RB, Nissen M, Burkhardt LB, Hardwig S, Cernaianu G. Laparoscopic appendectomy for perforated appendicitis in children has complication rates comparable with those of open appendectomy. J Pediatr Surg. 2013 Mar;48(3):555-61.
23. Dennett KV, Tracy S, Fisher S, Charron G, Zurakowski D, Calvert CE, et al. Treatment of perforated appendicitis in children: what is the cost? J Pediatr Surg. 2012 Jun;47(6):1177-84.
24. Zilbert NR, Stamell EF, Ezon I, Schlager A, Ginsburg HB, Nadler EP. Management and outcomes for children with acute appendicitis differ by hospital type: Areas for Improvement at public hospitals. Clin Pediatr (Phila). 2009 Jun;48(5):499-504.
25. Lee SL, Islam S, Cassidy LD, Abdullah F, Arca MJ. Antibiotics and appendicitis in the pediatric population: an American Pediatric Surgical Association Outcomes and Clinical Trials Committee Systematic Review. J Pediatr Surg. 2010 Nov;45(11):2181-5.
26. Yu TC, Hamill JK, Evans SM, Price NR, Morreau PN, Upadhyay VA, et al. Duration of postoperative intravenous antibiotics in childhood complicated appendicitis: A Propensity Score-Matched Comparison Study. Eur J Pediatr Surg. 2013 Jun;25(6):54-66
27. Alamili M, Gögenur I, Rosenberg J. Oral antibiotics for perforated appendicitis is not recommended. Dan Med Bull. 2010 Sep;57(9):1-4.
Recibido: 9 de diciembre de 2013
Aprobado: 3 de marzo de 2014
Dr. José Carlos Bueno Rodríguez. Especialista de II Grado en Cirugía Pediátrica. Profesor Auxiliar. Hospital Universitario Pediátrico Dr. Eduardo Agramonte Piña. Camagüey, Cuba. Email: jcbueno@finlay.cmw.sld.cu