INTRODUCCIÓN
Helicobacter pylori (Hp) es una de las bacterias más prevalentes en el mundo, 1,2 en la edad pediátrica varía entre 10 y 80 %. 3,4,5,6
Es una bacteria microaerófila gramnegativa. Representa un importante factor etiológico de la gastritis crónica activa, la úlcera péptica gastroduodenal (UPGD), el linfoma MALT (linfoma de tejido linfoide asociado a mucosa) y el cáncer gástrico. (7,8,9,10 Se estima que está presente en la mucosa gástrica de la mitad de la población mundial, (11,12,13,14 pero la enfermedad solo se produce alrededor del 15-20 % de los individuos colonizados. La elevada prevalencia está relacionada a factores predisponentes para la infección; entre ellos la situación socioeconómica del individuo, hacinamiento, aguas contaminadas y familiares infectados. 15
Con los esquemas de tratamiento más utilizados se logra una tasa de erradicación de alrededor del 85 % en muchas áreas geográficas. (9,16,17,18) La eficacia ha sido comprometida en los últimos años, por la rápida aparición de cepas resistentes, mala adherencia al tratamiento, ausencia de antimicrobianos alternativos y la capacidad de la bacteria de entrar en un estado viable no cultivable o forma cocoide cuando se somete a condiciones desfavorables dentro o fuera de su hábitat. (9,18,19,20
La curación de la gastritis crónica activa, la úlcera péptica, y de algunas formas del linfoma gástrico de bajo grado, así como la prevención de sus complicaciones, depende del éxito de la erradicación de Hp. 21
El propósito de esta revisión es realizar un enfoque general y actualizado sobre la infección por Hp en niños, se hace hincapié en las vías de transmisión, métodos diagnósticos y tratamiento.
MÉTODOS
La búsqueda y revisión fue realizada en cuatro meses (noviembre de 2018 a marzo de 2019) y fueron empleadas las palabras: Helicobacter pylori en niños, métodos diagnósticos, tratamientos actuales, cocoides. De 138 artículos en las bases de datos PubMed, Hinari, SciELO y LILACS mediante el gestor de búsqueda y administrador de referencias EndNote, se utilizaron 53 citas para realizar la revisión, de ellas 40 de los últimos cinco años, cuatro estudios de meta-análisis y cuatro estudios multicéntricos.
DESARROLLO
La infección Hp es el proceso de colonización bacteriana más común a nivel mundial. La prevalencia es reportada en la edad pediátrica entre 10 y 80 % así como la tendencia a la propagación intrafamiliar. (1 La prevalencia varía con la edad y el nivel socioeconómico, es alta en los países en desarrollo y baja en el mundo desarrollado, es muy elevada en África, Asia y zonas de centro y sur América, pero relativamente baja en el Norte y Oeste de Europa, Norteamérica y Australia, y juega un rol importante en la enfermedad ácido péptica. (2,3,4) La infección se adquiere en la infancia y aunque siempre está asociada con una inflamación gástrica microscópica, transcurre la mayor parte de las veces en forma asintomática en ausencia de úlcera péptica. (5,6,7,9 Esta bacteria está considerada como agente carcinógeno clase I, dada su estrecha asociación con el adenocarcinoma gástrico y el linfoma MALT. 1,2,4,21
En comparación con los adultos, los niños y los adolescentes desarrollan con poca frecuencia complicaciones de la infección y en la primera infancia puede estar asociada con beneficios inmunológicos más adelante en la vida. (9
Los principales factores de riesgo incluyen: características socioculturales, económicas, hacinamiento, prácticas higiénicas inadecuadas; ausencia de agua potable, presencia de vectores y alimentos contaminados. 10,22
Vías de transmisión
La cavidad oral representa un hábitat para la permanencia de Hp. Esta zona no favorece una prolongada colonización en individuos asintomáticos y se postula que la colonización es sólo transitoria y después de vómitos. 23,24 Se ha identificado en la placa dental subgingival de los niños y sus familias, y contribuye a la propagación intrafamiliar. (25 Se ha demostrado que el recién nacido lo adquiere a partir de levaduras como la Cándida albicans (hospedero) y que existe correlación significativa entre la aparición de genes en levaduras vaginales y levaduras orales de recién nacidos. (26) Diversos estudios proponen que el comportamiento sexual puede estar relacionado con la transmisión. (10,26
Los alimentos
El Hp puede sobrevivir en algunos alimentos: (hortalizas, carnes frescas y algunos lácteos), por debajo de 30 grados. 27,28
El agua
La frecuencia de infección es más alta (96 %) en épocas de lluvia. El agua constituye un intermediario en la transmisión fecal-oral, en el cual la bacteria puede permanecer por grandes períodos antes de ser ingerida accidentalmente a través del baño, alimentos contaminados, etc. Es resistente a las prácticas de desinfección normalmente empleadas en el tratamiento del agua potable. (10
La zoonosis
En perros y gatos predomina colonizando el fundus gástrico y cardias.
Las moscas
Este vector representa un riesgo de transmisión del patógeno. (10
Patogenia
La infección es necesaria, pero no suficiente, para el desarrollo de lesiones a nivel de la mucosa gástrica. Durante el proceso de colonización, infección y defensa se desencadenan eventos celulares y moleculares que pueden conllevar a la injuria de la mucosa gástrica; el proceso inflamatorio no solo depende de Hp sino de algunas condiciones individuales de cada huésped infectado. Otro aspecto relevante es la diversidad o heterogeneidad de las cepas. Y la presencia de ciertos factores de virulencia marca la diferencia entre las que se consideran microbiota de la mucosa gástrica y las que están asociadas con gastritis crónica y adenocarcinoma gástrico. (29,30,31,32
Los niños desencadenan una respuesta inmune diferente hacia la infección. En comparación con los adultos, las biopsias gástricas obtenidas de niños infectados con Hp muestran una disminución en la inflamación. Además, se detecta un aumento en el número de células reguladoras inmunosupresoras (Treg) junto con la Interleukina (IL)-10 antiinflamatoria, en lugar de una respuesta de citoquina IL-17 proinflamatoria, que pudiera explicar el menor número de complicaciones y podría conferir protección contra la autoinmunidad. (9
Formas cocoides de Hp
Al someterse a circunstancias ambientales perjudiciales tanto dentro como fuera de su hábitat natural, Hp cambia su clásica forma bacilar en viable no cultivable (VNC) que conduce a cambios morfológicos, metabólicos y en el comportamiento del crecimiento. Se ha confirmado la presencia de las formas cocoides tanto en el estómago como en el duodeno de humanos, aunque parece que el porcentaje de las formas cocoides es mayor en el duodeno que en el estómago; hasta en algunas biopsias duodenales puede observarse exclusivamente la forma cocoide. Esto puede indicar que las condiciones biológicas en el duodeno de alguna manera lo obligan a adaptarse a este medio, o estas condiciones son ideales para refugiarse en el estado VNC.
Diferentes experimentos tanto in vitro como in vivo han demostrado que en condiciones desfavorables como aerobiosis, pH alcalino, temperatura alta, incubación extendida, incubación prolongada en agua, tratamiento con inhibidores de la bomba de protones (IBP) o tratamiento con antimicrobianos, el fenotipo cocoide puede mantener cierta actividad metabólica ya que expresa una amplia variedad de genes presentes en la forma bacilar, mantiene niveles detectables de la actividad de la ureasa, sintetiza proteínas en mínimas cantidades y produce pequeñas cantidades de ADN. Todos estos datos subrayan que los cambios biológicos de Hp representan una poderosa habilidad para la preservación de la especie.
Muchos estudios han demostrado que puede pasar de forma bacilar a cocoides bajo la exposición, in vitro, a diversos agentes antimicrobianos. Diferentes concentraciones de amoxicilina (AMO), claritromicina (CLA), metronidazol (MET) y eritromicina, entre otros, pueden inducir esta transformación. El mayor efecto de inducción fue visto por la AMO. Se sabe que este tiene un efecto potente contra Hp in vitro; sin embargo, si se toman en cuenta las observaciones morfológicas de los cultivos, resulta evidente que el número de las formas bacilares disminuye a expensas de la aparición y el aumento de las formas cocoides. (20
Métodos diagnósticos
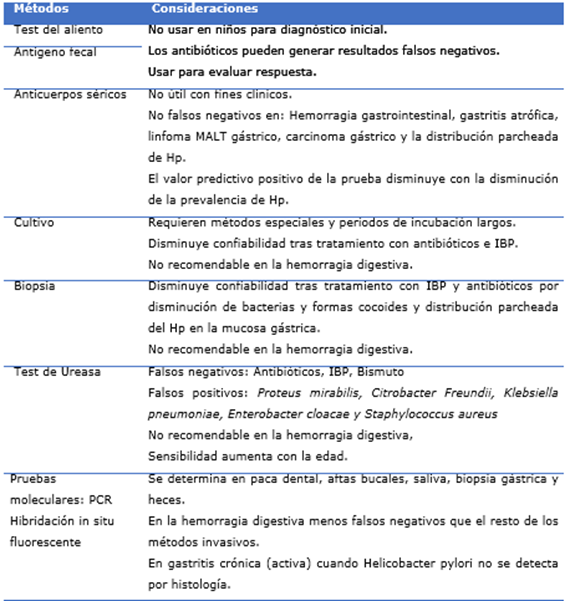
Los métodos directos o invasivos se basan en la demostración directa del microorganismo en muestras obtenidas por biopsia gástrica, los indirectos o no invasivos, se basan en el estudio y la detección de algunas características de la bacteria tales como su capacidad de hidrolizar la urea, propiedad en la que se basa la prueba del aliento o de la respuesta del sistema inmunitario (Tabla 1). 5,9,33,34
Consideraciones
EL objetivo principal de la investigación clínica de los síntomas gastrointestinales debe ser determinar la causa subyacente de los síntomas y no la presencia de Hp. No hay datos que respalden el papel de la infección como causa de los síntomas en ausencia de UPGD o erosiones.
En los casos de dolor abdominal en los que se considera una causa orgánica, se debe realizar una endoscopia diagnóstica superior en lugar de una prueba no invasiva.
Durante la endoscopia se deben tomar biopsias adicionales para la prueba de detección rápida (Test de ureasa) y los cultivos, solo si es probable que se ofrezca tratamiento si se confirma la infección. Si la infección es un hallazgo incidental en la endoscopia o se visualiza nodularidad antral sin erosiones o UPGD, el tratamiento puede considerarse después de una discusión cuidadosa con el paciente y los padres. Al ofrecer tratamiento a niños sin erosiones o úlcera, se debe explicar que no es probable que la infección sea la causa de los síntomas, y por lo tanto, no se esperaría que el tratamiento curara sus síntomas. La discusión con los padres o los niños mayores debe incluir el riesgo potencial de desarrollar complicaciones relacionadas con la infección (UPGD, cáncer gástrico) más adelante en la vida, comparados con los riesgos potenciales del tratamiento, por ejemplo, fracaso del tratamiento, efectos adversos del uso de antimicrobianos. (9
No se debe aplicar una estrategia de prueba y tratamiento en niños. No realizar una prueba no invasiva para detectar la infección y tratar si es positiva.
Existen varias causas de erosión, ulceración gástrica o duodenal en niños. Si se visualizan durante la endoscopia superior, se deben tomar biopsias para identificar la presencia de Hp.
Se debe esperar al menos dos semanas después de suspender los IBP y cuatro semanas los antimicrobianos para realizar pruebas de detección de Hp. Se aplican para diagnosticar o excluir la infección y para monitorear el éxito del tratamiento, tanto a las pruebas invasivas como a las no invasivas. Si el IBP no puede interrumpirse durante dos semanas debido a la recurrencia de los síntomas, el cambio a un antagonista del receptor histamina 2 con la interrupción del medicamento dos días antes de la prueba, puede mejorar la sensibilidad de la prueba de diagnóstico. Los antimicrobianos pueden suprimir el crecimiento bacteriano y generar resultados falsos negativos en todos los métodos de diagnóstico aplicados, excepto la serología que no se recomienda. Antes de la endoscopia, el niño y los cuidadores deben obtener un historial preciso de la ingesta de medicamentos durante las cuatro semanas anteriores.
El sangrado activo disminuye la sensibilidad de las pruebas de infección basadas en biopsias.
No realizar pruebas de diagnóstico para la infección en niños con dolor abdominal funcional (DAF).
No realizar pruebas de diagnóstico para la infección como parte de la investigación inicial en niños con anemia por deficiencia de hierro. Se sugiere en anemia refractaria en las que se hayan descartado otras causas, considerar las pruebas para Hp durante la endoscopia superior. Si la endoscopia superior está indicada clínicamente en el manejo de anemia refractaria a la terapia de hierro, se pueden considerar las biopsias para el diagnóstico. Los factores de riesgo para anemia por déficit de hierro y Hp son similares. Muchos niños tienen anemia concomitante e infección por Hp y no existe una relación causal entre ellas. (9,35 La posibilidad de que pueda deberse a una pérdida de sangre asociada con la úlcera/erosiones o la captación de hierro por parte de las bacterias debe considerarse en niños con anemia refractaria que no han respondido a la terapia de suplementación de hierro inicial, recaída o que tienen otros síntomas de alarma. (9,35
Los pacientes en los que se investiguen las causas de púrpura trombocitopénica inmune crónica (PTI), se deben considerar pruebas de diagnóstico no invasivas. Si la prueba es positiva, debe decidirse de forma individual y dependiendo del recuento de plaquetas si se necesita una endoscopia superior antes de la terapia de erradicación. (36
No investigar presencia de Hp cuando se investiguen las causas de baja estatura. La infección por Hp con la baja estatura se asocia con un bajo nivel socioeconómico, incluida una nutrición deficiente. (9
Las pruebas basadas en anticuerpos (inmunoglobulina IgG, IgA) para Hp en suero, sangre total, orina y saliva en el entorno clínico no deben utilizarse para detectar la presencia de infección activa por Hp o para su uso en la
evaluación posterior al tratamiento en niños o adolescentes. (9
Diagnóstico
Métodos invasivos basados en biopsia gástrica:
Cultivo bacteriano positivo o gastritis por Hp en histopatología según clasificación de Sydney, (37 con al menos otra prueba positiva, como test de ureasa, o pruebas de base molecular cuando estén disponibles, incluida reacción en cadena de polimerasa (PCR) o hibridación in situ fluorescente. (9
Gastritis por Hp en histopatología y una prueba positiva no invasiva en los casos en que la histología positiva es la única prueba invasiva disponible. (9
Ninguna de las pruebas de diagnóstico disponibles tiene una precisión del 100 %. Sin embargo, el cultivo bacteriano es 100 % específico. (9,38
Tratamiento
Aspectos a considerar para la selección del tratamiento:
Área geográfica, sensibilidad antimicrobiana, edad, antecedentes de tratamientos previos con macrólidos, nitroimidazoles quinolonas y alergia a medicamentos
El Hp reside por lo general dentro del moco presente en la cámara gástrica. La gran mayoría de los microorganismos permanecen en un estado no replicativo (pero viable), que convierte a la bacteria en fenotípicamente resistente, dado que se reduce ostensiblemente la capacidad de los antimicrobianos, en especial AMO y CLA, para destruir la bacteria. Este estado es mucho más frecuente cuando el pH de la cámara gástrica oscila entre tres y seis. Cuando el pH gástrico sube por encima de seis y siete, la bacteria entra en un estado replicativo, y se hace más susceptible a la AMO y a CLA. Cuanto más potente sea la supresión ácida, mayor será la capacidad de éxito del tratamiento con antimicrobianos. (5,9
Los IBP sufren un proceso de metabolización hepática mediante el citocromo CYP450 (principalmente por su isoforma CYP2C19) y existen diferencias interindividuales en el genotipo CYP2C19, que pueden influir en la eficacia clínica del fármaco. (9 Se describen en la actualidad tres fenotipos derivados de los polimorfismos genotípicos: metabolizadores rápidos, intermedios y lentos. La tasa de metabolizadores rápidos es muy elevada en Europa y América (56-81 %) y muy inferior en los países asiáticos (27-38 %). A dosis equivalentes de IBP, las tasas de erradicación son inferiores en metabolizadores rápidos, debido a una degradación más rápida y menor vida media de los IBP. Por lo tanto, todos los pacientes en Europa y América, dada la elevada probabilidad de ser metabolizadores rápidos, deberían recibir dosis elevadas diarias de IBP. (5,9,39
De hecho, las guías de consenso publicadas por Malfertheiner P et al., 5 Gisbert JP et al. 39 y Fallone CA et al. 40) recomiendan el uso de dosis altas de IBP en las terapias triples. Un nuevo supresor de la secreción ácida ha sido recién incorporado al arsenal terapéutico: vonoprazán, que funciona mediante inhibición competitiva de los canales de potasio, mecanismo distinto de los IBP. En la actualidad este fármaco sólo se encuentra disponible en Japón y Corea. Este nuevo fármaco ha demostrado conseguir una supresión ácida inmediata, potente y sostenida. (41,42 Para obtener una elevada tasa de cicatrización ulcerosa duodenal es suficiente con el empleo de un IBP durante el periodo de administración de los antimicrobianos. En la úlcera gástrica, sin embargo, se carece de información para establecer recomendaciones definitivas al respecto.
Los incrementos de la resistencia antimicrobiana unida a la ausencia de alternativas terapéuticas, hacen necesario aumentar la duración de todos los tratamientos a 14 días. (5,9,41,42
En relación a las terapias cuádruples, múltiples terapias sin bismuto (concomitante, secuencial, híbrida) y con bismuto (BIS) (clásica, nuevas terapias cuádruples combinando IBP + BIS + dos antimicrobianos) han demostrado, en general, mejores tasas de eficacia con duraciones de dos semanas. 5,9,42,43
Se deben tener en cuenta una serie de factores claves para adoptar la opción terapéutica con mayor probabilidad de ser eficaz en cada individuo. Se ha establecido un umbral teórico de eficacia: (excelente >95 %, bueno 90-95 %, regular 85-89 %, malo 81-84 % e inaceptable ≤ 80 %). (9
La creciente tasa de resistencia en especial CLA, MET y levofloxacino (LEV), es la causa más frecuente de fallo del tratamiento erradicador. 5,44,45,46 Se debería conocer la susceptibilidad a antibióticos para diseñar un tratamiento ideal, pero la realidad es que la mayoría de los tratamientos se prescriben de forma empírica. Por lo tanto, esta elección se debe hacer al tener en cuenta variables dependientes de la bacteria y del individuo.
Se debe conocer las tasas de resistencia a antibióticos locales, y en caso de desconocerlas, hacer una estimación de las mismas según la eficacia local de los tratamientos utilizados. (9,47
Interrogar al paciente acerca de tratamientos previos con macrólidos (faringoamigdalitis, infecciones en vías respiratorias altas), nitroimidazoles (tricomonas, giardiasis, amebiasis) y quinolonas (esencial en infecciones en tracto urinario y respiratorio). Si no es el primer tratamiento erradicador, una regla de oro es nunca repetir CLA y LEV si se utilizaron antes, por generación frecuente de resistencias secundarias. (9
El MET también genera resistencias secundarias, pero con la particularidad de que éstas pueden ser por partes superadas con el uso ulterior de dosis altas con duraciones prolongadas (14 días). Por el contrario, BIS, AMO y tetraciclina (TET) pueden volver a ser usados, ya que, tras la exposición a dichos antimicrobianos, la bacteria desarrolla resistencia secundaria en menos del 5 % de los casos. (5,9,45,46
Comentario
a) Los patrones de resistencia a los antimicrobianos varían según las regiones nacionales y geográficas y son un factor importante para determinar el éxito de la terapia de erradicación.
b) El fracaso del tratamiento de los regímenes en la práctica habitual a menudo se asocia con una elección inadecuada del régimen de tratamiento, falta de adherencia (la ingesta de medicamentos de <90 % de la dosis de medicación prescrita), resistencia a los antimicrobianos y a las formas cocoides.
c) Se debe explicar a la familia la importancia de la adherencia a la terapia para la erradicación exitosa.
d) Se recomienda como terapia de primera línea para la infección lo descrito en la (Tabla 2).
Tabla 2 Primera línea de tratamiento, 9
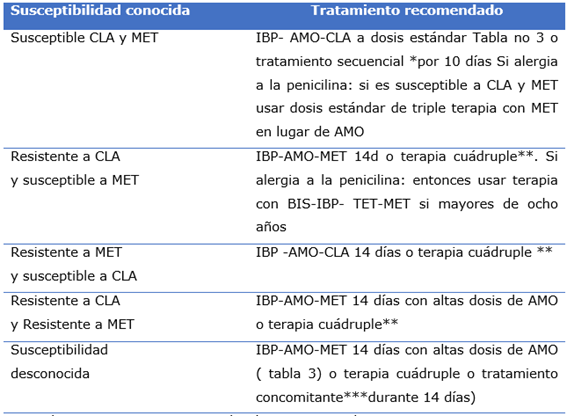
CLA: claritromicina MET: metronidazol AMO: amoxicilina
IBP: inhibidores de la bomba de protones TET: tetraciclina
BIS: bismuto* Tratamiento secuencial: IBP-AMO durante 5 días seguido del IBP-MET-CLA durante 5 días **Terapia cuádruple:( BIS-IBP- AMO - MET)
*** Terapia concomitante :(IBP-AMO-MET-CLA).
e) Si la cepa es susceptible a la CLA y MET, la opción preferida es la terapia triple (IBP, AMO, CLA durante 14 días). En comparación con la terapia secuencial, este régimen no inducirá resistencia al MET. En caso de fracaso del tratamiento con PPI, AMO y CLA, se puede hacer un cambio a IBP, AMO y MET sin más pruebas de susceptibilidad. (9
f) El tratamiento secuencial es igualmente efectivo en pacientes infectados con cepas totalmente susceptibles. Sin embargo, tiene la desventaja de exponer al niño a tres antimicrobianos diferentes. No usar si la cepa es resistente a MET-CLA, o si no se dispone de pruebas de sensibilidad. (5,9,45,46
g) Las dosis de IBP y antimicrobianos deben calcularse según el peso corporal como se muestra en la (Tabla 3).
h) Los niños más pequeños necesitan una dosis más alta de IBP por kg de peso corporal en comparación con los adolescentes y adultos para obtener una supresión de ácido suficiente. (9 El esomeprazol y el rabeprazol son menos susceptibles a la degradación por los metabolizadores rápidos, y por lo tanto, pueden ser preferibles cuando estén disponibles.
i) La dosis de IBP deben administrarse por lo general 15 minutos antes del desayuno y de la comida.
j) La evidencia actual no respalda la adición de rutina de probióticos únicos o combinados a la terapia de erradicación para reducir los efectos secundarios o mejorar las tasas de erradicación. (5,9
k) El éxito del tratamiento se ve afectado negativamente si la cepa es resistente a uno de los antibióticos utilizados.
l) Estas terapias recomendadas deben basarse en el conocimiento de las pruebas de sensibilidad de antimicrobianos. Si no se ha utilizado una terapia triple basada en claritromicina, esta no debe utilizarse como terapia de primera línea en zonas con altas de tasas de resistencia a la claritromicina. Una de las causas de la resistencia a la claritromicina se debe al consumo previo (hasta un período de 10 a 12 años) de otros macrólidos. (47,48
m) Las terapias cuádruples basadas en BIS tienen tasas de erradicación más altas que la terapia triple estándar. Se recomienda la terapia cuádruple de BIS (cuando esté disponible) en niños si se desconoce la susceptibilidad antimicrobiana o en el contexto de la resistencia dual a la CLA y al MET. La otra terapia recomendada en este contexto es la terapia triple de AMO en dosis altas, como se puede ver en la tabla tres. La evidencia que apoya este régimen es limitada. (5,9
n) En caso de fallo de erradicación el paciente debe recibir la terapia de rescate como se describe en la (Tabla 4).
Tabla 4 Terapia de rescate, (9

CLA: claritromicina MET: metronidazol AMO: amoxicilina
IBP: inhibidores de la bomba de protones TET: tetraciclina
BIS: bismuto.
o) El alivio de los síntomas no es un indicador para un tratamiento exitoso, se debe evaluar el éxito con una prueba confiable.
p) En los pacientes con UPGD sin complicaciones, rara vez se necesitan pruebas endoscópicas y biopsias para confirmar la erradicación. Tienen un bajo riesgo de recaída con la eliminación de la infección.
q) Los métodos en la práctica clínica para confirmar la erradicación no detectan las formas cocoides, por lo que, el huésped podría ser diagnosticado incorrectamente como libre de infección; Sería recomendable un seguimiento anual con técnicas no invasivas, en especial en las zonas de alta prevalencia y en los pacientes con factores de riesgo de recurrencia de la infección, o de disponerse, utilizar métodos moleculares para determinar la erradicación después del tratamiento. (9,48
En el período 2007-2008, el Laboratorio Nacional de Referencia de Neisserias y Helicobacter del Instituto de Medicina Tropical Pedro Kourí (IPK), investigó la sensibilidad de 70 aislados obtenidos de niños y adultos, de tres hospitales de La Habana, reportándose resistencia elevada a metronidazol (85,7 %), resistencia baja a ciprofloxacina (14,2 %), claritromicina (11,4 %) y amoxicilina (2 %) y no se encontró aislado resistente a tetraciclina. También fueron identificadas mutaciones en los genes rdxA y 23SARNr, relacionadas con resistencia a metronidazol y claritromicina. (49
En la actualidad existen varios reportes en los que se recomienda en áreas de alta resistencia al metronidazol el uso de dosis elevadas y prolongación del tratamiento durante 14 días para superar la resistencia a ese antibiótico. (5,9,12,42 También está demostrado que la resistencia es mayor cuando es usada como monoterapia y aumenta con la edad. (50,51,52
CONCLUSIONES
En nuestro país la selección adecuada del tratamiento para la infección por Hp es compleja y se impone pautas de tratamientos empíricos, por tanto, el tratamiento debe ser individualizado. No se recomienda un tratamiento secuencial como primera línea. Se sugiere extensión del tratamiento con antibióticos por 14 días con elevadas dosis de IBP. Se debe considerar el tratamiento con claritromicina sino existe antecedentes de tratamientos previos con macrólidos y si no se cuenta con claritromicina y ha realizado tratamientos previos con amoxicilina y metronidazol, considerar tratamiento con bismuto o dosis altas de amoxicilina.
Garantizar el éxito de la erradicación de Hp en todas sus formas biológicas y sostenerlo en el tiempo evita recaídas y la aparición de complicaciones.