Introducción
Salmonella enterica se encuentra asociada a infecciones gastrointestinales y septicemia en el hospedero humano, gracias a su capacidad de invasión celular y sobrevivencia intrafagocítica. La mayoría de los genes involucrados en el proceso de invasión a las células epiteliales, se encuentran localizados en la isla de patogenicidad 1 (SPI-1). Estos genes median la formación de un primer sistema de secreción tipo 3 (SST3), encargado de translocar las proteínas efectoras en el citosol de la célula eucariota promoviendo cambios en el citoesqueleto y facilitando el ingreso de la bacteria por macropinocitosis. Los genes localizados en la isla SPI-2 regulan la supervivencia y replicación bacteriana en los compartimientos intracelulares de fagocitos y células epiteliales, mediante la formación de un segundo SST3.1,2
Para comprender estos procesos de interacción entre patógenos y hospederos humanos se han utilizado diversos modelos animales, que han contribuido de manera significativa en el conocimiento de la fisiopatogenia de la enfermedad que ocasionan.3,4 En relación al estudio de la infección ocasionada por Salmonella se han utilizado voluntarios humanos, monos, terneros, vacas, asas de íleon de conejos y roedores.5 Entre los modelos mencionados destaca el murino, donde la posibilidad de manipular genéticamente la bacteria o la respuesta inmunológica del hospedero (ratón) permite estudiar las variaciones de la severidad de la enfermedad y facilitar la evaluación de las relaciones patogénicas entre la bacteria y el hospedero. En este orden de ideas, los análisis comparativos han revelado sorprendentes similitudes entre los mecanismos inmunológicos y genéticos que regulan la interacción de S. enterica y sus hospederos, tales como ratones, humanos y animales domésticos. Estos modelos experimentales en Salmonella han permitido la extrapolación de los hallazgos fisiopatológicos a otras infecciones bacterianas, causadas principalmente por enteropatógenos.5-7
En este sentido, se ha demostrado que los ratones BALB/c son particularmente susceptibles a la infección por Salmonella porque portan una mutación en el locus que codifica la proteína de macrófagos asociada a la resistencia natural (Nramp-1). Esta proteína participa en los mecanismos de la resistencia o susceptibilidad innata a las infecciones causadas por patógenos intracelulares.8 En Venezuela son escasos los trabajos que han incorporado modelos experimentales en animales asociados con el análisis ultraestructural para el estudio de los procesos de patogenicidad en bacterias entéricas.9,10
Con la finalidad de contar con un modelo animal que permita evaluar mutantes de genes involucrados en la patogenia de Salmonella, se evaluaron dos modelos in vivo empleando ratones BALB/c, en cepas de Salmonella Typhimurium con mutaciones en los genes invG/invE de la Isla de Patogenicidad de Salmonella 1 (SPI-1) y de los genes ssaJ/ssaK en la SPI-2.
Materiales y Métodos
Cepas de S. Typhimurium
En este estudio se utilizaron un total de 6 cepas de S.Typhimurium SL-1344 y S. Typhimurium LMM87 correspondiente a las colecciones del Centro de Biología Molecular "Severo Ochoa", Universidad Autónoma de Madrid, España y del Laboratorio de Microbiología Molecular, Universidad de Los Andes, Mérida, Venezuela, respectivamente. Las mutantes derivadas SL-1344/∆SPI1-R, SL-1344/∆SPI2-R y LMM87/∆SPI1, LMM87/∆SPI2 fueron obtenidas en un estudio anterior realizado por Velasco y col. (2010)11. Las características de las cepas se describen en la Tabla 1.
Tabla 1 Cepas de Salmonella Typhimurium empleadas en este estudio.
| Características | Origen o referencia | |
|---|---|---|
| SL-1344 | Cepa de referencia y control positivo | Co. CBMSO |
| SL-1344/∆SPI1-R | Cepa derivada de |
Velasco y col. 2010 |
| SL-1344/∆SPI2-R | Cepa derivada de |
Velasco y col. 2010 |
| LMM87 | Cepa de origen clínico | Co. LMM |
| LMM87/∆SPI1 | Cepa derivada de |
Velascoy col. 2010 |
| LMM87/∆SPI2 | Cepa derivada de |
Velascoy col. 2010 |
Co. CBMSO: Colección Centro de Biología Molecular "Severo Ochoa", Universidad Autónoma de Madrid, España; Co. LMM: Colección Laboratorio de Microbiología Molecular Universidad de Los Andes, Mérida, Venezuela; SPI: Isla de Patogenicidad de Salmonella.
Animales
Se utilizaron ratones BALB/c provenientes del Bioterio de la Facultad de Ciencias de la Universidad de Los Andes, Mérida, Venezuela. Los animales se mantuvieron en jaulas de polipropileno a una temperatura promedio 21°C ± 3 alimentados con ratarina comercial (Protinal®, Caracas, Venezuela) y con agua esterilizada ad libitum en un ambiente de 12 horas de luz y 12 horas de oscuridad.
Todos los procedimientos que se describen a continuación fueron aprobados y realizados según la normativa del Comité de Bioética del Bioterio de la Universidad de Los Andes, Mérida-Venezuela para la manipulación de animales de experimentación.
Modelo asa intestinal ligada de ratón
Para estos ensayos inicialmente se prepararon inóculos bacterianos conteniendo 3 x 109 UFC/mL de las cepas: SL-1344, LMM87, SL-1344/∆SPI1-R, SL-1344/∆SPI2-R, LMM87/∆SPI1, LMM87/∆SPI2 a partir de cultivos frescos en caldo Luria Bertani (LB).
El modelo de asa intestinal ligada de ratón se realizó de acuerdo a la metodología descrita por Jones y col. 1994.12 Se utilizaron siete ratones hembra BALB/c de 7 a 8 semanas de edad, los cuales se mantuvieron en ayuna por 24 horas previo al ensayo, con la finalidad de vaciar el contenido intestinal. Estos ratones fueron anestesiados con 240 mg/kg de Ketamina (Fort Dodge®) vía intradérmica y comprobado el efecto anestésico, se procedió a realizar una incisión en el abdomen de aproximadamente 2 cm de longitud para exponer el intestino delgado. El intestino fue ligado con hilos de seda en los extremos ileocecal y a 4 ó 5 cm del ciego y con una aguja calibre 25, se introdujo a la luz intestinal 200 μL del inóculo bacteriano. El intestino fue retornado a la cavidad abdominal y los ratones fueron mantenidos vivos bajo anestesia durante 1 hora. Posteriormente, se realizó la eutanasia con una sobredosis del anestésico empleado y el asa intestinal fue retirada de inmediato para su procesamiento y análisis ultraestructural por MET. En estos ensayos se utilizaron como control positivo y negativo la inoculación de un ratón con la cepa S. Typhimurium SL-1344 y otro inoculado con 200 μL de caldo LB estéril, respectivamente.
Preparación de las muestras para microscopía electrónica de transmisión
La preparación de las muestras para MET se realizó de acuerdo a la metodología descrita por Longa-Briceño y col. 2006.9 Se realizaron cortes cilíndricos intestinales de aproximadamente 3 cm de largo y se colocaron en una solución fijadora de glutaraldehído al 3% y formaldehído al 3%, preparada en tampón de cacodilato 0,1M a pH 6,3; durante 5 h a 4 °C. Transcurrido este tiempo, el tejido se seccionó en segmentos de 3 mm3 aproximadamente, y se colocaron en la mezcla fijadora durante 1 h. Posteriormente, el material se lavó en una solución tampón de cacodilato y se post-fijó por 18 h con tetraóxido de osmio (OsO4) al 1%. Cumplido el tiempo de post-fijación se lavó nuevamente con solución tampón y se continuó con el proceso de deshidratación utilizando alcohol etílico (C2H6O) en concentraciones ascendentes (30%, 50%, 80% y 100%) y óxido de propileno (C3H6O). Finalmente, el tejido se infiltró y se incluyó en resina epoxídica Epon 812, manteniéndose a 60°C durante 48 horas. Concluido este proceso se realizaron cortes de 90 nm de espesor y se contrastaron con acetato de uranilo y citrato de plomo, para luego ser observados bajo microscopía electrónica de transmisión (Hitachi H-7000).
Modelo de salmonelosis sistémica en ratón
El modelo de salmonelosis sistémica en ratón se realizó según la metodología descrita por Wood y col. 199813 con algunas modificaciones, las cuales se describen a continuación. Para este ensayo se seleccionaron las cepas derivadas mutantes SL-1344/∆SPI1-R y SL1344/∆SPI2-R. A partir de cultivos frescos en agar LB de cada cepa, se tomó una colonia y se subcultivó en 5 mL de caldo LB, incubándose por 16 horas a 37 °C hasta obtener un crecimiento bacteriano en fase estacionaria. De este cultivo se preparó una suspensión con solución salina fisiológica (SSF) ajustada a la turbidez equivalente al Patrón N° 0.5 de MacFarland (1,5 x 108 UFC/mL), y se tomaron 200 μL (3 x 107 UFC), la cual fue introducida a los ratones por vía oral.
En este modelo se utilizaron 10 ratones hembra BALB/c de 6 a 8 semanas de edad, los cuales se mantuvieron en ayuna por 4 horas previo al ensayo. Posterior a la ingesta de la suspensión bacteriana, se les suministró agua y luego de dos horas el alimento. La eutanasia de los ratones se realizó por dislocación cervical cuatro días posteriores a la infección y se les retiró de manera aséptica el hígado y el bazo, los cuales se homogeneizaron con 1 mL de SSF de manera independiente.14 Posteriormente, se realizaron diluciones seriadas de cada uno de los homogeneizados y el contaje de las bacterias viables se realizó en agar selectivo y diferencial Shigella-Salmonella (HiMedia®, India).15
Se sometieron al ensayo tres ratones por cada cepa incluyendo al control positivo y los resultados se expresaron como la media del número de bacterias viables (UFC) recuperadas a partir de cada órgano ± 1 desviación estándar. En estos ensayos se utilizaron como control positivo y negativo la inoculación de un ratón con la cepa S. Typhimurium SL-1344 y otro inoculado con 200 μL de SSF estéril, respectivamente.
Resultados
Modelo asa intestinal ligada de ratón
Para valorar los cambios morfológicos producidos por las cepas estudiadas sobre el epitelio intestinal, fue necesario inicialmente observar los cortes de intestino correspondiente al ratón considerado como control negativo. En las Figuras 1A y 1B se muestran las microfotografías por MET que demuestran la estructura del epitelio intestinal sin alteraciones.

Fig. 1 Microfotografías electrónicas de transmisión de una sección de tejido intestinal a nivel de una Placa de Peyer de ratón no infectado. A) La célula M (M) se diferencia de los enterocitos (E) adyacentes por sus microvellosidades más cortas y una mayor electrodensidad. B) Enterocitos (E) de tejido normal.
En la Figura 2, microfotografías A, B y C, se demuestra el proceso de infección del epitelio intestinal por S. Typhymurium SL-1344 y LMM87; iniciándose con una aproximación de la cepa de Salmonella al epitelio (A), posteriormente se establece el contacto (B) para luego, finalmente penetrar los enterocitos produciéndose, de esta manera, los cambios morfológicos de las microvellosidades (C) tales como: rearreglo del citoesqueleto evidenciado por la invaginación del epitelio intestinal e inicio de la penetración de Salmonella.

Fig. 2 Microfotografías representantivas de la adherencia e invasión de células epiteliales de un asa ligada de intestino de ratón después de 60 min de infección por S. TyphymuriumSL-1344 y/o LMM87 (cepas invasivas). A) Se observan bacterias (flechas) en la luz intestinal próximas a las microvellosidades (mv). B) Salmonella (S) en contacto directo con la microvellosidad. C) Salmonella en proceso de penetración al enterocito; se observan cambios morfológicos de las microvellosidades (mv) evidenciado por la invaginación del epitelio (flechas).
La observación de los tejidos infectados indistintamente de la cepa mutada SL1344/∆SPI1-R y LMM87/∆SPI1 reveló cambios en las microvellosidades de los enterocitos (Fig. 3 A). Estas alteraciones morfológicas se evidenciaron por la pérdida de la regularidad natural del epitelio, así como la aparición de espacios libres o vacíos en la estructura epitelial y liberación de detritos epiteliales en forma de vesículas ovoidales y otras de configuración irregular. En los cortes intestinales donde se logró observar bacterias, las mismas permanecieron separadas del epitelio intestinal (Fig. 3 B).
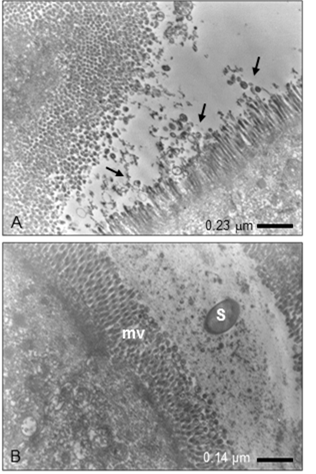
Fig. 3 Microfotografías representantivas de las células epiteliales de un asa ligada de intestino de ratón después de 60 min de infección por S. Typhymurium mutadas en SPI-1 (SL-1344 /∆SPI1-R y/o LMM87/∆SPI1). A) No se observan bacterias, sólo cambios en las microvellosidades (flechas), evidenciado por daño en la zona apical con liberación de detritos epiteliales en forma de vesículas ovoides e irregulares. B) Salmonella (S) se encuentra distante de la superficie de las microvellosidades (mv)
Finalmente, las bacterias mutadas en la SPI-2 (SL1344/∆SPI2-R y LMM87/∆SPI2-R) ocasionaron modificaciones en las microvellosidades (Fig. 4 A) y el rearreglo del citoesqueleto con cambios en la estructura del enterocito, el cual adquirió forma de copa con prolongaciones electrodensas que sugirieron la invaginación observada en los procesos de macropinocitosis (Fig. 4 B).
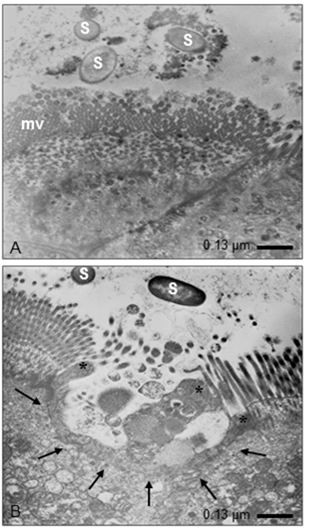
Fig. 4 Microfotografías representantivas de las células epiteliales de un asa ligada de intestino de ratón después de 60 min de infección por S. Typhymurium mutadas en SPI-2 (SL-1344 /∆SPI2-R y/o LMM87/∆SPI2). A) Se observan bacterias (S) muy próximas a las microvellosidades (mv) con cambios morfológicos de estas. B) Muestra que Salmonella induce cambios evidentes en la superficie del enterocito, la cual cambia su regularidad superficial (flechas), y emite prolongaciones electrodensas (asteriscos).
Modelo de salmonelosis sistémica en ratón
La infección sistémica fue demostrada con la recuperación de 4,03 x 106 ± 1 UFC y 2,5 x 107 ± 1,5 UFC en hígado y bazo, respectivamente en ratones infectados con la cepa SL-1344. Por el contrario, no se observó desarrollo bacteriano en los cultivos de órganos homogeneizados de los ratones inoculados con las cepas mutantes de SL-1344/∆SPI1-R y SL1344/∆SPI2-R (Tabla 2).
Tabla 2 Contaje de bacterias viables cuatro días post-infección en el modelo de salmonelosis sistémica en ratones BALB/c.
| Contaje post-infección (UFC/mL) | ||||
|---|---|---|---|---|
| Ratón inoculado con | Inóculo inicial (UFC/mL) | Hígado | Bazo | |
| SL-1344 | Cepa invasiva | 3 x 107 ± 1 | 4,03 x 106 ± 1 | 2,5 x 107 ± 1,5 |
| SL-1344 /∆SPI1-R | Cepa mutada en SPI-1 | 3 x 107 ± 1 | 0 | 0 |
| SL-1344/∆SPI2-R | Cepa mutada en SPI-2 | 3 x 107 ± 1 | 0 | 0 |
| Inóculosinbacterias | Caldo LB | 0 | 0 | 0 |
SPI: Isla de patogenicidad de Salmonella, media ± 1 desviación estándar. UFC: Unidades formadoras de colonia. LB: Luria Bertani.
Discusión
La comprensión de los mecanismos de virulencia de patógenos bacterianos que colonizan el tracto intestinal, así como la respuesta del hospedero a este nivel, es esencial para el desarrollo de medidas preventivas y nuevos agentes terapéuticos. En tal sentido, se han descrito diversos modelos animales para evaluar la interacción de Salmonella-hospedero, el modelo de asa intestinal ligada de ratón y la observación de los tejidos por MET realizado en este estudio, permitió evaluar la pérdida de la capacidad invasiva en las cepas de S. Typhimurium mutadas en la SPI-1 con deleción de los genes invG/invE, al observar sólo un ligero daño en el epitelio intestinal del ratón, con formación de vesículas ovaladas en la zona apical de las microvellosidades (Fig. 3 A), lo cual pudiera atribuirse al resto de los factores de virulencia descritos en este microorganismo que en este estudio no fueron alterados.1,5
En el caso de las cepas de S. Typhimurium mutadas en la SPI-2 mostraron la capacidad de adherirse al epitelio intestinal e inducir el rearreglo del citoesqueleto para promover la fagocitosis característica de Salmonella (Fig. 4 B), como primer paso en la invasión de las células del hospedero, ya que la SPI-1 permaneció intacta. Estos resultados confirman la importancia de los genes inv de la SPI-1 que codifican el SST3 indispensable para el proceso de invasión de células eucariotas. En este caso la proteína InvG participa en la formación del anillo externo de la base del complejo aguja y la proteína InvE permite el correcto ensamblaje del SST3. De esta manera, el SST3 interviene en la regulación del proceso de secreción, disparando los eventos intracelulares que permiten la invasión.15-20
El segundo modelo animal evaluado en este estudio, salmonelosis sistémica en ratón, permitió determinar la capacidad de diseminación de S. Typhimurium desde el epitelio intestinal hasta otros órganos como hígado y bazo, evaluando de esta forma el efecto biológico de las mutaciones en la SPI-1 y SPI-2. Las cepas mutadas en las SPI-1 y SPI-2 perdieron la capacidad de producir salmonelosis sistémica en el ratón, esto fue evidenciado por la observación de cultivos negativos de los órganos homogeneizados (hígado y bazo) 4 días post-infección. Estos resultados se correlacionan con el estudio realizado por Coburn y col. 2005,19 quienes inocularon ratones vía oral con S. Typhimurium SL-1344 y células mutantes en los genes invA (SPI-1) y ssaR (SPI-2) derivadas de esta cepa, los resultados revelaron translocación bacteriana intestinal y diseminación a hígado y bazo, y enfermedad sistémica fatal solo en el ratón infectado con la cepa invasiva.
Los resultados de este estudio permiten sugerir el modelo de asa intestinal ligada de ratón y observación de los tejidos por MET para la comprensión de la fisiopatología de la enfermedad diarreica aguda, mediante la observación de los eventos que implican la adherencia bacteriana y posterior invasión del epitelio intestinal por patógenos entéricos. Por otra parte, el modelo de salmonelosis sistémica en ratón permitió evaluar la capacidad de diseminación de un agente bacteriano a partir del epitelio intestinal a otros órganos y tejidos como el bazo y el hígado, mecanismo de virulencia con gran relevancia en algunos patógenos que facilitaría el estudio de su fisiopatogenia.
Conclusiones
Los modelos experimentales de infección in vivo empleando ratones BALB/c en este estudio, permitieron verificar la importancia que tienen los genes invG/invE de la SPI-1 y ssaJ/ssaK de la SPI-2 en la patogenia de la infección ocasionada por Salmonella, al observar la pérdida de la capacidad de invasión y diseminación de las mutantes de S. Typhimurium (ΔSPI-1 y ΔSPI-2).
Los resultados obtenidos en este estudio confirman la eficacia de este modelo animal para reproducir la enfermedad, el análisis ultraestructural por MET facilitó la observación en los tejidos de las lesiones compatibles con la salmonelosis.
Se sugieren estos modelos in vivo para evaluar mutantes de genes implicados en la patogenia de Salmonella, ya que representan una herramienta importante para investigar y comprender la interacción Salmonella-hospedero.














