Introducción
El tétanos es una enfermedad causada por Clostridium tetani, bacteria Gram positiva, anaeróbica, flagelada, móvil y formadora de esporas.1 Esta produce una neurotoxina muy potente, la tetanoespasmina que provoca rigidez muscular, espasmos, en particular en la mandíbula y la nuca y es generalmente mortal.1,2 Ésta afecta a los humanos tras sufrir heridas contaminadas; pero en particular, a los recién nacidos y a las parturientas en condiciones higiénicas deficientes, donde produce el tétano neonatal y materno, respectivamente.3 La tetanoespasmina producida se disemina en dirección central a través del transporte intra-axonal a lo largo de los nervios motores de la médula espinal. También se puede diseminar por vías hematógena o linfática. Ésta altera el control normal del arco reflejo y suprime la inhibición mediada por las neuronas pos-sinápticas al bloquear la liberación de los neurotransmisores glicina y gamma-amino-butírico. Esta inhibición permite que la neurona motora inferior aumente el tono muscular y produzca rigidez.4
El tétano es una enfermedad de distribución mundial, pero rara en la actualidad en los países bien desarrollados y en Cuba con programas de vacunación bien establecidos. En los países menos desarrollados se desconoce la magnitud real del problema por su incompleta notificación; pero si se sabe que es un problema prioritario de salud, sobre todo el tétanos neonatal.5. No obstante, aún existen unos 57 países en los que el tétanos se considera una de las enfermedades principales.6
El tétano continúa presentándose fundamentalmente en África y Asia. En África el problema es más grave en Ruanda, Burundi y Etiopía y en Asia la mayoría de los casos ocurren en el subcontinente indio y en el sudeste asiático.4 Su eliminación vía materno-infantil fue un objetivo de la Organización Mundial de la Salud (OMS) para el 2005; pero en noviembre de 2012, aún existen 31 países que no lo habían alcanzado. En 2010 unos 58.000 recién nacidos murieron por su causa, representando una reducción del 93% sobre la situación a finales de 1980.7
Cuba cuenta con un programa de inmunización cuyos principios son: integrado a la atención primaria; activa participación comunitaria; dirigido a toda la población; totalmente gratuito y la producción nacional de la mayoría de las vacunas, incluyendo el toxoide tetánico (TT) monovalente (vax-TET®), la vacuna triple bacteriana difteria-pertusis-tétano (DPT), la vacuna bivalente difteria-tétanos formulación pediátrica (DT), la vacuna de tétanos y dosis reducida de difteria para mayores de 7 años de edad (dT) y la pentavalente: DPT-hepatitis B (HB)-Haemophylus influenzae tipo b (Hib). También existen otras formulaciones de DPT a nivel mundial: DTwP; DTaP; dTaP. La primera formulada con células completas de pertussis y las últimas acelulares.8)
El esquema de vacunación cubano incluye: 3 dosis (pentavalente); tres reactivaciones a los 18 meses (DPT), 6 (DT) y 14 años (TT), así como refuerzos con TT cada 10 años hasta los 55 y luego cada 5 años. Además, dos refuerzos durante el embarazo en la 24 a 26 semanas, si no estaba vacunada o reactivada, con el objetivo de aumentar la transferencia de IgG antitoxina tetánica (anti TT) a la descendencia, protegiendo así no solo a la madre, sino a su recién nacido. Esto garantiza coberturas de más del 99% y haber eliminado el tétano neonatal desde 1972 y la reducción del tétano por debajo de 0,1 x 105 casos desde 1987, por lo que esta enfermedad no es un problema de salud en Cuba.8,9 No obstante, por su gravedad deben controlarse las reactivaciones imprescindibles que incluyen su refuerzo ante heridas contusas cuando se desconoce su cumplimiento, con independencia de la posibilidad de inducir reacciones de Arthus que siempre son menos graves que un tétano.8,9
La neutralización de la neurotoxina se logra a través de la inducción y permanencia sérica de anticuerpos IgG anti TT protectores. No se puede apostar a la memoria inducida por la inmunización inicial, sino que esta se emplea para producir respuestas secundarias de anticuerpos tras cada refuerzo.10
La vacunación es considerada por la OMS como la estrategia más eficiente costo-beneficio para controlar las enfermedades infecciosas. A pesar de los grandes éxitos con vacunas, muchas enfermedades contagiosas todavía son importantes causas de mortalidad, por la cobertura inadecuada de muchas vacunas. Varios factores han sido responsables de esta mortalidad: el número de dosis, alta reactogenicidad de las vacunas, los costos y las políticas de vacunación, entre otros.9
Contradictoriamente, pocas vacunas son de dosis única e incluso menos de administración mucosa. Sin embargo, las infecciones más comunes ocurren por vía mucosa, donde la inmunoglobulina A secretoria (IgAS) juega un papel esencial a nivel de la respuesta adquirida.11,12
A la luz de la meta ambiciosa de la OMS de producir vacunas que provean máxima protección en ambos compartimentos: el parenteral y el mucoso y con un número mínimo de dosis, se desarrolló esta nueva estrategia por nuestro grupo, denominada estrategia de vacunación unitemporal (SinTimVaS, ‘Single Time Vaccination Strategy’) mediante la inmunización de dos aplicaciones simultáneas: una por vía mucosa y la otra por vía parenteral. Esta induce similares respuestas de IgG sérica e IgA mucosa que al menos dos dosis parenterales y mucosas, respectivas.11,12,13,14 Para ello, se requería contar con formulaciones que funcionaran por vía mucosa. El principal problema de las vacunas mucosas es la ausencia de adyuvantes útiles por esta vía. Pérez y cols. han desarrollado una plataforma de adyuvantes denominada AFCo (Adyuvante Finlay Cocleato) derivados de Neisseria meningitis serogrupo B que funcionan por vía mucosa.15,16,17,18,19
Las esporas y las formas vegetativas del tétanos, al infectar a los humanos, atraviesan las mucosas por lo que debiera estarse induciendo respuesta inmune a este nivel, en particular su principal anticuerpo protector, la IgAS. No obstante, la inducción por la vacunación, así como, su posible papel protector no han sido explorados.
La vacuna cubana vax-TET® es adsorbida en hidróxido de aluminio (alúmina) que funciona como adyuvante y se emplea por vía intramuscular (im); pero ésta no induce respuesta mucosa. El Alusil es un medicamento de uso oral en humanos que posee propiedades antiácidas, antiurolitiásicas y antihiperfosfatémicas. Está compuesto de gel de hidróxido de aluminio desecado (0,3 g) y trisilicato de magnesio (0,2 g) por tableta.20 Así, vax-TET® pudiera funcionar por vía oral, lo que añadiría respuestas cualitativamente superiores al inducir IgAS anti TT mucosa, además de la IgG anti TT sistémica. Así, nos propusimos, evaluar el efecto de vax-TET® aplicado en SinTimVaS en ratones Balb/c y además, explorar la influencia del adyuvante sobre la inducción de la respuesta de IgA anti TT.
Materiales y Métodos
Se realizó un estudio experimental, explicativo y longitudinal prospectivo. Se emplearon ratones Balb/c hembras de 18 ± 2 g al inicio del experimento producidos por el Centro de Producción de Animales de Laboratorio (CENPALAB), Mayabeque, Cuba. Éstos fueron doblemente aleatorizados: por grupos (n=5) y tratamientos y se repitieron los ensayos al menos 3 veces. Los grupos experimentales consistieron en: SinTimVaS por vía oral e im simultáneas empleando vax-TET® una sola vez y TT formulado en AFCo1 aplicado por vía oral en 3 dosis, para valorar el efecto de un adyuvante mucoso más potente. El control negativo lo constituyeron los animales tratados con dos dosis de alúmina por vía im espaciados 14 días. Como control positivo aquellos con dos dosis de vax-TET® por vía im espaciados 14 días que es la inmunización tradicional en ratones. Otros controles incluyeron: una dosis de vax-TET® im para valorar el posible efecto de una sola dosis como ocurre en SinTimVaS; vax-TET® oral en tres dosis espaciadas 7 días para valorar la funcionabilidad de la vía oral y SinTimVaS aplicada en dos dosis orales e im empleando vax-TET® espaciados 7 días para valorar si se requerían más de una dosis simultánea. Las concentraciones de vax-TET® y TT empleadas fueron de 1,6 Lf (unidades de floculación).
Determinaciones de IgG, IgG1 e IgG2a séricas e IgA siálica anti TT
Se realizaron por un ELISA indirecto, cualitativo y no competitivo, según del Campo J y cols.21
Brevemente, se recubrieron placas de 96 pozos (Maxisorp, Nunc, EUA) con 100 µL/pozo de TT a 4 μg/mL en tampón carbonato-bicarbonato pH 9,6 por 12 h en cámara húmeda. Luego se incubaron con 150 μL/pozo de solución salina tamponada con fosfatos 0,15M pH 7,4 (SSTF)-seroalbumina bovina al 1% (solución de bloqueo) a 37ºC por 1 h. Los sueros y la saliva se diluyeron en solución de bloqueo a 1:100 y 1:1, respectivamente. Se depositaron 100 µL/pozo por duplicado y se incubaron 2 h a 37ºC. Se adicionaron 100 µL/pozo de anti IgG, o anti IgA de ratón conjugados a peroxidasa (Sigma, St. Louis, MO, EUA), diluido 1:5000 en solución de bloqueo más Tween 20, 0,1% (v/v), (solución de lavado), durante 1 h a temperatura entre 20-25ºC en cámara húmeda. Luego, se adicionaron 100 µL/pozo de una solución de peróxido de hidrógeno 0,01% (v/v) y del cromógeno ortofenilendiamina 0,6 mg/mL en solución tampón sustrato (Na2HPO4, 52 mM y ácido cítrico 25 mM, pH 5,6) y se incubaron en la oscuridad durante 30 min. Para las subclases se adicionaron 100 µL/pozo de anti IgG1, anti IgG2a biotinilados y se reveló con ortofenilendiamina. Las reacciones se detuvieron con 50 µL de una solución de H2SO4, 2 M. La densidad óptica (DO) se leyó a 492 nm en un lector SUMA PR 621 (Centro de Inmunoensayo, Cuba). Después de cada paso de incubación, las placas se lavaron tres veces con solución de lavado.
En cada placa se emplearon cuatro réplicas de un control negativo y otro positivo para suero y saliva. Se calcularon las DO promedios, sus desviaciones estándares (DE) y los límites superior e inferior (promedio ± 2 DE) de las réplicas de los controles positivo y negativo con vistas a eliminar los valores extremos. Cada placa se aceptó cuando: el promedio de las réplicas del control positivo sérico oscilaron entre 0,4-1,0 y del control negativo oscilaron entre 0,01 y 0,1 y en saliva el control positivo osciló entre 0,2-0,4 y el negativo entre 0,05 y 0,1. Si los resultados de los controles en cada placa no se encontraban entre dichos valores la placa sería rechazada y se repetirían las muestras.
Análisis estadístico
El procesamiento de los gráficos y el análisis de los resultados se realizó por GraphPad Prisma versión 5.00 (GraphPad Software, USA). La distribución normal de las variables y homogeneidad de las varianzas se realizó por Komolgorov-Smirnov respectivamente. Los resultados normales se analizaron por ANOVA de una cola, seguida de Tukey. Se consideró significación estadística cuando p≤0,05.
Resultados y Discusión
La administración de la vacuna vax-TET® adyuvada con alúmina administrada en SinTimVaS, dosis simultáneas únicas im y oral, indujeron similares respuestas de IgG anti TT que dos dosis de vax-TET im espaciadas 14 días, es decir, la vacunación convencional. La repetición de SinTimVaS en dos dosis espaciadas 7 días no incrementó la respuesta de IgG anti TT sérica ni tampoco el cambio de vía de la oral a la nasal.
Por otra parte, vax-TET® en una sola dosis indujo una respuesta significativamente menor (p<0,001) que con dos dosis o SinTimVaS. Tres dosis orales de vax-TET® espaciadas 7 días no indujeron IgG anti TT sistémico (Fig. 1).
Todas las formulaciones que indujeron IgG anti TT indujeron respuesta de IgG2a (Fig. 2) e IgG1, lo que se corresponde con la gran inmunogenicidad del TT y sus vacunas y su inmunopolarización hacia un patrón Th1. No se logró determinar la inducción de respuesta de IgA específica en saliva en los grupos inmunizados con SinTimVaS en una o dos dosis ni tres dosis orales de vax-TET®. No obstante, al cambiar el adyuvante de alúmina por AFCo1 coadministrado con TT en 3 dosis orales se indujo similares respuestas de IgG e IgG2a anti TT sérica (Fig. 1 y 2) que con dos dosis de vax-TET im y se adicionó la inducción de IgA anti TT en saliva (p<0,001).
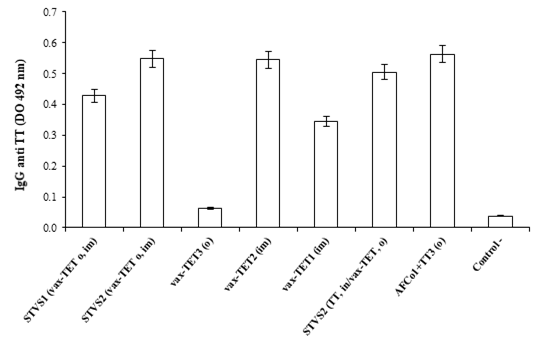
Fig. 1 IgG anti TT sérica inducida por SinTimVas (STVS). O, oral; im, intramuscular; in, intranasal; vax-TET® (vacuna monovalente de toxoide tetánico); AFCo1, adyuvante Finlay cocleato 1. Los números en la leyenda significan las dosis aplicadas con cada formulación. Letras diferentes significan diferencias significativas (p<0,05) determinadas por ANOVA, seguido de Tukey.
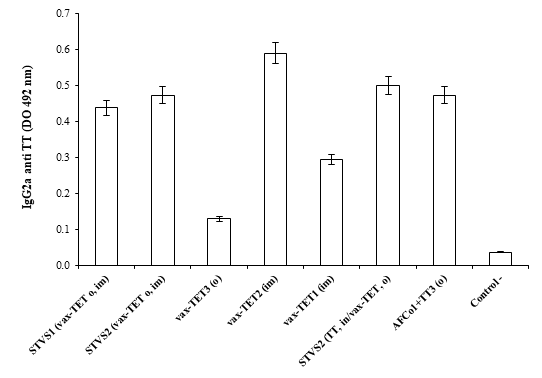
Fig. 2 IgG2a anti TT sérica inducida por SinTimVaS (STVS). O, oral; im, intramuscular; in, intranasal; vax-TET (vacuna monovalente de toxoide tetánico); AFCo1, adyuvante Finlay cocleato 1. Los números en la leyenda significan las dosis aplicadas con cada formulación. Letras diferentes significan diferencias significativas (p<0,001) determinadas por ANOVA, seguido de Tukey.
El funcionamiento de la vacunación en SinTimVaS permite incrementar la efectividad de la vacunación al reducir: el tiempo de inmunización, los costos de las campañas y la inducción de respuestas sérica y mucosa específicas, así como lograr proteger más rápidamente. Este sistema es eficiente con una sola dosis ya que no necesita ser potenciada por dosis de refuerzo a nivel de la respuesta inductiva y funciona por vías tanto oral como nasal.
Sabemos que la vía nasal es más potente que la oral para inducir respuestas a nivel de saliva y requiere menos concentraciones de antígeno; pero ambas inducen similares respuestas sistémicas como las encontradas en el presente trabajo. Ésta estrategia pudiera ser útil en los países donde el objetivo de la OMS de vacunar al menos con tres dosis de DPT aún no se ha logrado. También en la vacunación de animales valiosos, como los caballos y otros de compañía, se pueden lograr protecciones en menos tiempo, pues los esquemas para inducir respuestas protectoras requieren esperar hasta después de dos o tres dosis vacunales.
La no detección de IgA anti TT siálica en SinTimVaS por vías oral e im usando vax-TET® (TT adyuvado con alúmina) en una ni dos dosis, parece deberse a dicho adyuvante, ya que aunque induce respuestas de IgG anti TT sistémicas no logra inducir IgA. Esta hipótesis fue verificada al adyuvar TT con AFCo1 que es un potente adyuvante mucoso,17 con el que sí se logró inducir respuestas de IgA siálica. La hipótesis alternativa de que la vía oral induce respuestas en el tracto digestivo más que en el respiratorio también fue verificada, usando TT nasal y vax-TET® im, la que tampoco indujo IgA anti TT siálica. De cualquier manera, todos las formulaciones y SinTimVaS indujeron simulares repuestas de IgG anti TT séricas, anticuerpo reconocido como protector contra el tétano.
La inducción de IgA específica por las vacunas profilácticas en general y las infecciones naturales ha sido poco explorada. Esto pudiera deberse a varias causas:
Poco conocimiento de la respuesta mucosa en particular de la IgA como principal protector humoral mucoso.
Contar con un correlato de protección, que en el caso del tétano está basado en IgG anti TT sérica y que es inducida por todas las vacunas contra esta enfermedad.
Ausencia de adyuvantes mucosos funcionales en humanos; aunque se ha explorado con formulaciones que contienen quitosana o bilosomas, con buenos resultados en ratones.22,23,24
La vía mucosa, en particular la oral, requiere de altas concentraciones de antígeno; en nuestro caso solo exploramos 1,6 Lf, lo que pudiera ser insuficiente para inducir IgA, no así IgG específicas.
Poco conocimiento de los lugares de acción de la neuro-espasmotoxina, pues como su nombre lo indica afecta al sistema nervioso y se asume que es solo el central;1,2,4 no obstante, el sistema nervioso es también periférico y entérico. El entérico es el “segundo cerebro”, llamado así pues contiene sólo 850 veces menos neuronas que el sistema nervioso central.9 En consecuencia, el tratamiento de un tétano clínico o la profilaxis en heridas sospechosas sin esquemas de vacunación/reactivación completos, requiere de 12 aplicaciones de 250 mL (1 UI/mL) de gammaglobulinas en múltiples lugares para tratar de salvar al paciente, pues la neurotoxina puede estar distribuida en múltiples nervios localizados en todo el organismo.18
En conclusión, el presente trabajo extiende nuestra experiencia con SinTimVaS a la vacuna contra el tétano adyuvada con alúmina, lo que la hace funcional por vía oral; se pudieran reducir los esquemas de vacunación con el empleo de adyuvantes más potentes que inducirían respuestas sistémicas similares a su aplicación convencional parenteral, así como cualitativamente superiores al adicionar respuestas mucosas.














