Introducción
La Empresa Productora de Vacunas y Medios Diagnósticos (LABIOFAM), situada en La Habana, Cuba, dentro de sus plantas productoras ha desarrollado bioplaguicidas para el control de vectores; rodenticidas biológicos que sustituyen químicos de alta toxicidad y cuyos restos son difíciles de eliminar; así como vacunas contra varias enfermedades animales, elaboradas en unidades de producción carentes, no pocas de ellas, de algunas de las regulaciones ya establecidas sobre Bioseguridad. Entre esas vacunas figuran las que combaten la bronquitis infecciosa aviar, enfermedad de Newcastle, enfermedad de Gumboro, viruela aviar, encefalomielitis aviar, cólera porcino, moquillo, encefalomielitis equina del este (EEE), encefalomiocarditis del cerdo (EMC) y la enfermedad de Aujeszky; estas tres últimas, elaboradas en la unidad de producción objeto de estudio.1
La EEE afecta al equino y al hombre de una forma grave y altamente mortal, tiene evolución rápida, a diferencia de las otras dos. La misma provoca síntomas neurológicos que conducen al coma y la muerte en un 30-70% de los casos. No existe tratamiento específico para la enfermedad transmitida por este virus, por lo que el control debe basarse en el manejo intensivo del paciente.
En Cuba se produjeron ciclos de esta enfermedad epizoótica bastante extensos y brotes más reducidos, entre 1914 y 1915, así como en 1972; sin embargo, a partir de 1971 disminuyó la mortalidad y posteriormente fue nula, cuando se obtuvo una cobertura de vacunación de 86,7%.2 Los primeros casos reportados de EEE fueron descritos por Arenas en 1996,3el cual notificó humanos enfermos en 1953 en Florida, Camagüey, donde ocurrió un brote epizoótico que se extendió a todo el sur de Cuba con más de 25.000 caballos muertos y se presentaron más de 100 casos en humanos, con una mortalidad aproximadamente del 50 %. El último brote en equinos ocurrió en el año 1972 en Caibarién.4
La producción de vacunas veterinarias, como proceso general donde se manipulan microorganismos, requiere del establecimiento en cada una de sus etapas productivas, de medidas de bioseguridad que contribuyan a la eficacia y seguridad, propiciando un producto que cumpla con las normas establecidas y sea seguro para el hombre y el medio ambiente.5 Este aspecto no es de total cumplimiento en el área de vacunas inactivadas donde, por inspecciones realizadas, se han detectado incumplimientos de regulaciones y medidas, así como una insuficiente capacitación del personal. El método de estudio de la bioseguridad es la evaluación del riesgo biológico, que debe ser realizado por un personal especializado con el empleo de alguno de los métodos ya existentes para este fin, como es el caso de la matriz de estimación del riesgo, que nos permite estimarlo de forma cualitativa sobre la base de la identificación del peligro y la detección de vulnerabilidades presentes en el proceso según diferentes aspectos.6,7) Teniendo en cuenta lo anterior, el objetivo de este trabajo fue realizar una evaluación del riesgo biológico presente en el proceso de producción de la vacuna contra la EEE para la detección de factores de riesgo presentes en el mismo y de esta forma minimizar las posibilidades de contaminación tanto del hombre, la comunidad como el medio ambiente.
Materiales y Métodos
El estudio se realizó en el área de vacunas inactivadas de la Empresa Productora de Vacunas Virales y Bacterianas UP-7 perteneciente a LABIOFAM.
Se desarrolló en el período de enero a diciembre de 2018. Se trabajó con la plantilla del área de producción que está formada por 16 trabajadores en total, de ellos: 4 especialistas, 8 técnicos y 4 obreros con edades entre 32 y 53 años como promedio; el 62,5% son mujeres y poseen una experiencia laboral superior a los 10 años. Todo el personal durante el tiempo de la investigación mantuvo un buen estado de salud, tuvo actualizado su chequeo de salud con excepción de la actualización del registro vacunal y mostró un deficiente conocimiento sobre bioseguridad.
Esta instalación se ubica en el Nivel III de Bioseguridad, según las Resoluciones de Bioseguridad que definen estos aspectos teniendo en cuenta los agentes biológicos (AB) que se trabajan en ella.8,9
Análisis de riesgo
Para la realización del análisis de riesgo, primeramente, se realizó la confección y descripción del diagrama de flujo de las actividades que se desarrollan en la entidad. Para ello se utilizó la experiencia del personal ocupacionalmente expuesto y lo descrito en los procedimientos normalizados de operación, así como el objeto social de la entidad, que incluye los puntos críticos del proceso, teniendo en cuenta la manipulación del agente biológico.
En la identificación y caracterización de los peligros se tuvieron en cuenta los siguientes parámetros:8
La patogenicidad del agente infeccioso (grupo de riesgo donde están ubicados).
Las vías de transmisión (oral, fecal o por contacto, vectores).
El origen del material potencialmente infeccioso y las medidas de aseguramiento médico.
Daño que causa.
Tiempo de exposición al agente biológico.
Para evaluar el riesgo biológico por la manifestación de los peligros identificados y caracterizados, se detectaron las vulnerabilidades presentes empleando para ello una lista de chequeo descrita en el Manual de Inspecciones en Bioseguridad según Menéndez de San Pedro y cols.10 La lista la componen 68 preguntas relacionadas con la organización y gestión de la seguridad biológica, formación del personal, procedimientos escritos, equipos y sistemas de seguridad: equipos de protección personal (EPP) y equipos de protección colectiva (EPC), diseño de la instalación, desechos biológicos peligrosos (DBP), ubicación de la instalación, manipulación de los animales de experimentación e instalación de animales terrestres, teniendo en cuenta la metodología recomendada.10
Para el empleo de la matriz de estimación del riesgo se utilizó la metodología cualitativa de posibilidad de ocurrencia del peligro, descrita en el Manual para elaboración de matrices de peligro de Investigaciones y proyectos, desarrollados en la Escuela de Administración, Finanzas e Instituto Tecnológico, de Medellín.11) Los parámetros de posibilidad de ocurrencia o probabilidad se establecieron teniendo en cuenta el agente biológico de mayor peligro de los analizados en el estudio, en este caso nos referimos al virus de la encefalomielitis equina del este (VEEE), que como se ha comentado resulta la zoonosis más peligrosa para el humano, y tiene una elevada letalidad para los animales.
Se establecieron los siguientes parámetros de Posibilidad:
Altamente posible: se espera que ocurra la enfermedad en cualquier oportunidad bajo la que se realiza la actividad.
Posible: la enfermedad puede ocurrir bajo condiciones normales de desarrollo de la actividad.
Poco posible: la enfermedad ocurre sólo bajo condiciones inusuales.
Improbable: la enfermedad sólo ocurre bajo condiciones excepcionales.
Altamente improbable: la enfermedad prácticamente no ocurre.
Se establecieron los siguientes parámetros de Consecuencias:
Mínimas: no ocurren contaminaciones o son mínimas, para pocos individuos que puedan requerir primeros auxilios.
Menores: lesiones ligeras a personas que pueden requerir tratamiento médico.
Intermedias: lesiones en algunas personas que pueden requerir tratamiento médico.
Graves: lesiones severas en algunas personas que pueden requerir hospitalización o producir la muerte.
Los riesgos resultantes se evaluaron como altos, moderados, bajos o insignificantes, teniendo en cuenta la matriz de riesgo establecida (Tabla 1) según la metodología descrita previamente.11
Tabla 1 Matriz de estimación del riesgo, aplicada en el área de vacunas inactivadas del Laboratorio biológico farmacéutico.
| Riesgo estimado = Posibilidad x Consecuencias | |||||
|---|---|---|---|---|---|
| Posibilidad | Altamente Posible | Bajo | Moderado | Alto | Alto |
| Posible | Insignificante | Bajo | Alto | Alto | |
| Poco Posible | Insignificante | Bajo | Moderado | Alto | |
| Improbable | Insignificante | Insignificante | Bajo | Moderado | |
| Altamente Improbable | Mínima | Menores | Intermedias | Graves | |
| Consecuencias | |||||
Resultados
Se confeccionó el diagrama de flujo de actividades que se desarrollan en la entidad objeto de estudio, el cual se muestra en la Figura 1. Como puede observarse existen diferentes puntos críticos en dependencia del procedimiento específico.
El esquema muestra el Flujo de producción de la VEEE.

Fig. 1 Diagrama de flujo del área de vacunas inactivadas (LABIOFAM) para la vacuna contra la encefalomielitis equina del este. Se señalan en asterisco los puntos críticos.
Los puntos críticos (*) que se identificaron fueron:
Estos puntos críticos se consideraron teniendo en cuenta el trabajo directamente con el agente biológico en esas etapas, así como la concentración y el volumen con los cuales se trabaja.
El tratamiento de los desechos constituye uno de los puntos críticos importantes en el proceso de obtención de vacunas inactivadas, ya que el personal que participa en el proceso de elaboración de las vacunas es el mismo que manipula los DBP que se generan. De esta forma se expone al riesgo de infección debido a una posible manipulación incorrecta o por el no cumplimiento de las medidas de bioseguridad correspondientes, a pesar de estar descritos en los procedimientos.
Dentro del Área de investigación se elaboran otras dos vacunas, siendo el proceso similar, diferenciándose solamente en la prueba de inactivación y en el tipo de células a emplear; en el caso de Aujeszky, se utiliza Fibroblasto de embrión de pollo que son células cuyo crecimiento es en suspensión.
La posibilidad de contaminación entre los virus de Aujeszky, EEE y EMC, tres enfermedades consideradas como zoonosis en el área de vacunas inactivadas, constituyen peligros propios del manejo del inóculo de cada vacuna, incluyendo además el manejo de otros AB diferentes a los trabajados en el área como Leptospira, Brucella spp (cepas vacunales), Erisipela, entre otros (Tabla 2). Estos pueden provocar contaminación por su presencia en el ambiente, generalmente en el área de ensayo o atención de animales, a través de diferentes vías de transmisión, tales como: contacto directo con las heces, alimentos contaminados, aerosoles, vectores biológicos, mordeduras u otros fluidos, ya sea por mala manipulación o deficiente higiene en las áreas.
Tabla 2 Principales agentes biológicos potencialmente asociados al área de vacunas inactivadas y de ensayo en los diferentes procesos.
| Áreas | Procesos | Potenciales agentes biológicos asociados | Grupo de Riesgo (Resol. 38) | Daño |
|---|---|---|---|---|
| Área de vacunas inactivadas | Inoculación, colecta, elaboración y llenado | Virus de Aujeszky | 2 | Enfermedad de Aujeszky o Pseudorrabia |
| VEEE | 3 | Meningo-encefalomielitis hemorrágica (altos índices de morbilidad y letalidad) | ||
| Virus de EMC | 2 | Miocarditis intersticial | ||
| Área de ensayo | Prueba de Inactivación | Virus de Aujeszky | 2 | Enfermedad de Aujeszky o Pseudorrabia |
| VEEE | 3 | Meningo-encefalomielitis hemorrágica. | ||
| Virus de EMC | 2 | Miocarditis intersticial | ||
| Virus Ectima contagioso | 2 | Dermatitis pustular contagiosa | ||
| 2 | Leptospirosis | |||
| 2 | Brucelosis | |||
| 2 | Erisipeloide |
La Tabla 2 identifica y caracteriza los AB que participan en los diferentes procesos para la obtención de la vacuna, según el proceso y área en particular, el nivel de riesgo y el daño que ocasionan.
El área de ensayo resulta la de mayor contacto con AB, de las dos analizadas; es donde se realizan los ensayos con animales, por tanto, resulta la de mayor posibilidad de contaminación por las diferentes vías de transmisión y donde se encuentra el mayor número de AB (peligros), mayor concentración para los propios animales y el personal que labora en ella, aunque el tiempo de exposición es menor, si tenemos en cuenta que solo se realiza el proceso de inactivación.
En el área de vacunas inactivadas se realizan el resto de los procesos que implican un tiempo de exposición mayor del personal con los AB, pero en menor concentración, si tenemos en cuenta que cada proceso se realiza por separado y se trabaja con un solo AB cada vez.
No obstante, es el mismo personal el que labora en ambas áreas por lo que resultan vulnerables a los peligros presentes en ellas. Resulta importante destacar, además, que no se incluyeron la totalidad de AB que pudieran resultar peligrosos, descritos en la literatura para áreas de trabajo con animales, como estas.
Por otra parte, se conoce que el VEEE se puede transmitir a los huéspedes mamíferos por medio de vectores, mosquitos que se alimentan tanto de aves como de mamíferos. Los vectores del VEEE incluyen Coquilletidia perturbans y miembros del género Aedes, Ochlerotatus y Culex,12 constituyendo, por tanto, otra vía de transmisión de la enfermedad que podría incrementar el número de animales contaminados, afectando así a la comunidad y al medio ambiente; por estas razones resulta de gran importancia mantener y extremar las medidas de bioseguridad en el área de ensayo, donde cualquier descuido podría favorecer la propagación del virus en estudio.
Los AB que se analizaron son de los grupos de riesgo 2 y 3 cuya principal vía de transmisión es la inoculación, aunque podría existir contaminación por vía fecal y por contacto.
Evaluación del riesgo en el proceso de elaboración de vacunas inactivadas
En la Tabla 3 se muestran los resultados de la evaluación de riesgo, teniendo en cuenta las actividades fundamentales en la elaboración de vacunas inactivadas, los materiales y equipos empleados, el daño provocado, sus posibles causas y las medidas a tomar para disminuirlo o eliminarlo.
Tabla 3 Evaluación del riesgo en la elaboración de vacunas inactivadas.
| Procesos que constituyen puntos críticos | Peligro | Riesgo | Vulnerabilidades (Factores de riesgo) | Medidas para disminuir los riesgos |
|---|---|---|---|---|
| Preparación del inóculo | Contaminación con los agentes biológicos con que se trabaja (VEEE, Aujeszky, EMC) | Adquirir las enfermedades provocadas por los agentes biológicos con que se trabaja | No usar de forma correcta los medios de protección individual Uso incorrecto de los recipientes para el traslado de las muestras No empleo de los medios de protección colectiva No contar con personal debidamente capacitado en la actividad que realiza Diseño inadecuado del área de trabajo Baja percepción del riesgo biológico | Cumplimiento de las legislaciones vigentes en el país Capacitar al personal en la actividad que realiza Usar correctamente los contenedores adecuados para el traslado de las muestras Cumplimiento de las medidas de bioseguridad descritas en el reglamento del centro Incumplimiento de las Resoluciones 8 y 112 sobre Bioseguridad Realizar análisis de la precepción del riesgo del personal |
| Inoculación | Contaminación con los agentes biológicos con que se trabaja (VEEE, Aujeszky, EMC) | Adquirir las enfermedades provocadas por los agentes biológicos con que se trabaja | ||
| Colecta | Contaminación con los agentes biológicos con que se trabaja (VEEE, Aujeszky, EMC) | Adquirir las enfermedades provocadas por los agentes biológicos con que se trabaja | ||
| Prueba de inactividad | Contaminación con los agentes biológicos con que se trabaja (VEEE, Aujeszky, EMC), así como otros: bacterias ( |
Adquirir las enfermedades provocadas por los agentes biológicos con que se trabaja |
Una vez procesada la lista de chequeo para detectar vulnerabilidades, se obtuvieron 68 aspectos verificados en la misma y no se cumplieron 20, lo que representa un 29,4%.
Se consideraron como vulnerabilidades fundamentales los aspectos clasificados como negativos que afectan a todas las áreas del laboratorio en sentido general, son los denominados factores de riesgo:
1. No están certificados los gabinetes de seguridad biológica.
2. Las autoclaves para la descontaminación de desechos infecciosos no están certificadas.
3. El estado constructivo del laboratorio no es bueno.
4. No existe suficiente espacio para realizar el trabajo con seguridad.
5. El laboratorio no posee un diseño adecuado que facilite el flujo de trabajo.
6. El material de las paredes, pisos y techos no es el adecuado para este tipo de instalación.
7. El laboratorio no posee adecuadas mesetas y mobiliario.
8. No existe climatización adecuada para el trabajo con AB.
9. No existe antecámara en los locales de trabajo con AB.
10. No existe filtro sanitario en los locales.
11. No existe un adecuado sistema de suministro de agua.
12. No están disponibles los recipientes para cada tipo de desechos. Ejemplo: corto-punzantes.
13. No se utilizan las bolsas de color según el riesgo o el tipo de material desechado.
14. Los equipos utilizados para el tratamiento no son comprobados para verificar la efectividad del mismo.
15. No existe incinerador para el tratamiento de los desechos biológicos en la instalación.
16. No existe un transporte con las condiciones seguras para el traslado de los desechos biológicos.
17. La instalación no está separada de las áreas públicas por puertas.
18. No están distribuidas las zonas bajo el principio de caja en caja.
19. Las oficinas ubicadas dentro del laboratorio no están próximas a la salida.
20. Las zonas de mayor riesgo no están alejadas de las áreas públicas.
Al evaluar los aspectos generales a verificar de la lista de chequeo en las variables se obtuvo como resultado que los EPC, el diseño de la instalación, el manejo de los DBP y la ubicación de la instalación fueron en general clasificados como Inadecuados. El resto de los acápites se consideraron Adecuados (Fig. 2).
Se hace especial mención acerca de las vulnerabilidades 15 y 16 encontradas después de aplicada la lista de chequeo que nos advierte sobre las posibilidades de tratamiento de los desechos con que se cuenta.
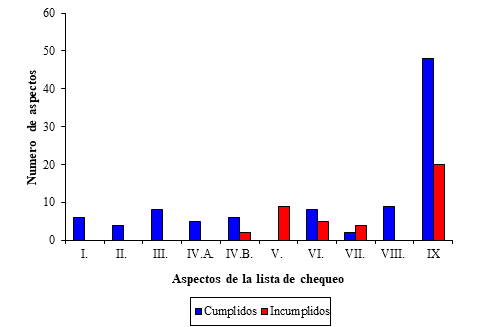
Fig. 2 Resultados de la aplicación de la lista de chequeo al área de vacunas inactivadas del Laboratorio biológico farmacéutico. I. Organización y gestión de la seguridad biológica, II. Formación del personal, III. Procedimientos escritos, IV.A EPP, IV.B EPC, V. Diseño de la instalación, VI. Desechos Biológicos Peligrosos, VII. Ubicación de la instalación, VIII. Manipulación de los animales. IX. Total.
El resultado de la aplicación de la Matriz de Estimación de riesgo se muestra en la Tabla 4. Observamos que la posibilidad de contaminación con los tres AB principales con los cuales se realiza el proceso de obtención vacunal, según el diagrama de flujo mostrado, es altamente posible si tenemos en cuenta que se trabaja con cada uno de ellos según el período o campaña; sin embargo, las consecuencias son diferentes ya que la contaminación con el VEEE tiene elevada letalidad en el humano, no así con los otros dos agentes, de ahí que con estos las consecuencias sean intermedias y con el VEEE graves. De la misma forma, con el resto de los AB reconocidos en este estudio, la posibilidad de contaminación es posible o poco posible, si tenemos en cuenta que no se trabaja directamente con ellos; sin embargo, con algunos las consecuencias son graves, lo que incrementa el riesgo. En general, el riesgo es alto en el área de producción de vacunas inactivadas de LABIOFAM.
Tabla 4 Estructura del análisis según la matriz de riesgo establecida.
| Peligro o Desviación | Posibilidad | Consecuencias | Riesgo |
|---|---|---|---|
| Contaminación con VEEE | Altamente posible | Graves | Alto |
| Contaminación con virus de Aujeszky | Altamente posible | Intermedias | Alto |
| Contaminación con virus de EMC | Altamente posible | Intermedias | Alto |
| Contaminación con virus Ectima contagioso | Poco Posible | Intermedia | Moderado |
| Contaminación con |
Posible | Grave | Alto |
| Contaminación con |
Poco Posible | Grave | Alto |
| Contaminación con |
Poco Posible | Intermedia | Moderado |
Discusión
Se puede observar que el personal que labora en el área de vacunas inactivadas de LABIOFAM se encuentra expuesto a peligros de infección por la manipulación de AB peligrosos, ya que pueden contaminarse por el derrame del material biológico, por el uso incorrecto de objetos corto-punzantes que pueden ocasionar cortaduras, pinchazos, derrames y salpicaduras cuando no se manipulan adecuadamente, según recomiendan las Buenas Prácticas de Laboratorio y las precauciones que deben tenerse en cuenta para la protección de los trabajadores.
De acuerdo a la literatura consultada, el riesgo se incrementa por la falta de conocimientos, de recursos y la negligencia, por lo que es de suma importancia realizar el proceso de análisis de los riesgos de una manera adecuada, utilizando conocimientos científicos especializados y actualizados, que permitan analizar los riesgos potenciales.13,14
Según otros autores,15 el accidente de tipo biológico es una condición circunstancial y “normal” de la actividad, ignorando la trascendencia de este, pues el riesgo biológico presenta una característica que lo diferencia de otros factores de riesgo laborales: la potencial transferencia del riesgo a otros trabajadores, familiares y a la comunidad en general, situación de especial importancia en los trabajadores de la salud. De ahí la importancia de nuestra investigación.
En este tipo de laboratorio es importante velar por el monitoreo de las autoclaves, ya que la mayor parte del material reutilizable se descontamina por este medio y si no se realizan controles biológicos, no se logra la descontaminación y el personal podría tener una posible fuente de infección. En este aspecto coincidimos con diferentes autores al comunicar que las prácticas incorrectas y el uso inadecuado de los equipos son las causas más frecuentes de las infecciones y de los accidentes en los laboratorios.13,14,16 El personal que labora en áreas de riesgo, necesita capacitarse para evitar contaminaciones.
Los peligros que identificamos durante el análisis de riesgo coinciden con lo reportado: derrames, salpicaduras, falta de hermeticidad, vuelco de los recipientes, envases de las muestras durante su manejo, manipulación de objetos corto-punzantes como causa de cortes o heridas y manipulación de materiales y equipos contaminados.17
Entre las principales causas de riesgo biológico se pueden mencionar: la negligencia e inobservancia de procedimientos, el diseño inadecuado de las instalaciones, la ausencia de un programa de seguridad, la no disposición de los medios adecuados de protección, el manejo deficiente de los desechos biológicos y el personal inadecuadamente entrenado.5,14
Los riesgos moderados requieren atención tan pronto como sea posible, los altos requieren corrección sin aplazamiento y mantener la alerta cuando la situación no sea una emergencia, mientras que los riesgos bajos o insignificantes no requiere corrección.18
No obstante, se considera que se deben eliminar todos los factores de riesgo o vulnerabilidades, ya que al hacerlo se incrementa el rango de seguridad durante el manejo de desechos y otros aspectos de interés; para ello siempre se deben establecer prioridades por el orden de importancia de los riesgos: altos, moderados, bajos, insignificantes. Los resultados del estudio permiten de una forma muy sencilla, pero estructurada, establecer prioridades para gestionar el riesgo y priorizar las acciones.19
El hecho de corregir sin aplazamiento los riesgos altos, resulta un aspecto que para el caso que nos ocupa, es de gran importancia. Se considera que los usos de los medios de protección no tienen como función eliminar el riesgo, ni el peligro, pero si disminuir su frecuencia de ocurrencia o el impacto de manifestarse en una actividad determinada. Por tanto, el uso de los medios de protección es una tarea que tiene que ser tomada con la seriedad que se requiere, con ellos damos una batalla por la calidad de vida de los trabajadores, aspecto este que igualmente se cumple en el área en estudio.20
El área de vacunas inactivadas de LABIOFAM tiene aspectos del diseño y ubicación inadecuados que se deben mejorar. Debido a la no existencia de locales para las diferentes etapas del proceso, las operaciones que constituyen puntos críticos tales como: preparación del inóculo e inoculación y colecta, se realizan en el mismo local, lo que hace que el espacio sea insuficiente para efectuar el trabajo con seguridad. El material de las paredes, pisos y techos no resulta el adecuado para este tipo de instalación; no hay flujo de las operaciones en un sólo sentido, o sea, pasillo limpio y pasillo sucio, ni principio de caja en caja, que permita el aislamiento de los AB con los cuales se trabaja. Por otro lado, las zonas de mayor riesgo no están alejadas de las áreas públicas y las oficinas se encuentran ubicadas dentro del laboratorio y no están próximas a la salida.
Lo anterior demuestra que estos incumplimientos violan los incisos d3, del Capítulo III, b1 del artículo 8 perteneciente al Capítulo III, que establece los requisitos y procedimientos para la seguridad biológica en las instalaciones con riesgo biológico. Igualmente se incumple el inciso n del artículo 9 del Capítulo III de la Resolución 112 del CITMA.8,9
Los resultados mostrados en la Figura 1 con relación a los sitios críticos de DBP sugieren cierto incumplimiento del Decreto Ley 190, que establece la obligación de cumplir con medidas y requisitos de seguridad biológicas en el tratamiento y disposición de DBP, sobre todo en sus artículos 15 y 16, que disponen de la responsabilidad para las áreas que generan DBP (tratamiento, transportación y disposición) en condiciones de seguridad y en correspondencia con las disposiciones ambientales vigentes; de forma tal que se garantice la protección del medio ambiente y en particular de la población y los trabajadores.21
El estudio mostró vulnerabilidades, pues no se cuenta con recipientes identificados con el símbolo de riesgo biológico. Existen los medios para la transportación interna, pero no se asegura la transportación externa, otro aspecto de importancia en este tema. No existe incinerador en la instalación, lo que hace necesario la salida con los desechos a otra unidad de producción perteneciente a LABIOFAM, pero distante del lugar. Se hace notar que no se ha actualizado la certificación de las autoclaves utilizadas para descontaminar desechos, por lo que aumenta el riesgo para los trabajadores responsabilizados con esta actividad.
La lista de chequeo confeccionada y empleada para analizar este laboratorio podría recomendarse para su utilización en los controles sistemáticos que se deben realizar en esta área, pues abarca los aspectos de seguridad, referentes a los procedimientos organizativos de trabajo y puede ser, inclusive, de aplicación en otras unidades de producción que elaboran vacunas, pues resulta imprescindible efectuar comprobaciones periódicas y planificadas para garantizar la eficacia de las medidas de gestión de los riesgos y para asegurarse de que no surjan nuevos peligros.














