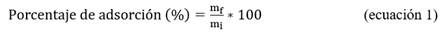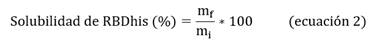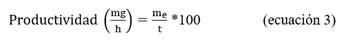Introducción
La urgente necesidad de desarrollar y producir vacunas contra la COVID-19, condujo a que el Instituto Finlay de Vacunas, la Universidad de La Habana y el Centro de Inmunología Molecular (CIM), desarrollaran dos vacunas: SOBERANA®02 y SOBERANA®Plus y un candidato vacunal: SOBERANA 01, que en su composición contienen el dominio de unión al receptor (RBD, por sus siglas en inglés) de la proteína spike (por su traducción, espiga) del coronavirus tipo 2 causante del síndrome respiratorio agudo severo (SARS-CoV-2, por sus siglas en inglés). Los anticuerpos producidos contra el RBD previenen la entrada del virus a la célula, al bloquear la unión del RBD con el receptor celular: la enzima convertidora de angiotensina 2.1,2,3 Este RBD se obtiene utilizando la tecnología de ácido desoxirribonucleico (ADN) recombinante empleando, para la expresión, la línea celular de mamífero células de ovario de hámster chino (CHO-K1, por sus siglas en inglés).4
La secuencia de la molécula de RBDhis (aa 319-541) monomérica, comprende los residuos de arginina 319 hasta la felinanalina 541 a los que se adicionan seis residuos de histidina (His) en su extremo C terminal. La secuencia aminoacídica contiene además cuatro sitios de glicosilación (2N y 2O) y nueve residuos de cisteína (Cys) de los cuales ocho se encuentran formando enlaces disulfuros intramoleculares y la Cys538 libre es la que permite obtener una molécula dimérica.4 El ingrediente farmacéutico activo (IFA) en su forma dimérica, es el antígeno de la vacuna SOBERANA®Plus2 y del candidato vacunal SOBERANA 01;3 mientras que el IFA en su forma monomérica es el antígeno de la vacuna SOBERANA®02.1
El diseño óptimo del proceso de purificación es considerado uno de los objetivos en el desarrollo del producto, el que incluye el tipo y orden secuencial de las técnicas de purificación, además del cumplimiento de los requisitos reglamentarios con los costos y tiempos mínimos. Su establecimiento y desarrollo implica la selección de varios factores incluido el tampón de equilibrio y de elución, el tipo de matriz, los parámetros de operación de la columna, que influyen en la pureza, homogeneidad, recobrado y economía del proceso. La importancia de cada parámetro variará dependiendo de la etapa en la que se trabaje: captura, purificación intermedia o final.5
La cromatografía de afinidad por quelatos metálicos (IMAC, por sus siglas en inglés) es un tipo de técnica de separación por afinidad que se basa en la unión covalente coordinada de las proteínas a separar y los iones metálicos unidos a la matriz. 6) Esta cromatografía se dificulta cuando se emplean sobrenadantes obtenidos de células de mamíferos, que presentan determinados componentes en el medio de cultivo, tales como agentes quelantes de metales o aminoácidos, que pueden interaccionar y desprender los metales acoplados a la matriz de la IMAC. Con el objetivo de contrarrestar este efecto indeseado se ha descrito el acondicionamiento del sobrenadante de células superiores mediante el empleo de diálisis, diafiltraciones o ajuste con soluciones concentradas de metales antes de aplicar a la matriz de la IMAC. Estos métodos brindan un incremento en la recuperación de la proteína de interés de las matrices de la IMAC. 7)
La cromatografía de intercambio catiónico como etapa intermedia o final, es uno de los pasos más empleados en las purificaciones de proteínas recombinantes y anticuerpos monoclonales, debido a su eficacia no solo para eliminar contaminantes relacionados con el proceso (proteínas de la célula hospedera: HCP, por sus siglas en inglés), ADN y endotoxinas), sino también impurezas relacionadas con el producto (agregados y variantes del producto).8
Uno de los principales desafíos en el desarrollo de procesos de purificación de biomoléculas es la remoción de los componentes del medio, HCP y otras impurezas asociadas al proceso o con el producto biofarmacéutico. Otro reto es la preservación de la estructura y la estabilidad del antígeno durante el proceso de purificación, ya que la mayoría son vulnerables a los cambios de temperatura, pH y concentración de sales. El cumplimiento de estas especificaciones garantiza la seguridad y la eficacia de la vacuna y evita respuestas inmunitarias no deseadas. 5,9)
El objetivo de este trabajo fue diseñar una variante de esquema de purificación de la molécula RBDhis (aa 319-541), que garantice el cumplimiento de las especificaciones de calidad, con vistas a su posterior transferencia tecnológica a escala industrial.
Materiales y Métodos
Se realizaron los experimentos con la proteína RBDhis (aa 319-541) expresada en células de mamífero CHO-K1 y producida en un biorreactor de tanque agitado de volumen de 2 L (Applikon, Holanda) en modo perfusión.4 Se emplearon seis cosechas obtenidas en el fermentador de 2 L, las que presentaron una viabilidad celular por encima del criterio de aceptación (> 70%, oscilando entre 81,33 y 92,42%), con una desviación estándar de ± 2,39 y un coeficiente de variación de 2,76%, por lo que se consideró el proceso de expansión y crecimiento celular como estable y consistente en cuanto a esa corrida. El sobrenadante cosechado del biorreactor se clarificó mediante una filtración profunda, seguido de dos microfiltraciones con filtros de 3,00 a 0,8 µm y de 0,45 a 0,20 µm respectivamente. Luego, se almacenó a 4°C para su posterior procesamiento.10
Etapa de captura mediante la cromatografía de afinidad por quelatos metálicos
Se aplicó a la matriz previamente equilibrada, 45 mL del sobrenadante ajustado con cada solución de equilibrio evaluada en el diseño descrito posteriormente, con una relación volumétrica de 1/1 (v/v) para acondicionar la cosecha filtrada a cada una de las condiciones de unión evaluadas en el diseño. Al sobrenadante se le adicionó 0,05 mmol/L de CuSO4, con el objetivo de incrementar la capacidad dinámica de adsorción de la matriz.11 El sobrenadante ajustado se aplicó manteniendo un tiempo de residencia igual a 2 min y con una capacidad de adsorción igual a 0,9 mg de RBDhis (aa 319-541)/mL de gel, resultados de capacidad dinámica y velocidad lineal obtenidos mediante las curvas de rupturas realizadas en estudios no mostrados. A continuación, la matriz se lavó con 3 volúmenes de columna (VC) de la solución de equilibrio hasta que la absorbancia alcanzó la línea base. Se realizó un lavado con 3 VC de la solución tampón fosfato de sodio 20 mmol/L, NaCl 300 mmol/L, Tween 20 0,1% (v/v), imidazol 10 mmol/L pH 7,4, solución seleccionada en estudios previos. 11) Luego, se eluyó la proteína con la solución Na2HPO4 8 mmol/L, KH2PO4 2 mmol/L, NaCl 150 mmol/L, Tween 20 0,1% (v/v), imidazol 200 mmol/L pH 9, solución seleccionada en estudios previos.11
Para la selección de la mejor condición de adsorción (acondicionamiento del sobrenadante y equilibrio de IMAC), se realizó un diseño de experimentos (DoE) fraccionado con resolución IV (24-1) con un punto central y dos réplicas en una columna Hitrap HP (Cytiva, Suecia) con 1 mL de Chelating Sepharose Fast Flow (Cytiva, Suecia). En el diseño se estudió el efecto de los parámetros: fuerza iónica empleando la concentración molar de NaCl entre 0 y 300 mmol/L, concentración molar de imidazol entre 0 y 5 mmol/L, concentración volumétrica de Tween 20 entre 0 y 0,1% (v/v) y concentración molar del tampón fosfato de sodio entre 20 y 50 mmol/L. Como variables respuestas se determinó: porcentaje de adsorción de RBDhis (aa 319-541) mediante la ecuación 1, contenido de dímeros+monómeros y oligómeros por la cromatografía de exclusión molecular por el sistema cromatográfico de alta eficiencia (SEC-HPLC) y relación proteína-ADN contaminantes (relación de densidades ópticas: 280/260).
Donde mf y mi son las masas de RBDhis (aa 319-541) eluída de la matriz cromatográfica y antes de aplicar a la matriz, respectivamente.
Etapa intermedia mediante la cromatografía de intercambio catiónico
La matriz de intercambio catiónico se equilibró con 5 VC de las soluciones de equilibrios evaluadas en el DoE de esta etapa. Luego se aplicó para cada condición el eluato de la cromatografía de exclusión molecular empacada con 138 mL de Sephadex G25 Medium (Cytiva, Suecia) en XK26/40 (Cytiva, Suecia). Finalizada la aplicación, se continuó pasando solución de equilibrio hasta que la absorbancia alcanzó la línea base. Se realizó la elución con la solución tampón fosfato de sodio 50 mmol/L, NaCl 250 mmol/L pH 6, solución seleccionada en estudios previos.11
Un DoE con dos factores a tres niveles (32) y dos réplicas para un total de 18 corridas experimentales se realizó para la selección de la solución de equilibrio en una Hitrap SP (Cytiva, Suecia) con un 1 mL de SP Sepharose Fast Flow (Cytiva, Suecia): cromatografía de intercambio catiónico. Los factores y niveles evaluados fueron: pH (5, 6, 7) y concentración molar del NaCl (0, 30, 60 mmol/L).
La condición de equilibrio óptima en el intervalo estudiado se seleccionó mediante el empleo de la función deseabilidad, a partir de las variables respuestas: solubilidad de RBDhis (aa 319-541) una vez eluída de la cromatografía de exclusión molecular, que se determinó mediante la ecuación 2 y porcentaje de adsorción de RBDhis (aa 319-541) al intercambiador catiónico, calculada mediante la ecuación 1.
Donde mf y mi son las masas de RBDhis (aa 319-541) después y antes de centrifugar respectivamente.
Etapa final mediante la cromatografía de exclusión molecular
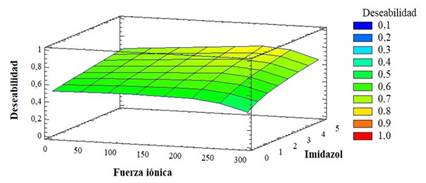
Se empleó una columna XK16/60 (Cytiva, Suecia), con 120 mL de matriz empacada, Superdex 200 Pregrade (Cytiva, Suecia) y una altura de gel de 60 cm. Se equilibró la matriz con 2 VC de la solución salina tamponada por fosfatos: Na2HPO4 8 mmol/L, KH2PO4 2 mmol/L, NaCl 150 mmol/L, pH 7,4. Se aplicó el eluato del intercambiador catiónico bajo las diferentes condiciones de operación evaluadas en el DoE. Luego se eluyeron las tres especies con la misma solución de equilibrio. En este DoE se estudió la influencia de dos factores y tres niveles (32) con dos réplicas, la velocidad lineal (cm/h) y el volumen de aplicación (% VC). Los niveles evaluados fueron: velocidad lineal (15, 30 y 60 cm/h) y volumen de aplicación (1, 4, 6 % VC). Se seleccionó la mejor condición de operación mediante las variables respuestas: resolución y productividad (mg/h). La resolución de los picos correspondientes al dímero y monómero se determinó con el software Unicorn 7/Evaluation y la productividad se calculó a partir de la ecuación 3.
Donde me es la masa eluída de dímero+monómero (mg) y t es el tiempo de operación (h).
Evaluación de desempeño a escala piloto
Una vez identificadas las condiciones de adsorción y los parámetros de operación para cada una de las etapas del proceso de purificación de RBDhis (aa 319-541) se procedió a evaluar su desempeño realizando cinco corridas experimentales a escala piloto, con el objetivo de verificar la reproducibilidad del proceso. El rendimiento del proceso se determinó mediante el recobrado global como la masa total de RBDhis (aa 319-541) que eluye al final del proceso y la masa total aplicada. Por otra parte, al producto purificado (dímero y monómero) se le determinó pureza por SEC-HPLC, actividad biológica, antigenicidad, niveles de HCP, endotoxinas bacterianas y ADN contaminante.
Técnicas analíticas
Las concentraciones de la proteína RBDhis (aa 319-541) del sobrenadante cosechado del biorreactor y de la elución de la etapa de captura se determinaron mediante una curva patrón de la especie monomérica a partir de la columna cromatográfica analítica de fase reversa Chromolith Performance RP-8e (100x4,6 mm) (Merck, Alemania) acoplada al HPLC Shimadzu Prominence (Japón) con un flujo volumétrico de 1 mL/min. Se empleó como disolvente A ácido trifluoroacético al 0,1 % (v/v) en agua y como disolvente B el ácido trifluoroacético al 0,1 % (v/v) en acetonitrilo. La detección de las muestras de RBDhis (aa319-541) se realizó a 214 nm. La concentración de la proteína de interés obtenida de la etapa intermedia y final se calculó mediante la medición de la absorbancia a 280 nm usando el espectrofotómetro UV Thermo scientific, Genesys 10S UV-Vis. La pureza de RBDhis (aa 319-541) se determinó mediante la metodología de la cromatografía de exclusión molecular en HPLC con la columna, TSKgel G2 000SWxl (7,8x300 mm, 5µm) (Tosoh Bioscience, Japón). Se empleó como solución de corrida fosfato de sodio 150 mmol/L pH 7 a un flujo de 0,25 mL/min. Para evaluar la actividad biológica se midió la unión de la molécula RBDhis (aa 319-541) con el dominio extracelular (aa 18-740) del receptor ACE2 fusionado al fragmento Fc de IgG1 humana (ACE2-hFc), empleando el ELISA. La antigenicidad se determinó mediante la unión de la molécula RBDhis (aa 319-541) con anticuerpos purificados de pacientes convalecientes de COVID-19 (donados gentilmente por Gilda Lemos, CIGB, La Habana, Cuba), utilizando un ELISA. Para ello, primeramente, se recubrió la placa de 96 pozos de cloruro de polivinilo con 2,5 µg/mL del anticuerpo anti-RBD CBSSRBD-S.1 (CIGB, Sancti Spíritus, Cuba) disuelto en la solución salina tamponada por fosfatos y se incubó de 16 a 20 h a 4°C. Después de bloquear con la solución de leche descremada al 2% disuelta en la solución salina tamponada por fosfatos, se aplicaron las disoluciones seriadas de las muestras de RBDhis (aa 319-541) y se incubó 1 h a temperatura ambiente. Luego de lavar la placa con la solución salina tamponada por fosfatos con Tween 0,05% (v/v), se añadió ACE2-hFc (donados gentilmente por Tays Hernández, CIM, Cuba) a 5 µg/mL y los anticuerpos policlonales humanos anti-SARS-CoV-2 (donados gentilmente por Gilda Lemos, CIGB, Cuba) a 25 µg/mL en los pozos correspondientes. Se empleó como control negativo del ensayo la inmunoglobulina humana normal 10% (Empresa de Sueros y Productos Hemoderivados ¨Adalberto Pesant¨, Cuba) y el receptor relacionado PDL1 Fc humano (CIM, Cuba) a 5 µg/mL. Se lavó la placa y se incubó con el anticuerpo monoclonal anti-IgG humana conjugado a peroxidasa de rábano picante durante 1 h a temperatura ambiente y se lavó la placa nuevamente. El ensayo se reveló con la solución sustrato de la peroxidasa (0,5 mg/mL de orto fenilendiamina y 0,015% (v/v) de peróxido de hidrógeno en 0,1 mol/L de solución fosfato-citrato pH 5). Después de 15 min, la reacción se detuvo con ácido sulfúrico al 10% (v/v) y se midió la absorbancia a 490 nm utilizando un lector de placas (Dialab, Austria).11 La determinación de HCP, se realizó por el método de ELISA, empleando el kit CHO (F015 de Cygnus Technologies). 11) El contenido de ADN contaminante en las muestras de RBDhis (aa 319-541) purificadas se cuantificó mediante la técnica de Dot Blot.11 La concentración de endotoxinas se determinó por el método del lisado de amebocitos de Limulus (LAL), empleando el ensayo cromogénico cinético.11
Estadística
El DoE y los análisis estadísticos de los resultados se llevaron a cabo mediante el software Statgraphics versión XVI. Se realizó un análisis de optimización multivariable, el cual permite determinar la combinación de factores experimentales que optimizan simultáneamente varias respuestas. Para realizar este análisis se empleó el método de la función deseabilidad.
Resultados y Discusión
A partir de las cosechas obtenidas de la fermentación de las CHO-K1 transfectadas para producir RBDhis (aa 319-541), se realizó la purificación de las moléculas RBDhis dimérica y monomérica.
Selección de la condición de adsorción de la matriz de afinidad mediante un diseño de experimentos
Como la proteína RBDhis (aa 319-541) se diseñó con una cola de 6His en el extremo C terminal para facilitar el proceso de purificación, se seleccionó como etapa de captura la IMAC.
En este experimento se evaluó la influencia de la concentración volumétrica del Tween 20, fuerza iónica y concentración molar del tampón fosfato de sodio y del imidazol, por ser recomendados para el estudio en la adsorción a la IMAC, 12) por lo que, teniendo los componentes presentes en el sobrenadante y los diferentes factores evaluados a través del DoE, se hizo necesario acondicionar la cosecha filtrada a cada una de las condiciones estudiadas. La condición de adsorción deseada es la que garantiza la máxima adsorción de RBDhis (aa 319-541) a la matriz de IMAC y pureza del producto eluído en cuanto al contenido de especie dimérica y monomérica, la mínima pureza del producto eluído en cuanto al contenido de oligómeros y la relación de proteína-ADN contaminante alrededor de 1,17.10
Los factores que presentaron mayores influencias significativas sobre las variables respuestas fueron la concentración volumétrica de Tween 20, la fuerza iónica y la concentración molar de imidazol con valor-P < 0,05. Estos resultados se corresponden con lo planteado en la literatura 6) donde se reporta que el empleo de detergentes no iónicos en la IMAC potencia la selectividad, minimiza las interacciones no específicas con la matriz y mejora el rendimiento y el recobrado. También se ha descrito en la literatura, 13) que el Tween 20 disminuye las interacciones hidrofóbicas intermoleculares y las especies oligoméricas, por lo que se pudiera sugerir que logra exponer la etiqueta de 6His presente en la RBD favoreciendo la adsorción al metal inmovilizado. Por otro lado, la fuerza iónica, incrementada por la adición de NaCl suprime las interacciones electrostáticas inespecíficas entre la proteína y el ligando quelante metálico y promueve el tipo de enlace de coordinación de electrones apareados.14 Sin embargo, en este experimento la condición que favorece el incremento de la capacidad de adsorción se obtuvo a baja fuerza iónica. Estos resultados se corresponden con los obtenidos por Pavan y colaboradores, quienes no lograron mejorar la separación de IgG humana en suero, empleando una solución de NaCl en IMAC.15
Se plantea que la presencia de una baja concentración de imidazol en el tampón de equilibrio ayuda a evitar y disminuir la unión de proteínas contaminantes no etiquetadas, lo que trae consigo el incremento de la capacidad de adsorción de la proteína marcada con el metal inmovilizado y de esta forma se logra incrementar la pureza de la proteína de interés.16
En la superficie de respuesta estimada se obtiene una deseabilidad compuesta (0,8) cercana a 1 (Fig. 1), lo que indica que la configuración logra resultados favorables para todas las respuestas como un todo.17 En dicha figura se observa el espacio de diseño donde se puede trabajar y se obtiene un producto que cumple con la calidad predeterminada: fuerza iónica 75-300 mmol/L, imidazol 4-5 mmol/L, Tween 20 0-0,1 % (v/v); y dentro de esta región la condición de adsorción de la matriz de afinidad en el punto óptimo es tampón fosfato de sodio 20 mmol/L, NaCl 300 mmol/L, imidazol 5 mmol/L, Tween 20 0,1 % (v/v) pH 7,4.
Selección de la solución de equilibrio de las matrices de exclusión molecular e intercambio catiónico mediante un diseño experimental
Con el objetivo de separar la proteína de interés de un grupo de impurezas contaminantes como otras proteínas, ácidos nucleicos, endotoxinas y virus, se realiza la evaluación de la incorporación de un intercambiador catiónico como etapa intermedia del proceso de purificación de RBDhis (aa 319-541).8
El material de partida en esta etapa es el eluato proveniente de la IMAC, que presenta condiciones no favorables para la adsorción al intercambiador catiónico, por ello, se hizo necesario acondicionar dicha elución a cada una de las soluciones del DoE, mediante una cromatografía de exclusión molecular.
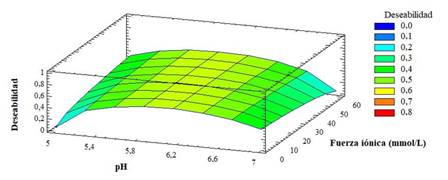
Los factores fuerza iónica y pH presentan una influencia significativa tanto en la solubilidad de la molécula RBDhis (aa 319-541) como en el porcentaje de adsorción al intercambiador catiónico, con un valor P < 0,05.
El efecto significativo del pH y la fuerza iónica presente sobre la solubilidad de las proteínas y en el empleo de los intercambiadores catiónicos se corresponde con lo reportado en las literaturas.8,18 La proteína RBDhis (aa 319-541) tiende a presentar menor estabilidad a medida que se disminuye el pH de 7 a 5. Esto puede estar asociado a que con el aumento del número de grupos cargados en una proteína (a un pH alejado del punto isoeléctrico (pI= 8,4)), el aumento de los efectos electrostáticos dentro de la proteína desestabiliza la conformación plegada debido a que la densidad de carga en la proteína plegada es mayor que en el estado desplegado.13
Por otra parte, los tres valores de pH evaluados se encuentran por debajo del pI (favorables para el empleo del intercambiador catiónico). Sin embargo, el porcentaje de adsorción a pH 7 resultó ser el más bajo, esto pudiera explicarse porque el pH se encuentra más cercano al pI y su densidad de carga disminuye y, por lo tanto, no se lograría adsorber la molécula de RBDhis (aa 319-541) a la matriz de intercambio catiónico; mientras que a pH 5, la proteína de interés presenta una menor solubilidad (presencia de agregación) y, cuando se determina la concentración de la fracción adsorbida mediante densidad óptica a 280 nm, dicha agregación puede interferir en los valores de porcentajes de adsorción.
Con respecto a la fuerza iónica, se conoce que una manera de incrementar la solubilidad de las proteínas para mejorar las interacciones proteína-proteína y a su vez prevenir la formación de agregados es mediante la adición de una sal. Los iones con baja densidad de carga se adsorben a los solutos mediante fuerzas de dispersión no localizadas, por lo que estos iones se comportan como surfactantes al adicionar carga a la superficie del soluto, lo que resulta en el incremento de la solubilidad de la proteína. Sin embargo, concentraciones muy elevadas tienden a desestabilizar la estructura de la proteína, al disminuir el grado de hidratación de los grupos iónicos superficiales de la proteína, donde los solutos compiten por el agua y rompen los puentes de hidrógeno o las interacciones electrostáticas y promueven las interacciones hidrofóbicas, de forma que las moléculas se agregan y precipitan.19
También se ha descrito que las matrices de intercambio iónico, se pueden equilibrar con una baja concentración de sal de al menos 10 mmol/L para garantizar una adecuada capacidad de interacción iónica, evitar la unión inespecífica de proteínas a la columna y estabilizar las estructuras proteicas para evitar la desnaturalización o precipitación de las proteínas.20 En este caso, un incremento de la conductividad disminuye el porcentaje de adsorción; no obstante, se debe tener en cuenta que la variable solubilidad de la proteína influye en la calidad de la molécula obtenida.
En la superficie de respuesta estimada se obtiene una deseabilidad compuesta: 0,6 (Fig. 2), lo que indica que la configuración logra resultados aceptables para todas las variables respuestas como un todo.17 En dicha figura se aprecia que la solución de equilibrio de la etapa intermedia se puede operar dentro del espacio de diseño: pH 5,8-6,2, fuerza iónica 0-60 mmol/L. También se observa que la combinación de los factores que maximizan la función deseabilidad es la solución de equilibrio tampón fosfato de sodio 50 mmol/L, NaCl 30 mmol/L pH 6.
Establecimiento de las condiciones de operación de la etapa final del proceso de purificación
El objetivo de la etapa final de un proceso de purificación es remover las trazas de HCP, las cantidades residuales de ADN, el ligando proteína A y los contaminantes virales del paso de captura, además de otras impurezas asociadas al producto de interés.12
En las etapas anteriores del proceso de purificación se observa la presencia de especies monoméricas y diméricas de la proteína de interés, que constituyen los antígenos de las vacunas SOBERANA®02 y SOBERANA®Plus y el candidato vacunal SOBERANA 01, por lo que es necesario separarlas de acuerdo a su masa molar. Para ello, se selecciona como etapa final del proceso de purificación de RBDhis (aa 319-541), la cromatografía de exclusión molecular (Superdex 200 pregrade). Con esta etapa se logra cambiar la proteína de interés a una solución tampón estable, en este caso, una solución salina tamponada por fosfatos,21 y separar las especies oligoméricas que constituyen un contaminante y las especies diméricas y monoméricas.
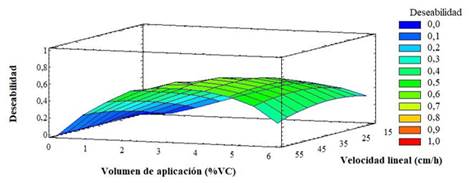
Los factores que influyeron significativamente (valor P ˂ 0,05) en la variable respuesta resolución son: volumen de aplicación, velocidad lineal y la interacción de ambos factores y en la variable respuesta productividad influyeron ambos factores, el efecto cuadrático de los dos factores y su interacción.
Se obtuvo que, a mayor velocidad lineal y volumen de aplicación, más productiva es la etapa final del proceso de purificación y se ha reportado que existe una menor probabilidad de degradación de la proteína durante el proceso de separación.22 Este resultado es esperado, ya que el incremento de la velocidad lineal trae consigo una disminución en el tiempo de operación de dicha etapa. Así como el aumento del volumen de aplicación, incrementa la masa obtenida al final de la etapa.
La influencia de estos dos factores también se debe analizar en cuanto a la resolución de los picos, ya que entre las dos variables respuestas existe un equilibrio entre la resolución y la productividad. 23) La resolución influye en la correcta separación de las especies de RBDhis (aa 319-541) y, por consiguiente, en la pureza final. Es decir, que a medida que se disminuya la velocidad lineal y el volumen de aplicación en la etapa final, disminuye la resistencia a la transferencia y la altura del plato teórico y, por lo tanto, se incrementa la resolución de las dos especies. 23) Sin embargo, si se aumenta tanto el volumen de aplicación como la velocidad lineal, las dos especies coeluyen y bajo estas condiciones es complicado separar el dímero y el monómero para alcanzar una elevada pureza y productividad. 22)
Para determinar la condición de operación que garantice la correcta separación de las especies dimérica y monomérica se buscó la combinación de velocidad lineal y volumen de aplicación que maximizan la productividad y se obtenga una resolución igual a 1. El espacio de diseño donde se logra la correcta separación de las especies dimérica y monomérica es a velocidad lineal 32,5-50 cm/h, volumen de aplicación 2-4 % y la combinación que maximiza la variable deseabilidad (0,4) es para una velocidad lineal de 50 cm/h y un volumen de aplicación del 4% VC con la que se obtiene una productividad de 16,25 mg/h y una resolución de 0,9 (Fig. 3).
Evaluación del desempeño del proceso de purificación y caracterización de RBDhis (aa 319-541) a escala piloto
Una vez seleccionadas las soluciones de adsorción para cada etapa cromatográfica y las condiciones de operación, se procedió a evaluar el desempeño del proceso de purificación de RBDhis (aa 319-541) a escala piloto y los principales atributos de calidad de la molécula dimérica y monomérica.
Los recobrados globales de cada corrida realizada a escala piloto resultaron mayores que 50%, con un recobrado global promedio igual a 60,02% con una desviación estándar de ± 5,15%. Estos valores se corresponden con los valores de recobrado global obtenidos por Chen y colaboradores, 55% de RBD203-N1.24
Una vez verificado el desempeño del proceso de purificación a escala piloto, se evaluó la calidad de las moléculas diméricas y monoméricas de RBDhis (aa 319-541). La especie dimérica en todos los perfiles de SEC-HPLC eluyó en el mismo tiempo de retención de 6,91 min y la especie monomérica en 8,16 min. La pureza promedio obtenida para la especie dimérica resultó ser igual a 99,96 ± 0,05% y para la especie monomérica de 98,78% ± 0,22%; ambas especies cumplen con lo reportado en la literatura (mayor del 95%).24
El reconocimiento de las dos moléculas de RBDhis (aa 319-541), al receptor ACE-2-hFc fue superior al 70%, lo que cumple con el criterio de aceptación: tres veces mayor que el control negativo del ensayo. La antigenicidad de las moléculas purificadas realizada con anticuerpos purificados de pacientes convalecientes fue superior al 90%.
Con los cinco lotes producidos a escala piloto se conformaron cuatro lotes de IFA: dos de la especie dimérica y dos de la especie monomérica de RBDhis (aa 319-541) y se verificó la remoción de los contaminantes asociados al proceso. El contenido de ADN contaminante resultó menor que 50 ppm, de HCP menor que 0,10% y de endotoxinas bacterianas menores que 87 UE/mg. Dichos valores se encuentran por debajo de las especificaciones establecidas por el CIM, según la literatura (< 100 ppm, < 0,40 % y < 200 UE/mg, respectivamente),25 por lo que se puede afirmar que el esquema y las condiciones de trabajo garantizan la eficiente remoción de contaminantes.
Conclusiones
La incorporación del detergente no iónico Tween 20, de la concentración molar del imidazol y de la fuerza iónica en la condición de adsorción de IMAC favoreció la unión de la molécula RBDhis (aa 319-541), el incremento de especies diméricas y monoméricas y la disminución de contaminantes (oligómeros y ADN). Con un valor de pH igual a 6 y una concentración molar de NaCl de 30 mmol/L en la solución de equilibrio de la etapa intermedia se logró la máxima solubilidad y adsorción de la molécula RBDhis (aa 319-541) al intercambiador catiónico. Con el incremento del volumen de aplicación y la velocidad lineal en la cromatografía de exclusión molecular (etapa final) se obtuvo la máxima productividad, pero menores valores de resolución de los picos de las especies diméricas y monoméricas de la proteína de interés. Con los parámetros de operación establecidos en la variante de esquema de purificación se alcanzó un 60% de recobrado global, una pureza por encima del 98% para ambas especies, un reconocimiento y antigenicidad de la RBDhis (aa 319-541) en el intervalo de aceptación y una eficiente remoción de los contaminantes.