Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med v.9 n.3 Ciudad de la Habana sep.-dic. 2004
Centro de Investigación y Desarrollo de Medicamentos (CIDEM)
Efecto del extracto acuoso liofilizado de Ocimun tenuiflorum L. sobre la anafilaxia pasiva cutánea, espasmo y tonicidad bronquial
Lic. Yanier Núñez Figueredo,1 Lic. Pedro Barzaga Fernández,1 Téc. Carmen Carrillo Domínguez,2 Lic. Humberto Lastra Valdés,3 Lic. Ismael Chávez Hernández,4 Lic. Dianelis Fernández Mena1 y Téc. María Lidia González Sanabria5
Resumen
Para demostrar las propiedades antialérgicas conferidas a Ocimum tenuiflorum L., se estudió su posible influencia sobre los mediadores anafilácticos y el espasmo bronquial inducido por histamina, así como su posible efecto broncodilatador. En la prueba de anafilaxia pasiva cutánea se emplearon ratas Wistar machos a las cuales se les administró el extracto en dosis de 250, 500 y 1000 mg/kg por vía oral durante 10 días. Se empleó como control positivo ketotifeno 3 mg/kg, la intensidad de la anafilaxia se determinó cuantificando la cantidad de azul de Evans extravasado. El efecto broncodilatador y protector del espasmo bronquial se determinó en cobayos Hartley machos, induciendo brococonstricción por administración intravenosa de histamina y determinando la presión bronquial. Como resultado de este trabajo se encontró que el extracto acuoso liofilizado de Ocimum tenuiflorum L. inhibió la anafilaxia pasiva cutánea y no presentó efecto protector del espasmo bronquial inducido por histamina, tampoco demostró propiedades broncodilatadoras en el modelo farmacológico empleado.
Palabras clave: Ocimum tenuiflorum L., anafilaxia pasiva cutánea, actividad broncodilatadora, espasmo bronquial.
La búsqueda de nuevos principios activos obtenidos a partir de productos naturales, es de vital importancia con vistas a incorporar los mismos en el tratamiento de diversas enfermedades muy frecuentes en la población entre de las que se encuentran el edema, prurito, broncoconstricción e hipotensión que se observan clínicamente como fiebre de heno, urticaria, asma, shock anafiláctico, entre otros.1Las reacciones de hipersensibilidad tipo I contra los antígenos ambientales (alergenos) en individuos genéticamente sensibles producen anticuerpos IgE contra alergenos tales como: polen, mohos, polvo, caspa de la piel de los animales y ciertos alimentos. La exposición al alergeno agresivo da por resultado la liberación de mediadores como histamina, sustancias de reacción lenta (SRS-A), y el factor quimiotáctico de los eosinófilos (ECF-A) en el órgano que sirve de blanco. La acción de estos mediadores sobre los vasos sanguíneos, músculo liso y glándulas secretoras con su reacción inflamatoria asociada, es responsable de las manifestaciones sintomáticas y de las características del padecimiento, entre ellas, una hipereactividad bronquial, es decir una respuesta exagerada en forma de broncoconstricción. 1
Ocimum tenuiflorum L. es una planta de la familia Lamiaceae conocida popularmente como albahaca morada. Se considera nativa de Cuba, siendo muy común su empleo en la medicina tradicional cubana como hipoglicemiante, antiasmático, y antiinflamatorio. En estudios de tamizaje fitoquímico se ha identificado la presencia de aminas, flavonoides, leuco-antocianinas, esteroles y triterpenos.2
Por su aceptación popular en el país para el tratamiento del asma bronquial,3 en el Centro de Investigación y Desarrollo de Medicamentos se preraró el extracto acuoso liofilizado de Ocimum tenuiflorum L. y en el presente trabajo se evaluan las propiedades del mismo sobre el espasmo bronquial inducido por la administración endovenosa de histamina, anafilaxia pasiva cutánea, así como sus posibles propiedades broncodilatadoras.4
Métodos
Sustancia de ensayo
Extracto acuoso liofilizado de O. tenuiflorum obtenido a partir de la suspensión acuosa del follaje de la planta.
El material vegetal fue colectado en la Estación Experimental de Plantas Medicinales "Juan Tomás Roig" (EEPM) del Centro de Investigación y Desarrollo de Medicamentos (CIDEM) en primavera, con No. de herbario 0019, lote 16-17 y secado a 40 ºC en estufa de recirculación de aire. La suspensión acuosa fue preparada por reflujo de 100 g de material vegetal con 1L de agua destilada durante 15 min y preservada con metilparabeno 0,2 % y propilparabeno 0,02 %. El perfil cromatográfico de la suspensión fue caracterizado por cromatografía de capa delgada. Posteriormente la suspensión acuosa fue sometida a un proceso de liofilización empleando para ello una liofilizadora Edward.
Animales
La evaluación del espasmo bronquial inducido por la administración de histamina se realizó en cobayos Hartley machos (400-450 g de peso corporal) procedentes del Centro Nacional para la Producción de Animales de Laboratorios (CENPALAB). En el ensayo de anafilaxia pasiva cutánea se utilizaron ratas Wistar machos de 300 a 350 g de peso corporal y ratones albinos Suizos machos de 18 a 22 g de peso corporal para la obtención del antisuero de ovoalbúmina, procedentes de la colonia de la UCTB control Biológico (CIDEM).
Condiciones ambientales y de laboratorio
Los animales se mantuvieron en un cuarto con temperatura controlada de 22 ± 2 ºC, con un ciclo luz-oscuridad 12/12 h. La dieta administrada consistió en pienso convencional para cobayos CCO 1302 y ratonina en pelotillas para ratas y ratones CMO 1000 proveniente del CENPALAB y agua a voluntad. Reactivos y Medicamentos
Aminofilina 20 mg inyectable. Laboratorios Eron S.A, La Habana, Cuba
Difenhidramina 25 mg tabletas. Laboratorios ERON S.A, La Habana, Cuba
Fosfato ácido de histamina. BDH, Inglaterra
Ketotifeno 1 mg tableta. Laboratorios Eron S.A, La Habana, Cuba
Albúmina de huevo. Fluka Chemie AG, CH-9740 Buchs, Suiza
El resto de los reactivos empleados provienen de la casa comercial SIGMA, EE.UU.
Espasmo bronquial inducido por histamina
Se confeccionaron 5 grupos de ensayo con 4 animales cada uno, 3 de los grupos fueron tratados con extracto acuoso liofilizado de O. tenuiflorum a las dosis de 200, 400 y 800 mg/kg respectivamente por vía oral durante 7 días, otro con difenhidramina 60 mg/kg en dosis única por la misma vía 1 h antes del desafío y un ultimo grupo control sin tratamiento.
Posteriormente todos los animales fueron anestesiados con 40 mg/kg de pentobarbital sódico para realizar la traqueotomía y ventilarlos con una bomba de respiración con 100 pulsaciones/min/ kg de peso, se canalizó la vena yugular y se administraron 15 mg/kg de pentobarbital sódico para producir el paro respiratorio. A continuación se realizaron 3 administraciones por vía intravenosa de 15 mg/kg de histamina tanto a los grupos tratados como al grupo control y se determinó la presión intratraqueal después de cada administración mediante un transductor de presión TP-101T acoplado a un polígrafo NIHON KOHDEN.4
Actividad broncodilatadora
Se siguió el mismo procedimiento que para el ensayo anterior sólo que en este caso se realizaron 3 administraciones de histamina con intervalo entre ellas de 6 min antes de administrar por vía intravenosa 25, 50 y 100 mg/kg de extracto acuoso liofilizado de O. tenuiflorum y posteriormente se realizaron otras 2 administraciones de histamina 15 mg/kg con el mismo intervalo de tiempo entre ellas.5 El criterio de positividad fue el mismo que para el ensayo anterior. Anafilaxia pasiva cutánea (APC)
Obtención del antisuero de ovoalbúmina Se administraron 0,2 mL de solución sensibilizante de albúmina de huevo a un grupo de 20 ratones por vía intraperitoneal, cuya composición fue: albúmina de huevo 0,1% (10 mL), NaHCO3 8,4 % (4,5 mL), KAl(SO4)2 10 % (10 mL), PBS pH 7,4 (20 mL). Los animales se inmunizaron 2 veces con 7 días de intervalo entre ellas. 14 días después de la última administración se sacrificaron los animales y se procedió a la extracción de la sangre por la vena femoral, la que se centrifugó a 2 500 rpm por 10 min a 37 ºC para obtener el antisuero.4
Para el ensayo de APC se formaron 4 grupos de trabajo de 4 ratas cada uno: 2 grupos recibieron extracto acuoso liofilizado de O. tenuiflorum a las dosis de 250, 500 y 1 000 mg/kg respectivamente, un grupo control positivo administrado con ketotifeno 3 mg/kg y un grupo control sin tratamiento. El extracto acuoso liofilizado de O. tenuiflorum se administró por vía oral durante un período de 10 días. La última administración de la sustancia de ensayo y la administración del ketotifeno fue realizada 1 h antes del desafío.
Las ratas fueron rasuradas en el área dorsal 1 h antes de la administración intradérmica de 0,1 mL de antisuero de albúmina de huevo (obtenido previamente de ratones) diluido en cloruro de sodio 0,9 % (1:20) en 6 sitios del lomo. Pasadas 24 h se provocó la reacción anafiláctica mediante la administración por vía intravenosa de 1 mL de una solución al 0,1% de albúmina de huevo en el colorante azul de Evans al 1 %. Los animales fueron sacrificados 1 h después de provocada la reacción de anafilaxia para la extracción de porciones de piel que fueron colocadas en tubos de ensayo que contenían 4 mL de formamida e incubados a 37 °C durante 48 h. Se midió la densidad óptica del colorante extravasado a una l= 623 nm.4,6 Los valores de densidad óptica obtenidos fueron expresados mediante una curva de calibración en mg de azul de Evans extravasado/sitio.
Procesamiento estadístico
Los resultados obtenidos se expresaron a través de la media ± desviación estándar. Los mismos se procesaron mediante un análisis de varianza de una vía y posteriormente se realizó una prueba de Duncan con un nivel de significación de p<0,05.7
Resultados
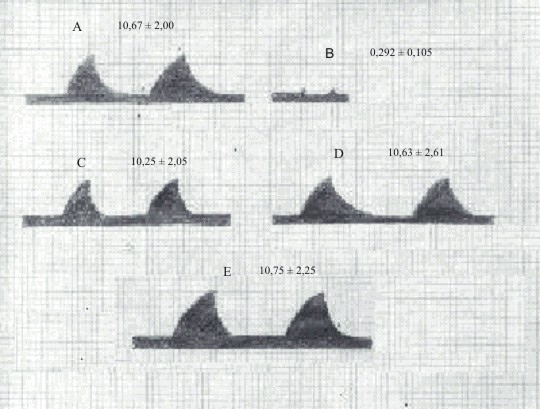
En el ensayo donde se provocó espasmo bronquial por administración intravenosa de histamina 15 mg/kg en cobayos, se pudo comprobar que los animales tratados con las diferentes dosis de extracto acuoso liofilizado de O. tenuiflorum no tuvieron efecto protector al mismo pues se obtuvieron valores de presión intratraqueal similares a los obtenidos en el grupo control negativo (figura 1).
Fig. 1. Efecto del extracto acuoso liofilizado O. tenuiflorum sobre el espasmo bronquial inducido por histamina 15 mg/kg, animales controles (A), tratados con difenhidramina 60 mg/kg (B), tratados con extracto acuoso liofilizado de O. tenuiflorum a las dosis de 200, 400 y 800 mg/kg (C, D y E respectivamente).
En el ensayo de actividad broncodilatadora el extracto acuoso liofilizado de O. tenuiflorum no presentó efecto positivo sobre este indicador en ninguna de las dosis ensayadas (figura 2), los animales tratados con aminofilina 25 mg/kg disminuyeron significativamente los valores de presión intratraqueal con respecto al grupo control negativo según el criterio de positividad empleado.
Fig.2. Efecto broncodilatador del extracto acuoso liofilizado O. tenuiflorum, animales controles (A), tratados con aminofilina 25 mg/kg (B), tratados con extracto acuoso liofilizado de O. tenuiflorum. a las dosis de 25, 50 y 100 mg/kg (C, D y E respectivamente).
Los resultados de la administración de extracto acuoso liofilizado de O. tenuiflorum a las dosis de 250, 500 y 1 000 mg/kg, por un período de 10 días sobre la APC, mostraron una disminución de la intensidad de la reacción anafiláctica en ratas (figura 3), la que fue diferente con respecto al grupo control negativo para p<0,01. Los grupos tratados con la dosis de 250 y 500 mg/kg de O. tenuiflorum mostraron resultados estadísticamente similares.
Fig. 3. Medias de la cantidad de colorante extravasado /sitio en cada uno de los grupos de ensayo.
Discusión
Como es conocido, la reacción antígeno- IgE produce un cambio estructural a nivel de la membrana de la célula mastocita que suele alterar la permeabilidad de la misma, permitiendo el rápido ingreso de diversos iones, entre ellos el calcio, el cual es esencial para la desgranulación de estas células. Además se produce un cambio bifásico en los niveles de AMP cíclico, lo que hace que ocurra un incremento rápido del mismo, seguido de una disminución notable. Es precisamente durante esta disminución notable de AMP cíclico que se liberan los mediadores de la anafilaxia. 4,8-14
En el ensayo donde se provocó la APC mediante un mecanismo inmunológico se observó el efecto inhibitorio de la intensidad de la misma por parte del extracto acuoso liofilizado de O. tenuiflorum a las dosis ensayadas, probablemente debido a que este impida de alguna manera la reacción antígeno-anticuerpo, impida la síntesis y/o liberación de los mediadores alérgicos por parte de los mastocitos especialmente de la serotonina, bradiquinina, factor activador de plaquetas, prostaglandinas y/o leucotrienos o antagonicen sus receptores que evitaría la fragilidad capilar provocada por ellos y por lo tanto que haya una disminución de la cantidad de colorante extravasado/sitio, ya que los productos antagonistas de estos mediadores inhiben el aumento de la permeabilidad capilar producida por los mismos. 15
También se pudo apreciar que el extracto acuoso liofilizado de O. tenuiflorum a las dosis de 200, 400 y 800 mg/kg después de haber sido administrado por vía oral durante un período de 7 días, no presentó efectividad en el tratamiento profiláctico de la broncoconstricción inducida por histamina, ya que los valores de presión bronquial entre el grupo control y los grupos tratados no fueron significativamente diferente según el criterio estadístico analizado. Tampoco se observó efecto broncodilatador por parte del extracto acuoso liofilizado de O. tenuiflorum administrado por vía endovenosa en cobayos, por lo que parece que el extracto de acuoso liofilizado de O. tenuiflorum no inhibe los efectos de la histamina a nivel bronquial, la cual al interactuar con los receptores H1 provoca broncoconstricción 4,16 y por consiguiente se convierte en uno de los mediadores de las enfermedades alérgicas.1,16
Finalmente se puede concluir que el extracto acuoso liofilizado de O. tenuiflorum inhibió la anafilaxia pasiva cutánea en ratas a las dosis ensayadas, no inhibió el espasmo bronquial inducido por la administración intravenosa de 15 mg/kg de histamina y por vía endovenosa no presentó efecto broncodilatador en el modelo farmacológico empleado.Summary
In order to show the antiallergic properties conferred to Ocimum tenuiflorum L., its possible influence on the anaphylactic mediators and on bronchial spasm induced by histamine, as well as its possible effect as bronchodilator, were studied. Wistar male rats were used in the passive cutaneous anaphylaxis test. They were administered the extract at doses of 250, 500 and 1000 mg/kg by oral route for 10 days, using ketotiphen 3 mg/kg as a positive control. The anaphylaxis intensity was determined by quantifying the amount of extravasated Evans blue. The bronchodilator and protective effect of bronchial spasm was determined in Hartley male guinea pigs by inducing bronchoconstriction through the intravenous administration of histamine and determining the bronchial pressure. As a result, it was found that the frozen dried aqueous extract of Ocimum tenuiflorum L. inhibited the passive cutaneous anaphylaxis and that it did not present a protective effect of the bronchial spasm induced by histamine. No bronchodilator properties were observed in the pharmacological model used.Key words: Ocimum tenuiflorum L.; passive cutaneous anaphylaxis, bronchodilator activity; bronchial spasm.
Referencias bibliográficas
1. Elena RJP. Aspectos no tradicionales en fisiopatología respiratoria. La Habana: Editorial Ciencias Médicas; 1988.p. 94-5.
2. Roig TJ. Plantas medicinales aromáticas o venenosas de Cuba. 2da ed. La Habana: Instituto del Libro; 1988.p.141-3.
3. Disponible en URL: [en línea] http://www.niam.com/corp-web/ocimum.htm. Abril 2002.
4. Núñez Y, Lagarto A, Tillán J, Lastra H, Agüero S, Guerra I, et al. Efecto del extracto hidroalcohólico de Eucalyptus citriodora Hook sobre la anafilaxia pasiva cutánea, espasmo bronquial y toxicidad aguda. Rev Mexicana Ciencias Farmacéuticas. 2003; 34 (4):3-7.
5. Carbajal D, Casacó A, Arruzazabala L, Gonzalez R, Fuentes V. Pharmacological screening of plant decoctions commonly used in Cuba folk medicine. J Ethnopharmacol. 1991; 33(1-2): 21-4.
6. Ukada K, Takeuchi Y, Movat HZ. Simple method for quantification of enhanced vascular permeability. Proc Soc Exp Biol Med. 1970;33:1384-7.
7. Sigarroa A. Biometría y Diseño Experimental. La Habana: Editorial Pueblo y Educación; 1985.p. 430.
8. Yang HN, Lee EH, Kim HM. Spirulina platensis inhibits anaphylactic reaction. Life Sci. 1997; 61(13): 1237-44.
9. Kim YC, Lee EH, Lee YM, Kim HK, Song BK, Lee EJ, et al . Effect of the aqueous extract of Aquilaria agallocha stems on the immediate hypersensitivity reactions. J Ethnopharmacol. 1997; 58(1): 31-8.
10. Kang BK, Lee EH, Kim HM. Inhibitory effects of Korean folk medicine 'Hi-Chum' on histamine release from mast cells in vivo and in vitro. J Ethnopharmacol. 1997; 57(2): 73-9.
11. Kim HM. Effects of Siegesbeckia pubescens on immediate hypersensitivity reaction. Am J Chin Med. 1997; 25(2):163-7.
12. Matsuda H, Dai Y, Ido Y, Yoshikawa M, Kubo M. Studies on kochiae fructus. IV. Anti-allergic effects of 70 % ethanol extract and its component, momordin Ic from dried fruits of Kochia scoparia L. Biol Pharm Bull. 1997; 20(11):1165-70.
13. Babakhin AA, Majoul LA, Vedernikov AA, Leskov VP, Pisarev VM. In vivo and in vitro immunomodulation induced by the extract of the mycelium fungus Polyporus squamosus. Allergy Asthma Proc. 1997; 18(5): 301-10.
14. Lee YM, Kim CY, Kim YC, Kim HM. Effects of Poncirus trifoliata on type I hypersensitivity reaction. Am J Chin Med. 1997; 25(1): 51-6.
15. Litter M. Farmacología Experimental y Clínica. 7ma ed. Buenos Aires: El Ateneo; 1986. p. 179- 200.
16. Friberg SG, Olgart Hoglund C, Gustafsson LE. Nerve growth factor increases airway responses and decreases levels of exhaled nitric oxide during histamine challenge in an in vivo guinea-pig model. Acta Physiol Scand. 2001; 173(2):239-45.
Recibido: 25 de mayo de 2004. Aprobado: 2 de agosto de 2004.
Lic. Yanier Nuñez Figuredo. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). Departamento de Investigaciones Biológicas. Calle 17 No. 6208 e/ 62 y 64 Playa, La Habana, Cuba. e-mail: cinfa@infomed.sld.cu
1 Licenciado en Farmacia. Aspirante a Investigador.
2 Técnico Medio en Farmacia.
3 Licenciado en Química. Investigador Auxiliar.
4 Licenciado en Bioquímica. Investigador Agregado.
5 Técnico Medio en Química Analista.