Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med v.11 n.1 Ciudad de la Habana ene.-abr. 2006
Artículos originales
Laboratorio Central de Farmacología. Facultad de Ciencias Médicas Dr. Salvador Allende
Tamizaje fitoquímico, actividad antiinflamatoria y toxicidad aguda de extractos de hojas de Annona squamosa L.
Lic. María del Carmen Victoria Amador,1 DrC. Francisco Morón Rodríguez,2 Lic. Zulema Morejón Rodríguez,3 Lic. María Julia Martínez Guerra4 y Lic. Marisol López Barreiro5
Resumen
Annona squamosa L. (anón) es una especie conocida y cultivada por sus frutos en todas las regiones tropicales. Tradicionalmente se emplea como antidiarreico, antiespasmódico, antiinflamatorio y analgésico, de ahí que fue de interés realizar esta investigación para validar la actividad analgésica y antiinflamatoria de la hoja de esta especie. Fueron identificados, además, los principales grupos de metabolitos secundarios presentes en el extracto acuoso (decocción) y en el fluido (etanol 30 %), de hojas frescas y secas, mediante un tamizaje fitoquímico. Ambos extractos fueron evaluados en los modelos farmacológicos de granuloma inducido por algodón en ratas, contorsiones por ácido acético 0,75% (0,1 mL/10 g intraperitoneal) en ratones; las dosis administradas por vía oral fueron equivalentes a 500 y 1 000 mg de material vegetal/kg de peso corporal, respectivamente. Se realizó un estudio de toxicidad aguda sistémica según el método de las Clases Tóxicas Agudas en ratas. Se encontraron diferencias en la composición de metabolitos secundarios entre ambos extractos. La decocción inhibió significativamente y de manera dosis dependiente la respuesta inflamatoria en el granuloma por algodón y las contorsiones inducidas por ácido acético intraperitoneal, el extracto fluido fue inactivo. No hubo evidencia de toxicidad aguda causada por ninguno de los 2 extractos, en la dosis máxima administrada por vía oral y equivalente a 10,0 y 15,67 g de material vegetal/kg, respectivamente. Estos resultados permiten validar el empleo y la seguridad del uso tradicional de la decocción de hoja fresca de A. squamosa para tratar problemas de salud relacionados con dolor e inflamación.
Palabras clave: Annona squamosa L., antiinflamatorio, analgésico, tamizaje fitoquímico.
Annona squamosa L. es una especie originaria de las Antillas, conocida y cultivada por sus frutos en todas las regiones tropicales y que, además, tiene atribuida tradicionalmente diversas propiedades medicinales. Entre sus usos populares se citan varios que pudieran tener relación con un posible efecto analgésico o antiinflamatorio del extracto acuoso de las hojas frescas de la planta; entre ellos se pueden citar: antidiarreico, antiespasmódico, antiinflamatorio y analgésico.1,2 La decocción de hojas es empleada para aliviar el dolor del bazo en Dominica3 y como colutorios, para aliviar el dolor de muelas en la India.4
Ha sido registrada la presencia en la hoja de: aminoácidos (ß-fenilalanina, arginina, metionina, prolina); carbohidratos (2-carboxiarabinitol, xilosa); alcanol (1-octacosanol, 1-triacontano, 1-traconsanol); aceite esencial 7,0-0,28 % (monoterpenos: a-terpineol 0,09 %; timol); flavonoides (quercetina) y esteroides (ß-sitosterol, estigmasterol).5-12
Diferentes autores, en el tamizaje fitoquímico, han informado la presencia de alcaloides y leucoantocianinas; así como, ausencia de ácido cianhídrico, quinonas, saponinas13 y taninos en toda la planta.14
Se realizó una búsqueda en las bases PubMed, LILACS y NAPRALERT hasta el 30 de enero de 2006, pero no se encontró ningún trabajo que demostrara los usos populares antes mencionados de esta especie.
Debido a la ausencia de confirmación experimental de los usos etnobotánicos de la planta, fue de interés realizar este trabajo para identificar los principales grupos de metabolitos secundarios, validar la actividad analgésica y antiinflamatoria de la hoja de esta especie y la toxicidad aguda de 2 extractos, acuoso e hidroetanólico al 30 %, de hoja, como parte de los estudios preclínicos destinados a avalar su uso como medicamento herbario.
Métodos
Material vegetal y extractos
Se preparó una decocción al 30 % (30 g de hojas frescas picadas finamente en 100 mL de agua destilada), en ebullición, durante 5 min, en recipiente de cristal tapado y un extracto fluido de hojas secas con etanol al 30 % mediante el método de repercolación.
Las hojas fueron colectadas por el Dr. Víctor Fuentes Fiallo en las áreas de la Estación Experimental de Plantas Medicinales Dr. Juan T. Roig, provincia La Habana, y una muestra fue depositada en el herbario de dicho centro con el número ROIG 4710.
El secado del material vegetal se realizó en horno a 40 oC con ventilación.
Se emplearon los indicadores de control de calidad establecidos en las normas cubanas ramales de salud para droga,15 extractos y tinturas.16,17
Los valores del control de calidad del extracto fluido fueron: índice de refracción (h D20 = 1,36685), porcentaje de sólidos totales (12,76 %), densidad relativa (1,0089) y contenido alcohólico (25,0 %).
Estudio fitoquímico
Luego de la preparación de los 2 extractos, se realizaron diferentes ensayos con reacciones químicas de identificación, mediante cambios de color o formación de precipitados, para determinar la presencia de metabolitos secundarios: flavonoides (Shinoda), compuestos fenólicos (cloruro férrico), alcaloides (Dragendorff y Mayer), triterpenos y esteroides (Liebermann-Buchard), quinonas (Bortrager), compuestos lactónicos y cumarinas (Baljet), aminoácidos (ninhidrina), antocianidinas (Rosemhein) y azúcares reductores (Fehling), presentes en ambos extractos.18
Estudio farmacológico
Modelo de analgesia por ácido acéticoSe utilizaron ratones machos, convencionales, no isogénicos OF-1 (20-25 g ).
Para los 2 experimentos, los animales fueron seleccionados al azar, en grupos de 10 ratones.
Los animales de los grupos controles negativos recibieron agua destilada o etanol al 25 % de manera isovolumétrica con la dosis administrada de extracto. A los animales del grupo tratado se les administró la decocción o el extracto fluido de A. squamosa, en dosis de 500 ó 1 000 mg de material vegetal/kg de peso corporal (pc).
El grupo control positivo recibió indometacina (10 mg/kg de pc) disuelta en bicarbonato de sodio al 4 %.
Los tratamientos de los grupos controles o con extracto fueron administrados por vía oral (po) mediante sonda orogástrica.
A los 60 min de haber recibido el tratamiento correspondiente, se inyectó ácido acético 0,75 % (0,1 mL/10 g pc) por vía intraperitoneal (ip) y se dejó al animal en reposo en su jaula para medir la variable: número total de contorsiones durante 15 min.19
Modelo de granuloma por algodónSe utilizaron ratas machos, no isogénicas, convencionales, de la línea Sprague-Dawley (150-200 g). En cada experimento, los animales fueron seleccionados al azar para formar los diferentes grupos.
Los animales de los grupos controles negativos recibieron agua o etanol 25 % de manera isovolumétrica con la dosis administrada de extracto.
Esta técnica consiste en hacer una incisión a cada lado de la línea media del dorso del tórax de cada animal, para introducir subcutáneamente 1 pellet de algodón de 50 mg, previo decolado de la piel, de manera que quedan situados aproximadamente a 3 cm de la herida. Se sutura con agrafes Mitchel y se añade antibiótico (sulfato de estreptomicina 1 %) en la herida para evitar las infecciones.19
Los grupos tratados recibieron extracto acuoso o fluido (500 ó 1 000 mg de material vegetal/kg p.c.), en dosis única diaria, y el grupo control positivo recibió indometacina (5 mg/kg/día pc) disuelta en bicarbonato de sodio al 4 %, en dosis única diaria por 4 días. Al quinto día, se procedió al sacrificio de los animales y a la exéresis de los granulomas, estos se llevaron a peso seco constante en un horno con ventilación a temperatura de 150 + 10 oC durante 3 h. Los granulomas fueron pesados antes y después de este proceder, con el propósito de determinar las variables: contenido acuoso del granuloma (peso húmedo-peso seco=contenido acuoso) y contenido fibrogranuloso (peso seco-peso del pellet de algodón) en gramos.
Estudio de toxicidad aguda
Se emplearon ratas machos y hembras, no isogénicas, convencionales, de la línea Sprague Dawley (200 ± 20 gramos ). Fue preparada una decocción de hojas frescas de A. squamosa al 50 % que tuvo como rendimiento 1,85 % de sólidos totales.
El método empleado fue el de las Clases Tóxicas Agudas (CTA),20,21 se administró la decocción o el extracto fluido, de hoja por vía oral.
La decocción fue administrada en dosis de volumen máximo (2 mL/100 g) para cada animal, equivalente a 10 g de material vegetal fresco/kg de pc, calculado a partir del contenido de sólidos totales del extracto acuoso (1,85 mg/mL).
El extracto fluido se suministró en una dosis máxima de 2 000 mg de sólidos totales/kg de pc, equivalente a 15,67 g de hoja seca/kg pc.
El grupo control recibió isovolumétricamente agua destilada.
Se emplearon 6 animales por dosis (3 de cada sexo), los grupos fueron conformados de manera aleatoria. Los animales fueron observados constantemente durante las primeras 4 h, la evaluación continuó diariamente durante 14 días. El protocolo de estudio tenía previsto registrar las muertes en las primeras 24 h y cualquier signo clínico durante los 14 días de observación, el peso se controló al inicio y al final del ensayo. Al sacrificar a los animales, se realizó un estudio macroscópico de los órganos.
Las observaciones clínicas a los animales incluyeron: apreciación del comportamiento y del el estado físico general; de las mucosas nasales y oculares en busca de secreciones y de la piel y el pelaje, sistema respiratorio, circulatorio, nervioso central y autónomo, en busca de cambios. Se realizó, además, la palpación del abdomen, se evaluó la actividad somato motora y se prestó especial atención a la posible ocurrencia de signos como temblores, convulsiones, diarrea, letargo, salivación, sueño y coma.
Los animales se pesaron al inicio del estudio ya los 7 y 14.días
Estudio anatomopatológico
El estudio anatomopatológico se realizó a todos los animales al finalizar el tratamiento. La eutanasia se realizó mediante sobre dosis de éter, para llevar a cabo las correspondientes observaciones macroscópicas de los siguientes órganos: corazón, pulmones, riñones, bazo, hígado, estómago e intestino.
Procedencia y atención a los animales
Todos los animales empleados en este estudio, fueron suministrados por el Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB) y mantenidos en cajas de poliuretano-T4 en el bioterio del Laboratorio Central de Farmacología, Facultad de Ciencias Médicas "Dr. Salvador Allende", a temperatura de 23 oC, humedad relativa de 50-60 %, un período de luz-oscuridad de 12 h cada uno, con libre acceso a pienso para ratones y ratas ALYCO ® CMO 1000 y al agua. Se tuvieron sin alimento, pero con libre acceso al agua, durante las 12 h antes del estudio.
Los estudios se realizaron cumpliendo las guías de buenas prácticas22 y para el cuidado y uso de animales de laboratorio.23
Procesamiento de los datos
Para el análisis estadístico de los resultados se sometieron a prueba la hipótesis de distribución normal de las variables estudiadas, con este propósito se utilizó el estadígrafo W y se encontró que se distribuyen normalmente. Entonces se aplicó el análisis de varianza de una vía (ANOVA) para determinar si existían diferencias entre las medias de los grupos.
El nivel de significación fue del 5 % (p < 0,05).
Resultados
Estudio fitoquímico
En la tabla se pueden apreciar los metabolitos secundarios presentes en la decocción de hojas frescas y en el extracto fluido de hojas secas; se encontraron diferencia en la composición entre ambos.
Tabla. Metabolitos secundarios en la decocción al 30 % de hojas frescas y en el extracto fluido al 30 % de hojas secas de A. squamosa
| Metabolitos secundarios | Decocción | Extracto fluido |
| Flavonoides | - | + |
| Compuestos fenólicos | + | + |
| Triterpenos y esteroides | - | - |
| Alcaloides | - | + |
| Quinonas | - | + |
| Cumarinas y compuestos lactónicos | + | + |
| Aminoácidos | + | + |
| Antocianidinas | - | + |
| Azúcares reductores | + | + |
+ significa una respuesta positiva para ese metabolito, - significa una respuesta negativa para ese metabolito.
Ambos extractos mostraron tener compuestos fenólicos, cumarinas y compuestos lactónicos, aminoácidos y azúcares reductores.
El extracto fluido presentó flavonoides, quinonas y antocianidinas en su composición.
Estudio farmacológico
Modelo de analgesia por ácido acéticoLa decocción al 30 % de hojas frescas disminuyó significativamente (F=4,582; p=8,106e-03) y de manera dosis dependiente el número de contorsiones durante 15 min, inducidas por ácido acético intraperitoneal en ratones. Las medias de los animales tratados con ambos extractos, con dosis de 500 y 1 000 mg/kg po, fueron significativas con relación al grupo control que recibió agua destilada por la misma vía (figura 1).
* = p < 0,05, media + desviación estándar.
Fig.1. Efecto de la decocción de hoja fresca de A. squamosa (30 %) sobre las contorsiones inducidas por ácido acética (0,75 % i.p.) en ratones.
El extracto fluido (etanol al 30 %) de hojas secas, administrado por vía oral, en dosis de 500 y 1 000 mg de hoja seca/kg, no modificó significativamente (F = 1,473; p = 0,2382) las contorsiones inducidas por ácido acético ip (figura 2).
media + desviación estándar, EF: extracto fluido.
Fig.2. Efecto del extracto fluido (30 %) de hoja seca de A. squamosa sobre las contorsiones inducidas por ácido acética (0,75 % i.p.) en ratones.
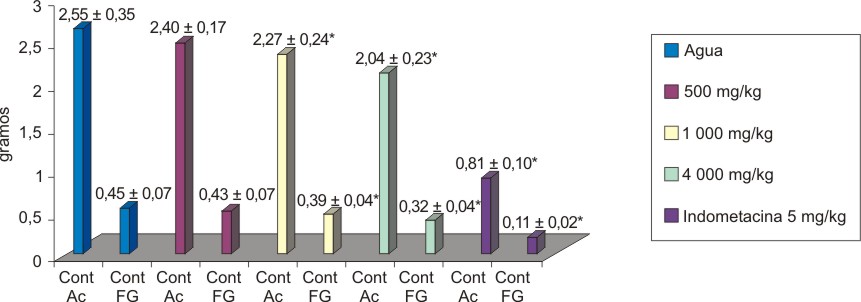
La decocción al 30 % de hojas frescas disminuyó significativamente y de manera dosis dependiente el contenido acuoso (F=37,297; p=3,630e-12) y el fibrogranuloso (F=28,891; p=1,176e-10) en la respuesta inflamatoria inducida por algodón en ratas. Las medias de ambas variables, de los grupos tratados con dosis de 1 000 y 4 000 mg de material vegetal/kg po) de extracto fueron significativas en relación con el grupo control que recibió agua destilada por la misma vía. La dosis de 500 mg/kg no modificó la respuesta inflamatoria; mientras que, el control positivo que recibió indometacina 5 mg/kg/día po inhibió significativamente la inflamación (figura 3).
* = p < 0,05, media + desviación estándar, Cont: contenido, Ac: acuoso, FG: fibrogranuloso.
Fig.3. Efecto de la decocción de hoja fresca de A. squamosa (30 %) en el granuloma inducido por algodón en ratas.
El ANOVA mostró una significación estadística para las variables: contenido acuoso (F=11,020; p=1,621e-06) y fibrogranuloso (F=16,738; p=8,017e-09) cuando se estudió el efecto del extracto fluido, preparado con etanol al 30 %, de hojas secas, administrado por vía oral, en dosis de 500 y 1 000 mg de material vegetal/kg. En este experimento la significación se debió al grupo control positivo que recibió indometacina 5 mg/kg po (figura 4).
* = p < 0,05, media + desviación estándar, Cont: conenido, Ac: acuoso, FG:fibrogranuloso.
Fig.4. Efecto del extracto fluido (30 %) de hoja seca de A. squamosa en el granuloma inducido por algodón en ratas.
Estudio de toxicidad aguda
La decocción (dosis máxima de 2 mL/100 g po) y el extracto fluido (2 000 mg de sólidos totales/kg p.o.) no causaron muerte, signos clínicos, ni daños macroscópicos en el estudio de Clases Tóxicas Agudas en los animales.
El aumento de peso fue el esperado para las ratas y no hubo diferencia significativa entre los tratados con ninguno de los 2 extractos en relación con los controles (figuras 5-8).
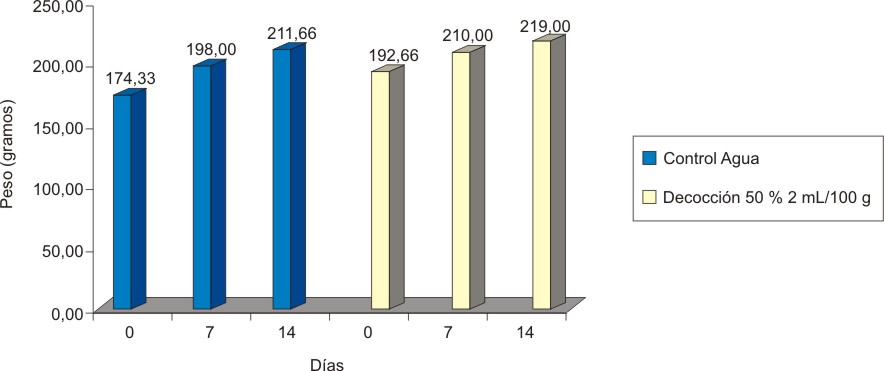
Valores = mediana, estadígrafo H = 7,310, p = 0,1986.
Fig.5. Variación de peso en Clases Tóxicas Agudas de la decocción 50 % de hoja fresca de A. squamosa en ratas hembras.
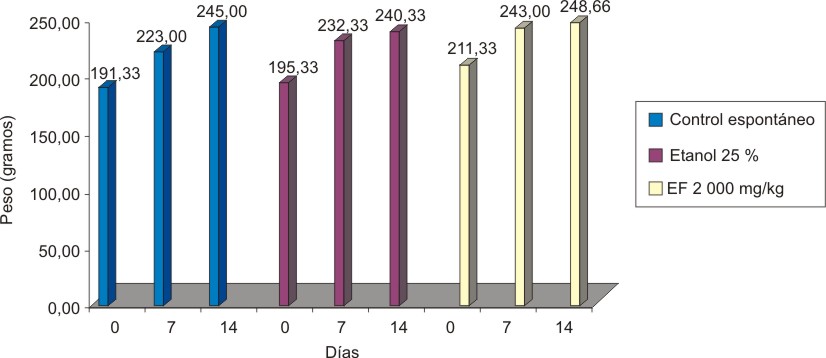
Valores = mediana, estadígrafo H = 13,070, p = 0,0227.
Fig.6.Variación de peso en Clases Tóxicas Agudas de la decocción 50 % de hoja fresca de A. squamosa en ratas machos.
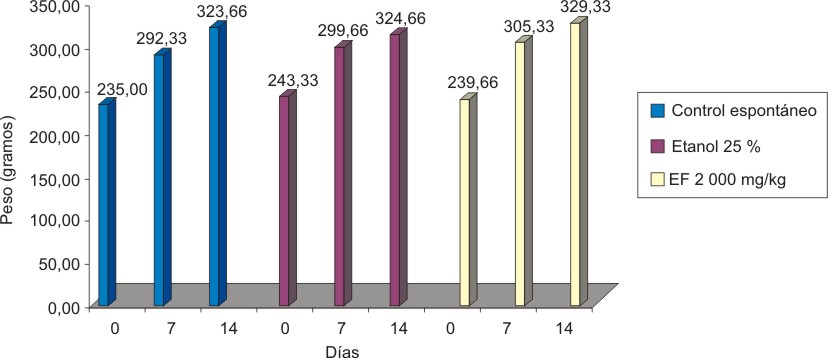
Valores = mediana, estadígrafo H = 16,545, p = 0,0352.
Fig.7. Variación de peso en Clases Tóxicas Agudas de extracto fluido 30 % de hoja seca de A. squamosa en ratas hembras.
Valores = mediana, estadígrafo H = 22,365, p = 4,283e -03.
Fig.8. Variación de peso en Clases Tóxicas Agudas de extracto fluido 30 % de hoja seca de A. squamosa en ratas machos.
Discusión
El estudio fitoquímico preliminar mostró diferencia entre los grupos químicos de metabolitos secundarios presentes en la decocción de hoja fresca y en el extracto fluido de hoja seca.
En el extracto fluido, realizado con un menstruo etanólico al 30 %, fueron detectados 3 grupos de compuestos, los flavonoides, las quinonas y las antocianidinas, que no se encontraron en el extracto acuoso. Esta diferencia pudiera explicarse, principalmente por la desigualdad de polaridad del etanol al 30 % respecto al agua; así como, a que el extracto fluido, preparado por repercolación, tiene mayor poder extractivo que la decocción o a que en ésta las concentraciones presentes no fueron suficientes para ser identificadas por los métodos cualitativos de Shinoda para flavonoides, de Bortrager para quinonas y de Rosemhein para las antocianidinas.
El resultado del tamizaje fitoquímico que se realizó con ambos extractos de hojas mostró presencia de aminoácidos y azúcares reductores, lo cual es coincidente con los reportes previos en la bibliografía, donde encontraron aminoácidos 5 y carbohidratos.5-9
En el extracto etanólico al 30 % se encontraron flavonoides, como había sido reportado previamente, la existencia de ese grupo químico y específicamente la quercetina.12
Sin embargo, no se detectó la presencia de esteroides en ninguno de los 2 extractos, a diferencia de la literatura que señala existencia de esteroides (ß-sitosterol, estigmasterol) en las hojas.9
El resultado del tamizaje fitoquímico contrasta también con otros publicados, donde se había reportado ausencia de quinonas y taninos en toda la planta.1
No haber encontrado esteroides, como informa la literatura, pudiera deberse a múltiples causas, como época del año, forma de cosecha y secado, variedad de la especie o a que las concentraciones en los extractos pueden haber estado por debajo del límite inferior de detección de los métodos que se emplearon para la determinación de esos grupos de metabolitos .
La reacción al cloruro férrico empleada indicó existencia de compuestos fenólicos en general, lo cual pudiera incluir la presencia de taninos.
El extracto acuoso, decocción, inhibió significativamente la respuesta dolorosa inducida por administración de ácido acético intraperitoneal en ratones, así como, la inflamación provocada en el modelo de granuloma inducido por algodón en ratas. Sin embargo, el extracto hidroetanólico al 30 % no tuvo efecto en ninguno de los 2 experimentos. Los resultados alcanzados en esta investigación constituyen un aporte a la información para la validación preclínica del efecto antiinflamatorio y analgésico de la decocción de hojas frescas de A. squamosa .
La diferencia de actividad pudiera explicarse porque los 2 extractos estudiados deben tener una composición distinta de principios activos por la diferencia de polaridad existente entre el agua y el etanol al 30 %. Es posible que las sustancias activas, responsables de las acciones analgésica y antiinflamatoria, deben estar ausentes o en muy baja concentración en el extracto fluido.
Los estudios de toxicidad aguda realizados con decocción, administrado a dosis de volumen máximo de 2,0 mL de decocción/100 g po, y con extracto fluido (2 000 mg de sólidos totales/kg po), equivalen a haber administrado 10,0 y 15,67 g de material vegetal/kg p.o., respectivamente. No existen guías establecidas para evaluar la toxicidad aguda de plantas medicinales y de medicamentos herbarios, la empleada en este trabajo establece que la dosis máxima debe ser 2 g/kg para los principios activos y se dice que no clasifica como tóxico (ATC0) cuando no causa muertes.20
Una persona adulta, que consume una planta medicinal de manera tradicional en decocción o infusión, lo hace aproximadamente en una dosis equivalente a 8 g de material vegetal seco/24 h, como ocurre con las bolsas filtrantes que se venden comercialmente y que suelen contener 2 g/bolsa; de esa manera un adulto de 70 kg de peso consume aproximadamente una dosis de 0,11 g de material vegetal seco/kg/día.
En este estudio, las dosis para evaluar la toxicidad aguda del extracto acuoso y etanólico 30% fueron 90,90 y 142,45 veces superiores, respectivamente, a las consumidas habitualmente de manera tradicional. Lo anterior indica que las dosis empleadas en el estudio toxicológico fueron notablemente superiores a las empleadas en adultos humanos.
Los resultados alcanzados con el extracto acuoso permiten validar el uso tradicional3,4 de la decocción de hojas frescas para el tratamiento sintomático de problemas de salud donde las actividades farmacológicas analgésica y antiinflamatoria puedan resultar beneficiosas.
Agradecimientos
Al Dr. Víctor Fuentes por el trabajo botánico, al Dr. Dionisio Olmedo por los comentarios al manuscrito, a las compañeras Elisa Boucourt Rodríguez y Zulima Pinedo Gutiérrez por su trabajo técnico, al alumno Carlos Campo Epalza de la Escuela Latinoamericana de Medicina (ELAM) por su colaboración en los estudios farmacológicos; así como, al Programa Ramal de Medicina Tradicional y Natural del Ministerio de Salud Pública de Cuba y la Association pour la Recherche sur la Valorisation des Ressources Naturelles de la Martinique (ARVARNAM) por el apoyo financiero para la realización del proyecto.
Summary
Phytochemical screening, antiinflammatory activity and acute toxicity of extracts from leaves of Annona squamosa L.
Annona squamosa L. (sugar apple, sweetsop) is a species cultivated and known by its fruits in all the tropical regions. It is traditionally used as an antidiarrheal, antispasmodic and analgesic. That's why we were interested in making this research to validate the analgesic and antiinflammatory effect of this leave. The main groups of secondary metabolites present in the aqueous extract (decoction) and in the fluid extract (ethanol 30 %) of fresh and dry leaves, respectively, were identified by a phytochemical screening. Both extracts were evaluated in the pharmacological models of cotton pellet-induced inflammation in rats, and writhing test induced by acetic acid 0,75 % (0,1 mL/10 g intraperitoneal) in mice. The orally administered doses were equivalent to 500 and 1 000 mg of plant material/kg of body weight, respectively. A study of systemic acute toxicity was conducted according to the method of Acute Toxic Classes in rats. Some differences were found in the composition of secondary metabolites between both extracts. The decoction significantly inhibited in a dose dependant way the inflammatory response in the granuloma caused by cotton and in the contortions induced by intraperitoneal acetic acid. The fluid extract was inactive. There was no certainty of acute toxicity produced by any of the two extracts in the maximum dose administered by oral route and equivalent to 10,0 and 15,67 g of plant material/kg, respectively. These results allow to validate the utilization and safety of the traditional use of decoction of fresh leaves of A. squamosa to treat health problems related to pain and inflammation
Key words: Annona squamosa L., antiinflammatory, analgesic, phytochemical screening.
Referencias bibliográficas
1. Roig JT. Plantas Medicinales, Aromáticas y Venenosas de Cuba. 2da ed. La Habana: Editorial Científico-Técnica;1988.p.161-3 (3ra reimpresión).
2. Robineau L, editor. Hacia una Farmacopea Caribeña p. 67-8. Santo Domingo, República Dominicana: Editorial BUHO;1995 (TRAMIL 7).
3. Hodge WH, Taylor D. The ethnobotany of the island caribs of Dominica. WEBBIA. 1956;12:513-644.
4. Reddy MB, Reddy KR, Reddy MN. Chenchu tribes of Andhra Pradesh, India. Int J Crude Drug Res. 1988;26(4):189-96.
5. Joshi HD, Baxi GA , Baxi AJ. Free amino acids and sugars of Annona squamosa Linn. Asian J Chem. 1992;4(1):49-52.
6. Moore BD, Isidoro E, Seemann JR. Distribution of 2-carboxyarabinitol among plants. Phytochemistry. 1993;34(3):703-7.
7. Sharma RK, Behari M. Screening of the compounds isolated from the leaves of Annona squamosa for antibacterial activity. Acta Cienc Indica Chem. 1992;18(3):249-52.
8. Sharma RK, Behari M. Screening of the compounds isolated from the leaves of Annona squamosa for antibacterial activity. Acta Cienc Indica. 1992;27(C3):249-52.
9. Sharma RK. Phytosterols: wide-spectrum antibacterial agents. Bioorg Chem. 1993;21(1):49-60.
10. Rai C, Muthana MS. Essential oil from the leaves of Annona squamosa . J Indian Inst Sci. 1954;36:117.
11. Balbaa SI, Haggag MY, Taha KF. Study of volatile oil content of the leaves of Annona squamosa growing in Egypt . Egypt J Pharm Sci. 1977;18:1-8.
12. Seetharaman TR. Flavonoids from the leaves of Annona squamosa and Polyalthia longifolia. Fitoterapia 1986;57(3):198-9.
13. Narayana LL, Sundari IT, Radhakrishnaiah M. Chemotaxonomy of some Annonaceae. Curr Sci. 1981;50:1079-80.
14. Atal CK, Srivastava JB, Wali BK, Chakravarty RB, Dhawan BN, Rastogi RP. Screening of indian plants for biological activity. P VIII. Indian J Exp Biol. 1978;16:330-49.
15. Cuba. Ministerio de Salud Pública. NRSP No. 309. Medicamentos de origen vegetal: droga cruda. Método de ensayos. La Habana: Editorial Ciencias Médicas;1992.
16. Cuba. Ministerio de Salud Pública. NRSP No.311. Medicamentos de origen vegetal: extractos fluidos y tinturas. Procesos Tecnológicos. La Habana: Editorial Ciencias Médicas;1992.
17. Cuba. Ministerio de Salud Pública. NRSP No. 312. Medicamentos de origen vegetal: extractos fluidos y tinturas. Métodos de ensayos. La Habana: Editorial Ciencias Médicas;1992.
18. Miranda M, Cuellar A. Manual de prácticas de laboratorio de análisis farmacognóstico. La Habana: Editorial Ciencia y Educación;1992.p.23-33.
19. Morón F, Furones JA, Pinedo Z. Ausencia de efectos antiinflamatorio y analgésico del extracto fluido de Cymbopogon citratus al 30 % por vía oral. Rev Cubana Plant Med. 1996;1(2):3-6.
20. Schlede E, Mischke V, Roll R, Kayser D. A national validation study of the acute-toxic-class method as alternative to the LD 50 test. Arch Toxicol. 1992;66:455-70.
21. Martínez MJ, Betancour J, Ramírez MR, Barceló H, Meneses R, Lainez A. Evaluación toxicológica aguda de los extractos fluidos al 30 y 80 % de Cymbopogon citratus (D.C.) Stapf. (caña santa). Rev Cubana Plant Med. 2000;5(3):97-101.
22. Cuba. Para la Protección de la Salud Pública. Principios de las Buenas Prácticas de Laboratorio no Clínico de Seguridad Sanitaria y Medioambiental: Regulación 39/2004. La Habana: El Buró Regulatorio; 2004.
23. EE.UU. National Research Council. Guide for the Care and Use of Laboratory Animals. Washington DC: National Academy Press;2001.p.21-79.
Recibido: 28 de abril de 2006. Aprobado: 12 de mayo de 2006.
Lic. María del Carmen Victoria Amador. Laboratorio Central de Farmacología, Facultad de Ciencias Médicas "Dr. Salvador Allende". Carvajal s/n e/ Agua Dulce y A. Cerro, La Habana 12000, Cuba. Telf. 406571 Ext. 1047 e-mail: mcvictoria@infomed.sld.cu
1Licenciada en Ciencias Farmacéuticas. Investigadora Aspirante.
2Doctor en Ciencias Médicas. Profesor Titular de Farmacología.
3Licenciada en Química.
4Licenciada en Biología.
5Licenciada en Bioquímica