Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.16 no.4 Ciudad de la Habana oct.-dic. 2011
ARTÍCULO ORIGINAL
Química y biología del extracto etanólico del epicarpio de Crescentia cujete L. (totumo)
Chemistry and biology of ethanol extract from the epicarp of Crescentia cujete L. (totumo)
Jorge Eliecer Espitia-Baena, Harriette del Rosario Duran-Sandoval, Jaime Fandiño-Franky, Fredyc Díaz-Castillo, Harold Alberto Gómez-Estrada
Universidad de Cartagena. Cartagena, Colombia.
RESUMEN
Introducción: el árbol de Crescentia cujete L. (Bignonaceae), conocido en Colombia como totumo, es una especie característica de climas tropicales. Su rasgo más distintivo es el fruto, el cual es una calabaza esférica con cáscara dura y leñosa, y una pulpa gelatinosa con numerosas semillas.
Objetivo: realizar el estudio químico y biológico sobre el extracto etanólico del epicarpio de Crescentia cujete L.
Métodos: se recolectó el material vegetal y se obtuvo el extracto etanólico total. Luego se realizó el tamizaje preliminar fitoquímico, los ensayos físico-químicos directos sobre el material vegetal, la cuantificación de metales pesados y, finalmente, el estudio biológico frente a larvas de Aedes aegypti L. (Culicidae) en estadios III y IV, larvas de Artemia salina Leach. (Artemiidae) y células apicales de raíces de Allium cepa L. (Amaryllidaceae).
Resultados: se identificó la presencia de tres grupos de metabólitos secundarios: flavonoides, esteroides y triterpenos. Asimismo, se cuantificó el contenido de agua y cenizas en base seca, y se determinaron las concentraciones de algunos metales pesados como cadmio, cromo, mercurio y plomo. En el estudio biológico se puso de manifiesto que el extracto no presenta toxicidad aguda en ninguno de los sistemas biológicos ensayados, a las concentraciones y tiempos de experimentación.
Conclusiones: la información obtenida en la presente investigación, constituye un recurso importante para la comunidad científica porque proporciona elementos relacionados con la naturaleza química y el comportamiento biológico del epicarpio del totumo, antes no reportados.
Palabras clave: Crescentia cujete, totumo, Aedes aegypti, Artemia salina, Allium cepa.
ABSTRACT
Introduction: Crescentia cujete L. (Bignonaceae) tree known in Colombia as totumo, is a characteristic species of tropical climates. Its most distinctive feature is the fruit, which is a spherical pumpkin with hard and woody peel, and a gelatinous pulp having a lot of seeds.
Objective: to conduct the chemical and biological ethanol extract of Crescentia cujete L. epicarp.
Methods: vegetal material was harvested and the total ethanol extract was obtained. Then, preliminary phytochemical screening, direct physical and chemical tests on vegetal material, the quantification of heavy metals and finally the biological study against Aedes aegypti L. (Culicidae) larvae in stages III and IV, Artemia salina Leach. (Artemiidae) larvae and apical cells of Allium cepa L. (Amaryllidaceae) roots.
Results: the presence of three groups of secondary metabolites, that is, flavonoids, steroids and triterpenes were identified. Likewise, the water and ash content on dry basis was quantified as well as the levels of concentration of some heavy metals such as cadmium, chromium, mercury and lead were estimated. The biological study revealed that the extract did not show acute toxicity either in any of the tested biological systems or at the concentrations and the time of experimentation.
Conclusions: the information obtained in this research is an important resource for the scientific community and provides elements associated to the chemical nature and the biological behavior of the totumo ´s epicarp not contained in previous reports.
Key words: Crescentia cujete, totumo, Aedes aegypti, Artemia salina, Allium cepa.
INTRODUCCIÓN
El árbol de Crescentia cujete L. (Bignonaceae), conocido popularmente en Colombia como totumo (Fig. 1), es una especie vegetal característica de climas secos a húmedos, sabanas y selvas bajas.
En Colombia, el totumo ha sido coleccionado en los departamentos de Antioquia, Atlántico, Bolívar, Cauca, Cundinamarca, Choco, Guajira, Magdalena, Norte de Santander, Santander y Valle, y en la intendencia de Casanare en alturas de 20 a 1 300 m sobre el nivel del mar (m.s.n.m.).1 Su rasgo más distintivo es el fruto, el cual es una calabaza esférica con cáscara dura y leñosa, que posee una pulpa gelatinosa donde están inmersas numerosas semillas. La mayoría de las investigaciones desarrolladas hasta la fecha sobre este árbol, han sido enfocadas en la pulpa del fruto, en menor grado las hojas, corteza y raíz.1 Sin embargo, no se conocen reportes sobre estudios llevados a cabo en el epicarpio del fruto, por lo que resulta imposible inferir los aspectos farmacológicos o toxicológicos que pudiesen tener lugar tras su utilización, con un propósito diferente al ornamental o tradicional. Por otro lado, de la pulpa del fruto, parte de la especie vegetal más relacionada con el epicarpio, diversas investigaciones han mostrado que tiene una marcada actividad antihemorrágica frente al veneno de la víbora Bothrops atrox,2 de igual forma, es útil como agente anticatarral y en trastornos ginecológicos,3 en el control de la hipertensión,4 contra el asma, dolores estomacales, antiparasitario y contra la infertilidad femenina.5 En 2008, en Colombia se publicó el listado de plantas medicinales aprobadas con fines terapéuticos por el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA), donde se permite el uso del jarabe con extracto de pulpa del fruto fresco como coadyuvante en el tratamiento de trastornos respiratorios leves.6 La investigación química sobre el árbol de totumo, ha permitido la elucidación estructural de diversas moléculas en su fruto. Un tamizaje preliminar fitoquímico muestra de manera general la presencia, en el fruto, de alcaloides cuaternarios, de cromóforos lipófilos y de polifenoles. Además, contiene ácido cianhídrico, ácido crescéntico, ácido clorogénico, ácido cítrico, ácido tánico y ácido tartárico. Otros estudios revelan la presencia de lapachona, ácido gentísico, saponinas y 1,4-naftoquinonas (esta última con actividad citotóxica), las cuales podrían ser consideradas como recursos potenciales para el tratamiento del cáncer. Las semillas poseen 20 % de aceite, del cual aproximadamente 52 % corresponde a ácido oleico, 17 % es ácido linoleico, otro 16 % es ácido palmítico y 10,6 % es ácido esteárico; otros constituyentes de la semillas son azúcares, ácido crescéntico, b-sitosterol, estigmasterol, glucósidos iridoides como la asperulosida y la plumierida.7-10 En cuanto a las hojas, reveló la presencia de fenoles y leucoantocianinas, pero se observó la ausencia de alcaloides; como conclusión de este estudio se especuló que los principales constituyentes de las hojas podrían ser derivados de la apigenina y de la quercetina.11
Debido a la poca información científica sobre el epicarpio del totumo, la Fundación Centro Colombiano de Epilepsia y Enfermedades Neurológicas (Hospital Neurológico-FIRE) de la ciudad de Cartagena (Colombia) y el Laboratorio de Investigaciones Fitoquímicas y Farmacológicas de la Universidad de Cartagena (LIFFUC), teniendo en cuenta la abundancia de C. cujete en numerosos departamentos del país,1 han realizado el primer estudio químico y biológico sobre el epicarpio del totumo, por considerar que este podría ser usado como una posible alternativa natural a los materiales sintéticos utilizados en la actualidad en implantes craneales.
MÉTODOS
Material vegetal: el epicarpio de Crescentia cujete L. (Código HUA166132, Herbario de la Universidad de Antioquia-Colombia) fue recolectado en la finca Astrocito del municipio Turbaco-Bolívar (Colombia). Se seleccionaron frutos verdes con ligeras manchas cafés, los cuales fueron despulpados, lavados y secados en un horno con circulación de aire a una temperatura aproximada de 40 oC, hasta obtener 1 kg neto de muestra, que se trituró finamente.
Estudio fitoquímico
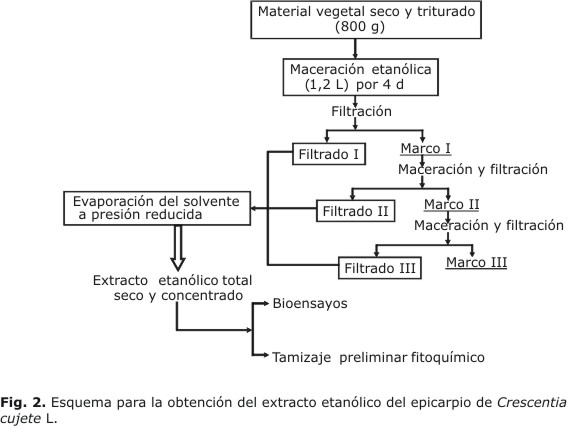
Preparación de los extractos: el epicarpio seco, previamente triturado (800 g) fue sometido a extracciones continuas en maceración con etanol grado reactivo, a temperatura de 25 ºC en un recipiente de vidrio cerrado y protegido de la luz; posteriormente se separó la solución etanólica del respectivo marco utilizando papel de filtro Whatman Nº1. Por último, se recolectaron todos los filtrados en un solo recipiente y se concentraron hasta la sequedad a presión reducida en un rotaevaporador Heidolph VV 2000, en el cual se obtuvo un extracto etanólico total seco, tal como se muestra en la figura 2.
Tamizaje preliminar fitoquímico: una porción de 2 g del extracto etanólico total se sometió a análisis fitoquímico cualitativo utilizando el método microquímico. Todos los disolventes utilizados fueron grado reactivo y los reactivos de identificación se prepararon al momento de realizar los ensayos, para minimizar errores por su degradación. Los reactivos de identificación utilizados fueron: reactivo de Mayer, Dragendorff y Wagner para alcaloides; para determinar naftoquinonas y antraquinonas se utilizó el reactivo de Borntränger (solución de hidróxido amónico) y acetato de magnesio; la reacción de Salkowsky y Liebermann-Buchard en el caso de los esteroides y triterpenos, para lo cual fue necesario hacer un procedimiento de separación previo y se obtuvo un extracto en hexano a partir del extracto etanólico seco; con los flavonoides se realizó por la prueba de Shinoda y la de leucoantocianinas; el reactivo de Baljet, Kedde, Raymond-Marthoud, Keller-Kiliani y Salkowsky en la determinación de glucósidos cardiotónicos, para los iridoides la reacción de vainillina-HCl; la prueba de la espuma para la cualificación de las saponinas; por último, en los taninos la prueba de cloruro férrico, gelatina, gelatina-NaCl y NaCl. 12-15
Ensayos físico-químicos directos sobre el material vegetal: para el desarrollo de este ensayo, se sometieron a molienda 10 g de epicarpio de totumo, del cual, una porción de 200 mg se utilizó para evaluar la presencia de celulosa, lignina, corcho y cutina,12 y otra porción de 4 g se destinó para analizar el contenido de humedad y cenizas en base seca.16,17
Cuantificación de metales pesados: del epicarpio, previamente molido, se pesó una cantidad de 4 g, que fueron sometidos a digestión con 5 mL de ácido nítrico (HNO3) concentrado y 2 mL de ácido perclórico (HClO4) 70 % con calentamiento a 80 ºC. Posteriormente se filtró y se completó volumen a 50 mL con agua desionizada hasta obtener la denominada "solución madre" de trabajo.18 El análisis de arsénico (As) fue realizado siguiendo el método colorimétrico de dietilditiocarbamato de plata;19 mientras que los demás metales pesados (cadmio (Cd), cromo (Cr), mercurio (Hg), níquel (Ni) y plomo (Pb)), fueron analizados utilizando un espectrofotómetro de absorción atómica Thermo Electron Corporation, S4-Serie con flujo de aire/acetileno, acetileno/óxido nitroso y corrector de fondo de deuterio.
Estudio biológico
Evaluación toxica frente a larvas de Aedes aegypti L. (Culicidae): el bioensayo se realizó de acuerdo con un protocolo reportado en la literatura, con ligeras modificaciones.20 Una población de larvas en estadio III y IV se expuso a soluciones de extracto etanólico a concentraciones de 1, 5, 10, 50 y 100 mg/L, respectivamente. El ensayo se desarrolló por triplicado a 28 ºC y humedad entre 52 y 55 %, con lecturas de mortalidad a 1, 6, 12, 24, 36 y 48 h; se empleó como control negativo solución de dimetilsulfóxido (DMSO) a 100 mg/L y control positivo temefos a 0,05 mg/L. Por último, las larvas se consideraron muertas cuando no reaccionaron al momento de ser tocadas con un puntero romo en la región cervical. Como condición, el ensayo se consideró inválido cuando en los controles más de 10 % de las larvas empuparon o en el control negativo la mortalidad superó 10 %.21
Evaluación tóxica frente a larvas de Artemia salina Leach. (Artemiidae): el bioensayo se realizó de acuerdo con un protocolo reportado en la literatura, con ligeras modificaciones.22 Larvas provenientes de la eclosión de huevos recolectados en la bahía de San Francisco (EE. UU.), fueron colocadas en contacto con soluciones del extracto etanólico seco preparado con agua de mar a concentraciones de 1, 10, 100, 500 y 1 000 mg/L, respectivamente. El ensayo se desarrolló por triplicado con lecturas de mortalidad a las 12 y 24 h; se empleó como control negativo agua de mar con una temperatura de 24 ºC, conductividad eléctrica 29,0 ms/cm, pH 8,05 y densidad 1,134 g/mL. Al finalizar las 24 h de exposición, se contó el número de organismos muertos y se calculó el porcentaje de mortalidad. Las larvas se consideraron muertas si no exhibían movimiento durante varios segundos de observación al microscopio. El experimento se consideró válido si el porcentaje de mortalidad en el control no excedió de 10 %.23
Evaluación genotóxica frente a Allium cepa L. (Amaryllidaceae): el bioensayo se realizó de acuerdo con un protocolo reportado en la literatura, con ligeras modificaciones.24 Un grupo de cebollas blancas (Allium cepa), se colocaron dentro de vasos plásticos con agua potable durante 3 d y se hizo recambio total de agua cada 24 h. Finalizado el período de estimulación, las unidades experimentales fueron expuestas durante 72 h a soluciones de extracto etanólico total con concentraciones de 1, 10, 100 y 500 mg/L, realizando el conteo celular al microscopio cada 24 h (índice mitótico [IM] e índice de aberraciones cromosómicas [IA]). Se utilizó como control positivo una solución de Cd a 5 mg/L y de control negativo agua potable. El proceso de tinción se efectuó con solución de fuscina y la temperatura de trabajo fue 24 ºC. Finalmente, todos los ensayos se realizaron por triplicado para cada tiempo y concentración ensayada; además, los resultados se expresaron como la media ± desviación estándar del porcentaje del IM e IA, y estos se analizaron mediante ANOVA de 2 vías, con un valor de p< 0,05 y previa comprobación de los supuestos.25-27
RESULTADOS
En el presente análisis fitoquímico del epicarpio de C. cujete se partió de extractos etanólicos, puesto que este solvente tiene la capacidad de extraer compuestos de una amplia gama de polaridades, además de ser menos costoso y tóxico que otros solventes orgánicos. La metodología seguida para este análisis fue la previamente reportada por Albornoz,12 y contempla la detección de los metabolitos secundarios generalmente relacionados con actividades biológicas.
A partir de 800 g del epicarpio de C. cujete se obtuvieron 15,8 g de extracto etanólico total seco, equivalentes a 1,97 % de rendimiento de extracción. De acuerdo con los resultados obtenidos mediante el tamizaje preliminar fitoquímico desarrollado sobre el epicarpio de totumo, fue posible detectar la presencia de tres grupos de metabolitos secundarios, como los flavonoides, esteroides y triterpenos, tal como se muestra en la tabla 1.
Por otra parte, en lo referente a la caracterización físico-química de la muestra en cuestión, se logró cuantificar el contenido de humedad, cenizas en base seca y algunos metales pesados con importantes efectos negativos para la salud humana. Del mismo modo, se determinó la presencia de varios componentes secundarios de la pared celular vegetal (celulosa, lignina, corcho y cutina), tal como se evidencia en la tabla 2.
Con respecto al estudio biológico, fue posible observar que los constituyentes químicos presentes en el epicarpio del totumo no producen efectos tóxicos en larvas de A. aegypti en estadio III y IV, larvas de A. salina y células apicales de raíces de A. cepa a las concentraciones y tiempos ensayados.
DISCUSIÓN
Los resultados del análisis fitoquímico preliminar efectuado sobre la muestra de epicarpio del fruto de C. cujete (totumo), evidencian la presencia de flavonoides, triterpenos y esteroides. Grupos de metabolitos secundarios como los alcaloides, glicósidos cardiotónicos, naftoquinonas, iridoides, antraquinonas, saponinas y taninos, no fueron detectados en el presente estudio; estos metabolitos son compuestos muy activos biológicamente y comunes en otros órganos del árbol de totumo, así como también en otras especies vegetales pertenecientes a la familia Bignoniaceae. Esto permite explicar en cierta forma la poca actividad toxicológica que pudiera derivar de la utilización del epicarpio en contraste con otras partes de C. cujete. La no detección de metales como el arsénico y níquel, sumado a las concentraciones de cadmio (0,01 ppm), cromo (0,12 ppm), plomo (0,09 ppm) y mercurio (0,03 ppm) encontradas en la matriz, las cuales se hallan por debajo de los niveles reportados como tóxicos, indica que existen muy buenas características ambientales que circundan el árbol en su hábitat natural.
Los resultados obtenidos a partir de los diferentes bioensayos realizados sobre la muestra del epicarpio de totumo, permitieron establecer que este material vegetal no produce ningún efecto tóxico sobre los diferentes organismos vivos utilizados como modelos experimentales, larvas de camarón en el ensayo de A. salina, larvas de mosquitos A. aegypti en estadios III y IV, y células meristemáticas de la zona de crecimiento de las raíces de A. cepa a las concentraciones y tiempos ensayados. Es bien conocido que este tipo de ensayos permite evaluar el efecto tóxico de diversos compuestos químicos de origen sintético, semisintético o natural sobre estos organismos tan frágiles, los cuales sirven para evaluaciones preliminares que ayuden en el monitoreo de sustancias potencialmente tóxicas para el hombre, porque se constituyen en herramientas muy económicas, rápidas y de fácil realización.
REFERENCIAS BIBLIOGRÁFICAS
1. Jussieu A. Familia Bignoniaceae. En: Cabrera I, editor. Las plantas y sus usos en las Islas de Providencia y Santa Catalina. Colombia: Editorial Universidad del Valle; 2005. p. 79-89.
2. Otero R, Núñez V, Barona J, Fonnegra R, Jiménez S, Osorio R, et al. Snakebites and ethnobotany in the northwest region of Colombia. Part III: Neutralization of the haemorrhagic effect of Bothrops atrox venom. J Ethnopharmacol. 2000;7:3233-41.
3. Beyra A, León M, Iglesias E, Ferrándiz D, Herrera R, Volpato G, et al. Estudios etnobotánicos sobre plantas medicinales en la provincia de Camagüey (Cuba). Anales Jardín Botánico Madrid. 2004;61(2):185-203.
4. Lans C. Ethnomedicines used in Trinidad and Tobago for urinary problems and diabetes mellitus. J Ethnobiology Ethnomedicine. 2006;2:45. Doi: 10.1186/1746-4269-2-45.
5. Volpato G, Godínez D, Beyra A, Barreto A. Uses of medicinal plants by Haitian immigrants and their descendents in the Providence of Camagüey, Cuba. J Ethnobiology Ethnomedicine. 2009;5:16. Doi:10.1186/1746-4269-5-16.
6. Vademécum Colombiano de Plantas Medicinales. Totumo. En: Plantas aprobadas por el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA). Bogotá: Imprenta Nacional de Colombia; 2008. p. 205.
7. Kaneko T, Ohtani K, Kasai R, Yamasaki K, Duct N. Iridoids and iridoid glucosides from fruits of Crescentia cujete. Phytochemistry. 1997;46(5):907-10.
8. Kaneko T, Ohtani K, Kasai R, Yamasaki K, Duct N. n-alkyl glycosides and p-hydroxybenzoyloxyglucose from fruits of Crescentia cujete. Phytochemistry. 1998;47(2):259-63.
9. Heltzei C, Leslie A, Glass T, Kingston D. Bioactive furanonaphthoquinones from Crescentia cujete. J Natural Products. 1993;56(9):1500-5.
10. Heltzei C, Leslie A, Glass T, Kingston D. Furofurano naphthoquinones: Bioactive compounds with a novel fused ring system from Crescentia cujete. Tetrahedron. 1993;49(31):6757-62.
11. Agarwal K, Popli SP. The constituents of Crescentia cujete leaves. Fitoterapia. 1992;63(5):476.
12. Albornoz A. "Screening" fitoquímico y ensayos generales de pureza del material vegetal, Cap. 23. En: Productos Naturales: estudio de las sustancias y drogas extraídas de las plantas. Caracas: Publicaciones de la Universidad Central de Venezuela; 1980. p. 381-8.
13. Díaz F, Gaitán R, Gómez H. Manual de Fitoquímica. Departamento de Farmacia, Universidad de Cartagena. Cartagena: Editorial Universitaria; 2004. p. 3-30.
14. Boxi M, Rajesh Y, Raja V, Praveen B, Mangamma K. Extraction, phytochemical screening and in-vitro evaluation of anti-oxidant properties of Commicarpus chinensis (aqueous leaf extract). International J Pharma Bio Sciences. 2010;1(4):537-47.
15. Madhav S, Upadhyaya K, Bisht A. Phytochemical screening and standardization of poly herbal formulation for dyslipidemia. International J Pharmacy Pharmaceutical Sciences. 2011;3(3):235-8.
16. WHO. Determination of water and volatile matter. En: Quality control methods for medicinal plants materials. Geneva: Word Health Organization; 1998. p. 32-33. Available in: http://apps.who.int/medicinedocs/pdf/h1791e/h1791e.pdf
17. WHO. Determination of ash. En: Quality control methods for medicinal plants materials. Geneva: Word Health Organization; 1998. p. 28-27. Available in: http://apps.who.int/medicinedocs/pdf/h1791e/h1791e.pdf
18. Perkin-Elmer. Analytical methods for atomic absorption spectrophotometry. Connecticuc, USA; 1976.
19. Clesceri L, Greenberg A, Trussell R, Franson M. Parte 3000: Determinación de Metales. 3500-As (Arsénico): 3500-As C. Método de dietilditiocarbamato de plata. En: Métodos Normalizados, para el Análisis de Aguas Potables y Residuales (Edición 17). España: Ediciones Díaz de Santos, S.A.; 1992. p. 3-84.
20. Carrascal M, Martínez N, Díaz F. Estudio químico biodirigido y efecto larvicida de los extractos de las semillas de Annona muricata Linnaeus [Trabajo de Grado]. Universidad de Cartagena: Programa de Química, Facultad de Ciencias Naturales y Exactas; 2007.
21. Bobadilla M, Zabala F, Sisniegas M, Zabaleta G, Mostacero J, Taramona L. Evaluación larvicida de suspensiones acuosas de Annona muricata Linnaeus «Guanabana» sobre Aedes aegypti Linnaeus (Diptera, Culicidae). Rev Peruana Biología. 2005;12(1):145-52.
22. Sánchez C, Pinzón R, Gupta M, San Román L. Bioensayo de toxicidad en Artemia salina. Manual de Técnicas de Investigación. Colombia: CYTED; Subprograma X, Proyecto X-1; 1995. p. 45-46.
23. Fernández-Calienses A, Mendiola J, Monzote L, García M, Sariego I, Acuña D, et al. Evaluación de la toxicidad de extractos de plantas cubanas con posible acción antiparasitaria utilizando larvas de Artemia salina L. Rev Cubana Med Trop. 2009;61(3):254-8.
24. Sánchez C, Pinzón R, Gupta M, San Román L. Actividad antimitótica, técnica de Deysson modificada. Manual de Técnicas de Investigación. Colombia: CYTED, Subprograma X, Proyecto X-1; 1995. p. 61-62.
25. Kurás M, Nowakowska J, Sliwinska E, Pilarski R, Ilasz R, Tykarska T, et al. Changes in chromosome structure, mitotic activity and nuclear DNA content from cells of Allium test induced by bark water extract of Uncaria tormentosa (Will.) DC. J Ethnopharmacol. 2006;107:211-21.
26. Akintonwa A, Awodele O, Afolayan G, Coker H. Mutagenic screening of some commonly used medicinal plants in Nigeria. J Ethnopharmacol. 2009;125:461-70.
27. Çelik TA, Aslantürk ÖS. Evaluation of cytotoxicity and genotoxicity of Inula viscosa leaf extracts with Allium test. J Biomedicine Biotechnology. 2010. Available in: http://downloads.hindawi.com/journals/jbb/2010/189252.pdf
Recibido: 11 de abril de 2011.
Aprobado: 19 de agosto de 2011.
Jorge Eliecer Espitia-Baena. Universidad de Cartagena. Facultad de Ciencias Farmacéuticas, Cartagena-Colombia. Correo electrónico: gomez_harold@yahoo.com