Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.17 no.4 Ciudad de la Habana oct.-dic. 2012
ARTÍCULO ORIGINAL
Actividad antioxidante in vitro y toxicidad de extractos hidroalcohólicos de hojas de Citrus spp. (Rutaceae)
Antioxidant activity in vitro and toxicity of hydroalcoholic extracts from Citrus spp. (Rutaceae) leaves
MSc. Katia Ojito Ramos, Lic. Yamila Herrera Sánchez, Lic. Nadine Vega Pérez, Dr. C. Orelvis Portal Villafaña
Universidad Central "Marta Abreu" de Las Villas. Villaclara, Cuba.
RESUMEN
Introducción: los cítricos constituyen un género de plantas rico en contenido de fenoles y flavonoides, metabolitos secundarios que debido a su efecto antioxidante y baja toxicidad, han recibido en los últimos años mucha atención como potenciales fármacos.
Objetivos: determinar la actividad antioxidante in vitro y la toxicidad frente a Artemia salina L. de extractos hidroalcohólicos de hojas de Citrus aurantium L. var. sinensis L.; Citrus aurantium L.; Citrus aurantiifolia (Christm.) Swingle; Citrus latifolia (Tanaka ex Yu. Tanaka) Tanaka; Citrus reticulata Blanco (Rutaceae).
Métodos: los extractos etanólicos y metanólicos se obtuvieron mediante extracción por ultrasonido y se caracterizaron fitoquímicamente; se determinó la concentración total de fenoles y flavonoides. La actividad antioxidante se halló mediante la capacidad atrapadora de radicales libre y el poder reductor. La toxicidad se evaluó mediante el bioensayo de letalidad sobre Artemia salina.
Resultados: en los extractos etanólicos se encontró mayor presencia de compuestos químicos que en los extractos metanólicos. La mayor concentración de fenoles totales se obtuvo en el extracto metanólico de Citrus reticulata y de flavonoides totales en el extracto etanólico de Citrus aurantifolia y Citrus reticulata, en ambos solventes. Todos los extractos mostraron actividad antioxidante mediante las 2 pruebas ensayadas. Los extractos presentaron toxicidad moderada frente Artemia salina, siendo el extracto metanólico de Citrus latifolia el de menor toxicidad (LC50 = 464,24 µg/mL).
Conclusiones: se evidenció la presencia de fenoles y clases de flavonoides, la actividad antioxidante de los extractos hidroalcohólicos de Citrus spp. y su moderada toxicidad frente a Artemia salina.
Palabras clave: actividad antioxidante, Artemia salina, cítricos, flavonoides.
ABSTRACT
Introduction: citrus fruits constitute an important source of flavonoids and phenols. The latter are secondary metabolites extensively studied in the last few years on account of their antioxidant effect and low toxicity and of their potentialities as pharmaceuticals.
Objectives: to determine the in vitro antioxidant activity and toxicity against Artemia salina of hydroalcoholic extracts obtained from leaves of Citrus aurantium L. var. sinensis L.; Citrus aurantium L.; Citrus aurantiifolia (Christm.) Swingle; Citrus latifolia (Tanaka ex Yu. Tanaka) Tanaka, Citrus reticulata Blanco (Rutaceae).
Methods: the ethanol and methanol extracts were obtained by ultrasound-assisted extraction method, and characterized using phytochemistry assays; the total amount of phenols and flavonoids was also determined. The antioxidant activity was estimated by the free radical scavenging activity and reducing power. The toxicity of the extracts was evaluated against Artemia salina.
Results: the amount of chemical compounds was higher in ethanol than in methanol extracts. The highest concentration of total phenols was found in methanol extract from Citrus reticulate where that of total flavonoids was seen in the ethanolic extracts from Citrus aurantiifolia and Citrus reticulate, in both solvents. The extracts showed antioxidant activity after the two tests. All the extracts presented moderate toxicity against Artemia salina, being the methanol extract from Citrus latifolia the least toxic (LC50= 464.24 µg/mL).
Conclusions: this study showed the existence of phenols and flavonoids, the antioxidant activity of hydroalcoholic extracts from Citrus spp. leaves and their moderate toxicity against Artemia salina.
Keywords: antioxidant activity, Artemia salina, citrus fruits, flavonoids.
INTRODUCCIÓN
Muchas enfermedades que se presentan con frecuencia en la actualidad como el cáncer, la aterosclerosis, la diabetes mellitus, las enfermedades glomerulares renales, cardiovasculares, coronarias y enfermedades cerebrales asociadas al envejecimiento, entre otras, son producidas por estrés oxidativo. Recientemente, se ha dirigido gran atención hacia el desarrollo de medicamentos de origen vegetal con el fin de tratar diversas enfermedades relacionadas con el estrés oxidativo, para ello se precisa de investigaciones acerca de plantas con alto poder antioxidante y baja toxicidad.
En Cuba, el empleo de las plantas medicinales se ha extendido en los últimos años, sin embargo a pesar de que han existido avances en este sentido, aún hay déficit de investigaciones sobre la extracción de compuestos bioactivos de las plantas y la demostración de su actividad fisiológica, de manera que se faciliten los estudios farmacológicos, así como la síntesis de medicamentos. En correspondencia con la evaluación farmacológica de las plantas medicinales se encuentra su estudio toxicológico, el cual permite rechazar o avalar la continuidad del proceso investigativo y el uso de un medicamento de origen vegetal.1 Uno de los bioensayos más utilizados con este fin es el ensayo con Artemia salina L., debido a que sus nauplios son muy sensibles a gran variedad de sustancias y se considera útil, rápido y simple para predecir la toxicidad de extractos de plantas.2
El género Citrus, perteneciente a la familia Rutaceae, se considera un género cosmopolita, con abundante representación en la región tropical. Las plantas pertenecientes a este género son bien conocidas por el hombre, no solo por el consumo de sus frutos, de alta demanda a nivel mundial, sino también por sus propiedades curativas. Los cítricos deben su actividad biológica, en gran medida, a la presencia de fenoles; entre ellos, los flavonoides, metabolitos secundarios que se oxidan fácilmente, por lo que constituyen potentes antioxidantes.3-5 La mayoría de los trabajos publicados sobre las propiedades antioxidantes de los cítricos se centran en extractos obtenidos a partir de los frutos, son pocos los estudios sobre las propiedades de otros órganos aéreos de la planta como las hojas. Estas plantas fructifican solo una vez al año, sin embargo, presentan hojas durante todo este tiempo que como parte de las estrategias de cultivo muchas veces son podadas y constituyen un material de desecho. sería de gran utilidad la obtención de extractos a partir de las hojas de estas especies, con el propósito de desarrollar un producto farmacológico con actividad biológica demostrada, de poca toxicidad y bajo costo de producción. El objetivo del presente trabajo radicó en determinar la actividad antioxidante in vitro y la toxicidad frente a Artemia salina de extractos de hojas de cinco especies de cítricos naturalizados en Cuba.
MÉTODOS
Preparación de los extractos
Las hojas de naranjo dulce (Citrus aurantium L. var. sinensis L.), naranjo agrio (Citrus aurantium L.), limón criollo (Citrus aurantiifolia (Christm.) Swingle), lima persa (Citrus latifolia (Tanaka ex Yu. Tanaka) Tanaka) y mandarina (Citrus reticulata Blanco) se recolectaron en áreas del Centro de Estudio Jardín Botánico de la Universidad Central "Marta Abreu" de Las Villas, se identificaron taxonómicamente y una muestra de cada especie se depositó en el herbario de la institución (O. Méndez No. 9882, 9878, 9884, 9885, 9883 (UCLV)). El material vegetal se lavó con agua destilada, se secó a 60 °C durante 12 h y se pulverizó en molino de cinco pulgadas (Chrisly & Norris, Chelmesford, Gran Bretaña).
A 1 g del material pulverizado se le adicionó 20 mL de etanol o metanol 70 %. Las soluciones se sometieron a ultrasonido (Ultrasonic Cell Crusher, Scientz-llD, China), durante 20 min y se filtraron al vacío. Se obtuvieron 5 extractos en etanol 70 %: naranjo agrio (NA-et), naranjo dulce (ND-et), limón criollo (LMN-et), lima persa (LMA-et), mandarina (MAN-et); y 5 en metanol 70 %: naranjo agrio (NA-met), naranjo dulce (ND-met), limón criollo (LMN-met), lima persa (LMA-met) y mandarina (MAN-met).
Caracterización fitoquímica
Se realizó acorde al método descrito por Schabra y otros.5 Se evaluó la presencia de saponinas, fenoles, taninos, aminoácidos, aminas, coumarinas, quinonas, alcaloides, triterpenos, esteroides y flavonoides. Todas las determinaciones se hicieron por triplicado.
Cuantificación de compuestos fenólicos
Se realizó según el método descrito por Tuberoso y otros6, con modificaciones. El contenido de fenoles totales se determinó mediante extrapolación en una curva de calibración, empleando como patrón ácido gálico a diferentes concentraciones y se expresó en mg de ácido gálico/mL extracto. Todas las determinaciones se hicieron por triplicado.
La cuantificación del contenido de flavonoides totales se realizó empleando el método NaNO2 - AlCl3,7 con modificaciones. El contenido de flavonoides total se determinó por extrapolación en una curva de calibración, utilizando como patrón quercetina a diferentes concentraciones y se expresó en mg de quercetina/mL extracto. Las determinaciones se hicieron por triplicado.
Determinación de la actividad antioxidante in vitro
La capacidad atrapadora de radicales libres de los extractos se determinó mediante el método con ABTS [2,2'-azinobis-(3-etilbezotiazoline-6-ácido sulfónico)],8 usando ácido ascórbico y quercetina como patrones antioxidantes. Se evaluaron los extractos a diferentes concentraciones de flavonoides totales (0,5, 1,0, 1,5 mg/mL). El porcentaje de inhibición de la absorbancia se calculó según la fórmula [(A0 A)/A0] x 100), donde A0 es la absorbancia de ajuste de la solución de ABTS.+ y A es la absorbancia después de trascurrir 1 min de adicionada la muestra. Según el porcentaje de inhibición de la absorbancia se consideró la capacidad de atrapar radicales libres de cada extracto. Cada determinación se hizo por triplicado.
La determinación del poder reductor de los extractos vegetales y de los patrones antioxidantes de quercetina y ácido ascórbico se realizó según el método descrito por Pan y otros9. Se evaluaron los extractos a diferentes concentraciones de flavonoides totales (12,5; 25; 50; 200 y 400 µg/mL). Se consideró el aumento de la absorbancia como indicador del poder reductor de los extractos. Cada determinación se realizó por triplicado.
Letalidad frente a Artemia salina
Se valoró la toxicidad in vitro mediante el ensayo de letalidad frente a A. salina.2 Se evaluaron 3 concentraciones de los extractos: 10, 100 y 1 000 µg/mL. Se emplearon como controles los solventes metanol y etanol 70 % y se realizó por triplicado. La toxicidad de los extractos se expresó como porcentaje de mortalidad de los nauplios de A. salina y se interpretó de la forma siguiente: 0-10 % no tóxico, 11-50 % moderadamente tóxico, 51-90 % altamente tóxico y 100 % extremadamente tóxico. Los porcentajes de mortalidad se graficaron en función de la concentración utilizada, se obtuvo la línea de tendencia potencial, a partir de la ecuación de la gráfica obtenida se determinó la concentración letal para 50 % de la población expuesta (CL50).
Procesamiento estadístico
Los datos se analizaron con el paquete estadístico PASW Statistics para Windows versión 18.0, verificándose los supuestos de normalidad mediante Sapiro Wilk. Se realizó un análisis de varianza (ANOVA) y pruebas de comparaciones múltiples (HSD de Tukey), en variables con distribución normal. Los datos que no seguían distribución normal se procesaron mediante análisis de varianza para dos variables no relacionadas, U de Mann Whitney, y varias muestras independientes, Kruskal Wallis. Los análisis de correlación entre variables se hicieron mediante el cálculo del coeficiente de correlación de Pearson. En todos los casos las diferencias se consideraron significativas para un valor de p< 0,05.
RESULTADOS
En todos los extractos se encontraron abundante presencia de quinonas y aminoácidos, taninos, fenoles, flavonoides y dihidroflavonoles, con los aminoácidos y aminas como los de mayor presencia (tabla 1). Solo la mandarina mostró presencia de esteroides y triterpenos en ambos solventes de extracción. Las coumarinas no se presentaron en ningún extracto de tipo etanólico y en los metanólicos se encontró en todos excepto en la lima persa.
En los extractos ensayados se obtuvieron concentraciones de fenoles totales superiores a los 25 mg de ácido gálico/mL de extracto y a los 4 mg de quercetina/mL de extracto de flavonoides totales (tabla 2).
Los extractos MAN-met y LMN-et mostraron las mayores concentraciones de fenoles y flavonoides totales. No se encontraron diferencias significativas en la concentración de fenoles totales entre los diferentes solventes de extracción en ninguna de las plantas analizadas. Solo se encontraron diferencias significativas en la concentración de flavonoides totales entre los diferentes solventes de extracción para el limón criollo.
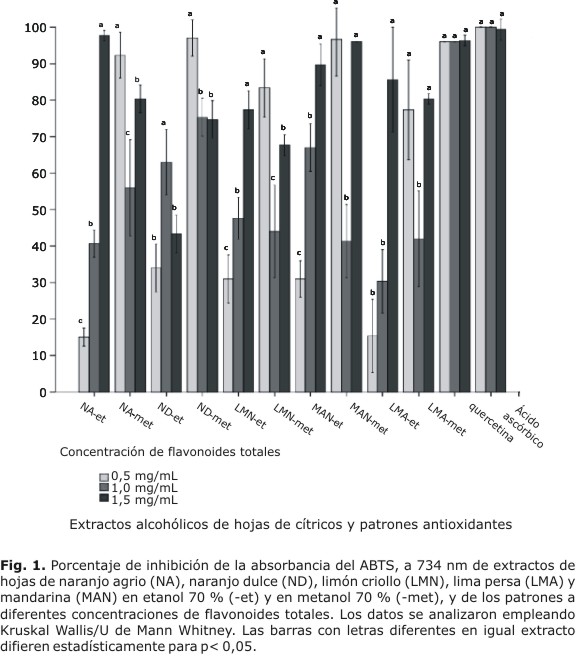
Todos los extractos mostraron capacidad de atrapar radicales libres a diferentes concentraciones de flavonoides totales (Fig. 1), la cual fue dependiente de la concentración de flavonoides totales en los extractos etanólicos. Con excepción de ND-et y LMA-et, existieron diferencias significativas entre los valores de absorbancia a diferentes concentraciones de flavonoides totales, lo cual muestra buena relación lineal entre ambos factores, con coeficientes de correlación de Pearson superiores a 0,942.
En los extractos metanólicos, aunque existieron diferencias significativas entre los valores de absorbancia según la concentración de flavonoides totales, no hubo relación lineal entre estas variables; se obtuvieron los mayores valores de absorbancia a 0,5 mg/mL de flavonoides totales.
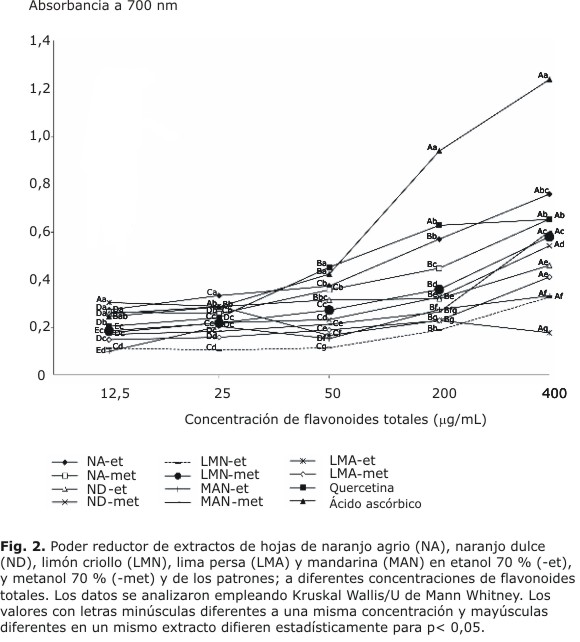
Los extractos ensayados mostraron poder reductor a diferentes concentraciones de flavonoides totales (Fig. 2).
En todas las concentraciones de flavonoides totales probadas se encontraron diferencias significativas entre el poder reductor de todos de los extractos ensayados.
Los extractos NA-et, NA-met, ND-met y LMA-met, mostraron diferencias significativas en el poder reductor a diferentes concentraciones de flavonoides totales, a mayor concentración mayor poder reductor, que muestra buena relación lineal entre ambos factores, con coeficiente de correlación de Pearson superiores a 0,851. En el resto de los extractos hubo diferencias significativas entre el poder reductor a las diferentes concentraciones empleadas pero no cumplieron una relación lineal entre estos factores.
El ensayo de letalidad con A. salina demostró que la toxicidad de los extractos fue dependiente de la concentración, no siendo tóxico a concentraciones menores que 10 µg/mL, sin embargo mostraron toxicidad moderada a concentraciones entre 100 y 1 000 µg/mL. En la tabla 3 se muestra la CL50 para todos los extractos hidroalcohólicos ensayados.
El extracto LMA-met mostró el mayor valor de CL50 (464,24 µg/mL) y la menor toxicidad, mientras que el extracto de limón criollo en metanol 70 % mostró menor valor de CL50 (74,78 µg/mL) y mayor toxicidad.
DISCUSIÓN
En la última década ha existido un marcado interés biomédico sobre los cítricos, debido a sus efectos antioxidantes, que han sido atribuidos a la abundancia de flavonoides, metabolitos secundarios muy activos en estas plantas.10,11
Las flavonas y flavonoles, son clases de flavonoides que contienen en su estructura química grupos 3' y 5' OH en los anillos fenólicos A y C necesarios para ejercer el máximo potencial antioxidante.8 En los extractos de hojas de cítricos obtenidos en este trabajo se encontraron estas clases de flavonoides; otros autores también han encontraron diferentes flavonas, flavonas polimetoxiladas, flavonoles y flavanonas en hojas10,12 y frutos11-14 de varias especies de cítricos con actividad antioxidante, por lo que esta actividad pudiera estar mediada por esos compuestos.
El hecho de que la composición de flavonoides sea similar en hojas y frutos de cítricos, puede deberse a las funciones fisiológicas de estos metabolitos de contribuir al desarrollo y crecimiento de la planta, así como a la defensa contra infecciones y radiaciones ultravioleta.
En todos los extractos de hojas de los cítricos obtenidos se cuantificaron valores de fenoles y flavonoides totales superiores a los publicados por otros autores para extractos de frutos y jugos de estas especies.4,11-15 Solo Guimarães, en las fracciones volátiles de aceites esenciales de frutos de limón y lima obtuvieron valores de fenoles y flavonoides totales superiores a los presentados en este estudio.16 Estos resultados demuestran que las hojas pueden utilizarse como fuente de ese tipo de compuestos bioactivos en estas plantas.
Para evaluar la capacidad antioxidante in vitro de muestras biológicas se han empleado varias técnicas analíticas, pero aún no existe un método universal que pueda determinar esta capacidad total cuantitativamente,16 por tanto, es recomendable realizar esta evaluación por varios métodos.14 En este trabajo se utilizaron dos métodos y como patrones antioxidantes ácido ascórbico y quercetina, compuestos con probada capacidad de atrapar radicales libres,17 poder reductor18 y ser abundantes en estas plantas.10,15
Para determinar la capacidad de atrapar radicales libres en compuestos coloreados, como son estos extractos de hojas de cítricos, se recomienda el radical ABTS•+,17 porque presenta un máximo de absorción cerca de la región infrarroja que reduce las posibilidades de interferencias por compuestos coloreados que absorban en la región visible del espectro.9
La capacidad de atrapar radicales libres de extractos obtenidos a partir de frutos de diferentes especies de cítricos ha sido demostrada,3,14 no así en extractos obtenidos a partir de hojas. Las actividades antioxidantes de frutos de cítricos están en correspondencia con la concentración de compuestos fenólicos.13 Varios estudios han demostrado una relación lineal entre el contenido de fenoles totales y la alta actividad antioxidante,2,4 lo que coincide con los resultados mostrados en este trabajo, en la mayoría de los extractos etanólicos. Sin embargo, esta correlación no se cumplió para los extractos metanólicos, resultados que coincide con los obtenidos en extractos de corteza y frutos de C. sinensis, donde a pesar de que las fracciones metanólicas mostraron una significativa capacidad de atrapar radicales libres y un alto contenido de compuestos fenólicos, no se obtuvieron buenos índices de correlación.3 Otros autores encontraron correlaciones negativas entre estas variables.13 Esos resultados podrían deberse al establecimiento de relaciones antagónicas entre las diferentes clases de flavonoides o con otros metabolitos presentes en los extractos.19 No obstante, a concentraciones de 1,5 mg/mL de flavonoides totales, se obtuvieron porcentajes de inhibición de la absorbancia superiores a 60 % en todos los extractos empleados.
El poder reductor de un compuesto sirve como indicador significativo de su actividad antioxidante. Todos los extractos de cítricos ensayados mostraron poder reductor similares a los obtenidos en diferentes fracciones de extractos de corteza de limón, naranja y lima.16 En este método también se ha encontrado correlación entre la concentración de compuestos fenólicos en los extractos vegetales y el incremento del poder reductor.20
El hecho de que todos los extractos de hojas de cítricos estudiados mostraron capacidad de atrapar radicales libres y poder reductor iguales o superiores a los publicados en estudios realizados en extractos obtenidos a partir de frutos de estas plantas, demuestra su potencial para emplearlos como antioxidantes.
La evaluación de la toxicidad de extractos vegetales es indispensable con el objetivo de considerar un tratamiento seguro, permite la definición de la toxicidad intrínseca de la planta y los efectos de una sobredosis aguda. Pocos son los estudios sobre evaluación de la toxicidad frente a A. salina de extractos de especies de cítricos. En la literatura consultada solo se encontró un estudio en extractos de corteza del fruto de C. aurantium, donde los resultados se compararon con estudios de toxicidad realizados en ratones, que mostraron una buena correlación entre los mismos, demostrando la confiabilidad de este método. La toxicidad mostrada por extractos de corteza del fruto de C. aurantium fue similar a la mostrada por los extractos obtenidos en este trabajo.
Estos resultados demuestran el potencial de los extractos hidroalcohólicos de hojas de cítricos para su empleo como potentes antioxidantes, aunque sería necesario realizar estudios de estabilidad y formulación química, así como la evaluación de la toxicidad y seguridad del extracto en animales experimentales para proponer su uso como producto farmacológico.
AGRADECIMIENTOS
Por el apoyo financiero para el trabajo a la Facultad de Ciencias Agropecuarias. Universidad Central "Marta Abreu" de Las Villas.
REFERENCIAS BIBLIOGRÁFICAS
1. Khairunnuur FA, Zulkairi A, Azrina A, Moklas MAM, Khairullizam S, Zamree MS, et al. Nutritional composition, in vitro antioxidant activity and Artemia salina L. Lethality of pulp and seed of Tamarindus indica L. extracts. Malays J Nutr. 2009;15(1):65-75.
2. Lagarto A, Silva R, Guerra L, Iglesias L. Comparative study of the assay of Artemia salina L. and the estimate of the medium lethal dose (LD50 value) in mice, to determine oral acute toxicity of plant extracts. Phytomedicine. 2001;8(5):395-400.
3. Amin I, Norazaidah Y, Hainida KIE. Antioxidant activity and phenolic content of raw and blanched amaranthus species. Food Chem. 2006;94(1):47-52.
4. Anagnostopoulou MA, Kefalas P, Apageorgiou VP, Assimopoulou AN, Boskou D. Radical scavenging activity of various extracts and fractions of sweet orange peel (Citrus sinensis). Food Chem. 2006;94(1):19-25.
5. Schabra SC, Ulso FC, Mshin EN. Phytochemical screening of Tanzanian medical plants. J Etnopharmacol. 1984;11(2):157-9.
6. Tuberoso CIG, Montoro P, Piacenteb S, Coronac G, Deianac M, Dessìc MA, et al. Flavonoid characterization and antioxidant activity of hydroalcoholic extracts from Achillea ligustica All. J Pharm Biomed Anal. 2009;50(3):440-8.
7. Liu B, Zhu Y. Extraction of flavonoids from flavonoid-rich parts in tartary buckwheat and identification of the main flavonoids. J Food Eng. 2007;78(2):584-7.
8. Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic Biol Med. 1999;26(9/10):1231-7.
9. Pan Y, Wang K, Huang S, Wang H, Mu X, He Ch, et al. Huang.Antioxidant activity of microwave-assisted extract of longan (Dimocarpus Longan Lour.) peel. Food Chem. 2008;106(3):1264-70.
10. Djoukeng JD, Arbona V, Argamasilla R, Gómez-Cadenas A. Flavonoid proûling in leaves of citrus genotypes under different environmental situations. J Agric Food Chem. 2008;56(23):11087-97.
11. Peterson JJ, Dwyer JT, Beecher GR, Bhagwat SA, Gebhardt SE, Haytowitz DB, et al. Flavonones in oranges, tangerines (mandarins), tangors, and tangelos: a compilation and review of the data from the analytical literature. J Food Compos Anal. 2006;19(1):S66-S73.
12. Kawaii S, Tomono Y, Katase E, Ogawa K, Yano M, Koizumi M, et al. Quantitative study of flavonoids in leaves of Citrus plants. J Agric Food Chem. 2000;48(9):3865-71.
13. Ghafar MFA. Prasad KN, Weng KK, Ismail A. Flavonoid, hesperidine, total phenolic contents and antioxidant activities from citrus species. Afr J Biotechnol. 2010;9(3):326-30.
14. Khan MK, Abert-Vian M, Fabiano-Tixier A-S, Dangles O, Chemat F. Ultrasound-assisted extraction of polyphenols (ûavanone glycosides) from orange (Citrus sinensis L.) peel. Food Chem. 2010;119(2):851-8.
15. Moriguchi T, Kita M, Hasegawa S, Omura M. Molecular approach to citrus flavonoid and limonoid biosynthesis. Food Agric Environ. 2003;1(1):22-5.
16. Guimarães R, Barros L, Barreira JCM, M. Sousa AJ, Carvalho AM, Ferreira IC. Targeting excessive free radicals with peels and juices of citrus fruits: grapefruit, lemon, lime and orange. Food Chem Toxicol. 2010;48(1):99-106.
17. Dae-Ok K, Lee KW, Hyong JL, Chang Y. Vitamin C equivalent antioxidant capacity (VCEAC) of phenolic phytochemicals. J Agric Food Chem. 2002;50(13):3713-7.
18. Kim NY, Jang MK, Lee DG, Yu KH, Jang H, Kim M, et al. Comparison of methods for proanthocyanidin extraction from pine (Pinus densiflora) needles and biological activities of the extracts. Nutr Res Pract. 2010;4(1):16-22.
19. Escamilla C, Cuevas E, Guevara J. Flavonoides y sus acciones antioxidantes. Rev Fac Med UNAM. 2009;52(2):73-5.
20. Chang HY, Ho YL, Sheu MJ, Lin YH, Tseng MC, Wu SH, et al. Antioxidant and free radical scavenging activities of Phellinus merrillii extracts. Botanical Studies. 2007;48(4):407-17.
Recibido: 12 de enero de 2012.
Aprobado: 19 de junio de 2012.
Katia Ojito Ramos. Departamento de Biología. Facultad de Ciencias Agropecuarias. Universidad Central "Marta Abreu" de Las Villas. Carretera a Camajuaní km 5.5. Santa Clara 54 830. Villaclara, Cuba. Teléf.: 281692; 201002. Correo electrónico: kojito@uclv.edu.cu