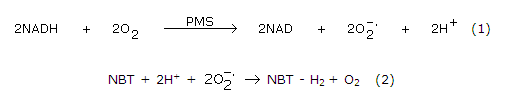Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.17 no.4 Ciudad de la Habana oct.-dic. 2012
ARTÍCULO ORIGINAL
Capacidad atrapadora de radicales libres de Passiflora mollissima (Kunth) L. H. Bailey (curuba)
Free radical trapping capacity of Passiflora mollissima (Kunth) L. H. Bailey (curuba)
Dr. Benjamín Alberto Rojano, Dra. Karol Zapata Acosta, MSc. Farid B. Cortes Correa
Universidad Nacional de Colombia, Sede Medellín. Medellín, Colombia.
RESUMEN
Introducción: en Colombia hay un gran número de especies exóticas sin explotación con potencial agroindustrial que constituyen una fuente futura de ingresos. El género Passiflora, el más grande de la familia Passifloraceae comprende cerca de 500 especies, ninguna se caracteriza por poseer un alto contenido de compuestos polifenólicos con propiedades antioxidantes; excepto Passiflora mollissima (Kunth) L.H. Bailey (curuba) que es una fruta con alta capacidad reductora.
Objetivos: determinar la capacidad que tienen los extractos acuosos de curuba, proveniente de la región de Antioquia, Colombia, para atrapar especies reactivas de oxígeno.
Métodos: los contenidos de fenoles, flavonoides y taninos se determinaron por métodos espectrofotométricos. Los ácidos fenólicos se establecieron por high-pressure liquid chromatography. La capacidad para atrapar radicales libres peroxilos por los métodos fluorescentes ORAC (oxygen radical absorbance capacity) hidrofílico y lipofílico. La capacidad para atrapar las especies reactivas de oxígeno total e hidroxilos, se realizó por métodos fluorescentes y los radicales superóxido por espectrofotometría.
Resultados: los extractos acuosos de curuba son ricos en polifenoles, especialmente en taninos, flavonoides y ácidos fenólicos. Además, poseen una alta capacidad para atrapar las diversas especies reactivas de oxígeno, especialmente el radical ROO•, con un valor ORAC igual a 108164,9 mmol de Trolox/100 g de pulpa seca, más alto que la mayoría de las frutas y verduras.
Conclusiones: el extracto acuoso de curuba tiene un alto potencial nutracéutico, debido al contenido de polifenoles, que inciden directamente en su capacidad para atrapar radicales especies reactivas de oxígeno.
Palabras clave: curuba, Passiflora mollissima, radicales libres, ORAC.
ABSTRACT
Introduction: Colombia has a large number of exotic species with unexploited agroindustrial potential as a source of future income. Passiflora is the biggest Passifloraceae family, including about 500 species that do not have high content of polyphenolic compounds with antioxidant properties, except for Passiflora mollissima (Kunth) L.H.Bailey (curuba), a fruit with high antioxidant capacity.
Objectives: to determine the ability of aqueous extracts to trap reactive oxygen species in curuba fruits from the region of Antioquia, Colombia.
Methods: the contents of phenols, flavonoids and tannins were determined by spectrophotometric methods. The phenolic acids were determined by high-pressure liquid chromatography. The ability to trap free peroxyl radicals was measured by hydrophilic and lipophilic fluorescent ORAC (oxygen radical absorbance capacity) methods. The ability to trap total reactive oxygen species and hydroxyls, and superoxide radicals were ascertained by fluorescent methods and by spectrophotometry respectively.
Results: aqueous extracts of passion fruit are polyphenol-rich, particularly tannins, flavonoids and phenolic acids. They also have a high capacity to trap the various reactive oxygen species, especially the radical ROO•, with an ORAC value of 108164.9 mmol Trolox/100 g of dry pulp, which is higher than in most fruits and vegetables.
Conclusions: the aqueous extract of passion fruit has high nutraceutical potential due to the polyphenol content that directly affects their ability to trap reactive oxygen species radicals.
Keywords: passion fruit, Passiflora mollissima, free radicals, ORAC.
INTRODUCCIÓN
Las especies reactivas de oxígeno (ERO) son producto del proceso metabólico. En condiciones fisiológicas normales, el estado redox es controlado por los antioxidantes. Sin embargo, el aumento en la producción de ERO puede sobrepasar las defensas antioxidantes, lo que ocasiona un desbalance llamado estrés oxidativo, que provoca daños en los lípidos, proteínas y ácidos nucleicos; esto puede desencadenar diferentes enfermedades crónicas. Diversos estudios epidemiológicos han establecido una correlación inversa entre la ingesta de frutas y verduras y la mortalidad.1 El alto contenido de los compuestos poilifenólicos en las frutas les aporta un mayor potencial antioxidante y les imparte diversas propiedades farmacológicas asociadas a enfermedades producidas por especies reactivas de oxígeno, inductoras de leucemia y cáncer de colon, entre otras.2,3 Por ejemplo, los taninos condensados, flavonoides, ácidos fenólicos como el clorogénico, cumárico y elágico presentes en muchos frutos son capaces de atrapar radicales libres causantes del estrés oxidativo, y con ello reducir la probabilidad de padecer enfermedades crónicas. Los polifenoles en general presentes en frutas poseen además propiedades antiinflamatorias, antialérgicas, antitrombóticas, antimicrobianas y antineoplásicas.4,5
Colombia cuenta con un gran número de especies nativas y exóticas, con poca explotación y con un gran potencial agroindustrial que constituye una fuente futura de ingresos para la población local. El género Passiflora es el más grande de la familia Passifloraceae y comprende cerca de 500 especies, ninguna se ha caracterizado por poseer un alto contenido de compuestos polifenólicos con propiedades antioxidantes.6 La Passiflora mollissima (Kunth) L.H. Bailey es una baya de forma elipsoidal de 7 a 10 cm de largo, de color verde claro cuando se está desarrollando y completamente amarillo al madurar. La pulpa es firme, carnosa, jugosa y con pequeñas semillas de color negro. Su sabor es exótico, suave, agradable, perfumado y algo ácido y astringente. Es una fruta originaria de las tierras frías del norte de Suramérica, crece bien entre 2 000 y 3 000 m sobre el nivel del mar con temperaturas de 8 a 16 °C. La curuba es cultivada principalmente en Ecuador, Perú, Bolivia, Colombia y Venezuela; la variabilidad genética en esta especie es muy alta, por lo que se encuentra una gran heterogeneidad de plantas y frutas que se diferencian en cuanto a tamaño, forma, color, resistencia sanitaria, rendimiento, y composición química. La curuba se consume en fresco y brinda posibilidades en la forma de jugo, néctar, concentrados y licores.7 Hay muy pocos reportes sobre el valor nutricional y los compuestos bioactivos de la curuba; Botero y otros encontraron que la curuba posee mayor capacidad reductora comparada con 15 frutas colombianas, usando las técnicas FRAP y midiendo el potencial de ionización por voltametría cíclica.8 Contreras-Calderón y otros reportan por algunas técnicas (ABTS, DPPH y FRAP) diferencias significativas entre la capacidad antioxidante de la curuba y otras frutas colombianas.9 Sin embargo, no hay reportes de los compuestos bioactivos tipo fenoles y polifenoles, como los ácidos fenólicos, flavonoides y taninos responsables de la actividad antioxidante y su efecto sobre la capacidad atrapadora de algunos radicales libres como superóxido, hidroxilo, y los radicales peroxilos.
Teniendo en cuenta el creciente interés en las propiedades nutracéuticas de los alimentos y la gran demanda de aditivos naturales en los mercados internacionales; el objetivo de esta investigación es mostrar el potencial de la curuba, una fruta altoandina que no ha sido explotada y que tiene todas las características nutracéuticas, para ser utilizada en la industria de alimentos y cosmética. Para lo cual, se evaluaron en extractos de curuba, la actividad antioxidante mediante la aplicación de diferentes metodologías que miden la capacidad para atrapar las más importantes especies reactivas de oxígeno como hidroxilo, peroxilo y superóxido. Además, determinar los polifenoles comprometidos con la actividad antioxidante.
MÉTODOS
Material vegetal
Los frutos de curuba (P. mollissima) se colectaron en la ciudad de Medellín (Colombia). Un material vegetal, con código JAUM-54600, fue clasificado por el Biólogo Álvaro Cogollo y se encuentra en el herbario "Joaquín Antonio Uribe" del jardín botánico de la ciudad de Medellín.
Las frutas se lavaron y desinfectaron con hipoclorito 100 ppm; 0,2000 g de pulpa de curuba fueron extraídos con 20 mL de agua supra pura y homogenizados con un Ultra-Turrax Brand: IKA-WERK©; luego la muestra se mezcló en un agitador por 16 h y se centrifugó a 3 000 rpm y 25 ºC por 20 min.5 El extracto obtenido (sobrenadante) fue usado para los ensayos antioxidantes. Para el ensayo lipofílico la muestra se extrajo con n-hexano. El extracto hexánico seco se disolvió en una mezcla 1:1 de acetona:agua con 7 % de metil â-ciclodextrina.10 Los extractos se almacenaron a - 20 °C durante el período de estudio.
Reactivos ensayos antioxidantes
El radical libre DPPH (1,1-difenil2-picrilhidrazilo), fosfato ácido de sodio, MeOH, 2,2-Azinobis-(3-etilbenzotiazolin-6-sulfónico) (ABTS), ácido acético, tricloruro de hierro, 2,2'-Azinobis (2-amidinopropano) diclorhidrato (AAPH) y fluoresceína se compraron a AldrichChem. Co. (Millwakee, WI); persulfato de potasio, reactivo de Folin-Ciocalteu, ácido gálico, ácido ascórbico fueron obtenidos de Merck (Alemania). El agua usada en los experimentos era grado HPLC (high-pressure liquid chromatography). Todos los experimentos espectrofotómetricos se realizaron en un lector de placas Multiskan Spectrum UV-Vis Marca Thermo Scientific, Finlandia. La disminución en la intensidad de la fluorescencia medida en el ensayo ORAC se realizó en un espectrofluorímetro Perkin-Elmer LS-55, Beaconstield, U.K. Los estudios cromatográficos por HPLC se hicieron en un equipo Shimadzu Prominence UFLC.
Determinación de fenoles totales
Se usó el método colorimétrico de Folin-Ciocalteu, el cual mide la reducción de este reactivo, inducida por el poder reductor de los compuestos fenólicos, con la consecuente formación de un complejo azul que se lee a 760 nm.11 Se construyó una curva patrón usando como estándar ácido gálico. Se diluyó el extracto de curuba a una concentración en la cual el contenido de fenoles se encontraba dentro del intervalo de la curva patrón. Los resultados se expresaron como mg de ácido gálico/100 g de pulpa seca (GAE).
Determinación de flavonoides
Se construyó una curva patrón usando como estándar (+)-catequina. Los resultados se expresaron como mg de catequina/100 g de pulpa seca. Las lecturas se realizaron a 510 nm.12
Determinación de taninos condensados
Este método se fundamenta en la reacción de los taninos condensados con vainillina bajo condiciones ácidas, usando como estándar catequina. Una alícuota de 2 ml de una solución recién preparada de vainillina (1 g/100 mL) en ácido sulfúrico al 70 % se agregó a 500 µL del extracto de curuba (0,01 g/mL). La mezcla se incubó a 20 °C durante 15 min y se leyó la absorbancia a 500 nm. Se usó (+) catequina para construir la curva de referencia, y los resultados se expresaron como mg catequina/100 g de pulpa seca.13
Determinación de ácidos fenólicos por high-pressure liquid chromatography
El contenido de ácido cafeico, ferúlico y cumárico, se determinó mediante un análisis cromatográfico por HPLC. Se utilizó un cromatógrafo líquido (Shimadzu, LC-20AD), equipado con un auto inyector SIL-20A /HT, un módulo de comunicación CBM-20A y un detector con arreglo de fotodiodos (PDA) SPD-M20A, calibrado a 280 nm. La separación de los ácidos fenólicos se llevó a cabo en una columna C-18 ultra acuosa, cuyas dimensiones eran 5 µm de tamaño de partícula, 250 mm de longitud y 4,6 mm de diámetro. Como fase móvil se utilizó metanol (A) acidulado con ácido fórmico 0,1 % (B), con gradientes de elución de 0,01 min 60 % de A; 5-12 min 80 % de A; 13-14 min 60 % de A. La razón de flujo de la fase móvil fue 1,0 mL/min. La cuantificación de los diversos ácidos fenólicos se realizó usando curvas estándares.14
Evaluación de la capacidad atrapadora de radicales superóxido
En este ensayo se evaluó la capacidad del extracto de curuba, para atrapar el radical superóxido, los cuales son generados por el sistema NADH/PMS. El mecanismo consistió de dos etapas principales. La primera en la oxidación del NADH por acción del PMS (reacción 1) y la segunda en la reducción del NBT mediante la transferencia de electrones provenientes del anión superóxido (reacción 2).15
La actividad atrapadora del radical superóxido se determinó mediante espectrofotometro.16 La reacción se llevó a cabo en buffer fosfato 75 mM, pH 7,4. Las soluciones se adicionaron en las cantidades siguientes: 60 µL de NBT 156 µM, 60 µL de NADH 468 µM, 15 µL de extracto de curuba o catequina (estándar) y finalmente 165 µL de PMS 10 µM. Luego de 5 min de reacción, se registró la absorbancia a 560. Los resultados obtenidos se reportaron como mg de catequina/100 g de pulpa seca.
Evaluación de la capacidad total para atrapar especies reactivas del oxígeno
En este ensayo se evaluó la capacidad de los antioxidantes del extracto de curuba para atrapar especies reactivas del oxígeno, las cuales se generaron por el azo compuesto, 2,2'-diazobis (2- amidinopropano) dihidrocloruro) (AAPH), que en medio acuoso produjo radicales libres a una velocidad constante.17La reacción se llevó a cabo en buffer fosfato 75 mM y pH 7,4. Se mezclaron 50 µL de una solución de AAPH 0,3 M, 50 µL de una solución etanólica de 2,7-diclorofluoresceína diacetato 2,4 mM, 2850 µL de buffer y 50 µL de la muestra a evaluar. Inmediatamente se leyó la intensidad de fluorescencia emitida durante los primeros 10 min y se comparó con la intensidad emitida en ausencia de la muestra. Los resultados se expresaron como valores TEAC (mg de Trolox/100 g de pulpa seca), mediante la construcción de una curva patrón usando diferentes concentraciones de Trolox®.
Evaluación de la capacidad atrapadora de radicales hidroxilos •OH.
La actividad atrapadora del radical hidroxilo se determinó por fluorescencia.18 La reacción se llevó a cabo en buffer fosfato 0.2 M y pH 7,4. Se mezclaron 300 µL de una solución de tereftalato de sodio 1x10-4 M, 2 420 µL de buffer, 100 µL de la muestra a evaluar, 90 µL de una solución de EDTA 1x10-2 M y finalmente 90 µL de una solución de Fe+21 x 10-2 M. La mezcla se dejó reposar durante 6 min con aireación constante y a temperatura ambiente, luego se mide la intensidad de fluorescencia a una ë excitación: 326 nm, una ë emisión: 432 nm y 10 nm de slit. Los resultados se expresaron como mg de DMSO/100 g de pulpa seca, mediante la construcción de una curva patrón usando diferentes concentraciones de DMSO.
Método oxygen radical absorption capacity (ORAC)
El ensayo ORAC se determinó por la metodología siguiente11,19 Se prepararon 3 mL de la solución siguiente: 21 µL de una solución de fluoresceína 10 µM, 2899 µL de buffer fosfato 75 mM (pH 7,4), 50 µL de AAPH 600 mM y 30 µL de extracto de curuba. La fluorescencia se registró en un espectrofluorímetro Perkin Elmer LS45 con una multicelda termostatizada. El valor ORAC se calculó utilizando la ecuación siguiente.
Donde AUC es el área bajo la curva y f es el factor de dilución de los extractos. Los resultados son expresados como valores TEAC (µmol de Trolox/100 g de pulpa seca).
Análisis estadístico
Todos los experimentos se realizaron por triplicado. Las regresiones se calcularon con un nivel de significancia de 95 % (p< 0,05), usando el programa Statgraphics Plus versión 5.0 (Statistical Graphics Corp., Rockville, MD).
RESULTADOS
Las semillas de la curuba fueron separadas y la pulpa obtenida tiene las características fisicoquímicas siguientes: 85,2 % de humedad, 13 grados Brix, un pH de 3,4 y una acidez titulable igual a 2,26 % equivalentes de ácido cítrico, con un rendimiento en pulpa respecto a la fruta completa de 47,69 %. El rendimiento de extracción para el extracto acuoso fue de 10,94 %, mientras que para el extracto hexanico resultó de 1,12 %.
Fenoles totales: la pulpa de curuba, posee un contenido de fenoles igual a 5 012,8 mg de acido gálico/100 g de pulpa seca (tabla 1).
Taninos condensados: el contenido de taninos condensados encontrados en curuba equivalen a 8 492,4 mg de catequina/100 g de pulpa seca.
Flavonoides totales: la pulpa de curuba contiene 1 203,4 mg de catequina/100 g de pulpa seca. Además, contiene ácidos fenólicos como: cumárico, cafeico y ferúlico en cantidades apreciables; 4,0, 9,7 y 16,1 mg/100 g de pulpa seca, respectivamente (tabla 2).
Actividad antioxidante: para los extractos de curuba se midió fundamentalmente por técnicas de fluorescencia, excepto la determinación de anión superóxido (tabla 3). Los valores ORAC hidrofílico y lipofílico resultaron: 108 061,8 y 103,1 mmol de Trolox/100 g de pulpa seca, respectivamente; para un valor ORAC total igual a 108 164,9 mmol de Trolox/100 g de pulpa seca. La pulpa de curuba tiene una capacidad total para atrapar especies reactivas del oxígeno igual a 28 297 mmol de Trolox/100 g de pulpa seca. La curuba tiene una capacidad para atrapar radicales hidroxilo igual a 23 086,1 mmol de DMSO/100 g de pulpa seca y, por último, la capacidad para los radicales superóxido igual a 107 750,0 mg de catequina/100 g de pulpa seca.
DISCUSIÓN
Polifenoles
Los metabolitos secundarios con características polifenólicas, son determinantes en la actividad antioxidante de las frutas. Los resultados encontrados para los extractos acuosos de curuba son mucho mayores que los reportados para la mayoría de los vegetales. Por ejemplo, el contenido de fenoles de la curuba es mucho mayor que todos los frutos del género Passiflora estudiados y que la mayoría de los vegetales de muchas latitudes reportadas, incluidas diversas frutas tipo cerezas y otras, granos y legumbres.6,9,10,20 Los taninos condensados, proantocianidinas o procianidinas son oligómeros o polímeros formados por unidades de flavan-3-ol (catequina, epicatequina, antocianinas) y se encuentran en altas cantidades en muchos vegetales como el té y el cacao. En nuestro estudio se encontró un contenido de taninos en la curuba muy superior a los reportados para cacao, té, algunos arándanos y otras frutas.21,22
Los flavonoides son un grupo amplio de compuestos polifenólicos, que están asociados a muchos efectos benéficos para la salud, debido a sus propiedades antioxidantes, los cuales se encuentran en frutas y vegetales. Se han aislado más de 4 000 flavonoides, asociados al color de hojas, flores y frutas. Además, para los flavonoides se han reportado muchas actividades biológicas como antiinflamatorios, antivirales y antibacteriales; de otro lado se ha asociado la ingesta de flavonoides con efectos benéficos en enfermedades cardiovasculares.23,24 De igual manera los contenidos de flavonoides de la curuba son muy superiores a diversos extractos de plantas y frutas.12,25,26 Los ácidos fenólicos son compuestos importantes en la potenciación de la actividad antioxidante; especialmente la presencia de ácido ferúlico y cafeico presentes en los extractos acuosos de curuba.11
Actividad antioxidante
La actividad antioxidante de un alimento es la expresión de los diferentes componentes polifenólicos, los cuales se comportan mediante diferentes mecanismos de acción reductora en sus interacciones con las especies reactivas de oxígeno u otros radicales. La medida de la capacidad antioxidante de frutas ha tenido mucha relevancia en los últimos años, debido a la calidad de la información que se puede obtener; desde la resistencia a la oxidación, la contribución cuantitativa de sustancias antioxidantes y la actividad antioxidante producida por la fruta en el organismo al momento de consumirla.27 Aunque no se ha demostrado a satisfacción el efecto directo de los antioxidantes naturales sobre la salud en humanos, sin embargo, cuando los niveles de antioxidantes en la sangre y los tejidos son altos, se pueden reducir los daños a las células.
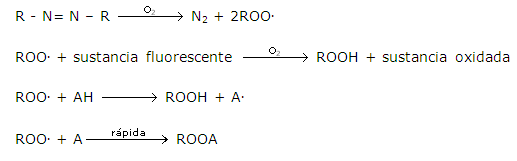
Los métodos fluorimétricos para determinar la actividad antioxidante han tenido una gran implementación en los últimos años debido a su gran sensibilidad y precisión. El método ORAC mide la capacidad antioxidante mediante un mecanismo de transferencia de protones HAT (hydrogen atom transfer), es la técnica avalada por el Departamento Federal de Agricultura de Norteamérica para medir el potencial antioxidante total de alimentos y suplementos nutricionales.28 El método consiste en evaluar la degradación oxidativa de una molécula fluorescente (fluoresceína) en presencia de iniciadores de radicales libres como los azocompuestos (AAPH). Los iniciadores de radicales libres producen radicales peroxilos que causan daño a las moléculas fluorescentes. Las especies antioxidantes como los extractos de curuba inhiben el proceso oxidativo atrapando los radicales peroxilos formados.19 El mecanismo se describe a continuación:
El valor ORAC total encontrado para la curuba de 108 164,9 mmol de Trolox/100 g de pulpa secaes más alto que la mayoría de granos, legumbres y frutas, incluidos muchos tipos de cerezas, como mortiño (Vaccinium meridionale), fresas, uvas, arándanos; y superados solo por fracciones seleccionadas de extractos de acai (Euterpe oleraceae) y algunos flavonoides separados de esta especie, por algunos tipos de sorgos ricos en taninos, y de algunas especies como orégano seco (Origanum vulgare), cúrcuma (Curcuma longa), y por algunas flores de plantas de la familia Anacardiaceae.27-30
Las especies reactivas de oxígeno en diferentes muestras se determinan con la sonda no fluorescente 2,7-dichloro dihydro fluorescein diacetato (DCFH-DA), la cual en un medio básico origina 2,7 diclorodihidrofluoresceína (DCFH), que al ser oxidado por algunas ERO, origina 2,7 diclorofluoresceína (DCF) un compuesto fluorescente. La actividad atrapadora de especies reactivas de oxígeno y especies reactivas de nitrógeno se determinó siguiendo el método descrito por Martín-Romero con algunas modificaciones.17 Los valores de TEAC para curuba iguales a 28 297 mmol de Trolox/100 g de pulpa seca, son equivalentes a una actividad de 7,0827 g de Trolox/g de pulpa seca y no se pueden comparar con los de otras frutas por falta de información.
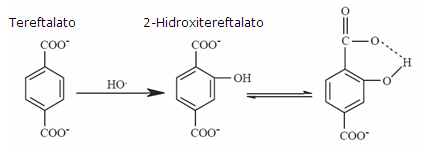
Los radicales hidroxilos son generados por el sistema Fe2+-EDTA/H2O2. El mecanismo se lleva a cabo en tres etapas: en la primera se da la oxidación de la dupla Fe2+-EDTA con oxígeno molecular para formar Fe3+-EDTA y el radical superóxido; en la segunda, el radical superóxido en presencia de hidrógeno es dismutado a H2O2; y en la última etapa, el Fe(II)-EDTA cataliza la descomposición del H2O2 hasta •OH.18 Luego de ser generados, los radicales hidroxilos reaccionan con el ácido tereftálico para formar un producto monohidroxilado altamente fluorescente, el ácido 2-hidroxitereftalato. La capacidad del antioxidante para atrapar los radicales hidroxilos hace que disminuya la cantidad del producto 2-hidroxitereftalato, lo cual puede ser evidenciado en la disminución de la intensidad de fluorescencia emitida por la reacción siguiente.
Los resultados para atrapar los radicales hidroxilos se expresan como valores DMSO, que es una especie altamente reconocida como atrapador de radicales hidroxilo y usado como patrón de referencia en muchos trabajos con técnicas espectrofotométricas.30,31 Los valores para curuba 23 086,1 mmol de DMSO/100 g de pulpa seca, son equivalentes a 1,8030 g de DMSO/100 g de fruta seca, un valor bastante considerable como una expresión bioactiva.
El radical superóxido (O2•-) está asociado con la producción de especies reactivas de nitrógeno al reaccionar con NO•, que altera la vasodilatación y promueve la vasoconstricción. El anión superóxido, además interviene en la producción de otras especies reactivas de oxígeno y nitrógeno como H2O2, OH•, peroxinitrito, ácido hipocloroso y radicales lipídicos (ROO•) importantes en los desórdenes oxidativos; 1 g de extracto seco de curuba tiene la misma capacidad para atrapar los radicales superóxido que 1 g de catequina. La capacidad atrapadora del radical superóxido en este caso particular también se puede expresar como la concentración inhibitoria 50 (IC50) para atrapar el radical superóxido producido en el sistema NADH/PMS, equivalente a 1,854 g de extracto seco/L.
En conclusión, la curuba es una fruta que tiene una alta capacidad para atrapar los radicales libres peroxilos (ROO•), hidroxilos (OH•), superóxido (O2•-) y en general las especies reactivas de oxígeno y nitrógeno (ROS y RNS). Una ingesta de 100 mL de jugo de curuba aporta alrededor de 4 000 UI ORAC, suficientes para mantener un buen equilibrio oxidativo. La curuba es la fruta altoandina diferente a los frutos rojos tipo cerezas con mayor valor ORAC.
AGRADECIMIENTOS
A Colciencias por el apoyo, a la joven investigadora Karol Zapata, a la DIME y al laboratorio de Ciencia de los Alimentos de la Universidad Nacional de Colombia sede Medellín, por el apoyo económico en la ejecución del trabajo.
REFERENCIAS BIBLIOGRÁFICAS
1. Ceconi C, Boraso A, Cargnoni A, Ferrari R. Oxidative stress in cardiovascular disease: myth or fact? Arch BiochemBiophys. 2003;420(2):217-21.
2. Pacheco-Palencia LA, Talcott ST, Safe S, Mertens-Talcott S. Absorption and biological activity of phytochemical-rich extracts from Açai (Euterpeoleracea Mart.) pulp and oil in vitro. J Agric Food Chem. 2008;56(10):3593-600.
3. Del Pozo-Insfran D, Percival SS, Talcott ST. Açai (Euterpeoleracea Mart.) polyphenolics in their glycoside and aglycone forms induce apoptosis of HL-60 leukemia cells. J Agric Food Chem. 2006;54(4):1222-9.
4. Ruxton C, Gardner E, Walker D. Can pure fruit and vegetable juices protect against cancer and cardiovascular disease too? A review of the evidence. International. J Food Sci Nut. 2006;57(3): 249-72.
5. Kuskoski M, Asuero A, Troncoso A. Aplicación de diversos métodos químicos para determinar actividad antioxidante en pulpa de frutos. Ciência Tecnol Aliment. 2005;25 (4):726-32.
6. Dhawan K, Dhawan S, Sharma A. 2004. Passiflora: a review update. J Ethnopharmacol. 2004;94(1):1-23.
7. Bernal JA, Díaz CA. Tecnología para el cultivo de la curuba. Medellín, Colombia: Ed. Litomadrid; 2005. p. 133-54.
8. Botero ML, Ricaurte S, Monsalve C, Rojano B. Capacidad reductora de 15 frutas tropicales. Scientia Tech. 2007;33(13):295-6.
9. Contreras-Calderón J, Calderón-Jaimes L, Guerra-Hernández E, García-Villanova B. Antioxidant capacity, phenolic content and vitamin C in pulp, peel and seed from 24 exotic fruits from Colombia. Food Research International. 2010;44(7):2047-53.
10. Rautenbach F, Venter I. Hydrophilic and lipophilic antioxidant capacity of commonly consumed South African fruits, vegetables, grains, legumes, fats/oils and beverages. J Food Composition Analysis. 2010;23(7):753-61.
11. Naranjo M, Vélez T, Rojano B. Actividad antioxidante de café colombiano de diferentes calidades. Rev Cubana Plant Med. 2011;16(2):164-73.
12. Debnath T, Park P, DebNath N, Samad NB, Park HW, Lim B O. Antioxidant activity of Gardenia jasminoides Ellis fruit extracts. Food Chemistry. 2011;128(3):697-703.
13. Hagerman A, Butler LG. Choosing appropriate methods and standards for assaying tannin. J Chem Ecol. 1989;15(6):1795-810.
14. Kelebek H, Serkan S, Ahmet C, Turgut C. HPLC determination of organic acids, sugars, phenolic compositions and antioxidant capacity of orange juice and orange wine made from a Turkish cv. Kosan. Microchemical J. 2009;91(2):187-92.
15. Petyaev IM, Hunt JV. Micellar acceleration of oxygen-dependent reactions and its potential use in the study of human low density lipoprotein. Biochimica Biophysica Acta (BBA) - Lipids and Lipid Metabolism. 1997;1345(3):293-305.
16. Barreca D, Bellocco E, Caristi C, Leuzzi U, Gattuso G. Flavonoid composition and antioxidant activity of juices from chinotto (Citrus myrtifolia Raf.) fruits at different ripening stages. J Agric Food Chem. 2010;58(5):3031-6.
17. Martín-Romero FJ. Contribution of culture media to oxidative stress and its effect on human oocytes. Reproductive BioMedicine Online. 2008;17(5) 652-61.
18. Yang XF, Guo XQ. Fe(II)EDTA chelate-induced aromatic hydroxylation of terephthalate as a new method for the evaluation of hydroxyl radical-scavenging ability The analyst. 2001;126(6):928-32.
19. Bisby RH, Brooke R, Navaratnam S. Effect of antioxidant Oxidation potential in the oxygen radical absorption capacity (ORAC) assay. Food Chemistry. 2008;108(3):1002-7.
20. Vasco C, Ruales J, Kamal-Eldin A. Total phenolic compounds and antioxidant capacities of major fruits from Ecuador. Food Chemistry. 2008;111(4):816-23.
21. Gu L, Kelm M, Hammerstone JF, Beecher G, Cunningham D, Vannozzi S, et al. Fractionation of polymeric procyanidins from lowbush blueberry and quantification of procyanidins in selected foods with an optimized normal-phase HPLC-MS fluorescent detection method. J Agric Food Chem. 2002;50(17):4852-60.
22. White BL, Howard LR, Prior RL. Proximate and polyphenolic characterization of cranberry pomace. J Agric Food Chem. 2010,58(7):4030-6.
23. Middleton EJR, Kandaswami C, Theoharidesl T. The effects of plant flavonoids on mammalian cells: Implications for inflammation, heart disease and cancer. Pharmacological Reviews. 2000;52(4):673-51.
24. Knekt P, Jarvinen R, Reunanen A, Maatela J. Flavonoid intake and coronary mortality in Finland: a cohort study. BMJ.1996;312(7029):478-81.
25. Biglari F, AlKarkhi AFM, Easa AM. Antioxidant activity and phenolic content of various date palms (Phoenix dactylifera) fruits from Iran. Food Chem. 2008;107(4):1636-41.
26. Biglari F, AlKarkhi AFM, Easa AM. Cluster analysis of antioxidant compounds in dates (Phoenix dactylifera): Effect of long-term cold storage. Food Chem. 2009;112(4):998-1001.
27. Zulueta A, Esteve MJ, Frígola A. ORAC and TEAC assays comparison to measure the antioxidant capacity of food products. Food Chemistry. 2009;114(1):310-6.
28. Wu X, Beecher G R, Holden JM, Haytowitz DB, Gebhardt SE, Prior RL. Lipophilic and hydrophilic antioxidant capacities of common foods in the United States. J Agric Food Chem. 2004;52(12):4026-37.
29. Kang J, Li Z, Wu T, Jensen GS, Schauss AG, Wu X. Antioxidant capacities of flavonoid compounds isolated from acai pulp (Euterpeoleracea Mart.). Food Chemistry. 2010;122(3):610-7.
30. Schinella G, Fantinelli JC,Tournier H, Prieto JM, Spegazzini E, Debenedetti S, Mosca SM. Antioxidant and cardioprotective effects of Ilex brasiliensis: A comparative study with Ilex paraguariensis (yerba mate). Food Research International. 2009;42(10):1403-9.
31. Schinella G, Troiani G, Dávila V, de Buschiazzo PM, Tournier HA. Antioxidant effects of an aqueous extract of Ilex paraguariensis. Biochemical Biophysical Research Communications. 2000;269(2):357-60.
Recibido: 27 de octubre de 2011.
Aprobado: 10 de junio de 2012.
Benjamín Rojano. Laboratorio de Ciencia de Alimentos. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias. A.A 3840, Medellín, Colombia. Teléf.: +57(4) 430 9381; Fax: +57(4) 430 9347. Correo electrónico: brojano@unal.edu.co