Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.20 no.4 Ciudad de la Habana oct.-dic. 2015
ARTÍCULO ORIGINAL
Eficacia de extractos vegetales sobre la garrapata adulta Rhipicephalus (Boophilus) microplus y su oviposición
Efficacy of plant extracts on the adult tick (Rhipicephalus Boophilus) microplus and oviposition
MSc. Carlos Eduardo Rodríguez Molano, Dr. Néstor Julián Pulido Suárez
Universidad Pedagógica y Tecnológica de Colombia. Tunja, Colombia.
RESUMEN
Introducción: se usó la Morus alba (L.) y la Gliricidia sepium como alternativa en el control in vitro de la garrapata adulta ( Rhipicephalus (Boophilus) microplus).
Objetivo: evaluar la eficacia del extracto de Morus alba y Gliricidia sepium en el control in vitro de la garrapata adulta ( Rhipicephalus (Boophilus) microplus) y su oviposición.
Métodos: las hojas de cada planta se sometieron a secado, que se utilizaron para la preparación del extracto hidroalcohólico, obtenido por el método de maceración. Los ensayos fueron in vitro, mediante la técnica de inmersión de adultas y se usó el extracto puro y la dilución 1:2. Se utilizaron garrapatas adultas que fueron expuestas a los extractos de cada planta. A las 24, 48, 72 y 96 h de exposición, se realizó la lectura de mortalidad, donde se tomó como mínimo eficaz, una mortalidad del 60 %. Para evaluar la inhibición de la oviposición se colocaron las garrapatas en posición dorsal en número de 10, sobre una caja de Petri, se realizó el pesaje de los huevos diario, pasados 15 días de este proceso. Se efectuaron pruebas cualitativas para determinar la presencia de metabolitos secundarios.
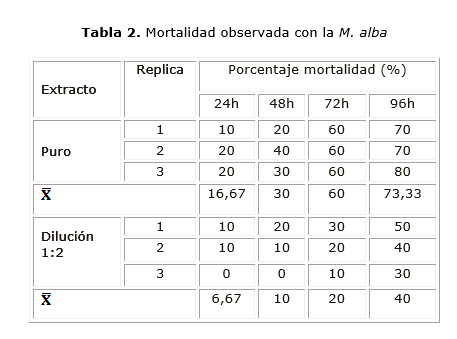
Resultados: el extracto puro de morera, mostró una mortalidad del 73,3 % y con la dilución 1:2, una mortalidad del 40 % y el extracto de matarratón, manifestó una mortalidad del 53,33 % en garrapata adulta. Para la inhibición de la oviposición el extracto puro de morera expuso 73,01 % de inhibición y para la dilución 1:2 reveló 26,21 % de inhibición y el matarratón mostró con el extracto puro una inhibición del 58 %.
Conclusiones: el extracto que presentó el mejor índice de mortalidad sobre Rhipicephalus (Boophilus) microplus e inhibición en la oviposición, fue el obtenido con la planta Morus alba y se encontró presencia de alcaloides y cumarinas.
Palabras clave: control biológico, Morus alba, Gliricidia sepium, Rhipicephalus (Boophilus) microplus, oviposición, metabolitos secundarios.
ABSTRACT
Introduction: the Morus alba (L.) and Gliricidia sepium was used as an alternative in vitro control of the adult tick (Rhipicephalus (Boophilus) microplus.
Objective: evaluate the efficacy of the extract of Morus alba and Gliricidia sepium in vitro control adult tick (Rhipicephalus (Boophilus) microplus) and oviposition.
Methods: the leaves of each plant was used dry, each plant extract and hydroalcoholic was obtained by maceration techniques. Assays were in vitro by immersion technique adult, pure extract and 1:2 dilution was used. Adult ticks that were exposed to extracts from each plant were used. at 24, 48, 72 and 96 h of exposure, performed the reading mortality, it was taken as effective minimum mortality of 60 %, to assess inhibition of oviposition ticks were placed in the dorsal position in number of 10 on a petri dish, weighing the eggs past day 15 was performed days of this process, the capacity of each extract was assessed inhibit oviposition. Qualitative tests were performed to determine the presence of secondary metabolites.
Results: pure mulberry extract showed a mortality of 73.3 % and 1:2 dilution with a mortality of 40 % and matarratón extract showed 53.33% mortality in adult tick; for inhibition of oviposition pure mulberry extract showed 73.01 % inhibition for 1:2 dilution and showed 26.21 % inhibition and the pure matarratón extract showed 58 % inhibition.
Conclusions: the extract showed the best mortality rate of Rhipicephalus (Boophilus) microplus and inhibition in oviposition was obtained with the Morus alba plant and presence of alkaloids and coumarins.
Key words: biological control, Morus alba, Gliricidia sepium, Rhipicephalus (Boophilus) microplus, oviposition, secondary metabolites.
INTRODUCCIÓN
La garrapata Rhipicephalus (Boophilus) microplus es un ectoparásito hematófago que se encuentra con frecuencia en bovinos, en lo principal, en regiones tropicales y subtropicales, y está distribuida en Colombia. Dentro de los efectos adversos producidos, se destaca la transmisión de microorganismos de los cuales es vector, como Babesia spp., y Anaplasma spp.; así mismo, induce anemia, daño de la piel y estrés; esto último conduce a anorexia, disminución de peso y pérdidas económicas en los sistemas de producción animal.1
A pesar de que en el ámbito mundial se han utilizado diferentes estrategias para controlar estos ectoparásitos, a través, del manejo integrado con control inmunológico por medio de vacunas, hongos, etc., el método más empleado incluye el tratamiento con compuestos químicos como piretroides, organofosforados, carbamatos. Sin embargo, el uso indiscriminado de estos fármacos ha favorecido su residualidad en diferentes componentes del ecosistema y la selección de poblaciones de garrapatas resistentes, hasta hacer ineficaz su uso
Según Pérez, cuando un acaricida es utilizado de manera intensiva, ocasiona una fuerte presión de selección que elimina los individuos susceptibles y el acaricida se convierte, en el agente de selección más importante. De hecho, el uso indistinto de ixodicidas ha contribuido al desarrollo de resistencia que corresponde a un proceso evolutivo que aparece por selección genética y que conduce a la ineficacia de los productos químicos.1
Adicional, el uso exagerado de ixodicidas, bajo un esquema de erradicación, genera mayor susceptibilidad a la anaplasmosis y tal vez la presencia de mayor número de cargas parasitarias, cuando la población de garrapatas aumenta por cualquier razón. Así mismo, el desarrollo de la resistencia a los ixodicidas, aumenta los costos requeridos para el control de las garrapatas, bien sea porque exige la asociación de productos o bien porque se deben utilizar dosis mayores. El método de control tradicional mediante el uso de acaricidas químicos, como es el caso de la ivermectina aunque ha sido exitoso, ha traído serios problemas de contaminación en la carne y la leche.1
En respuesta a esta problemática y buscando disminuir los costos que implica la creación de nuevas moléculas biológicas, activas, se ha despertado el interés por investigar la presencia de principios farmacológicos, en aquellas plantas que por tradición popular son reconocidas en estudios de etnobotánica como antiparasitarias
Lo anterior, determinó la necesidad de emplear extractos naturales en la lucha integral contra las garrapatas porque brinda un control efectivo y duradero, reduce el empleo de acaricidas sintéticos comerciales y por consiguiente, disminuye el gasto invertido en ellos, al tiempo que prolonga la vida útil de los compuestos acaricidas. Además, Luis Pérez sugiere reducir el volumen de residuos químicos que se vierten al medio y reducir la resistencia que la población de garrapatas presenta a los diferentes productos de origen químico; también reduce las pérdidas económicas por muerte del animal y los costos por tratamiento.1
Las dos plantas seleccionadas para la investigación Morus alba (morera) y Gliricidia sepium (matarratón); fueron seleccionadas en base a la tradición popular como insecticidas en el departamento de Boyacá – Colombia. Además, se tuvo en cuenta que dentro de su composición química, ambas tuvieran sustancias como alcaloides, taninos, cumarinas, saponinas, flavonoides o nicotina.
De acuerdo a lo anterior, el objetivo de este trabajo es determinar si los extractos hidroalcohólicos de Morus alba y la Gliciricidia sepium tienen efecto ixodicida en garrapatas Rhipicephalus (Boophilus) microplus.
MÉTODOS
Recolecta del material vegetal e identificación en herbario
El material fue colectado en Nuevo Colón, municipio que pertenece a la provincia de Márquez, Ventaquemada y Rondón, su cabecera está localizada a los 05° 21’ 30’’ de latitud norte y 73° 27’ 38’’ longitud oeste. A una altura sobre el nivel del mar de 2,500 metros; tienen una temperatura media de 16 °C, así como en el campus de la Universidad Pedagógica y Tecnológica de Colombia, ubicada en la ciudad de Tunja. La Ciudad de Tunja se encuentra localizada en el Valle del Alto Chicamocha, en la región del Altiplano Cundiboyacense, sobre la Cordillera Oriental de los Andes, en el centro del país, con una altura promedio de 2,820 msnm y su temperatura promedio es 12 °C.
El muestreo se hizo una vez localizadas las especies vegetales, donde se tomaron tres ejemplares de cada una, se preservaron en Etanol al 70 % y se llevaron a secado por tres días a 70 °C. Detrás, se realizó el etiquetado y montaje del mismo, donde se determinó y se incluyó a la colección de referencia del Herbario de la Universidad Pedagógica y Tecnológica de Colombia, Tunja; bajo la denominación de Néstor Julián Pulido Suárez (NJPS): [Morus alba L. NJPS 20923] y [Gliricidia Sepium NJPS 20930].
E laboración de extractos
Se tomaron cerca de 500 gr de Morus alba (morera) y Gliricidia Sepium (matarratón) y se transportaron bolsas de malla, para su posterior selección y conservación en el Laboratorio de Nutrición Animal de la Universidad Pedagógica y Tecnológica de Colombia (UPTC). Para la adecuada conservación se separaron las hojas (material a tener en cuenta) del resto de la planta, con la ayuda de unas tijeras y se distribuyeron semejante, envueltas en papel periódico. Luego se realizó el proceso de secado al aire libre bajo sombra, durante 20 días. En la noche el material vegetal fue recogido, se usó este método como alternativa de replicación para el pequeño productor campesino. Adicional, se tuvo que destapar, revolver y verificar cada una de las muestras, para evitar la presencia y desarrollo de hongos, por el grado de humedad de las hojas.
La obtención de los extractos de M. alba y G. sepium, se logró a través, del método de maceración, el cual consistió en:
· Se tomó 1 kg de material vegetal fresco y se secó al sol, sobre papel periódico.
· Se molieron las hojas secas en un molino y se obtuvieron así 500 gramos de material vegetal seco y molido.
· En un recipiente de vidrio con tapa y revestido con papel aluminio, se mezcló 1,5 litros de alcohol al 70 %, para la elaboración del extracto de morera y 1,5 litros de éter mono-etílico del Etilenglicol 99 %, para la elaboración del extracto de matarratón, y 1 litro de agua al respecto.
· A esta mezcla de alcohol y éter con agua mutua, se agregaron los 500 g de material molido. Se agitó y se dejó en reposo durante 10 a 15 días, se agitó a veces.
· Cumplido ese tiempo, se filtró la mezcla en un lienzo; se descartó el ripio y así se obtuvo el extracto, se conservó a una temperatura ambiente de entre 15 °C y 20 °C y en frascos color ámbar.2
Identificación cualitativa de los metabolitos secundarios
Con el fin de corroborar la presencia de metabolitos secundarios, a cada uno de los extractos puros, se les realizó pruebas cualitativas así:
· Prueba de Shinoda (flavonoides): la prueba cualitativa de los flavonoides se determinó tomando 2 mL de extracto y se le adicionó limaduras de magnesio, seguido de ácido clorhídrico concentrado, y se consideró positivo cuando el alcohol amílico se coloreó de amarillo, naranja, carmelita o rojo; intensos en todos los casos. Aunque no se conoce el mecanismo de esta prueba, es muy utilizada para reconocer esta clase de compuestos.3
· Reacción de espuma (saponinas): la presencia de saponinas se determinó tomando 2 mL de cada extracto, se le añadió 10 mL de agua a cada uno, se agitó por 30 segundos y se dejó en reposo durante 15 minutos en la muestra según Rondina.4 La proporción de saponinas se midió de acuerdo a la altura de la espuma sobrenadante así:
- Altura de menos de 5 mm = no se detectan saponinas.
- Altura de 5 – 9 mm = contenido bajo de saponinas.
- Altura de 10 – 14 mm = contenido moderado de saponinas.
- Altura mayor de 15 mm = contenido alto de saponinas.
· Prueba de Wagner (alcaloides): para la prueba cualitativa de alcaloides se empleó el reactivo de Wagner (yodo y yoduro de potasio), se tomaron 2 mL de extracto y se le agregó 2 gotas de reactivo Wagner, se agitó con una varilla de vidrio y se esperó un precipitado de color marrón.4
· Reacción legal (cumarinas): la presencia de cumarinas se determinó fácil, mediante la adición de 2 mL de solución de nitroprusiato de sodio al 0,5 %, y 2 gotas de hidróxido de potasio, cuando presentó un color amarillo al agitar el tubo de ensayo, la prueba es positiva.4
Recolección de Garrapatas y mantenimiento en laboratorio
En el municipio de Nuevo Colón, Boyacá, se buscaron bovinos infestados con garrapatas repletas de sangre (Teleoginas). La recolección se realizó de forma manual, una vez ubicada la garrapata, se tomó de la base y se haló de manera regular hasta desprender la garrapata, la totalidad de los especímenes se recogieron de la misma localidad.
Una vez desprendida, se colocó la garrapata en un frasco de vidrio adecuado para su transporte. En el laboratorio se revisaron una a una para desechar las muertas o mutiladas, como ya se mencionó; se lavaron y después se secaron con papel absorbente.
Evaluación del efecto ixodicida de los extractos puros y diluidos
La exposición de las garrapatas a los extractos, se hizo mediante, la prueba de inmersión de adultas. Para esto, en una caja de Petri se depositaron 5 mL del extracto a probar (puro o dilución), luego se colocaron allí las garrapatas (n = 10), las cuales se sumergieron completas, con la ayuda de una aguja punta roma, para evitar daño en la cutícula, permanecieron sumergidas durante 15 min. Completado este tiempo, se eliminó la totalidad del extracto, se dejó así, las garrapatas en un medio seco. A continuación las cajas se taparon con un lienzo y se rotularon, se indicó el nombre del extracto, la dilución y hora de exposición.5
La lectura de mortalidad se realizó a las 24, 48, 72 y 96 h. Se consideró como garrapatas muertas, aquellas que luego de una exposición a una fuente de calor por 10 minutos, mostró ausencia de movimientos en sus patas. Se tomó como valor mínimo de eficacia, una mortalidad del 60 %, por lo cual valores inferiores fueron tomados como ineficacia. En el trabajo se tomó como valor aceptado, una mortalidad no mayor al 10 % en los grupos control de lo contrario, se sospecharía de malos manejos del material biológico.6
Para probar los extractos, se utilizó como modelo experimental de mínimas y máximas de efectividad biológica, es decir la mínima concentración a la cual se consigue efectividad, a la par, la máxima concentración a la cual se consigue su efecto.6
Las diluciones se realizaron con agua destilada a partir del extracto puro de cada planta, se inició con una dilución 1:2 es decir 5 mL de extracto puro y 5 mL de agua destilada (solución) para completar los 10 mL de la dilución. Si superaba una mortalidad del 60 %, (tomada como mínimo eficaz) esta dilución se disminuyó a la mitad de la concentración, es decir, 2,5:10, así sucesivo, hasta que la dilución dejara de mostrar efectividad.
Se realizaron observaciones periódicas y se llevó un seguimiento de los datos; hasta el punto de poder calcular la eficacia de los extractos naturales en la supervivencia de las garrapatas, tanto de los grupos control como de los grupos experimentales, de la siguiente manera:
![]()
La eficacia de mortalidad en los diferentes extractos fue evaluada a través, de la mortalidad de teleoginas (B. microplus) del grupo control y de cada tratamiento con la siguiente formula.6

Para evaluar la eficacia en la oviposición, se empleó la prueba de eficacia de oviposición de las teleoginas, para ello las cajas de Petri con las garrapatas y los respectivos extractos, se colocaron en una incubadora (Memmert) a 27 °C y se controló la humedad con algodones húmedos en cada caja de Petri.
Cada una de las teleoginas se pesó en una balanza analítica y se les realizó la prueba de inmersión de adultas. Luego fueron colocadas en posición invertida de manera que su región dorsal quedara adherida, a una cinta adhesiva colocada a lo largo del borde exterior de una lámina portaobjeto, al cuidado de que la base del capítulo, coincida con el borde libre del conjunto, garrapata-cinta adhesiva, con la finalidad de permitir el libre movimiento de patas y capítulo, aspecto importante durante el proceso de oviposición.
Se colocaron las teleoginas en posición dorsal, en número de 10, sobre una caja de Petri. Esto permitió que una vez iniciado el proceso de oviposición, los huevos se depositen por gravedad, al fondo de la caja. Estas cajas fueron mantenidas en la incubadora y se realizó el pesaje de los huevos diarios, con una balanza analítica, se usó un pincel para evitar el daño de los mismos. Pasados 15 días de este proceso, se evaluó la capacidad de cada extracto de inhibir la oviposición, esta variable se midió con la fórmula recomendada por Drummond:7
% Inhibición de oviposición (IO) = (PLt / PLT - PHLt / PHLT) X 100
Dónde:
PLt = peso de hembras del lote tratado.
PLT = peso de hembras del lote testigo.
PHLt = peso de huevos del lote tratado.
PHLT = peso de huevos del lote testigo.
Análisis estadístico
Se realizó la prueba Chi2 para determinar si hay alguna diferencia entre los valores de porcentaje de mortalidad con M. alba en el extracto puro y su dilución y los porcentajes de mortalidad de G. sepium.
RESULTADOS
Pruebas cualitativas de los metabolitos secundarios
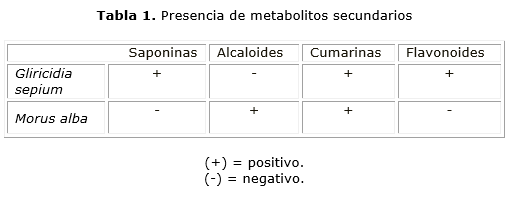
En lo que respecta al análisis cualitativo de metabolitos secundarios, se tuvo en cuenta el orden secuencial para el análisis colorimétrico hacia la identificación de saponinas, flavonoides, alcaloides y cumarinas. Se encontró que ambas plantas contienen cumarinas y que la presencia
de los demás metabolitos, cambió entre una y otra (tabla 1).
Eficacia ixodicida de la M. alba
Según lo planteado en el estudio el extracto de M. alba (morera), mostró la mayor eficacia sobre garrapatas hasta la dilución 1:2, observándose diferencias estadísticas, significativas con las pruebas con extracto puro (Ext. Puro) y la dilución 1:2 (tabla 2 ).
Se observó una mortalidad acumulada en aumento con el tratamiento con M. alaba, desde las 48 hasta las 96 h post- aplicación, en el extracto puro y sus diluciones. Se realizó la prueba Chi2 para determinar si hubo alguna diferencia entre los valores de porcentaje de mortalidad con M. alba en el extracto puro y su dilución.
Eficacia ixodicida de la G. sepium
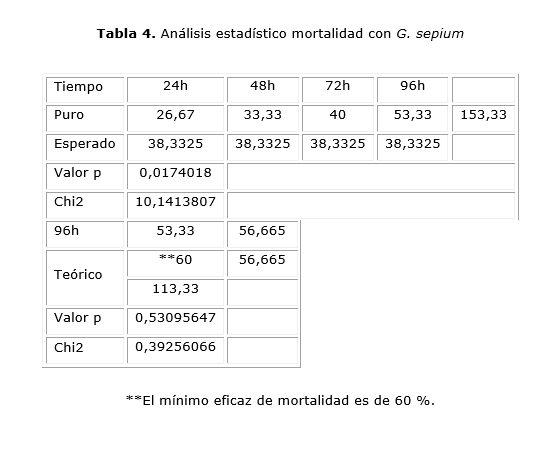
Al analizar el extracto de G. sepium (matarratón), se observó eficacia de mortalidad con el extracto de G. sepium, único, con el extracto puro (tabla 3).
Se observa una mortalidad acumulada del tratamiento con G. sepium con un aumento significativo en el extracto puro desde las 48 h post – aplicación. Se realizó la prueba Chi2 para determinar si hay alguna diferencia entre los valores de porcentaje de mortalidad con G. sepium.
El porcentaje y eficacia de mortalidad sobre el tratamiento con G. sepium no se observaron diferencias estadísticamente significativas (tabla 4).
Inhibición de oviposición de M. alba y G. sepium
Resultados de los grupos control
Durante el desarrollo de la investigación se realizó una prueba testigo, con un control positivo cipermetrina (diluciones según etiqueta), un control negativo con agua destilada, uno con alcohol al 70 %, uno con éter y uno sin ninguna sustancia. Para el caso de la cipermetrina se observó una mortalidad del 70 % y para los grupos control negativo, se observó una mortalidad no mayor al 10 %, esto indica que no intervinieron factores ambientales en la mortalidad de las garrapatas de los grupos tratados (tabla 5).
DISCUSIÓN
Por otra parte, en este estudio para el matarraton se encontraron saponinas, cumarinas y flavonoides, lo cual coincide con estudios fitoquímicos de Herath, en donde se identifica la presencia de flavonoides como son 7,4'-dihydroxy-3'- ethoxyisoflavan y otros isoflavonoides, isovertsol, formononetin, afrormosin y una pterocarpan y medicarpin.12
En el estudio de Serrano,13 se encontraron flavonoides y cumarinas, pero no alcaloides, ni saponinas, lo cual se puede explicar por los factores agroclimáticos ya mencionados, así como por la variedad de la planta y el tipo de material vegetal utilizado (hojas, tallos, flores, frutos y raíces).14,15
De acuerdo, que la eficacia de mortalidad mínima para este estudio fue de 60 %, se observa que los resultados no fueron los esperados, posible, porque según el análisis cualitativo de metabolitos, no hubo presencia de flavonoides, los cuales son sustancias que evitan o interrumpen el proceso de alimentación del insecto tras, un consumo inicial del extracto y conducen de esta manera a su muerte por inanición o intoxicación.16
Como ya se mencionó, se identificaron cumarinas en las muestras evaluadas de Morus alba, aunque algunos autores indican ausencia de este metabolito.10 Es así como se ha demostrado el efecto antiparasitario de las cumarinas extraídas de diferentes plantas, sobreSpodoptera frugiperda, Helicoverpa zea,17 con la anterior caracterización fitoquímica de la M. alba recolectada. Se concluye que los principales metabolitos secundarios de la planta son: alcaloides y cumarinas y podría considerarse en una fuente de principios activos que contribuyan al descubrimiento de ixodicidas, de origen natural, los cuales pueden ser utilizados como línea base para la síntesis de moléculas útiles a nivel farmacéutico.
Además, Alvarez,18 encontró que la actividad ixodicida de un extracto de Morus alba diluido en diclorometano fue mayor que la de un extracto diluido en agua, y afirma que las determinaciones de actividad ixodicida dependen del tipo de solvente usado y de la metodología empleada.
Con respecto a que G. sepium en este trabajo no fue eficaz, con lo que se puede pensar, que la planta no tiene capacidad ixodicida, o bien el extracto no logró superar la cutícula de la garrapata o la concentración mínima tóxica no fue alcanzada. Sin embargo, en otros casos los principios activos que contienen (alcaloides, cumarinas y flavonoides) tienen acción ixodicida.10
En estudios realizados con G. sepium sobre Hibiscus sabdariffa L., este extracto mostró ser eficaz cuando las plantas son tratadas con la aplicación del extracto acuoso de matarraton (G. sepium). La infestación promedio fue de 20,7 ± 7,6, con relación a las plantas no tratadas, que en promedio presentaron 79,2 ± 16,1.1
Al hacer una comparación de los resultados obtenidos, con lo reportado por Herath y colaboradores, quienes mencionan que los extractos obtenidos de la corteza del árbol de matarrata (G. sepium) a una concentración de 2,5 %, aplicada al cultivo de Jamaica,19 la mantiene libre de plagas que la dañan. Se confirma que la aplicación del extracto acuoso de matarraton disminuye la infestación por las plagas que dañan a este cultivo; por lo que resulta en un producto eficaz para contrarrestar los daños que los insectos le ocasionan a la planta de Jamaica.
De forma similar a lo encontrado con la Morus alba, en este estudio se encontró un efecto ixodicida acumulativo, expresado en una mayor mortalidad a medida que aumentaba el tiempo, después de la exposición inicial. Este comportamiento se ha observado en otros estudios realizados con los aceites de limoncillo por Heimerdinger,10 al evaluar los extractos etanólicos de esta planta (Cymbopogon citratus), sobre la garrapata Rhipicephalus (Boophilus) microplus, se encontró una mortalidad de 40,3 %, 41,5 % y 46,6 % durante los días 3, 7 y 14 post tratamiento al respecto.
A pesar que no se encuentran otros estudios sobre esta planta para el control de garrapatas, otras plantas medicinales de frecuente hallazgo en el departamento de Boyacá, han demostrado efecto ixodicida, como extracto puro y en diluciones similares a las utilizadas en este estudio. Dentro de dichas vegetaciones se destaca Nicotiana tabacum, Brugmasia arbórea, con mayor eficacia, seguidas por Sambucus nigra y Bidens pilosa.20 Igual, estudios realizados con las mismas plantas, para evaluar el efecto insecticida sobre la mosca Hematobian irritans, indican mayor eficacia para el tabaco, seguida por Brugmasia arbórea, y Sambucus nigran con menor eficacia, para Bidens pilosa y la Ambrosia cumarense, porque el extracto se obtuvo por el método Soxhlet, puesto que este se hace por extracción etanólica en frío.21
Tal como se indicó en los resultados, los porcentajes de mortalidad observados en los grupos control, determinan que el grupo positivo, en el cual el tratamiento se realizó con un ixodicida comercial a base de cipermetrina al 15 %, mostró una eficacia del 70 %. Ratificó, el poder ixodicida de dicho compuesto; los demás grupos control, en este estudio mostraron un porcentaje de mortalidad no superior al 10 %, la cual es aceptable y se justifica por la variación en las condiciones ambientales. Sin embargo, estos resultados permiten asegurar que las condiciones de laboratorio en las que se trabajó en este estudio, fueron adecuadas; igual, se considera que los solventes (agua, alcohol y éter), no causaron la mortalidad observada y que esta se debió al efecto de los metabolitos de las plantas evaluadas.
Mientras que el tratamiento control tuvo un porcentaje de inhibición del 0 %, lo que indica que estos artrópodos tienen una alta resistencia y adaptación al medio ambiente, aun en condiciones de laboratorio. Según Rodríguez,6 pueden llegar a pasar varios meses sin alimentarse, gracias a que poseen un exoesqueleto duro que recubre su cuerpo segmentado, protegiéndolas de las condiciones adversas.
Conforme, que los componentes activos de las plantas pueden variar por muchos factores, es recomendable la realización de trabajos similares, donde se evalúe la acción de estas plantas, y se utilice diferentes partes de la planta (hojas, raíces, frutos) y diferentes métodos extracción como, extracción en caliente (Soxleth), hidrolatos, infusión, etc.
Es así como, al comparar los resultados obtenidos con las dos plantas evaluadas, se puede concluir que en este estudio, M. alba presentó mayor eficacia contra las garrapatas, superó al tratamiento con G. sepium por cerca de un 20 % en la mortalidad.
REFERENCIAS BIBLIOGRÁFICAS
1. Pérez L, Palma C, Villegas R, Vega M, Pérez R. Metodología analítica y detección de residuos de ivermectina en muestras de leche de rebaños de la provincia de Ñuble. Chile: Archivos de medicina veterinaria. 2006;38(2):143-50.
2. Xu W, Xin F, Sha Y, Fang J, Li YS. Two new secoiridoid glycosides from Verbena officinalis. Journal of Asian natural products research. 2010 Ago;12(8).
3. Ming Jiuan W. Glossogyne tenuifolia acts to inhibit inflammatory mediator production in a macrophage cell line by downregulating LPS-induced NF-κB. Journal of Biomedical Science. 2004 Mar;11(2):186-99.
4. Serrano Gallardo LB. Actividad antiespasmódica de extractos de plantas medicinales en preparaciones de íleon de cobayo. Tesis de la Universidad Autónoma de Nuevo León; 2005.
5. Lurantos M, Medina J, Rondina R, Coussio J. Estudio fitoquímico de plantas indígenas argentinas. VIII. RIA. 1982;17(1).
6. Rodríguez Á, Rodríguez C, Cruz A. Efecto ixodicida de los extractos etanólicos de algunas plantas sobre garrapatas Rhipicephalus (Boophilus) microplus. Revista MVZ Córdoba. 2010 Ene;15(3).
7. Drummond R. Tick-borne livestock diseases and their vectors. Chemical control of ticks. World Animal Review. FAO. 1983;36:28-33.
8. Aragón García A, Torija Torres A, Avelleira Cortés R. Control de plagas de la jamaica (Hibiscus sabdariffa L.) con Gliricidia sepium (Jacq.) en Chiautla de Tapia, Puebla. Avances en Investigación Agropecuaria. 2008 Sep;12(3):33-42.
9. Maldoni B. Alkaloids: isolation and purification. Journal of chemical education. 1991 Ago;68(8):700.
10. Heimerdinger A, Olivo C, Molento M, Agnolin C, Ziech M, Scaravelli L, et al. Extrato alcoólico de capim-limão (Cymbopogon citratus) no controle de Boophilus microplus em bovinos. Jornal de Parasitologia Veterinária Brasileira = Revista Brasileira de Parasitología veterinária: orgão oficial do Brasileiro Colégio de Parasitologia Veterinária. 2005 dezembro;15(1):37-9.
11. Gutiérrez G, Villegas M. Efecto tóxico de Verbena officinalis (familia verbenaceae) en Sitophilus granarius (coleoptera: curculionidae). Revista Lasallista de Investigación. 2008;5(2).
12. Borges L, Sousa L, Barbosa C. Perspectivas para o uso de extratos vegetais para verificar os carrapato Rhipicephalus (Boophilus) microplus. Revista Brasileira de Parasitología Veterinária. 2011 junho;20(2):89-96.
13. Favari Perozzi L, Nava Álvarez R, Meléndez Camargo ME. Probable efecto hepatoprotector de la verbena en la hepatitis inducida con tetracloruro de carbono en la rata. Revista Mexicana de Ciencias Farmacéuticas. 2007;38(3):19-25.
14. Duan K, Yuan Z, Guo W, Meng Y, Cui Y, Kong D, et al. LC–MS/MS determination and pharmacokinetic study of five flavone components after solvent extraction/acid hydrolysis in rat plasma after oral administration of Verbena officinalis L extract. Journal of ethnopharmacology. 2011 May;135(2):201-8.
15. Drummond R, Ernst S, Trevino J, Gladney W, Graham O. Boophilus annulatus and B. microplus: Laboratory Tests of Insecticides. Journal of Economic Entomology. 1973 Feb;66(1):130-3.
16. Dowd PF, Berhow MA, Johnson ET. Differential activity of multiple saponins against omnivorous insects with varying feeding preferences. Journal of chemical ecology. 2011 May;37(5):443-9.
17. Bravo MJ, Coronado A, Henríquez H. Eficacia in vitro del amitraz sobre poblaciones de Boophilus microplus provenientes de explotaciones lecheras del estado Lara, Venezuela. Zootecnia Trop. 2008 Mar;26(1):35-40.
18. Álvarez V, Loaiza J, Bonilla R, Barrios M. Control in vitro de garrapatas (Boophilus microplus; Acari: Ixodidae) mediante extractos vegetales. Revista de Biología Tropical. 2008 Mar;56(1):291-302.
19. Herath H, Dassanayake R, Priyadarshani A, De Silva S, Wannigama G, Jamie J, et al. Los isoflavonoides y la Pterocarpano de Gliricidia sepium. Fitoquímica. 1998 Ene;47(1):117-9.
20. Ramírez A, Cruz Carrillo A, Rodríguez Molano C. Evaluación preliminar del efecto de los extractos etanólicos de cinco plantas medicinales sobre la mosca de los cuernos Haematobia irritans L.(Diptera: Muscidae). Revista UDCA Actualidad & Divulgación Científica. 2009;12(1):69-78.
21. Hernandez Villegas MM, Pérez Pérez C, de la Cruz Burelo P, Hernández Bolio GI, Bolio López GI. Efecto in vitro de hoja antihelmíntico metanólico extracto de Gliricidia sepium contra los nematodos gastrointestinale de ovejas. Tropicales y Subtropicales Agroecosistemas. 2014 Abr;17(1).
Recibido: 17 de agosto de 2014.
Aprobado: 31 de marzo de 2015.
Carlos Eduardo Rodríguez Molano. Grupo de Investigación en Bioquímica y Nutrición Animal-Universidad Pedagógica y Tecnológica de Colombia. Avenida Central del Norte. Tunja-Boyacá, Colombia.
Correo electrónico: ceromol@gmail.com