Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.21 no.2 Ciudad de la Habana abr.-jun. 2016
ARTÍCULO ORIGINAL
Atividade antimicrobiana de produtos obtidos de espécies de Piper (Piperaceae)
Actividad antimicrobiana de productos obtenidos a partir de especies de Piper (Piperaceae)
Antimicrobial activity of products obtained from Piper species (Piperaceae)
Harley da Silva Alves,I,II Wilma Raianny Vieira da Rocha,I,II Anna Flávia Costa Fernandes,II Luanne Eugênia Nunes,III Danielle Serafim Pinto,IV Jacqueline Irís Vasconcelos Costa,IV Maria Célia de Oliveira Chaves, IV Raïssa Mayer Ramalho CatãoI
I Departamento de Farmácia. Universidade Estadual da Paraíba. Campina Grande (PB), Brasil.
II Programa de Pós-Graduação em Ciências Farmacêuticas. Universidade Estadual da Paraíba, campus I. Campina Grande (PB). Brasil.
III Programa de Pós-Graduação em Ciências Farmacêuticas. Universidade Federal de Pernambuco. Recife (PE). Brasil.
IV Instituto de Pesquisa em Fármacos e Medicamentos. Universidade Federal da Paraíba. João Pessoa (PB). Brasil.
RESUMO
Introdução: espécies do gênero Piper são encontradas nas regiões tropicais do globo e possuem inúmeras indicações terapêuticas.
Objetivos: avaliar a atividade antimicrobiana de extratos e frações de quatro espécies de Piper, além de dois flavonoides isolados de Piper montealegreanum e determinar a concentração inibitória mínima dos produtos ativos.
Métodos: o material vegetal foi coletado em diferentes regiões do estado da Paraíba e na cidade de Belém (Pará) submetido à extração com etanol e partição com solventes em grau crescente de polaridade. Os flavonoides foram isolados por meio de técnicas cromatográficas. A avaliação da atividade antimicrobiana foi realizada pelo método de disco-difusão frente a três espécies bacterianas: Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922, Pseudomonas aeruginosa ATCC 27853 e três espécies fúngicas: Candida albicans ATCC 76645, Candida tropicalis ATCC 13803 e Candida glabrata ATCC 15545.
Resultados: quase metade dos produtos testados foi capaz de inibir o crescimento de S. aureus com halos de inibição variando entre 8-16 mm. O extrato etanólico bruto e as frações hexânica e CHCl3 das folhas de P. mollicomum mostraram atividade antibacteriana frente as três linhagens testadas. As frações hexânicas de P. arboreum, de P. caldense e de P. mollicomum apresentaram atividade antifúngica, enfatizando a formação do halo de inibição de 28 mm para a fração de P. mollicomum. Os dois flavonoides isolados de P. montealegreanum não apresentaram atividade antimicrobiana.
Conclusões: os resultados preliminares deste estudo sugerem que alguns dos produtos obtidos das espécies de Piper são uma fonte promissora de compostos com atividade antimicrobiana.
Palavras-chave: Piper; Staphylococcus aureus; Escherichia coli; Pseudomonas aeruginosa; gênero Candida.
RESUMEN
Introducción: el género Piper se encuentra en las regiones tropicales del mundo y numerosas indicaciones terapéuticas.
Objetivos: evaluar la actividad antimicrobiana de extractos y fracciones de cuatro especies de Piper, además de dos flavonoides aislados de Piper montealegreanum y determinar la concentración inhibitoria mínima de los productos activos.
Métodos: el material vegetal fue recolectado en diferentes regiones del estado de Paraíba y en Belém (Pará) y sometido a extracción con etanol y partición com disolventes en grado creciente de polaridad. Los flavonoides fueron aislados por medio de técnicas cromatográficas. La evaluación de la actividad antimicrobiana se realizó por el método de difusión en disco frente a tres especies bacterianas:Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922, Pseudomonas aeruginosa ATCC 27853 y três especies de hongos: Candida albicans ATCC 76645, Candida tropicalis ATCC 13803 y Candida glabrata ATCC 15545.
Resultados: casi la mitad de los productos ensayados fueron capaces de inhibir el crecimiento de S. aureus con zonas de inhibición entre 8-16 mm. Los extractos etanolicos crudo y fracciones hexano y CHCl3 de las hojas de P. mollicomum mostraron actividad antibacteriana contra todas las cepas probadas. Las fracciones hexano de P. arboreum, P. caldense y P. mollicomum mostraron actividad antifúngica, con énfasis en la zona de inhibición de 28 mm para la fracción de P. mollicomum. Los dos flavonoides aislados de P. montealegreanum no mostraron actividad antimicrobiana.
Conclusiones: los resultados preliminares de este estudio sugieren que algunos de los productos obtenidos de especies de Piper son una fuente prometedora de compuestos con actividad antimicrobiana.
Palabras clave: Piper; Staphylococcus aureus; Escherichia coli; Pseudomonas aeruginosa; género Candida.
ABSTRACT
Introduction: The species of the genus Piper are widely found in the tropical regions of the globe and have numerous therapeutic indications.
Objective: To evaluate the antimicrobial activity of extracts and fractions of four species of Piper and two flavonoids isolated from Piper montealegreanum and determine the minimum inhibitory concentration of the active products.
Methods: The plant material was collected in different regions of the state of Paraíba and in Belém (Pará) and subjected to extraction with ethanol and partition with solvents in increasing degree of polarity. Flavonoids were isolated through chromatographic techniques. The evaluation of antimicrobial activity was performed by disk diffusion method front the three bacterial species: Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922, Pseudomonas aeruginosa ATCC 27853 and three fungi species: Candida albicans ATCC 76645, Candida tropicalis ATCC 13803 and Candida glabrata ATCC 15545.
Results: Almost half of the products tested were able to inhibit the growth of S. aureus with inhibition zones between 8-16 mm. The crude ethanolic extract and hexane fractions and CHCl3 of P. mollicomum leaves showed antibacterial activity against all the tested strains. The hexane fractions of P. arboreum, P. caldense and P. mollicomum showed antifungal activity, emphasizing the formation of 28 mm inhibition zone for the fraction of P. mollicomum. The two flavonoids isolated from P. montealegreanum showed no antimicrobial activity.
Conclusions: preliminary results suggest that some the products obtained from Piper species are a promising source of compounds with antimicrobial activity.
Key words: Piper; Staphylococcus aureus; Escherichia coli; Pseudomonas aeruginosa; genus Candida.
INTRODUÇÃO
A família Piperaceae compreende, três mil espécies distribuídas em oito gêneros, dentre os quais se destacam os gêneros Piper e Peperomia. As plantas desses gêneros são arbustos, ervas e pequenas árvores. A família é muito importante como fonte de substâncias, devido ao seu potencial farmacológico. Pela ampla ocorrência e abundância no Brasil, várias espécies dessa família foram referidas por suas propriedades etnomedicinais.1,2
Dentre as várias atividades farmacológicas e biológicas registradas no gênero Piper ressalta-se a potente atividade antiplasmodial de flavonoides de P. hostmannianum,3 o efeito mutagênico de piplartina, um alcaloide isolado deP. tuberculatum,4 a atividade sedativa relacionada com a transmissão dopaminérgica e serotoninérgica deP. methysticum5 e o potencial fungitóxico sobre fungos fitopatogênicos do óleo essencial de Piper hispidinervum.6 Os extratos etanólicos e as fases hexânica e acetato de etila de P. arboreum mostraram atividade frente a cepas de Candida krusei, Candida parapsilosis e Cryptococcus neoformans.7 Estudos anteriores mostraram também atividade antibacteriana da fase acetato de etila de P. montealegreanum contra Bacillus subtilis, Pseudomonas aeruginosa e Escherichia coli. 8
Piper arboreum é utilizada pelas comunidades do Nordeste Brasileiro para o tratamento de doenças venéreas e infecções do trato urinário.9 Piper mollicomum é utilizada para o tratamento de distúrbios do trato gastrointestinal10 e Piper caldense para o alívio de dores de dente, como sedativo e antídoto para picadas de cobra.11 Não foi encontrado nenhum relato para o uso etnofarmacológico de Piper montealegreanum, apesar das atividades biológicas já registradas na literatura, como o efeito antibacteriano.8
A pesquisa por novos agentes farmacologicamente ativos, a partir de extratos de plantas com potencial antimicrobiano, tem levado a descoberta de drogas úteis que desempenham um papel importante no tratamento de doenças humanas.12 O estudo da resistência bacteriana é baseado em microrganismos de importância epidemiológica, tais como S. aureus, E. coli, P. aeruginosa e fungos leveduriformes, responsáveis por diferentes processos etiológicos tanto em pacientes imunocompetentes quanto em pacientes imunodeprimidos.13,14
Este trabalho teve por objetivo avaliar a atividade antimicrobiana e a concentração inibitória mínima de extratos, frações e compostos isolados de espécies do gênero Piper sobre micro-organismos de importância clínica.
MÉTODOS
As espécies vegetais utilizadas neste estudo, seus respectivos locais de coleta e identificação estão descritos na tabela 1.
As folhas de P. montealegreanum, de P. arboreum e de P. mollicomum e os caules de P. mollicomum e de P. caldense foram desidratados em estufa com circulação de ar sob temperatura média de 40 °C durante 96 h e, em seguida, triturados em moinho mecânico. Os materiais vegetais secos e moídos foram submetidos à maceração em etanol a 95 %, com renovação do solvente a cada três dias, repetindo-se o processo até extração exaustiva dos constituintes químicos.
Os extratos etanólicos brutos (EEBs) foram concentrados em evaporador rotativo sob pressão reduzida à temperatura de 50 °C. Em seguida, foram diluídos numa solução de metanol: água (7:3 - V:V) e particionados em solventes com polaridade crescente, seguindo a ordem: hexano, clorofórmio e acetato de etila. Para P. arboreum foi utilizado diclorometano na partição ao invés de clorofórmio. As concentrações iniciais dos extratos e fases obtidas estão descritas na tabela 2.
Para o fracionamento foram utilizados 13,5 g do EEB de P. montealegreanum Y; o EEB foi cromatografado em coluna utilizando-se como fase fixa Sephadex LH-20 (Sigma) e como eluentes MeOH e CHCl3, em gradiente decrescente de polaridade. Foram coletadas 12 frações em volumes de 100 mL cada, as quais foram analisadas por meio de cromatografia em camada delgada analítica (CCDA) e reunidas de acordo com semelhança dos valores dos seus fatores de retenção (RF).
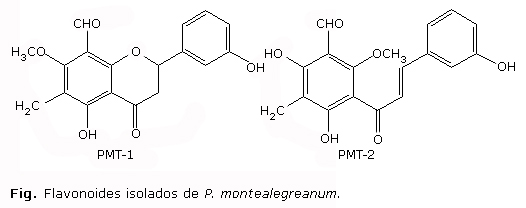
Das 12 frações iniciais obtidas, a fração 06 foi recromatografada em coluna com Sephadex LH-20 fornecendo 05 novas frações, das quais a fração 02 apresentou-se como cristais amarelos sendo codificada por Piper montealegreanum 1 (PMT-1) e a fração 03 forneceu uma mistura de PMT-1 e Piper montealegreanum 2 (PMT-2) (Fig.).
A elucidação estrutural de PMT-1 e das misturas de PMT-1 e PMT-2 foi realizada por meio de técnicas espectroscópicas: ressonância magnética nuclear de 1H e 13C, utilizando técnicas uni e bidimensionais, infravermelho, ultravioleta e espectroscopia de massas.15
O EEB, as fases e os flavonoides foram solubilizados em 1,0 mL do solvente correspondente à extração ou partição em banho de ultrassom (Ultrassonic 1440 A) por 15 min.
Os experimentos de atividade antimicrobiana das amostras foram realizados pelo método de difusão em meio sólido, de acordo com as normas doClinical and Laboratory Standarts Institute.16 As cepas bacterianas de S. aureus ATCC 25923, E. coli ATCC 25922 e P. aeruginosa ATCC 27853 foram inoculadas em caldo BHI (Difco®) e incubadas a 37 ºC por 24 h para reativação. Após esse período foram semeadas em Agar Müeller Hinton (Difco®) e incubadas nas mesmas condições anteriores de temperatura para crescimento e isolamento de colônias. O mesmo procedimento foi adotado para as cepas fúngicas de C. albicans ATCC 76645, C. tropicalis ATCC 13803 e C. glabrata ATCC 15545, que foram reativadas em caldo Sabouraud (Difco®) e semeadas em Agar Sabouraud (Difco®) e incubadas a 30 ºC por 24-48 h. Após o período, algumas colônias de cada crescimento microbiano foram transferidas para tubos de ensaio contendo 2,0 mL de solução salina estéril (NaCl 0,85 %), até atingir turbidez de 0,5 da escala de McFarland (equivalente a 1,5x108 UFC/mL). Os inóculos microbianos foram semeados por meio de swabs estéreis em placas de Petri contendo os meios Agar Müeller Hinton (Difco®) e Agar Sabouraud Dextrose (Difco®) para cepas bacterianas e fúngicas.
Para avaliação da atividade antimicrobiana e a determinação da concentração inibitória mínima (CIM), discos de papel de filtro estéreis (CECON®) foram embebidos com 20 μL das soluções das amostras (extratos, fases e flavonoides), contendo diferentes concentrações (tabela 2). As diluições foram realizadas com o mesmo solvente utilizado na preparação inicial das amostras. Os discos foram aplicados equidistantes sobre a superfície do ágar com auxílio de uma pinça estéril. As placas com cepas bacterianas foram incubadas em estufa a 37 ºC por 24 h e as com cepas fúngicas a 30 ºC por 24-48 h.
Como controle negativo foram utilizados todos os solventes envolvidos na solubilização das amostras, os quais também foram aplicados em discos estéreis e aplicados em superfícies de ágar contendo semeio microbiano, a fim de se observar uma possível interferência dos mesmos na ação dos produtos em estudo. Como controle positivo de atividade antimicrobiana foram utilizados discos de gentamicina (GEN-10 µg) e discos de fluconazol (FLU-10 µg) para as cepas bacterianas e fúngicas. Foram considerados ativos todos os produtos que apresentaram halos de inibição de crescimento microbiano ≥ 8 mm.17,18
RESULTADOS
Verificou-se que a amostra referente à mistura dos dois flavonoides PMT-1 e PMT-2, assim como a amostra que continha apenas PMT-1, não apresentaram atividade para as linhagens microbianas utilizadas neste estudo.
Na avaliação da atividade antimicrobiana, observou-se que o EEB e as fases CHCl3 e ACOEt de P. montealegreanum, a fração hexânica de P. arboreum, o EEB e a fração hexânica de P. caldense e as frações hexânica e CHCl3 de P. mollicomum apresentaram atividade antibacteriana frente a cepa de S. aureus ATCC 25923, formando halos de inibição de crescimento com diâmetros variáveis entre 8 e 16 mm (tabela 3). E em relação à determinação da atividade antifúngica, observou-se que as fases hexânicas de P. arboreum, de P. caldense e de P. mollicomum inibiram o crescimento de todas as linhagens de leveduras utilizadas nos ensaios (tabela 4).
Dentre os extratos e frações obtidas das folhas de P. mollicomum, foi possível observar que o EEB e a fração hexânica foram ativos frente às cepas de E.coli ATCC 25922 e S. aureus ATCC 25923. Além disso, a fração CHCl3 inibiu o crescimento tanto das cepas de S. aureus quanto das cepas de P. aeruginosa (tabela 3).
A CIM foi determinada, pela mesma metodologia, para as amostras consideradas ativas (halo ≥ 8 mm). Observou-se que apenas a fração hexânica de P. caldense mostrou-se ativa na concentração de 50 mg/mL, frente a cepa de S. aureus ATCC 25923. Os demais produtos apresentaram atividade apenas nas concentrações iniciais. A fase hexânica de P. arboreum [200 mg/mL] foi capaz de inibir o crescimento de C. albicans e de C. glabrata. Entretanto, frente a C. tropicalis só apresentou atividade na concentração de 400 mg/mL. As fases hexânicas de P. caldense e de P. mollicomum inibiram o crescimento das linhagens fúngicas testadas, destacando-se a atividade da fase hexânica de P. mollicomum [50 mg/mL] frente a C. tropicalis (tabela 4).
DISCUSSÃO
Para o tratamento de diversas infecções, muitas plantas são utilizadas no Brasil na forma de extrato bruto, infusões ou emplastros, sem nenhuma evidência científica de sua eficácia,19 sendo relevante a realização de estudos que confirmem determinadas ações farmacológicas evidenciadas empiricamente. Além disso, o uso de extratos como agente antimicrobiano, apresenta uma baixa possibilidade dos microrganismos adquirirem resistência à sua ação, porque são misturas complexas, fazendo com que a adaptabilidade microbiana seja dificultada.20
Conforme os resultados os compostos codificados por PMT-1 e PMT-2 não mostraram atividade pela técnica de disco de difusão, contudo é comum observar que os flavonoides geralmente são dotados de atividade antimicrobiana. Estudos preliminares21 mostraram que o composto 7-hidroxi-5,8-dimetoxiflavanona, flavonoide isolado de P. glandulosissimum, foi ativo contra cepas de Trichophyton mentagrophytes (LM 06), Microsporium canis (LM 828), S. aureus (ATCC 6528) e S. epidermidis (ATCC 12.228).
Estudos anteriores mostraram que PMT-1 e PMT-2 apresentaram atividade antibacteriana contra P. aeruginosa ATCC 8027 e P. aeruginosa ATCC 25619,8 contudo nestes ensaios, além da técnica de microdiluição, que favorece a difusão dos produtos-testes no meio, também foram utilizadas linhagens de Pseudomonas spp. diferentes, o que pode ter influenciado nos resultados.
O EEB e as frações hexânica e clorofórmica das folhas de P. mollicomum foram mais ativas quando em comparação com os demais produtos provenientes das outras espécies de Piper, haja vista que inibiram o crescimento das três espécies bacterianas ensaiadas (tabela 3). Segundo Cordova e outros,22 foi possível observar uma grande atividade dos extratos etanólicos brutos obtidos das folhas de P. mollicomum na inibição do crescimento bacteriano frente à Mycoplasma arginini, M. hominis e Ureaplasma urealyticum.
A formação dos maiores halos de inibição foi observada em conjunto pelos EEB e fração hexânica obtidos do caule de P. caldense e pela fração CHCl3 obtida das folhas de P. mollicomum. Estudos anteriores mostraram também que o EEB obtido das folhas de P. caldense inibiram o crescimento bacteriano, evidenciando a presença de substâncias químicas com atividade antimicrobiana tanto no caule quanto nas folhas.22 Nos estudos de Cordova e outros22 o EEB de P. caldense apresentou CIM de 2,5 mg/mL para Mycoplasma argininie de 5,0 mg/mL para M. hominis e Ureaplasma urealyticum. Entretanto, neste estudo, o valor detectado da CIM [50 mg/mL] foi bem superior, o que pode ser justificado por diversos fatores, destacando-se dentre eles, a parte botânica escolhida para obtenção do extrato, os tipos de solventes utilizados, a forma de extração dos produtos, e em especial as diferentes espécies microbianas testadas. Estes fatores isolados ou não podem influenciar na detecção da atividade antimicrobiana de produtos vegetais.23
Nos estudos realizados foi possível evidenciar que a fase clorofórmica de P. mollicomum promoveu a formação do maior halo de inibição (16 mm) frente à cepa de S. aureus e ainda mostrou atividade frente à cepa de P. aeruginosa (tabela 3). Esses dois gêneros microbianos distintos apresentam várias diferenças, principalmente, quanto à estruturação da parede e envoltórios celulares. Além do mais, Pseudomonas estão presentes em várias microbiotas, incluindo a microbiota vegetal. Dessa forma a presença dessas bactérias nas plantas pode ser responsável por processos de defesa e pela produção de metabólitos secundários que impeçam o dano ao tecido vegetal e que funcionem como agentes antibacterianos.24
Durante a triagem foi verificado que nueve amostras promoveram atividade frente à cepa de S. aureus. Esta cepa apresentou sensibilidade maior quando comparada com número de amostras que apresentou atividade sobre P. aeruginosa e E. coli (una amostra para cada cepa). Bactérias Gram positivas são mais sensíveis aos agentes antibióticos do que as Gram negativas.25 As bactérias Gram negativas apresentam uma membrana mais externa, que impediria a entrada de moléculas antibióticas, além de um espaço periplasmático que contém numerosas enzimas capazes de quebrar moléculas estranhas presentes no meio.26,27
Nos testes para se verificar a atividade antifúngica observou-se que as frações hexânicas de P. caldense, de P. arboreum e de P. mollicomum foram às únicas que inibiram o crescimento in vitro das leveduras analisadas. Vale salientar os diâmetros dos halos de inibição formados pela fase hexânica de P. caldense (tabela 4). Nas concentrações de 400 e 200 mg/mL formaram-se halos com diâmetros de 28 e 26 mm. A fração particionada obtida com o solvente hexano apresenta característica apolar e é caracterizada pela presença de metabólitos secundários como esteroides, acetofenonas e terpenoides.28 Os terpenoides, assim como os flavonoides, são dotados de atividade antimicrobiana por atuarem na defesa química das plantas contra fungos e bactérias.29
O estudo demonstrou que os extratos e as fases das espécies de Piper testadas nesse estudo apresentaram potencial antibacteriano e antifúngico frente às cepas ensaiadas, principalmente as fases hexânicas de P. arboreum, P. mollicomum e P. caldense que demonstraram uma atividade antifúngica relevante. Também não se pode considerar que os extratos e as fases particionadas que não apresentaram resultados positivos sejam desprovidos de atividade antimicrobiana, uma vez que a concentração dos produtos é um fator considerado determinante para a atividade. Além disso, a difusão dos produtos no meio sólido pode ter sido prejudicada, pois o ágar possui características hidrofílicas, impedindo, assim, a difusibilidade das amostras com características lipofílicas, levando a uma diminuição ou até mesmo ausência de atividade. Estudos futuros de isolamento e identificação dos metabólitos secundários estão sendo providenciados para se avaliar o potencial antimicrobiano dos constituintes dessas espécies.
Agradecimentos
Ao Programa de Iniciação Científica UEPB/CNPq.
Apoio Financeiro
Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes).
REFERÊNCIAS
1. Mabberley DJ. The plant-book: a portable dictionary of the higher plants. 1st ed. Cambrigde: Univ. Press, New York; 1997. p. 720.
2. Mendes LPM, Maciel KM, Vieira ABR, Mendonça LCV, Silva RMF, Rolim Neto PJ, et al. Atividade antimicrobiana de extratos etanólicos de Peperomia pelúcida e Portulaca pilosa. Rev Cienc Farm Básica Apl. 2011;32(1):121-5.
3. Portet B, Fabre N, Roumy V, Gornitzka H, Bourdy G, Chevalley S, et al. Activity-guided isolation of antiplasmodial dihydrochalcones and flavanones from Piper hostmannianum var berbicense. Phytochemistry. 2007;68(9):1312-20.
4. Bezerra DP, Moura DJ, Rosa RM, Vasconcellos MC, Silva AC, Moraes MO, et al. Evaluation of the genotoxicity of piplartine, an alkamide of P. tuberculatum in yeast and mammalian. Mutat Res. 2008;652(2):164-74.
5. Simões CMO (Org). Farmacognosia: da planta ao medicamento. 6. Ed. Porto Alegre: Editora UFRGS/UFSC; 2007. p. 1104.
6. Zacaroni LM, Cardoso MG, Souza PE, Pimentel FA, Guimarães LGL, Salgado AP, et al. Potencial fungitóxico do óleo essencial dePiper hispidinervum (pimenta longa) sobre os fungos fitopatogênicos Bipolaris sorokiniana, Fusarium oxysporum e Colletotrichum gloeosporioides. Acta Amaz. 2009;39(1):193-8.
7. Regasini LO, Cotinguiba F, Morandim AA, Kato MJ, Scorzoni L, Mendes-Giannini MJ, et al. Antimicrobial activity of Piper arboreum and Piper tuberculatum (Piperaceae) against opportunistic yeasts. Afr J Biotechnol. 2009;8(12):2866-70.
8. Pinto DS, Duarte FM, Costa JIV, Filho GGA, Alves HS, Chaves MCO, et al. Antibacterial and hemolytic activities from Piper montealegreanum Yuncker (Piperaceae). Anti-Infective Agents. 2012;10(1):1-5.
9. Agra MF, Silva KN, Basílio IJLD, França PF, Barbosa-Filho JM. Survey of medicinal plants used in the region Northeast of Brazil. Rev Bras Farmacogn. 2008;18:472-508.
10. Potrich FB, Baggio CH, Freitas CS, Mayer B, Santos AC, Twardowschy A, et al. Ação de extratos de plantas medicinais sobre a motilidade do trato gastrointestinal. Rev. Bras. Pl. Med. 2014;16(3):750-4.
11. Cardozo Junior EL, Chaves COM, Caldensin A New Natural N-Methylaristolactam from Piper caldense. Pharmac Biology. 2003;41:216-8.
12. Ramos DF, Leitão GG, Costa FN, Lisandra A, Villarreal JV, Leitão SG, et al. Investigation of the antimycobacterial activity of 36 plant extracts from the Atlantic Forest Brazilian. Braz J Pharm Sci. 2008;44(4):669-74.
13. Antunes RMP, Lima EO, Pereira MSV, Camara CA, Arruda TA, Catão RMR, et al. Atividade antimicrobiana "in vitro" e determinação da concentração inibitória mínima (CIM) de fitoconstituintes e produtos sintéticos sobre bactérias e fungos leveduriformes. Rev Bras Farmacogn. 2006;16(4):517-24.
14. Gonçalves DM, Araújo JHB, Francisco MS, Coelho MA, Franco JM. Avaliação da atividade antimicrobiana in vitro do extrato de Tabernaemontana catharinensis DC. Rev Bras Plantas Med. 2011;13(2):197-202.
15. Alves HS, Souza MFV, Chaves MCO. Three New Compounds from Piper montealegreanum Yuncker (Piperaceae). J Braz Chem Soc. 2011;22(8):1610-15.
16. Clinical and Laboratory Standards Institute. Method for antifungal disk diffusion susceptibility testing of yeasts: approved guideline M44-A2 CLSI, Wayne, PA, USA; 2010.
17. Catão RMR, Lima EO, Barbosa-Filho JM, Antunes RMP, Gutierrez SJC, Arruda TA, et al. Avaliação da atividade antimicrobiana de riparinas sobre cepas de Staphylococcus aureus e Escherichia coli multirresistentes. Rev Bras Anal Clin. 2007;37(4):247-9.
18. Parekh J, Chanda SV. In vitro antimicrobial activity and phytochemical analysis of some Indian medicinal plants. Turk J Pediatr. 2007;31:53-8.
19. Pessini GL, Holetz FB, Sanches NR, Cortez DAG, Dias Filho BP, Nakamura CV, et al. Avaliação da atividade antibacteriana e antifúngica de extratos de plantas utilizados na medicina popular. Rev Bras Farmacogn. 2003;13(1):21-4.
20. Souza DL, Tintino SR, Figueredo FG, Borges MCM, Braga MFBM, Felipe CFB, et al. Atividade antibacteriana e moduladora de Cecropia pachystachya Trécul sobre a ação de aminoglicosídeos. Rev cubana plantas med. 2014;19(1):121-32.
21. Santos FP, Alves HS, Lima EO, Chaves MCO. Flavonoides de Piper glandulosissimum Yuncker (Piperaceae). Quím Nova. 2015;38(2):172-7.
22. Cordova SM, Benfatti CS, Magina MDA, Guedes A, Cordova CMM. Análise da atividade antimicrobiana de extratos isolados de plantas nativas da flora brasileira frente a Mycoplasma arginini, M. hominiz e Ureaplasma urealyticum. Rev. Bras. Anal. Clin. 2010;42(4):241-4.
23. Martins TVF, Almeida PSVB, Oliveira LL, Amaro MOF, Dal Prá V, Mazutti M, et al. Atividade antibacteriana de Brassica oleracea var. capitata em modelos experimentais in vitro. Monografias ambientais. UFMS. 2012;9(9):2088-100.
24. Valéria CP, Zago HP, Norma G. Pseudomonas spp fluorescentes - Bactérias promotoras de crescimento de plantas e biocontroladoras de fitopatógenos em sistemas de produção agrícola. Embrapa-CNPAB. 2000;127:32.
25. Madigan M, Martinko J. The Bacteria In: Brock - Biology of Microorganisms 1st ed.: New Jersey: Prantice Hall; 2000. p. 718-814.
26. Pool-Zobel BL, Munzner R, Holzapfel WH. Antigenotoxic properties of lactic acid bacteria in the S. Typhimuriium antigenicity assay. Nutr Cancer. 1993;20(3):261-70.
27. Holley RA, Patel D. Improvement in shelf-life and safety of perishable foods by plant essential oils and smoke antimicrobials. Food Microbiol. 2005;22(4):273-92.
28. Chechinel FV, Yunes RA. Estratégias para a obtenção de compostos farmacologicamente ativos a partir de plantas medicinais. Conceitos sobre modificação estrutural para otimização da atividade. Quim. Nova. 1998;21(1):99-105.
29. Castro HG, Ferreira FA, Silva DJH, Mosquim PR. Contribuição ao estudo das plantas medicinais: metabólitos secundários. 1º ed. Viçosa: Editora Produção Independente; 2001. p. 113.
Recibido: 14 de abril de 2015.
Aprobado: 14 de mayo de 2015.
Harley da Silva Alves. Departamento de Farmácia. Universidade Estadual da Paraíba - UEPB. Rua Baraúnas, 351. Bairro Universitário. Campina Grande-PB, Brasil.
Correo eletrónico: harley.alves@hotmail.com