Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.21 no.2 Ciudad de la Habana abr.-jun. 2016
ARTÍCULO ORIGINAL
Identificación de metabolitos secundarios de Anredera vesicaria (Yuca hiedra)
Identification of secondary metabolites from Anredera vesicaria (Yuca Hiedra)
Mayren de la Cruz Frías,I Eugenio Torres Rodríguez,II José Ángel Morales León,II Robinson Hermosilla Espinosa,II René Hernández GonzálezIII
I Departamento de Biología-Geografía. Facultad de Ciencias Informáticas, Naturales y Exactas. Universidad de Granma. Cuba.
II Centro de Estudios de Química Aplicada. Facultad de Ciencias Informáticas, Naturales y Exactas. Universidad de Granma. Cuba.
III Departamento de Química. Facultad de Ciencias Informáticas, Naturales y Exactas. Universidad de Granma. Cuba.
RESUMEN
Introducción: Anredera vesicaria es una planta muy empleada en la región oriental de Cuba para tratar inflamaciones provocadas por golpes y fracturas, sin embargo, no existen datos de su composición química que justifiquen su uso como antiinflamatorio.
Objetivo: identificar metabolitos secundarios de interés medicinal en las hojas, tallos y rizomas de Anredera vesicaria.
Métodos: a la biomasa recolectada se le aplicó un proceso de lavado, desinfección, secado y pulverización. Un ejemplar fue identificado y consignado en la serie Catasús, número 2601. Muestras aéreas y subterráneas se sometieron a extracciones con agua y etanol usándose ultrasonido. A los extractos se les realizó tamizaje fitoquímico, cuyos resultados fueron corroborados por cromatografía de capa delgada y espectroscopía ultravioleta e infrarroja.
Resultados: se identificaron carbohidratos, fenoles, flavonoides, cumarinas, alcaloides, triterpenos, mucílagos y saponinas. En el extracto etanólico de las hojas se encontró la mayor diversidad de metabolitos secundarios, sin embargo, en los rizomas hay mayor abundancia de fenoles, esteroides y mucílagos. A partir de los rizomas se aisló un sólido blanco amorfo que fue identificado como ácido oleanólico.
Conclusiones: la abundancia de triterpenos y mucílagos en Anredera vesicaria podría contribuir con su actividad antiiflamatoria.
Palabras clave: Anredera vesicaria; tamizaje fitoquímico; ácido oleanólico; actividad antiinflamatoria.
ABSTRACT
Introduction: Anredera vesicaria is a plant very used in the East of Cuba to treat inflammations provoked by blows and fractures, however, data of the chemical composition that justify its use as antiinflamatory don't exist.
Objective: To Identify secondary metabolites with medicinal interest in the sheets, stems and rhizomes from Anredera vesicaria.
Methods: To the recollected biomass was applied a process of washing, disinfection, drying and pulverization. A sample was identified and consigned in the Catasús series, with number 2601. Aerial and subterranean samples submitted extractions with water and ethanol themselves using ultrasound. To the extracts were carried out the phytochemical screening whose results were corroborated by thin layer chromatography and ultraviolet and infrared spectroscopy.
Results: Carbohydrates, phenols, flavonoids, coumarins, alkaloids, triterpenes, mucilages and saponines were identified. In the ethanolic extract from leaves it was found the biggest diversity of secondary metabolites, however, in the rhizomes there are bigger abundance of phenols, steroids and mucilages. Starting from rhizomes was isolate an amorphous white solid which was identified as oleanolic acid.
Conclusions: The abundance of triterpenes and mucilages in Anredera vesicaria could to contribute with their anti-inflamatory activity.
Key words: Anredera vesicaria; phytochemical screening; oleanolic acid; anti-inflamatory actvity.
INTRODUCCIÓN
Anredera vesicaria, conocida como Yuca hiedra, es una planta rastrera perteneciente a la familia Basellaceae,1 es muy empleada en la región oriental de Cuba para tratar golpes, contusiones y para aliviar dolores causados por fracturas debido a sus acentuadas propiedades antiinflamatorias. Las partes más usadas son los rizomas, los que se tratan con etanol y se colocan sobre la región afectada en forma de cataplasma, obteniéndose magníficos resultados. En la revisión bibliográfica realizada sólo se encontró un artículo relacionado con la planta, en el que se reporta la presencia de esteroles.2 Para la realización de este estudio se tomó como referencia a la especie Anredera cordofolia que pertenece a la misma familia, para ella se reporta actividad antioxidante y antiinflamatoria, atribuidas a la presencia de triterpenos como el ácido oleanólico.3,4
En este trabajo se realiza un estudio de la composición química preliminar de cada una de las partes de la planta: hojas, tallos y rizomas, que pudiera contribuir a la justificación de su empleo en el tratamiento antiinflamatorio. El objetivo es identificar metabolitos secundarios de interés medicinal en las hojas, tallos y rizomas de Anredera vesicaria.
MÉTODOS
La biomasa fue recolectada en Palmas Altas, a 6 km de la ciudad de Manzanillo, a las 9:00 a.m. del 18 de septiembre de 2015, a una temperatura de 29 °C y se clasificó según NRSP 309 del MINSAP.5 La muestra vegetal fue desinfectada según un método reportado por varios autores.6-8
Un ejemplar de Anredera vesicaria fue identificado en el Herbario del Jardín Botánico Cupaynicú, situado en el municipio de Guisa, provincia Granma. Este trabajo estuvo a cargo del DrC. Luis Catasús, quien le asignó el código: Serie Catasús, número 2601.
El trabajo experimental fue desarrollado en el Laboratorio de Productos Naturales del Centro de Estudios de Química Aplicada de la Universidad de Granma. Se tomaron muestras de hojas, tallos y rizomas que se secaron durante una semana a la sombra sobre planchas de cartón perforadas, removiendo el material 2 veces por día; el secado se completó en una estufa con circulación de aire, a 40 °C durante tres h. La muestra fue pulverizada hasta obtener un tamaño de partícula de 0,5 mm de diámetro.
La obtención de los extractos se realizó en un baño ultrasónico9 a partir de las muestras secas y pulverizadas, empleándose agua y etanol como disolventes. El extracto etanólico de las hojas se mezcló con carbón activado y luego fue filtrado para eliminar la clorofila, cuya coloración interfiere en las determinaciones preliminares de la composición fitoquímica. En el caso de la extracción etanólica de los rizomas, las muestras fueron tratadas con cloroformo con el objetivo de eliminar lípidos y otros compuestos de naturaleza apolar extrema. Las disoluciones acuosas y etanólicas obtenidas fueron concentradas en un evaporador rotatorio y luego se les desarrolló tamizaje fitoquímico. Los reactivos y disolventes empleados fueron de calidad "puros" o "analíticos" provenientes de las firmas Merck y British Drug Houses (BDH).
Los resultados del tamizaje fitoquímico fueron corroborados mediante cromatografía de capa delgada (CCD) y espectroscopía ultravioleta (UV) e infrarroja (IR). La CCD se desarrolló en cromatofolios (Al) de gel de sílice 60 F 254 con espesor de capa 0,2 mm (Merck). El revelado de las placas se efectuó con una mezcla de anisaldehído y ácido sulfúrico.10 El espectro UV se obtuvo en un espectrofotómetro Rayleigh UV-2100, y el espectro IR se determinó en un espectrofotómetro Rayleigh WQF-510 FTIR.
RESULTADOS
Se obtuvieron extractos acuosos y etanólicos debido a que en estas formas la población elabora los preparados medicinales de la planta.
Se partió en cada caso de 200 g de material vegetal (hojas, tallos y rizomas) que fueron sometidos a extracciones con 500 mL de disolvente (agua destilada y etanol) bajo ultrasonido durante 2 h. A cada uno de los extractos obtenidos le fue practicado el tamizaje fitoquímico (tabla).
Identificación de glicósidos (Ensayo de Harborne)
En tres tubos de ensayos se colocaron 2 mL del extracto etanólico de hojas tallos y rizomas, a cada tubo se añadieron 3 gotas de HCl (c) y la mezcla se calentó en Baño de María durante 30 min. Cuando se añadió el reactivo de Fehling se observó la formación de un precipitado de cobre, lo que indica la presencia de glicósidos.
Aislamiento del ácido oleanólico
Fueron tratados 100 g de rizomas secos y pulverizados con 250 mL de éter de petróleo durante 2 h bajo la acción de ultrasonido. Después de separar el disolvente, el residuo se extrajo con 300 mL de etanol (70 %) durante 2 h bajo ultrasonido; la mezcla resultante se concentró y el residuo se trató con 50 mL de cloroformo, el sólido obtenido se precipitó en metanol. Los resultados de la CCD se muestran en la figura 1.
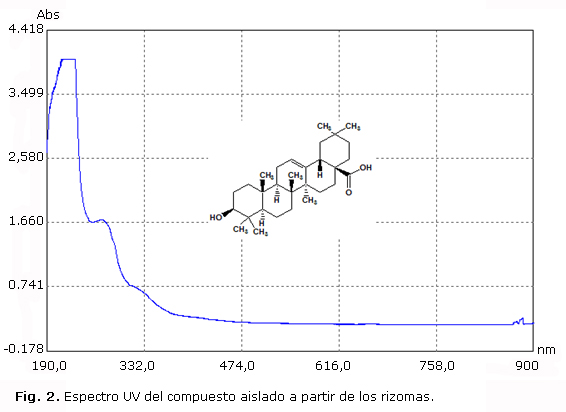
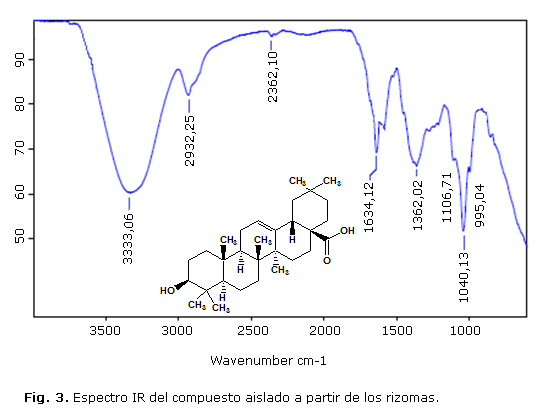
A partir de una muestra del sólido precipitado se obtuvieron los espectros UV e IR (Fig. 2 y 3).
DISCUSIÓN
En el tamizaje fitoquímico realizado (tabla) se identificaron carbohidratos, fenoles, flavonoides, cumarinas, alcaloides, triterpenos, mucílagos y saponinas. Existe mayor variabilidad de metabolitos secundarios en el extracto etanólico de las hojas, pero es en los rizomas donde se encuentran en mayor abundancia los compuestos fenólicos, los mucílagos y los triterpenos. Estos resultados justifican que sean los rizomas las partes más utilizadas de la planta, sin embargo, no explican su elevada actividad antiinflamatoria. La realización de ensayos adicionales permitió conocer la presencia de otros componentes. El ensayo de Molish indicó la presencia de carbohidratos, aunque en ninguna de las partes de la planta se detectaron carbohidratos reductores; esto unido al resultado positivo del ensayo para glicósidos11 y la identificación de triterpenos permitió inferir que los glicósidos existentes son de naturaleza esteroidal12 y que las agliconas pudieran ser el ácido oleanólico, el ácido ursólico, o ambos; los dos compuestos son potentes antiinflamatorios que están presentes en Anredera cordifolia, especie perteneciente a la misma familia que la planta estudiada.13 En el espectro UV del extracto etanólico de los rizomas (Fig. 2) se observa un pico con máximos de absorción de 1,70 y 4,0 en la región entre 332 y 190 nm, zona del espectro en la que aparecen los triterpenos,13 lo que permitió comprobar la presencia de esta clase de compuestos en la muestra estudiada.
En el IR (Fig. 3) se observa una banda ancha en 3333 cm-1, típica de un grupo OH carboxílico; una banda estrecha de intensidad media en 1634 cm-1, asignada al grupo carbonilo y una banda típica de grupos metilos geminales en 1362 cm-1, características espectroscópicas que se corresponden con la estructura del ácido oleanólico.14
Las constantes físicas,15 el resultado de CCD14 y los datos de los espectros UV e IR permiten confirmar que el compuesto aislado es el ácido oleanólico.
En el tamizaje fitoquímico realizado a hojas, tallos y rizomas de Anredera vesicaria se determinó la presencia de fenoles, flavonoides, alcaloides, triterpenos, esteroides, mucílagos y saponinas. El ácido oleanólico se encuentra en gran concentración en los rizomas y pudiera contribuir en gran medida a la elevada actividad antiinflamatoria de la planta.
Agradecimientos
A Willian Pérez Torres, estudiante de segundo año de Medicina Veterinaria, de la Facultad de Medicina Veterinaria, Universidad de Granma. Cuba.
Declaración de Conflicto de Intereses
El presente trabajo fue realizado por un grupo multidisciplinario compuestos por diferentes departamentos de la Universidad de Granma, los resultados obtenidos responden a una investigación conjunta, por lo que no existe conflicto de intereses entre ninguna de las partes involucradas.
REFERENCIAS BIBLIOGRÁFICAS
1. Roig JT. Diccionario botánico de nombres vulgares cubanos. T2. M-Z. 3ra ed. La Habana: Editorial Científico-Técnica; 1988:953-4.
2. Sihua X, Glenn W. Phytolaccaceae and Closely Related Families. Communications Lipids. 1990;25(4):230-4.
3. Ratna D, Wayudi PS, Wahono S, Hanafi M. Antioxidant Activity of Flavonoid from Anredera Cordifolia (Ten) Steenis Leaves. International Research Journal of Pharmacy. 2012;3(9):241-3.
4. Sri MA, Mimi S. Determination of Saponin Compound from Anredera cordifolia (Ten). Steenis Plant (Binahong) to Potential Treatment for Several Diseases. Journal of Agricultural Science. 2011;3(4):224-32.
5. Cuba. Ministerio de Salud Pública. NRSP No. 309. Medicamentos de origen vegetal: droga cruda. Métodos de ensayos. La Habana: MINSAP; 1992.
6. Carballo Guerra C. Desinfección química de Pedilanthus tithymaloides L. Poit. Rev Cubana Plant Med. [online]. 2005;10(2):0-0. ISSN 1028-4796. Disponible en: http://bvs.sld.cu/revistas/pla/vol10_2_05/pla12205.htm
7. Morales León JA, Fonseca García A, Almeida Saavedra M, Morales Torres G, Torres Rodríguez E. Tamizaje fitoquímico de Cassia uniflora Mill. Rev Cubana Plant Med. 2011;16(4):331-6.
8. Hermosilla Espinosa R, Almeida Saavedra M, Viera Tamayo Y, Morales León JA, Sánchez García Y, Gé Proenza Y, et al. Estudio fitoquímico y control de calidad de extractos de hojas de Rheedia aristata Griseb. Rev Cubana Plant Med. 2013;18(3):361-7.
9. Gangwal A, Parmar SK, Sheth NR. Triterpenoid, flavonoids and sterols from Lagenaria siceraria fruits. Der Pharmacia Lettre. 2010;2(1):307-17.
10. Torres E, Guillén S, Hermosilla R. Empleo de ultrasonido en la extracción de curcumina a partir de su fuente natural. Rev Cubana Plant Med. 2014;19(1):1-7.
11. Harborne JB. Phytochemical Method. London: Chapman and Hall, Ltd; 1973. p. 49-188.
12. Okwu HODE, Mbaeble BO. Phytochemical Constituents of Some Nigerian Medicinal Plants. African Journal of Biotechnology. 2005;4(7):685-8.
13. Chengyuan L, Zhiqiang L, Xinyu L, Yang G, Huihui S, Shunjun D, et al. The extract optimization and identification study of bioactive total triterpenoids from the rare traditional Chinese medicine Qinling Polyporusumbellatus. Journal Chem Pharm Research. 2014;6(6):1283-9.
14. Narendra V, Ameeta A. Isolation and Characterization of oleanolic acid from roots of Lantana Camara. Asian Journal Pharm Clinical Research. 2014;7(2):189-91.
15. Abcam. Oleanolic acid. Certificate of Analysis. 2012 [citado 6 Nov 2015]. Disponible en: http://www.abcam.com/Oleanolic-acid-ab141066.html
Recibido: 23 de noviembre de 2015.
Aprobado: 19 de febrero de 2016.
Eugenio Torres Rodríguez . Centro de Estudios de Química Aplicada. Facultad de Ciencias Informáticas, Naturales y Exactas. Universidad de Granma. Cuba.
Correo electrónico: etorresrodriguez@udg.co.cu