Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.22 no.1 Ciudad de la Habana ene.-mar. 2017
ARTÍCULO ORIGINAL
Tamizaje fitoquímico y actividad antibacteriana in vitro de extractos y fracciones de tres especies colombianas del género Hypericum
Phytochemical screening and in vitro antibacterial activity of extracts and fractions from three Colombian species of the genus Hypericum
Erika Andrea Plazas Gonzalez
Jardín Botánico de Bogotá "José Celestino Mutis". Colombia.
RESUMEN
Introducción: el género Hypericum se caracteriza por poseer gran importancia etnobotánica en diferentes culturas a nivel mundial lo cual ha impulsado los estudios para el aislamiento e identificación de metabolitos bioactivos.
Objetivo: realizar la caracterización fitoquímica preliminar y el estudio de actividad antibacteriana in vitro de extractos y fracciones de tres especies colombianas del género Hypericum.
Métodos: a partir de las hojas secas de Hypericum myricariifolium Hieron, Hypericum mexicanum L. e Hypericum juniperinum Kunth se obtuvieron los extractos etanólicos, se realizó el tamizaje fitoquímico preliminar y se obtuvieron fracciones de polaridad creciente (hexano, cloroformo, acetato de etilo y metanol). Se evaluó la actividad antibacteriana in vitro de extractos y fracciones por el ensayo de difusión en agar frente a Staphylococcus aureus (ATCC 29213), Staphylococcus epidermidis (ATCC 1228) y Escherichia coli (ATCC 8739). A las fracciones y extractos que presentaron mayor inhibición del crecimiento bacteriano se les determinó la CMI por el método de dilución en micropozos (SPOTi).
Resultados: el análisis fitoquímico preliminar mostró la posible presencia de esteroides, terpenos, fenoles, flavonoides y quinonas. Los extractos y fracciones de H. mexicanum y H. myricariifolium resultaron activos frente a todas las cepas con halos de inhibición superiores a 15 mm. El extracto de H. juniperinum presentó actividad frente la cepas gram-positivas. El extracto total y la fracción de hexano de H. mexicanum presentaron la mejor actividad frente a S. epidermidis con CMI de 0,05 mg/mL y 0,001 mg/mL respectivamente.
Conclusiones: la caracterización fitoquímica preliminar permitió determinar la presencia mayoritaria de metabolitos de tipo fenólico en los extractos de las 3 especies de estudio. Los extractos etanólicos y las fracciones de polaridad baja de estas especies poseen alta actividad inhibitoria frente a las bacterias gram-positivas (S. aureus y S. epidermidis) causantes de un gran número de infecciones cutáneas.
Palabras clave: actividad antibacteriana; Hypericum; Staphylococcus aureus; Staphylococcus epidermidis; Escherichia coli; CMI.
ABSTRACT
Introduction: The genus Hypericum has been awarded great ethnobotanical importance by various cultures worldwide, which has given an impulse to the conduct of studies aimed at isolating and identifying its bioactive metabolites.
Objective: Perform a preliminary phytochemical characterization and study the antibacterial activity in vitro of extracts and fractions from three Colombian species of the genus Hypericum.
Methods: Ethanolic extracts were obtained from dry leaves of Hypericum myricariifolium Hieron, Hypericum mexicanum L. and Hypericum juniperinum Kunth. Preliminary phytochemical screening was performed and increasing polarity fractions were obtained (hexane, chloroform, ethyl acetate and methanol). In vitro antibacterial activity of the extracts and fractions was evaluated with the agar diffusion test against Staphylococcus aureus (ATCC 29213), Staphylococcus epidermidis (ATCC 1228) and Escherichia coli (ATCC 8739). The MIC was determined for fractions and extracts displaying greater bacterial growth inhibition, using the microwell dilution method (SPOTi).
Results: Preliminary phytochemical analysis showed the possible presence of steroids, terpenes, phenols, flavonoids and quinones. Extracts and fractions of H. mexicanum and H. myricariifolium were active against all strains with inhibition haloes above 15 mm. The extract of H. juniperinum was active against gram-positive strains. The total extract and the hexane fraction of H. mexicanum displayed the best activity against S. epidermidis with an MIC of 0.05 mg/mL and 0.001 mg/mL, respectively.
Conclusions: Preliminary phytochemical characterization revealed the prevailing presence of phenolic metabolites in extracts of the three study species. Ethanolic extracts and low polarity fractions of these species exhibit high inhibitory activity against gram-positive bacteria (S. aureus and S. epidermidis) responsible for a large number of skin infections.
Keywords: antibacterial activity; Hypericum; Staphylococcus aureus; Staphylococcus epidermidis; Escherichia coli; MIC.
INTRODUCCIÓN
El género Hypericum también conocido Hierba de San Juan representa uno de los 100 géneros más grandes de angiospermas en el mundo cuenta con aproximadamente 450 especies de origen natural o introducido, distribuidas en zonas templadas del hemisferio norte y a gran altitud en zonas tropicales y subtropicales.1
Las especies del género Hypericum son usadas en la medicina tradicional de diferentes países alrededor del mundo para el tratamiento de la inflamación, infecciones bacterianas y virales, quemaduras y trastornos gástricos.2,3 La especie de mayor importancia tanto etnobotánica como farmacológica es Hypericum perforatum L. a partir de sus flores y parte aérea se preparan infusiones que se toman con fines sedativos y se aplican externamente en cataplasmas para tratar neuralgias.4,5 Europa y Estados Unidos se prescriben y comercializan extractos de flores de la especie H. perforatum como antidepresivos moderados.6,7 Otras especies de este género también han demostrado tener propiedades antidepresivas asociadas principalmente a la presencia de compuestos fenólicos.2,8
En Colombia existen poco reportes de los usos tradicionales de especies del género Hypericum. En las zonas rurales del Distrito Capital a partir de las hojas de la especie Hypericum mexicanum L. se obtienen decocciones para tratar problemas de los riñones y desinfectar heridas; además las raíces mezcladas con otras especies se toman para aliviar dolores.9
Los estudios químicos de especies del género Hypericum han permitido aislar e identificar mayoritariamente seis tipos de metabolitos secundarios que se caracterizan por la presencia de núcleos fenólicos. Entre ellos se encuentran quinonas de tipo naftodiantronas, derivados de floroglucinol, flavonoides y fenilpropanoides.10-13 Adicionalmente, en menor cantidad se ha determinado la presencia de taninos, xantonas y terpenos.10,14,15 Los metabolitos secundarios de las especies de este género varían considerablemente no solo en contenido, si no en tipo como respuesta a las condiciones ambientales.12,16
Los fenoles y flavonoides son los metabolitos secundarios bioactivos de mayor abundancia en especies del género Hypericum, se han aislado con rendimientos variables de 2 a 4 %. En extractos de H. perforatum se reporta la presencia de agliconas de flavonol como kaemferol, luteolina, myricetina y quercetina, así como glicosidos de flavonol como el hyperosido y ruteina que han presentado actividad espasmolítica y antidepresiva.17-19
Las especies del género Hypericum no solo se caracterizan por sus propiedades antidepresivas, en estudios recientes se ha determinado su potencial citotóxico y antimicrobiano frente a bacterias y hongos patógeno.20-23 Algunos estudios en extractos y fracciones de H. perforatum se ha centrado en su actividad antimicrobiana frente a cepas bacterianas y fúngicas. Diferentes componentes químicos como las antraquinonas, los flavonoides, los floroglucinoles prenilados, los taninos y los aceites esenciales han evidenciado actividad marcada y comparable con antibióticos comerciales, lo que ha conllevado a que actualmente se comercialicen varios tipos de preparaciones como, ungüentos, cremas, extractos y preparados para tratar heridas, como cicatrizantes, antivirales y antimicrobianos. Los únicos principios antibacterianos aislados hasta la fecha son la tetracetona y la hyperforina. Los estudios disponibles indican que esta especie tiene un mayor actividad antibacteriana contra las bacterias Gram-positivas que las bacterias Gram-negativas, y que la actividad principalmente se concentra en los extractos alcohólicos (metanol/etanol).24,25
Este trabajo tiene como objetico la caracterización fitoquímica preliminar y la evaluación de la actividad antibacteriana in vitro de los extractos etanólicos y las fracciones de polaridad creciente de tres especies del género Hypericum: Hypericum myricariifolium Hieron, Hypericum mexicanum L. y Hypericum juniperinum Kunth frente a tres bacterias patógenas S. aureus, S. epidermidis y E. coli.
MÉTODOS
Material vegetal
El material vegetal de tres especies del género Hypericum: H. mexicanum, H. juniperinum y H. myricariifolium fue colectado en la vía Usme-Sumapaz, Cuenca del río Curubital a 3542 m.s.n.m, en las coordenadas N 04'19.310' y w 074'12.400', el 29 de mayo de 2013. Los especímenes testigo reposan en el herbario de la Subdirección Científica del Jardín Botánico de Bogotá José Celestino Mutis con los números JBB10659, JBB00348 y JBB00350 respectivamente.
Obtención de extractos
El material vegetal de las especies H. mexicanum, H. juniperinum e H. myricariifolium colectado se separó en los diferentes órganos hojas, tallos y flores, se limpió y secó a temperatura ambiente durante 5 días. El material seco, se molió y pesó para someterlo a extracción por maceración con etanol del 96 % a temperatura ambiente. Los extractos resultantes se concentraron a presión reducida en el rotaevaporador. Se dejaron secar en la cabina de extracción y se pesaron para calcular el rendimiento de extracción.
Tamizaje fitoquímico preliminar
A partir de los extractos etanólicos se realizaron separaciones sucesivas empleando solventes de diferentes polaridades con el fin de agrupar los metabolitos estructuralmente semejantes en tres fracciones: ácida para el análisis de alcaloides, para ello se empelaron las pruebas de Dragendorff, Valser, Mayer y Wagner. En la fracción etérea se realizó el análisis de esteroides y terpenos, por medio de las pruebas de Salkowski, Liebermann y VAO. En la fracción etanólica desengrasada se hizo el análisis de fenoles y taninos (cloruro férrico, gelatina-sal), flavonoides (Shinoda y leucoantocianidinas), cumarinas (Erlich y Fluorescencia) y quinonas (comportamiento ácido-base). De esta forma fue posible caracterizar los grupos de compuestos, de acuerdo a su comportamiento químico, frente a reacciones cualitativas. Para corroborar los resultados, se emplearon controles positivos y negativos. Como control positivo se usó un extracto rico en metabolitos del tipo a analizar o un compuesto puro o patrón y como control negativo se usó ácido clorhídrico, éter de petróleo o etanol según el caso.26-28
Fraccionamiento de extractos
Los extractos etonólicos secos de hojas de las tres especies se sometieron a un fraccionamiento sólido-líquido con solventes de polaridad creciente: hexano, cloroformo, acetato de etilo y metanol.
50 g de extracto crudo de H. mexicanum, 50g de H. myriicariifolium y 20 g de H. juniperinum fueron puestos en contacto con hexano a temperatura ambiente, se agitó para homogenizar las fases y aumentar el área de extracción. El residuo líquido se filtró y el extracto sólido se extrajo nuevamente con hexano. Este procedimiento se realizó aproximadamente diez veces, hasta observar una disminución de la coloración en el solvente de extracción. Las fases de hexano se juntaron y se concentraron a presión reducida en el rotaevaporador. El extracto restante se dejó secar en la cabina de extracción para repetir el procedimiento anterior con cloroformo, acetato de etilo y metanol sucesivamente.
Ensayo de actividad antibacteriana
Los ensayos de actividad antibacteriana se realizaron empleando la bacteria Gram negativa: Escherichia coli (ATCC 8739) y las bacterias Gram positivas Staphylococcus aureus (ATCC 29213) y Staphylococcus epidermidis ATCC 1228, provenientes de cepas de control del laboratorio de microbiología de la Universidad Javeriana.
Para la determinación preliminar de la actividad antibacteriana se empleó el método de difusión en agar Muller-Hinton por medio de pozos de 3-5 mm de profundidad. El medio de cultivo fue inoculado con 10 µL/mL de suspensión microbiana en solución salina al 0,9 % (al 0,5 de la escala de Mac-Farland) correspondiente aproximadamente a 1,5 × 106 UFC/mL. Se pesaron 30 mg de extractos y fracciones de las tres especies del género Hypericum y se solubilizaron en dimetilsulfoxido (DMSO) a una concentración final de (30 mg/mL). En cada pozo se adicionaron 50 µL de los extractos y fracciones de prueba (1,5 mg), 50 µL de DMSO y 50 µL control positivo (cloranfenicol 100 µg/mL). Las cajas se sellaron y se incubaron a 36 °C durante 20 h. La actividad antibacteriana se determinó midiendo el diámetro de la zona de inhibición.29 Todos los ensayos se realizaron por triplicado.
Concentración Mínima Inhibitoria
Para la determinación de la concentración mínima inhibitoria (CMI) se empleó el método de inhibición del crecimiento a la gota (SPOTi-spot culture growth inhibition).30 Los extractos y fracciones de polaridad creciente las tres especies del género Hypericum se solubilizaron en DMSO a una concentración final de 300 mg/mL, a partir de la solución stock se hicieron seis diluciones seriadas. 100 µL de las soluciones se transfirieron a una placa de 24 pozos y se completó a 1000 µL con medio de cultivo (Muller-Hinton). Las concentraciones finales evaluadas fueron 30, 15, 10, 5, 2, 1, 0.5, 0.2, 0.1, 0,005 y 0.001 mg/mL. El inoculo de la bacteria fue preparado en solución salina a una concentración microbiana de aproximadamente 1.5 × 106 UFC/mL, comparando con el tubo 0,5 de la escala turbidimétrica de Mcfarland. Las placas secas se inocularon con una alícuota de 3μL de la solución bacteriana en el centro de cada pozo. Las placas se sellaron e incubaron durante 20 h a 36 °C. Se observó la inhibición del crecimiento a las diferentes concentraciones, tomando como CMI la concentración más baja a la cual se observó la inhibición del crecimiento del microorganismo. Como control negativo se usó DMSO.
Todas las determinaciones de la actividad antibacteriana se realizaron por triplicado y fueron analizados estadísticamente utilizando estimadores de media y dispersión del diámetro de la zona de inhibición con el programa estadístico statgraphics Plus. Los datos fueron analizados por un análisis de varianza ANOVA, las diferencias con p< 0,05 se consideraron estadísticamente significativas.
RESULTADOS
La extracción de las hojas secas de las tres especies de estudio se realizó de forma exhaustiva con el fin de determinar el rendimiento del proceso. Se observó mayor efectividad en la extracción con etanol con rendimientos superiores al 24 % en las hojas de H. myricarifolium y mexicanum, comparados con las hojas de H. juniperinum en donde le rendimiento fue muy inferior. Los extractos etanólicos de las tres especies son de color amarillento, con mayor intensidad rojiza en H. mexicanum. Tienen apariencia oleosa y olor frutal
Tamizaje fitoquímico preliminar
Para el análisis fitoquímico los extractos etanólicos de hojas de las tres especies fueron sometidos a extracciones con solventes con el fin de agrupar los metabolitos secundarios de acuerdo a sus características de polaridad y realizar los respectivos análisis cualitativos (tabla 1).
Por medio del análisis fitoquímico preliminar de los extractos de hojas de H. myricariifolium, H. juniperinum y H. mexicanum se identificó la presencia de metabolitos secundarios principalmente de tipo fenólico.
Fraccionamiento
Los extractos se fraccionaron con los solventes desde baja hasta alta polaridad comenzando con hexano y aumentando la polaridad gradualmente hasta llegar a metanol y se calculó el rendimiento del fraccionamiento (tabla 2).
En el fraccionamiento de los extractos etanólicos de las tres especies de estudio se observó un mayor rendimiento de extracción con metanol con porcentajes entre un 48 y 62 %, lo que indica que la mayor parte de los metabolitos presentes en el extracto crudo poseen polaridad alta. Los sub-extractos de baja polaridad como hexano y cloroformo poseen rendimientos cercanos en cada especie, sin embargo al comparar las tres se observa una mayor cantidad de metabolitos apolares en la especie H. mexicanum con un porcentaje superior al 40 % y una menor cantidad de metabolitos apolares en H. myricariifolium con un 20 %. En las tres especies se observa baja extracción en acetato de etilo con porcentajes entre el 5 y 10 %, lo que indica menor cantidad de metabolitos de polaridad media-alta, posiblemente porque gran parte se solubiliza preferiblemente en cloroformo o poseen polaridades mayores y se solubilizaron en metanol.
Actividad antibacteriana preliminar
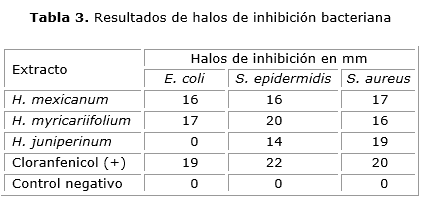
Se evaluó la actividad antibacteriana preliminar de los extractos etanólicos por el método de difusión en agar y se determinó midiendo el diámetro del halo de inhibición en cada caso. En la tabla 3 se presenta el promedio de los halos de inhibición en milimetros frente a E. coli, S. epidermidis y S. aureus.
El extracto etanólico de hojas de la especie H. myricariifolium evidenció altos porcentajes de inhibición (85-90 %) frente a las cepas evaluadas. La mayor inhibición se presentó frente aS. epidermidis con un porcentaje superior al 90 %, seguido por E. coli (89 %) y S. aureus (85 %). Las variaciones de la actividad no son significativas en las diferentes cepas por lo tanto se puede concluir que el extracto etanólico de esta especie posee un amplio espectro de actividad antibacteriana.
El extracto etanólico de hojas de la especie H. mexicanum resultó ser activo frente a las tres especies evaluadas. El mayor porcentaje de inhibición se presentó frente a S. aureus (90 %) seguido de E. coli (84 %) y S. epidermidis (73 %). El extracto etanólico de H. juniperinum presentó actividad frente a S. epidermidis con un porcentaje de inhibición del 95 %, actividad moderada frente a S. aureus (63 %) y resultó ser totalmente inactivo frente a E. coli.
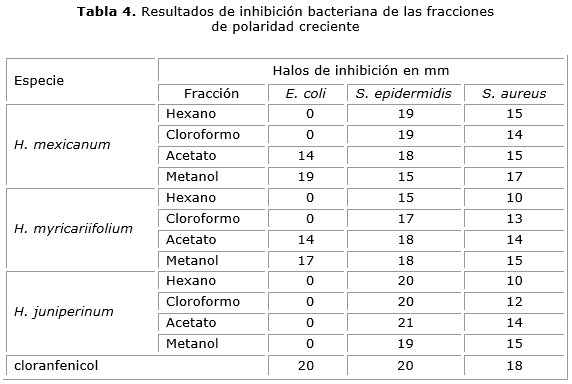
Con el fin de hacer una aproximación al tipo de compuestos responsables de la actividad de cada extracto, se realizó la evaluación de la actividad de las fracciones de polaridad creciente (Hexano, cloroformo, acetato de etilo y metanol) frente a las cepas en las que el porcentaje de inhibición fue superior a 70 %. En la tabla 4 se presentan los resultados de los halos de inhibición en milímetros frente a E. coli, S. epidermidis y S. aureus.
Las fracciones de baja polaridad de la especie H. mexicanum resultaron ser inactivas frente a E. coli, por lo tanto se puede concluir que la actividad del extracto etanólico se debe a la presencia de compuestos de polaridad alta solubles preferiblemente en acetato de etilo y metanol, en donde se obtuvieron porcentajes de inhibición de 70 y 95 % respectivamente. Todas las fracciones de esta especie inhibieron el crecimiento de S. aureus y S. epidermidis, los mayores porcentajes de inhibición (> 90 %) se obtuvieron frente a S. epidermidis.
Las fracciones apolares (hexano y cloroformo) de la especieH. myricariifolium no mostraron inhibición del crecimiento de E.coli, mientras que las fracciones de polaridad alta (acetato y metanol) fueron activas con porcentajes de 70 y 85 %.
Concentración mínima inhibitoria de extractos y fracciones
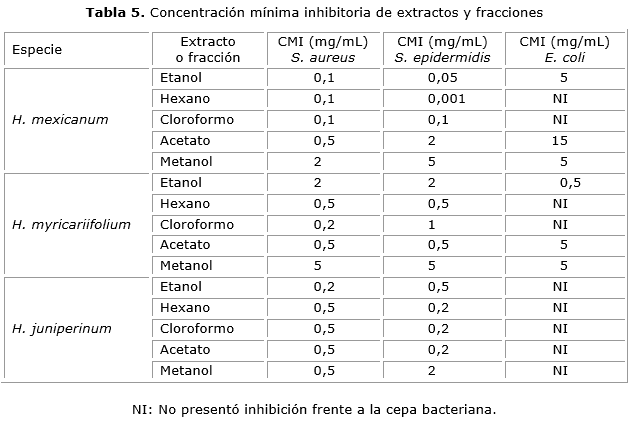
A los extractos y fracciones que presentaron porcentajes de inhibición superiores al 70 % en el ensayo de difusión en agar, se les determino la CMI frente a S. aureus, S. epidermidis y E. coli. Los resultados de CMI de los extractos totales y las fracciones de polaridad creciente de las tres especies de estudio frente a E. coli, S. epidermidis y S. aureus se compilan en la tabla 5.
DISCUSIÓN
De acuerdo con lo reportado en estudios previos los colores amarillos o rojizos en los extractos de especies del género Hypericum se atribuyen a la presencia de quinonas (naftodiantronas), floroglucionoles y/o flavonoides; lo cual coincide con los resultados obtenidos en el tamizaje cualitativo. De esta forma es posible inferir la posible presencia de metabolitos secundarios con núcleo fenólico como: flavonoides, taninos y quinonas en las especies de estudio. Estos resultados son el primer reporte de composición química para las especies de estudio y están en concordancia los reportes previos del género Hypericum.24 Aunque no se tienen reportes del aislamiento de quinonas en especies colombianas cabe resaltar que la producción de metabolitos secundarios en las especies de este género se encuentra altamente influenciada por la adaptación bioquímica de las especies las condiciones ambientales,31,32 así que no es posible descartar la presencia o ausencia de quinonas; por lo tanto nuestros resultados solo permiten suponer la posible presencia de metabolitos secundarios con núcleos fenólicos.
En el ensayo preliminar de actividad antibacteriana se observó que los extractos de H. mexicanum y H. myricariifolium fueron activos frente a todas las cepas ensayadas, siendo el segundo el más activo. Sin embargo, el extracto de H. juniperinum no inhibió el crecimiento de la cepa Gram-negativa (E. coli), este comportamiento había sido previamente reportado en otras especies de este género.22,23
Al realizar el fraccionamiento con solventes se agrupan los metabolitos secundarios de acuerdo a sus características estructurales y de polaridad, de esta forma es posible determinar qué tipo de compuestos son responsables de la actividad en los extractos totales. En este caso se observó que las fracciones de baja polaridad no poseen actividad frente a E. coli, esta cepa bacteriana fue susceptible a compuestos de polaridad alta, solubles en acetato de etilo y metanol que pueden poseer un gran número de grupos funcionales polares o a estar en forma de glicosidos.
El estudio de actividad antibacteriana fue realizado empleando tres bacterias patógenas en humanos, dos bacterias Gram-positivas, S. aureus y S. peidermidis y una Gram-negativa, E. coli. Los resultados inhibición empelando las técnicas de difusión en agar y dilución en micropozos permitieron observar que las especies de estudio presentan mayor actividad en la inhibición bacteriana frente a las bacterias Gram positivas. La principal diferencia que existe entre estas bacterias es la composición de la pared celular. Las bacterias G+ poseen una pared celular interna y una pared de peptidoglucano. Por otro lado las bacterias G- poseen una pared celular de mayor complejidad con una pared celular interna, la pared de peptidoglucano y una bicapa lipídica externa o membrana externa que forma un saco rígido alrededor de la bacteria, lo que constituye una barrera impermeable a macromoléculas y le ofrece protección en condiciones adversas.33 Debido a las diferencias celulares de las bacterias G+ y G- es posible suponer que los compuestos presentes en los extractos y fracciones de las especies de estudio pudieron permear más fácilmente la pared celular en S. aureus y S. epidermidis afectando la reproducción y supervivencia del organismo, lo que no ocurrio con E. coli.
La mayor actividad la presentaron el extracto total y la fracción de hexano de H. mexicanum frente a S. epidermidis, con CMI de 0,05 mg/mL y 0,001 mg/mL respectivamente, al comprar estos resultados con los reportados para la especie H. perforatum en donde los extractos de éter de petróleo y cloroformo presentaron CMI de 0,05 mg/mL frente a esta bacteria, se observa la misma actividad en el extracto total y mayor para la fracción de hexano de la especie de estudio.
El extracto total y las fracciones de hexano y cloroformo de la especie H. mexicanum mostraron la mayor actividad inhibitoria frente a la bacteria S. aureus con CMI de 0,1 mg/mL. En estudios de la actividad antibacteriana de la especie H. perforatum estos extractos presentaron CMI de 0,31 mg/mL24 de acuerdo a estos resultados se observa mayor actividad en los extractos y fracciones de las especies colombianas estudiadas.
Los resultados del estudio de actividad antibacteriana de extractos y fracciones de polaridad creciente de tres las tres especies del género Hypericum permiten concluir que los extractos totales y algunas fracciones poseen alta actividad inhibitoria frente a las bacterias gram-positivas (S. aureus y S. epidermidis) causantes de un gran número de infecciones cutáneas. Por otro lado los extractos y fracciones presentaron menor actividad frente a la bacteria gram-negativa usada (E. coli), de los extractos y fracciones evaluadas solamente el extracto etanólico de hojas de H. myricariifolium logró alta inhibición de E. coli a una baja concentración, sin embargo con el fraccionamiento la actividad disminuyó, indicando que la inhibición se debe a un efecto sinérgico de todos los compuestos presentes en el extracto total. Estos resultados permiten comprobar los usos tradicionales que se asocian a especies del género Hypericum en las zonas rurales del Distrito Capital, en donde se reporta que se obtienen diferentes preparaciones de estas especies para tratar infecciones cutáneas o heridas infectadas.9
De acuerdo a los resultados obtenidos en el estudio de actividad antibacteriana de las tres especies colombianas del género Hypericum se recomienda realizar estudios biodirigidos de las fracciones de polaridad media-alta frente a las bacterias gram-positivas para aislar e identificar los metabolitos activos.
REFERENCIAS BIBLIOGRÁFICAS
1. Sánchez MA, Aldasoro JJ, Sanmartín I. Bayesian inference of phylogeny, morphology and range evolution reveals a complex evolutionary history in St. John´s wort (Hypericum). Mol Phylogenet Evol . 2013;67(1):379-403.
2. Dutra RC. Campos MM. Santos AR. Calixto JB. Medicinal plants in Brazil: Pharmacological studies, drug discovery, challenges and perspectives. Pharmacolgical Research. 2016;112(1):4-29.
3. Marrelli M, Statti G, Conforti F, Menichini F. New Potential Pharmaceutical Applications of Hypericum Species. Mini Reviews in Medicinal Chemistry. 2016;16(9):710-20.
4. Schmidt M, Butterweck V. The mechanisms of action of St. John's wort: an update. Wien. Med. Wochenschr. 2015;165(11-12):229-35.
5. Sosa S. Topical anti-inflammatory activity of extracts and compounds from Hypericum perforatum L. J Pharm Pharmacol. 2007;59(5):703-9.
6. Bongiorno P, LoGiudice P. Hypericum for Depression. Nat. Med. Journal. 2010;12(2):3-9.
7. Tatsis EC, Boeren S, Exarchou V, Troganis AN, Vervoort J, Gerothanassis IP. Identification of the major constituents of Hypericum perforatum by LC/SPE/NMR and/or LC/MS. Phytochemistry. 2007;68(1):383-93.
8. Daudt R, von Poser GL, Neves G, Rates SM. Screening for the antidepressant activity of some species of Hypericum from South Brazil. Phytother Res. 2000;14(5):344-6.
9. Gutierrez OM, Pineda FM, Garcia AX. Las maticas de mi región. Bogotá: Jardín Botánico de Bogotá. 2011.
10. Crockett SL, Robson NK. Taxonomy and chemotaxonomy of genus Hypericum. Medicinal and Aromatic Plants Science and Biotechnology. 2011;5(1):1-13.
11. Ferraz A, Bordignon S, Mans DR, Schmitt A, Ravazzolo AP, Poser GL. Screening for the presence of hypericins in Southern Brazilian species of Hypericum. Pharmaceutical Biology. 2002;40(4):294-7.
12. Çirak C, Radusiene J, Ivanauskas L, Jakstas V, Çamas N. Phenological changes in the chemical content of wild and greenhouse-grown Hypericum pruinatum: flavonoids. Turkish Journal of Agriculture and Forestry. 2014;38(3):362-70.
13. Çirak C, Radusiene J, Jakstas V, Ivanauskas L, Seyis F, Yayla F. Secondary metabolites of seven Hypericum species growing in Turkey. Pharmaceutical biology. 2016;54(10):2244-53.
14. Tanaka N, Yano Y, Tatano Y, Kashiwada Y. Hypatulins A. Meroterpenes from Hypericum patulum. Organic Letters. 2016;18(20):5360-3.
15. Xu WJ, Li RJ, Quasie O, Yang MH, Kong LY, Luo J. Polyprenylated Tetraoxygenated Xanthones from the Roots of Hypericum monogynum and Their Neuroprotective Activities. J. Nat. Prod. 2016;79(8):1971-81.
16. Çirak C, Radusiene J, Jakstas V, Ivanauskas L, Seyis F, Yayla F. Altitudinal changes in secondary metabolite contents of Hypericum androsaemum and Hypericum polyphyllum. Biochem. Syst. Ecol. 2017;70:108-15.
17. Verma V, Smelcerovic A, Zuehlke S, Hussain MA., Ahmad SM, Ziebach T, et al. Phenolic constituents and genetic profile of Hypericum perforatum L. from India. Biochem. Syst. Ecol. 2008; 36:201-6.
18. de Matos NJ, Santos PP, de Loreto SA, Rech SB, Lino G. Phenolic compounds in Hypericum species from the Trigynobrathys section. Biochem. Syst. Ecol. 2010;38:224-8.
19. Guan LP, Liu BY. Antidepressant-like effects and mechanisms of flavonoids and related analogues. Eur. J. Med. Chem. 2016;121:47-57.
20. Aztopal N, Erkisa M, Celikler S, Ulukaya E, Ari F. Antigrowth and Apoptosis Inducing Effects of Hypericum Olympicum L. and Hypericum Adenotrichum Spach. On Lung Cancer Cells In Vitro: Involvement of DNA Damage. Journal of Food Biochemistry. 2016;40(4):559-66.
21. Dulger G, Dulger B. Antifungal activity of Hypericum havvae against some medical Candida yeast and Cryptococcus species. Tropical Journal of Pharmaceutical Research. 2014;13(3):405-8.
22. Nogueira T, Medeiros MA, Marcelo MJ, García BE, Luna J, Costa MC. Profile of antimicrobial potential of fifteen Hypericum species from Portugal. Industrial Crops and Products. 2013;47:126-31.
23. Dall'Agnol R, Ferraz A, Bernardi AP, Albring D, Nör C, Sarmento L, et al. Antimicrobial activity of some Hypericum species. Phytomedicine. 2003;10(6):511-6.
24. Saddiqe Z, Naeem I, Maimoona A. A review of the antibacterial activity of Hypericum perforatum L. J. of Ethnopharma. 2010;131(1):511-21.
25. Süntar I, Oyardı O, Akkol EK, Ozçelik B. Antimicrobial effect of the extracts from Hypericum perforatum against oral bacteria and biofilm formation. Pharmaceutical biology. 2016;54(6):1065-70.
26. Sanabria A. Análisis fitoquímico preliminar. Metodología y su aplicación en la evaluación de 40 plantas de la familia Compositeae. Bogotá: Facultad de Ciencias, Departamento de Farmacia, Universidad Nacional de Colombia. 1983.
27. Bilbao M. Investigación fitoquímica. Pereira: Universidad del Quindío. Facultad de Ciencias Básicas y tecnológicas. Programa de Química de Productos Vegetales. 1994.
28. Merck E. Reactivos de coloración para cromatografía en capa fina y en papel. Darmstadt. R. F. Alemania: Merck. 2000.
29. Valgas C, Machado SS, Smânia EF, Smânia AJ. Screening methods to determine antibacterial activity of natural products. Brazilian J. of Microbiol. 2007;38(1):369-80.
30. Guzman JD, Gupta A, Evangelopoulos D, Basavannacharya C, Pabon LC, Plazas EA, et al. Anti-tubercular screening of natural products from Colombian plants: 3-methoxynordomesticine, an inhibitor of MurE ligase of Mycobacterium tuberculosis. J. Antimicrob. Chemother. 2010;65(10):2101-7.
31. Hosni K, Msaada K, Taârit MB, Marzouk B. Phenological variations of secondary metabolites from Hypericum triquetrifolium Turra. Biochem. Syst. Ecol. 2011;39:43-50.
32. Filipini R, Piovan A, Borsarini A, Canianto R. Study of dynamic accumulation of secondary metabolites in three subspecies of Hypericum perforatum. Fitoterapia. 2010;81:115-9.
33. Navarra WD, Schneewind O. Surface Proteins of Gram-Positive Bacteria and Mechanisms of Their Targeting to the Cell Wall Envelope. Microbiol. Mol. Biol. Rev. 1999;63(1):174-229.
Recibido: 24 de febrero de 2016.
Aprobado: 9 de enero de 2017.
Erika Andrea Plazas Gonzalez. Jardín Botánico de Bogotá "José Celestino Mutis". Colombia. Correo electrónico: erikaandrea.plazasgonzalez@gmail.com