Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.22 no.1 Ciudad de la Habana ene.-mar. 2017
ARTÍCULO ORIGINAL
Actividad antibacteriana del extracto total de hojas de Cucurbita moschata Duchesne (Ahuyama)
Antibacterial activity of total extract from leaves of Cucurbita moschata Duchesne (ahuyama)
Alvaro del Castillo Pereira, Piedad Molinares Moscarella, Mirna Campo Urbina, Alfonso Bettin Martínez
Universidad Metropolitana de Barranquilla-Colombia.
RESUMEN
Introducción: Cucurbita moschata Duchesne (Ahuyama) es cultivada en toda América, así como en Medio Oriente y Europa. Es utilizada desde la antigüedad como medicina alternativa. En la zona norte del departamento de Bolívar-Colombia es empleada por los campesinos para tratar infecciones en la piel, lo que generó el interés por desarrollar esta investigación.
Objetivo: evaluar la actividad antibacteriana del extracto total de hojas de C. moschata frente a Staphylococcus aureus, Klebsiella pneumoniae y Escherichia coli.
Métodos: hojas frescas de C. moschata fueron clasificadas taxonómicamente de acuerdo a métodos estándares. La obtención de los extractos se realizó por secado en horno, pulverización en molino de cuchilla, extracción por percolación sólido-líquido en frío y concentración en evaporador rotatorio. La actividad antibacteriana de los extractos etanólicos y hexánicos se evaluó in vitro frente a Staphylococcus aureus meticilino resistente, Escherichia coli y Klebsiella pneumoniae, mediante el método de Concentración Inhibitoria Mínima (CIM), siguiendo los lineamientos establecidos por Clinical and Laboratory Standards Institute (CLSI).
Resultados: el extracto hexánico generó inhibición significativa desde la dilución 0,16 µg/mL para la cepa de S. aureus ATCC 43300. Para la cepa ATCC 25923 (MSSA) el extracto hexánico generó inhibición significativa desde la dilución 19,5 µg/mL. Los extractos etanólico y hexánico inhibieron significativamente el crecimiento de la cepa clínica de E. coli., mientras que para K. pneumoniae no hubo inhibición significativa en ninguna de las concentraciones evaluadas.
Conclusiones: se demostró por primera vez que el extracto hexánico total de hojas de C. moschata tuvo el mayor poder de inhibición frente a las cepas clínicas de S. aureus y E. coli. Se reconoce el potencial antimicrobiano de esta especie autóctona de la costa del Caribe colombiano y se recomienda realizar ensayos en un número mayor de patógenos humanos.
Palabras clave: Cucurbita moschata Duchesne; hojas; extracto hexánico; extracto etanólico; actividad antimicrobiana; CIM.
ABSTRACT
Introduction: Cucurbita moschata Duchesne (ahuyama) is grown across America as well as in the Middle East and Europe. It has been used as alternative medicine since ancient times. In the northern section of the department of Bolívar, Colombia, the plant is used by peasants to treat skin infections, hence our interest in conducting this study.
Objective: Evaluate the antibacterial activity of total extract from leaves ofC. moschata against Staphylococcus aureus, Klebsiella pneumoniae and Escherichia coli.
Methods: Fresh leaves of C. moschata were classified taxonomically using standard methods. The leaves were dried in an oven and pulverized in a blade mill. Extraction was performed by cold solid-liquid percolation and concentration in a rotary evaporator. Antibacterial activity of the ethanolic and hexanic extracts was evaluated in vitro against methicillin-resistant Staphylococcus aureus, Escherichia coli and Klebsiella pneumoniae, using the minimum inhibitory concentration (MIC) method, in compliance with guidelines from the Clinical and Laboratory Standards Institute (CLSI).
Results: The hexanic extract caused significant inhibition from dilution 0.16 µg/mL for S. aureus strain ATCC 43300, and from dilution 19.5 µg/mL for strain ATCC 25923 (MSSA). The ethanolic and hexanic extracts significantly inhibited the growth of the clinical E. coli strain, whereas no significant inhibition was observed for K. pneumoniae at any of the concentrations tested.
Conclusions: For the first time it was shown that the total hexanic extract of leaves of C. moschata had the greatest inhibition power against clinical strains of S. aureus and E. coli. The antimicrobial potential of this native species from the Colombian Caribbean has been recognized, and it is recommended to conduct assays with a larger number of human pathogens.
Keywords: Cucurbita moschata Duchesne; leaves; hexanic extract; ethanolic extract; antimicrobial activity; MIC.
INTRODUCCIÓN
El uso milenario de sustancias de origen vegetal con fines terapéuticos y antimicrobianos, ha llevado a investigar nuevas sustancias a partir de plantas consideradas popularmente medicinales. Un gran número de investigaciones revelan que las plantas representan una fuente potencial de agentes antimicrobianos. Teniendo en cuenta las altas tasas de resistencia tanto en bacterias Gram negativas como Gram positivas y después de un período en que la industria farmacéutica se dedicó exclusivamente a la fabricación de fármacos de síntesis, dejando atrás las antiguas medicinas que tenían como base los extractos de plantas medicinales, se hace necesario retomar las investigaciones que apunten a encontrar nuevas moléculas de origen vegetal.1,2
Colombia, por su diversidad climática es un país con gran pluralidad de especies vegetales, las cuales representan la principal herramienta terapéutica en la medicina tradicional,3 a tal punto, que el entorno ha sido de interés para muchos investigadores, quienes buscan principios farmacológicamente activos. Sin embargo, un número significativo de estas especies, aún no han sido estudiadas.4 Un ejemplo de esto, lo constituye la utilización de macerados de hojas de Cucurbita moschata Duchesne por campesinos colombianos de la zona norte del departamento de Bolívar como tratamiento de lesiones de piel infectadas.
C. moschata, cuyo fruto es utilizado como alimento,5 es una planta herbácea, rastrera o trepadora, que goza de propiedades terapéuticas. Estudios recientes muestran que su raíz y sus semillas han sido utilizadas no sólo como antiinflamatorio en afecciones de la próstata, sino también como antiparasitario y antibacteriano, producto de la acción de polisacáridos presentes en ellas.6,7
Tomando como base la tradición oral de los campesinos de la región norte de Colombia, en este estudio se evaluó la actividad antibacteriana in vitro del extracto etanólico y hexánico de hojas de C. moschata, frente a microrganismos de interés clínico tales como Staphylococcus aureus, Klebsiella pneumonie y Escherichia coli, quienes presentan altas tasas de resistencia, acompañados de una mayor morbilidad y mortalidad en pacientes con infecciones asociadas a la atención en salud.
MÉTODOS
Material vegetal y clasificación taxonómica
En enero del 2015 se recolectaron 3 kilogramos de hojas frescas de C. moschata perteneciente a la familia Cucurbitaceae en un área del sur-oriente del departamento del Atlántico-Colombia, a 7 m sobre el nivel del mar, con una temperatura promedio de 29 °C, se tuvo en cuenta que fueran hojas verdes de plantas adultas y con tamaño de 15 cm de diámetro en promedio. La clasificación taxonómica indicó que el material vegetal estudiado corresponde a C. moschata. Dicha clasificación se realizó de acuerdo a métodos estándares en el herbario Armando Dugand Genecco de la Universidad del Atlántico, en Barranquilla-Colombia, donde se encuentra registrada como DUGAND 2912.
Obtención y preparación de los extractos
Los extractos se prepararon de acuerdo a Ramírez y colaboradores,8 con algunas modificaciones. Inicialmente se realizó un secado a temperatura ambiente, bajo sombra, por 72 h, seguido de calor a 40 °C en un horno (Dinámica modelo AP-60 serie 504683). La pulverización del material seco se realizó con molino de cuchilla hasta obtener un peso de 150 gramos. La extracción se realizó por el método de percolación sólido-líquido en frío empleando como solventes alcohol etílico (1.00983 - 2500 Merck), N-hexano (104374 Merck) y filtración sobre papel filtro (Whatman No.1) Los extractos obtenidos se concentraron a presión reducida en un evaporador rotatorio (BUCHI Heating Bath B-490) a 55 °C, por debajo de una atmósfera de presión y se conservaron en refrigeración entre 6-8 °C (Nevera NPIC-90A Inoxcaribe Serie1215) hasta su uso. A partir de cada extracto concentrado se preparó una solución madre con una concentración de 200.000 µg/mL utilizando alcohol etílico y N-hexano como solventes y de éstas se realizaron diluciones seriadas con concentraciones desde 312,5; 156,25; 78,125; 39; 19,53 y 9,76 µg/mL, dado que en ensayos previos realizados en esta investigación, se encontró que concentraciones mayores a 312,5 µg/mL generaron una interacción con el medio de cultivo, formando un precipitado en los pozos de las microplacas que interfiere con la lectura de la densidad óptica, igualmente los ensayos previos mostraron inhibición a partir 9,76 µg/mL.
Evaluación de la actividad antibacteriana
Para los estudios microbiológicos se utilizaron cepas de referencia de Staphylococcus aureus meticilino sensible SAMS (ATCC 25923),Staphylococcus aureus meticilino resistente SAMR (ATCC 43300), Escherichia coli (ATCC 25922) y Klebsiella pneumoniae (ATCC 7006033); (Microbiologics KWIK STIK plus) reconstituidas según las recomendaciones de la casa comercial y conservadas a 4 °C en ambiente de aerobiosis. Además se utilizaron 3 aislamientos clínicos de S. aureus, E. coli y K. pneumoniae, provenientes de lesiones de piel en pacientes atendidos en la unidad de urgencias del Hospital Universitario Metropolitano de Barranquilla conservadas a 4 °C en ambiente de aerobiosis. Los inóculos bacterianos se prepararon a partir de cultivos puros en agar Mueller Hinton (HiMedia M173/17) incubados a 37 °C durante 24 h (Incubadora Memmert 40050 IP20). Entre 10 y 15 min previos al ensayo se suspendieron las colonias de cada una de las cepas, en Caldo Infusión cerebro corazón (BHI) hasta obtener una suspensión bacteriana de 1 × 108 UFC/mL correspondiente al tubo 0.5 en la escala de Mc Farland (Ref. 70900 bioMerieux), las cuales presentaron una densidad óptica entre 0.08 y 0.1 medida a 620 nm por espectrofotometría (Espectrofotómetro GENESYS 20). Se utilizó como control positivo de actividad antibacteriana una solución de gentamicina a 10 µg/mL, como control de crecimiento se empleó una suspensión de cada microorganismo en el medio de cultivo y como control negativo o de inhibición se realizó una siembra de cada microorganismo en caldo BHI en presencia del disolvente (alcohol etílico o N-Hexano).
Concentración Inhibitoria Mínima (CIM)
Las pruebas de actividad antibacteriana se realizaron por el método de CIM, siguiendo los lineamientos establecidos por el Clinical & Laboratory Standards Institute (CLSI),9 con algunas modificaciones. Para ello, se utilizaron placas de microdilución de 96 pocillos, cada uno con volumen final de 150 µL en donde se sembraron por triplicado los blancos, controles y las muestras diluidas a 312,5; 156,25; 78,125; 39; 19,53 y 9,76 µg/mL, luego se incubaron a 37 °C, por 24 h y el crecimiento microbiano se evaluó, a través de la medición de la turbidez respecto al control por espectrofotometría (Espectrofotómetro GENESYS 20).
Análisis estadístico
Los datos de las densidades ópticas (OD) fueron analizados utilizando el programa estadístico Graphpad Prism 6XML. Projet. Los resultados se expresaron como el valor de la media de las densidades ópticas más o menos dos desviaciones estándar, para abarcar el 95,44 % de los valores posibles, según el modelo de Zampini y colaboradores.10 La obtención de la media se determinó a partir de las lecturas de la densidad óptica desde el tiempo 0 h hasta las 24 h, tanto para el control de etanol como para los extractos y se calculó la desviación estándar, luego se trazó como líneas de control el rango de más o menos dos desviaciones estándar alrededor de la media, y se tomó como referencia para determinar que hubo inhibición los valores por debajo de la línea de menos dos desviaciones estándar.
RESULTADOS
En la tabla se resumen los resultados obtenidos para los tratamientos con los extractos etanólicos y hexánicos de C. moschata frente a los microorganismos en estudio.
Actividad frente a S. aureus
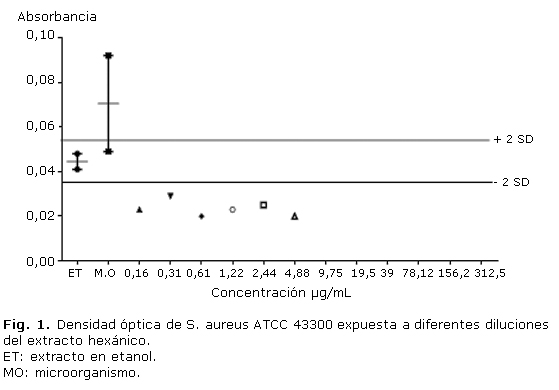
El extracto hexánico, generó inhibición significativa desde la dilución 0,16 µg/mL para la cepa de S. aureus ATCC 43300, ya que a partir de esta concentración las densidades ópticas se encuentran por debajo de la línea de menos dos desviaciones estándar (Fig. 1). El extracto etanólico no inhibió de manera significativa el crecimiento de esta cepa bacteriana.
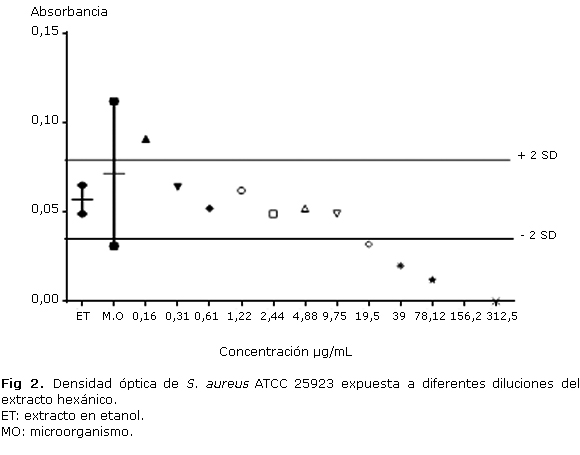
Para la cepa de S. aureus ATCC 25923 (SAMS) el extracto hexánico generó inhibición significativa desde la dilución 19,5 µg/mL (fig. 2). A diferencia del extracto hexánico, el etanólico no produjo inhibición significativa del crecimiento de este microorganismo.
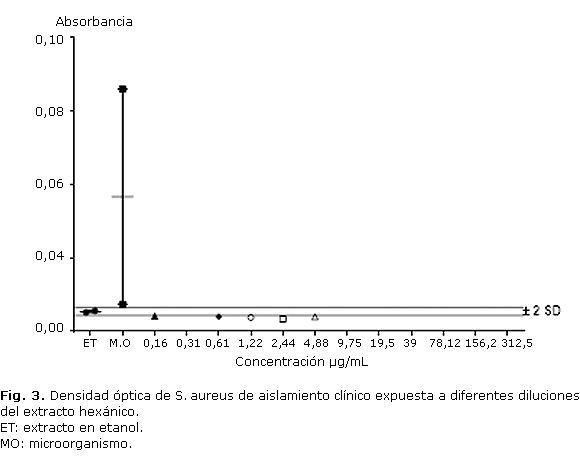
En cuanto a la cepa de aislamiento clínico de S. aureus el extracto hexánico presentó inhibición significativa a partir de 0,16 µg/mL (fig. 3). El extracto etanólico no produjo inhibición significativa del crecimiento de este microorganismo.
Actividad frente a E. coli
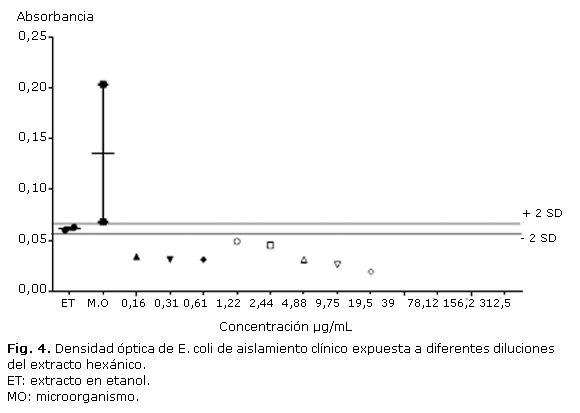
Los extractos etanólico y hexánico frente a la cepa clínica presentaron un comportamiento similar. Ambos extractos inhibieron significativamente el crecimiento de esta bacteria (fig. 4). En la cepa ATCC 25922, no se evidenció inhibición significativa con ninguno de los extractos.
DISCUSIÓN
Ramirez y colaboradores12 encontraron que el extracto hexánico de una planta del género Gnaphalium produjo inhibición a partir de 0,39 µg/mL, lo cual muestra que C. moschata tiene un poder inhibitorio dos veces más alto. Caso contrario ocurrió con el extracto etanólico, el cual no generó inhibición en ninguna de las tres cepas de S. aureus, lo que podría deberse a que los componentes activos extraídos con este solvente no presentan ningún efecto antibacteriano, dado que los metabolitos secundarios que se obtienen con éste, presentan mayor polaridad que los extraídos con N-hexano.
En un estudio realizado por Henao y colaboradores,13 se evaluó la actividad antimicrobiana de los extractos de Lippia origanoides H.B.K. (orégano), cultivada en el departamento del Quindío, en el centro de Colombia. Estos autores encontraron que la actividad del extracto polar (etanol) fue escasa, mientras que la actividad del extracto apolar (N-hexano) resultó ser más efectiva contra S. aureus, Enterococcus gallinarum, Aeromona hidrophila, Pseudomonas aeruginosa, Proteus mirabilis y Enterobacter cloacae. Esto permite sugerir que estos extractos de C. moschata tienen el potencial de seguir siendo evaluados frente a un número significativo de aislamientos clínicos de S. aureus. Adicionalmente, en el estudio de Henao, se reportó que el extracto obtenido por el método de percolación en frío presentó mayor actividad antibacteriana que el método de Soxhlet que emplea calor. Basados en esto, los autores llegaron a la conclusión que la baja temperatura permite conservar la actividad antimicrobiana de los extractos, por lo tanto, sugieren que en este tipo de investigación se utilice el método de percolación; método que fue utilizado en este estudio, en el que se obtuvo como resultado una diferencia significativa entre un extracto y otro en cuanto al poder inhibitorio frente a las cepas de S. aureus evaluadas.
En lo que respecta al tipo de compuesto presente en las hojas de C. moschata con posible actividad antimicrobiana frente a S. aureus, se podría pensar que pertenecen a las familias de terpenos, alcoholes, taninos o naftoquinonas; sin embargo, no hay evidencias de que este tipo de compuestos estén presentes en la familia de C. moschata. Sin embargo, Machado y colaboradores,14 reportaron que algunos de estos compuestos extraídos de plantas de otras familias si tienen actividad antimicrobiana contra S. aureus meticilino resistente; por lo que los extractos de C. moschata pueden ser candidatos a estudio y tener el potencial de ser utilizados en el tratamiento de infecciones por este microorganismo.
En este estudio se observó que el extracto hexánico inhibió significativamente las cepas de S. aureus de aislamiento clínico y meticilino resistente, es una muestra del potencial que podrían tener las plantas de este tipo cultivadas en la costa del Caribe colombiano y sobre todo cuando se trata de controlar este microorganismo, el cual es considerado la principal especie patógena causante de la mayoría de las enfermedades infecciosas de la piel y los tejidos blandos, tanto comunitarias como hospitalarias.15 Además, su sensibilidad a los antibióticos se ha visto reducida con el paso del tiempo, con mortalidad superior al 30 %, causando aumento en los costos de atención en salud, como lo refieren en sus estudios Sabriá y colaboradores y Castillo y colaboradores.16,17
En cuanto a E. coli los resultados muestran que ninguno de los dos extractos generó inhibición en la cepa ATCC, pero ambos fueron efectivos contra la cepa de aislamiento clínico desde 0,16 µg/mL siendo ésta concentración diez veces más baja que la referida por Ramirez y colaboradores,12 quienes encontraron que la inhibición se producía desde 1,56 µg/mL, para E. coli, en extractos de plantas del género Gnaphalium, en la que se han encontrado metabolitos secundarios con actividad antimicrobiana, antifúngica y antioxidante, como: eugenol, linalool, transcaryofilina entre otros, lo que muestra que el poder inhibitorio sobre este microorganismo, fue más alto en los extractos de C. moschata. Los hallazgos anteriores sugieren que esto podría deberse a que la cepa clínica como ha estado expuesta a un ambiente hospitalario y muy probablemente a varios antibióticos, la ha llevado a adaptarse a estos ambientes, siendo probable que frente a estos cambios, se haga sensible a otras moléculas como son los metabolitos secundarios que podrían estar presentes en el extracto de C. moschata.18 A diferencia de esto, la cepa ATCC 25922 (cepas de control de calidad y estándares biológicos) que no ha sido expuesta a estos ambientes, conserva propiedades que le confieren resistencia a los componentes bioactivos de los extractos a los cuales se desconoce su mecanismo de acción.
Resulta interesante destacar que la cepa de aislamiento clínico de E. coli en su antibiograma mostró un perfil de resistencia a antibióticos betalactámicos, como, amoxicilina/clavulanico, cefepima, ceftriaxona y cefuroxima, por lo que se considera una cepa multirresistente productora de betalactamasas de espectro extendido (BLEE), lo que hace difícil su manejo y tratamiento, y en la actualidad son de gran interés clínico en microbiología y Salud Pública.19
En lo que respecta a K. pneumoniae los extractos etanólico y hexánico no produjeron inhibición significativa sobre la cepa de aislamiento clínico ni sobre la cepa ATCC 700603, por lo que se podría pensar que no hay fitocompuestos activos en las hojas de C. moschata contra estos microorganismos que sean solubles en etanol y en N-hexano, que son dos solventes con polaridades diferentes, esto es concordante con lo reportado por Vallejo y colaboradores,1 quienes realizaron un tamizaje de la acción antimicrobiana de 34 extractos vegetales contra bacilos Gram negativos y encontraron que es menor el porcentaje de extractos que tienen efecto sobre el crecimiento de K. pneumoniae ATCC 700603 que sobre las otras cepas Gram negativas estudiadas.
También es importante tener en cuenta que las cepas de K. pneumoniae estudiadas, son productoras de carbapenemasas, un complejo enzimático capaz de inhibir la acción de una gran cantidad de antibióticos, por lo que se podría pensar que si hubiesen sustancias activas contra este microorganismo en las hojas de C. moschata, estas podrían estar siendo inhibidas por algún mecanismo de resistencia presente en esta cepa bacteriana, o simplemente no existen blancos reconocidos por las moléculas extraídas, tal como señalan Thomson y colaboradores.20
Por otro lado, Vallejo y colaboradores,1 concluyeron en su estudio que las bacterias Gram negativas, poseen una resistencia intrínseca a los antibióticos más alta que la de las Gram positivas. Al comparar el efecto de los extractos etanólico y hexánico frente a las dos cepas Gram negativas se encontró que solo generaron inhibición significativa en la cepa clínica de E. coli, siendo inactivos para K. pneumoniae, esto puede deberse a las diferencias tanto fenotípicas como genotípicas de estas dos cepas bacterianas, lo que les confiere características propias de respuesta frente a los antibacterianos. Lo encontrado en este estudio es coherente con lo reportado por Gaitán y colaboradores,21 que en su estudio de caracterización molecular de E. coli y K. pneumoniae, productoras de betalactamasas de espectro extendido, en hospitales de la región del Caribe colombiano, encontraron que en su mayoría las resistencias fueron más frecuentes en K. pneumoniae que en E. coli.22
Finalmente, como se puede evidenciar en los resultados presentados en este estudio, la mayor actividad de los extractos fue sobre las diferentes cepas de S. aureus (Gram positiva), mientras que la actividad fue menor sobre las Gram negativas a excepción de la cepa clínica de E. coli, donde ambos extractos produjeron inhibición. Por otra parte, vale la pena destacar que ambos extractos produjeron inhibición significativa ante las cepas clínicas, lo que conduce a suponer que las sustancias activas presentes en la hoja de C. moschata poseen una polaridad intermedia entre el etanol y N-hexano, ya que ambos solventes fueron capaces de extraerlos, por lo tanto, resultaría interesante probar en otros estudios con solventes de polaridad intermedia como el diclorometano con el fin de lograr extraer una mayor cantidad de metabolitos secundarios que podrían tener efecto antimicrobiano y que posteriormente podrían ser evaluados.
En este estudio, se demostró por primera vez, que el extracto hexánico total de hojas de C. moschata tuvo el mayor poder de inhibición frente a las cepas clínicas de S. aureus y E. coli. Se reconoce el potencial antimicrobiano de esta especie autóctona de la costa del Caribe colombiano y se recomienda realizar ensayos en un número mayor de patógenos humanos.
REFERENCIAS BIBLIOGRAFICAS
1. Vallejo A, Feitosa A, Gourlart AE, Pires LL, Mosquera OM. Tamizaje de acción antimicrobiana de 34 extractos vegetales contra bacilos gramnegativos. Salud Soc Uptc. 2014 [citado 10 jun 2015];1(2). Disponible en: http://revistas.uptc.edu.co/revistas/index.php/salud_sociedad/article/view/3257
2. Vega-Menchaca MC, Verde-Star J, Oranday-Cárdenas A, Morales-Rubio ME, Núñez-González MA, Rivera-Guillén MA, et al. Actividad antibacteriana y citotóxica de Leucophyllum frutescens (Berl) IM Johnst del Norte de México contra Staphylococcus aureus de aislados clínicos. Rev Mex Cienc Farm. 2013 [citado 15 jun 2015];44(2). Disponible en: http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S1870-01952013000200004&lng=es
3. Vera Marín B, Sánchez Saénz M. Registro de algunas plantas medicinales cultivadas en San Cristóbal, municipio de Medellín (Antioquia-Colombia). Rev. Fac. Nal. Agr. 2015;68(2):7647-58.
4. Barrios Paternina E, Mercado Gómez J. Plantas útiles del corregimiento Santa Inés y la vereda San Felipe (San Marcos, Sucre, Colombia). CIENCIA EN DESARROLLO. 2015 [citado 10 may 2015];5(2). Disponible en: http://revistas.uptc.edu.co/revistas/index.php/cienciaendesarrollo/article/view/3668
5. Zhi-Gang Q. Cellulase-assisted extraction of polysaccharides from Cucurbita moschata and their antibacterial activity. Carbohydr Polym. 2014;101(30):432-4.
6. Marie-Magdeleine C, Hoste H, Mahieu M, Varo H, Archimede H. In vitro effects of Cucurbita moschata seed extracts on Haemonchus contortus. Vet parasitol. 2009;16(1):99-105.
7. Rodríguez Diego JG, Arece J, Olivares JL, Alemán Y, Sánchez Castilleja Y. Antihelmínticos, resistencia y método FAMACHA: Experiencia cubana en ovinos. Rev Salud Anim. 2015 [citado 12 jun 2015];37(1). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0253-570X2015000100009&lng=es
8. Ramírez A, Luz S, Díaz B, Hilda E. Actividad antibacteriana de extractos y fracciones del ruibarbo (Rumex conglomeratus). Scientia et Technica. 2007 [citado 12 jun 2015];1(33). Disponible en: http://www.redalyc.org/articulo.oa?id=84933113
9. Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing. Twenty-second informational supplement. M100-S22. Wayne PA: Clinical and Laboratory Standards Institute. 2012.
10. Zampini IC, Cudmani N, Isla MI. Actividad antimicrobiana de plantas medicinales argentinas sobre bacterias antibiótico-resistentes. Acta Bioquím. Clín Latinoam. 2007 [citado 12 jun 2015];41(3). Disponible en: http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0325-29572007000300013&lng=es
11. Padrón Márquez B. Componentes químicos con actividad bactericida, fungicida y citotóxica de plantas de la familia Myrtaceae y Lauraceae. [Tesis doctoral]. Facultad de Ciencias Biológicas; Universidad Autónoma de Nuevo León, México. 2010.
12. Ramírez-Rueda RY, Mojica DN. Actividad antibacteriana de extractos de Gnaphalium polycephalum Michx contra Staphylococcus aureus, Escherichia coli y Pseudomonas aeruginosa. Revista Investig. Salud Univ. Boyacá. 2014;1(1):63-71.
13. Henao J, Muñoz LJ, Ríos E, Padilla L, Giraldo GA. Evaluación de la actividad antimicrobiana de los extractos de la planta Lippia origanoides HBK cultivada en el Departamento del Quindío. Rev Invest Univ Quindio. 2009;(19):159-64.
14. Machado TB, Pinto AV, Pinto M.C.F.R, Leal I.C.R, Silva MG, Amaral A.C.F. In vitro activity of Brazilian medicinal plants, naturally occurring naphthoquinones and their analogues, against methicillin-resistant Staphylococcus aureus. Int J Antimicrob Agents. 2003;21(3):279-84.
15. Bermejo V, Spadaccini L, Elbert GR, Duarte AIE, Erbin M, Cahn P. Prevalencia de Staphylococcus aureus resistente a meticilina en infecciones de piel y partes blandas en pacientes ambulatorios. Medicina (B. Aires). 2012 [citado 20 jul 2015];72(4). Disponible en: http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0025-76802012000400002&lng=es
16. Sabrià M, Pedro-Botet ML. Bacteriemia por Staphylococcus aureus. Mortalidad y resistencia asociada a la meticilina. Med Clin (Barc). 2007;128(18):697-8.
17. Castillo JS, Leal AL, Álvarez CA, Cortés JA, Henríquez E, Buitrago G et al. Bacteriemia por Staphylococcus aureus resistente a la meticilina en la unidad de cuidados intensivos: revisión de los estudios de pronóstico. Infectio. 2011; 15(1):25-32.
18. Hernandez-Gomez C, Blanco VM, Motoa G, Correa A, Maya JJ, Cadena E, et al. Evolución de la resistencia antimicrobiana de bacilos Gram negativos en unidades de cuidados intensivos en Colombia. Biomedica. 2013 [citado 20 jul 2015];34(1). Disponible en: http://www.scielo.org.co/pdf/bio/v34s1/v34s1a11.pdf
20. Thomson JM, Bonomo RA. The threat of antibiotic resistance in Gram-negative pathogenic bacteria: β-lactams in peril. Curr Opin Microbiol. 2005;8(5):518-24.
21. Gaitán CSL, Espinal MPA. Caracterización molecular de Escherichia coli y Klebsiella pneumoniae productores de ß-lactamasas de espectro extendido en hospitales de la Región Caribe, Colombia. Rev Chil Infectol. 2009 [citado 20 ago 2015];26(3). Disponible en: http://www.scielo.cl/scielo.php?script=sci_arttext&pid=S071610182009000400006&lng=es
22. Gonzalez L, Cortes JA. Revisión sistemática de la farmacorresistencia en enterobacterias de aislamientos hospitalarios en Colombia. Biomédica. 2014;34(2):180-97.
Recibido: 6 de abril de 2016.
Aprobado: 24 de enero de 2017.
Alfonso Bettin Martínez. Universidad Metropolitana de Barranquilla-Colombia. Correo electrónico: alfonsobettin@yahoo.es