Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.22 no.1 Ciudad de la Habana ene.-mar. 2017
ARTÍCULO ORIGINAL
Actividad antibacterial y larvicida sobre Aedes aegypty L. de extractos de Ambrosia peruviana Willd (Altamisa)
Antibacterial and larvicidal activity against Aedes aegypti L. of extracts from Ambrosia peruviana Willd (altamisa)
Ana María Mesa Vanegas, Juan Pablo Naranjo, Andrés Felipe Diez, Omar Ocampo, Zulma L. Monsalve
Universidad de Antioquia. Medellín, Colombia.
RESUMEN
Introducción: en la actualidad, nuevas tendencias tecnológicas e iniciativas se están presentando en el desarrollo de productos insecticidas derivados de productos naturales, y de nuevos agentes antimicrobianos, dado que poseen bioactivos que son selectivos, biodegradables y tienen menores efectos adversos. La especie Ambrosia peruviana Willd. es de gran interés en el estudio por su gran potencial biológico y etnobotánico.
Objetivo: evaluar la actividad larvicida sobre Aedes aegypty L. y la actividad antibacteriana sobre bacterias Gram positivas y Gram negativas de extractos de A. peruviana.
Métodos: a partir del material vegetal seco (hojas), se obtuvieron cinco extractos de diferente polaridad en hexano (H), diclorometano (D), acetato de etilo (A) y etanol (E) y aceites esenciales (AE), los cuales fueron evaluados mediante la inhibición del crecimiento de larvas por el método recomendado de la OMS y la inhibición de las bacterias por el método de difusión en agar de Kirby-Bauer.
Resultados: la tasa de mortalidad encontrada a las 24 h a una concentración de 200 ppm para todos los extractos fue del 10 %. Al evaluar el paso de los insectos de larvas a adultos a las 144 h se observó a esta misma concentración una mortalidad del 100 % con todos los extractos. Por otra parte, los extractos de A. peruviana presentaron inhibición sobre Bacillus cereus Frankland & Frankland y Bacillus subtilis (Ehrenberg) Cohn con halos de inhibición del extracto de diclorometano (APExtD) de 10,5 y 15,0 mm de diámetro respectivamente, al contrario sobre las cepas Serratia marcescens Bizio, Proteus mirabilis Hauser, Enterobacter cloacae (Jordan) Hormaeche & Edwards y Staphylococcus aureus Rosenbach no se presentó actividad antibacteriana.
Conclusiones: esta investigación es el primer reporte de actividad larvicida sobre A. aegypty y de actividad antibacteriana sobre B. cereus y B. subtilis de varios extractos de A. peruviana con promisorios resultados en estos modelos.
Palabras clave: actividad antibacteriana; actividad larvicida; Ambrosia peruviana Willd; Aedes aegypty L.; Bacillus subtilis; Bacillus cereus.
ABSTRACT
Introduction: New technological trends and initiatives are currently being put forth concerning the development of insecticidal products and antimicrobial agents of natural origin, since their bioactive components are selective and biodegradable, and cause fewer adverse effects. The species Ambrosia peruviana Willd. was of great interest to the present study, due to its great biological and ethnobotanical potential.
Objective: Evaluate the larvicidal activity of A. peruviana extracts against Aedes aegypti L., and its antibacterial activity against gram-positive and gram-negative bacteria.
Methods: Dry plant material (leaves) was processed to obtain five extracts of different polarity in hexane (H), dichloromethane (D), ethyl acetate (A), ethanol (E) and essential oils (AE), which were evaluated for larval growth inhibition with the method recommended by WHO, and for bacterial inhibition with the Kirby-Bauer agar diffusion method.
Results: The mortality rate at 24 h and a concentration of 200 ppm was 10 % for all extracts. Examination of the transition of larvae into adults at 144 h and the same concentration revealed a mortality of 100 % with all extracts. On the other hand, the extracts of A. peruviana displayed inhibition capacity against Bacillus cereus Frankland & Frankland and Bacillus subtilis (Ehrenberg) Cohn with inhibition haloes for the dichloromethane extract (APExtD) of 10.5 and 15.0 mm in diameter, respectively, whereas no antibacterial activity was found against the strains Serratia marcescens Bizio, Proteus mirabilis Hauser, Enterobacter cloacae (Jordan) Hormaeche & Edwards and Staphylococcus aureus.
Conclusions: This study is the first report of larvicidal activity againstA. aegypti and antibacterial activity against B. cereus and B. subtilis by several extracts of A. peruviana with promising results in these models.
Keywords: antibacterial activity; larvicidal activity; Ambrosia peruviana Willd; Aedes aegypti L.; Bacillus subtilis; Bacillus cereus.
INTRODUCCIÓN
Los vectores son organismos vivos que pueden transmitir patógenos causales de enfermedades infecciosas trasferidas entre personas, o de animales a personas, causando millones de muertes en el mundo anualmente. El cambio climático, la globalización de los desplazamientos y los impactos medioambientales han influido considerablemente en la prevalencia de enfermedades transmitidas por vectores.1 Los mosquitos principalmente del género Aedes, son los vectores transmisores de patógenos que causan enfermedades tales como el dengue, Chikungunya y el virus del Zika.2 Garrapatas, moscas, flebótomos, pulgas, triatominos y algunos caracoles de agua dulce también son vectores de otros agentes etiológicos.1 Muchos de esos vectores son insectos hematófagos que ingieren los microorganismos patógenos junto con la sangre de un hospedero intermediario (persona o animal), y posteriormente los inoculan a un nuevo hospedero al ingerir su sangre. Virus emergentes como el Zika, que es transmitido por vectores, requieren de alternativas de control amigables con el medio ambiente para mitigar su reproducción y resistencia a insecticidas tradicionales.3 En la actualidad, nuevas tendencias tecnológicas e iniciativas se están presentando en el desarrollo de productos insecticidas derivados de productos naturales, dado que poseen bioactivos que son selectivos, biodegradables y tienen menores efectos o ninguno en el medio ambiente, por lo que potencialmente son adecuados para el uso en programas de gestión integral de plagas.4
Por otra parte, la resistencia a los antibióticos constituye actualmente una de las mayores amenazas para la salud mundial. El uso indebido de antibióticos en los seres humanos y animales acelera los procesos de selección que conllevan a la adquisición de fenotipos resistentes, lo que hace que se prolonguen las estancias hospitalarias, se incrementen los costos médicos y que aumente la mortalidad. 5 En la actualidad se están buscando nuevos principios activos a partir de productos naturales con potencial antibacteriano como alternativa terapéutica a los antibióticos de uso frecuente que desencadenan fenómenos de resistencia.6
Ambrosia peruviana Willd. conocida como Altamisa, pertenece a la familia Asteraceae, orden Asterales, ha sido reportada por la medicina tradicional con potencial antibacteriano, antiparasitario, emoliente, emenagogo, analgésico, entre otros. En el departamento de Antioquia en Colombia se ha usado la planta tradicionalmente en infusiones o bebidas para tratar infecciones, artritis, cólicos y regular el ciclo menstrual.7 Por otra parte, en la etnoveterinaria esta especie ha sido empleada para aliviar inflamaciones y el moquillo en ganado bovino. Además se ha empleado en forma de baños con potencial uso como repelente y/o insecticida, para la eliminación de parásitos externos como pulgas, nuches, garrapatas y ácaros.8 Estudios fitoquímicos de A. peruviana han reportado la presencia de mono, dioles y sesquiterpenos lactonas denominados pseudoguaianolidos, los cuales se han identificado y caracterizado como peruvina, peruvinina, psilostaquinas B y C, tetrahidroambrosina, entre otros.9-12 Con una metodología de extracción por arrastre de vapor se han identificado en el extracto de aceites esenciales de esta especie el γ-curcumeno (23,99 %), -curcumeno (14,08 %), acetato de bornilo (10,35 %), camfor (5,03 %) y epóxido de oximene (4,79 %).13 Gran variedad de reportes en cuanto a otras especies del género Ambrosia presentan una amplia gama de sesquiterpenos estructuralmente correlacionados,14,15 además de otros metabolitos a los cuales se les ha comprobado la actividad antioxidante en Ambrosia artemisiifolia L.,16 antiepiléptica en Ambrosia paniculata Michx,17,18 antimicrobiana en A. artemisiifolia19 y Ambrosia trifida L.20
En cuanto al potencial biológico de extractos y componentes de A. peruviana, mediante pruebas in vitro se ha evaluado la acción citotóxica,21 antiviral,22 antibacteriana,23 antihelmitica,24,13 antimicótica,25 además del efecto alelopático e inhibitorio de la germinación de esporas de Cladosporium herbarium (Pers.) Link.9 Sin embargo, aún no se han realizado reportes de la actividad insecticida y/o larvicida de A. peruviana y son pocos los reportes que sustentan su potencial antibacteriano sobre bacterias Gram positivas del género Bacillus, por lo que el presente trabajo tiene como objetivo evaluar la actividad larvicida sobre Aedes aegypty L. y la actividad antibacteriana sobre bacterias Gram positivas y Gram negativas de extractos de diferente polaridad de A. peruviana.
MÉTODOS
Material vegetal
Se colectaron las partes aéreas de A. peruviana (familia Asteraceae) en la finca Las Acacias, Vereda San Isidro, Municipio de Guarne, Departamento de Antioquia, Colombia; coordenadas: 6º17'35" N 75º27'27" W, altitud: 2200 msnm. La identificación taxonómica fue realizada en el Herbario Universidad de Antioquia (HUA), número Voucher (191250).
Reactivos y Equipos
Solventes grado reactivo hexano (H), diclorometano (D), acetato de etilo (A), etanol (E) y dimetilsulfóxido (DMSO), fueron obtenidos de Sigma Chemical Co. Silica gel 60 GF254 Merck®, Agar Nutritivo Oxoidâ, Tetraciclina, Ampicilina fueron obtenidos de Merck (Darmstadt, Germany). Cámaras de flujo laminar marca DIES®.
Preparación de los extractos de diferente polaridad y aceite esencial
El material vegetal (hojas), se secó a temperatura ambiente durante 10 días y posteriormente se molieron con un tamaño de partícula de 5 mm. Se empleó la metodología de extracción soxhlet empleando hexano (H), diclorometano (D), acetato de etilo (A) y etanol (E) como solventes, también se extrajeron mediante arrastre con vapor los aceites esenciales (AE). Los cinco extractos se codificaron con las iniciales de A. peruviana y el tipo de solvente empleado en la extracción (APExtH, APExtD, APExtA, APExtE, APExtAE), se monitorearon por cromatografía de capa delgada con fase estacionaria de Silica gel 60 GF254 Merck® con un sistema de elución diclorometano: metanol (DCM-MeOH; 94:6) y revelando con lámpara ultravioleta UVGL-58 a 254 y 366 nm.26
Evaluación de la actividad antimicrobiana
Los ensayos de inhibición del crecimiento de microorganismos se realizaron mediante el método de sensibilidad por difusión con discos de Kirby-Bauer.27 Los ensayos se realizaron por duplicado y se evaluaron los extractos sobre tres cepas de bacterias Gram negativas: Serratia marcescens Bizio, Proteus mirabilis Hauser , Enterobacter cloacae (Jordan) Hormaeche & Edwards; y tres cepas de bacterias Gram positivas: Staphylococcus aureus Rosenbach, Bacillus cereus Frankland & Frankland y Bacillus subtilis (Ehrenberg) Cohn, las cuales fueron suministradas por el Laboratorio de Microbiología del Instituto de Biología de la Universidad de Antioquia. Las pruebas de las bacterias se realizaron en Agar Nutritivo Oxoidâ y se evaluaron todos los extractos en los discos impregnados estérilmente con el volumen de absorción de discos de papel de filtro de 6 mm de diámetro, dejándolos secar en campana de flujo laminar a temperatura ambiente. Las concentraciones iniciales de masa en disco fueron de aproximadamente 500 µg. Como control positivo se utilizaron discos con Tetraciclina (30 µg) para todas las cepas a excepción de P. mirabilis que se probó con Ampicilina (10 µg). El control negativo se realizó con 5 µL de dimetilsulfóxido al 100 %. Todos los ensayos se incubaron por 24 h a 30 °C. Los datos se reportan como halo de inhibición del extracto en milímetros. Obtenidos los resultados se seleccionó el extracto con mejor actividad antibacteriana para realizar un segundo ensayo y determinar la relación dosis-respuesta empleando concentraciones dobles seriadas desde 500 hasta 50 µg.
Evaluación de la actividad larvicida
Para probar la actividad larvicida de los extractos, se tomó como referencia el protocolo de evaluación de agentes larvicidas propuesto por la Organización Mundial de la Salud (OMS),28 sobre el tercer estadio de larvas de Aedes aegypty L. de la cepa Rockefeller adaptada en el laboratorio de Biología y Control de Enfermedades Infecciosas, BCEI Universidad de Antioquia en un periodo de tiempo que comprendía larvas en estadio III temprano y V tardío. Las larvas se mantuvieron a 27,0 °C (± 2,0) de temperatura, con un fotoperiodo de 12:12 h luz: oscuridad, y 78 % (±2) de humedad relativa. Las larvas se alimentaron con una dieta de alimento para peces TetraMin. Los extractos se evaluaron por duplicado y los tratamientos se contrastaron con un control negativo de larvas sin tratar y otro control de larvas tratadas con el vehículo, que para este caso fue el dimetilsulfóxido al 1 %. Todos los ensayos se realizaron con 20 larvas en cada tratamiento sin suplemento nutricional hasta las 48 h y control por duplicado. Cada extracto fue evaluado a una concentración de 200 ppm en agua estéril declorinada y se determinó la tasa de mortalidad mediante la revisión de larvas a las 12, 24, 36 y 48 h de exposición con los extractos. Adicionalmente, se realizó una observación a las 144 h para evaluar el paso de larva a pupa y luego a adulto, con el fin de determinar si los extractos podrían generar defectos en el desarrollo de las larvas a insectos. La mortalidad se midió con el estímulo de la cabeza de la larva, la reacción inmediata de la misma, la normalidad o anormalidad de sus movimientos y la flotabilidad.
Análisis estadístico
Todas las mediciones se realizaron por duplicado y los resultados son presentados como la media y su desviación estándar (Media ± DS). Para los resultados de actividad antimicrobiana se realizó la comparación entre los microorganismos y los diferentes extractos junto con el control (tetraciclina), mediante un análisis de varianza de dos vías (ANOVA), con un nivel de confianza de p< 0,05 empleando el programa Graph-Pad Prism 5.
RESULTADOS
Actividad antimicrobiana
En este estudio se presentan los resultados de la actividad antibacteriana de extractos de A. peruviana evaluados sobre tres cepas de bacterias Gram negativas: S. marcescens, P. mirabilis, E. cloacae; y tres cepas de bacterias Gram positivas: S. aureus, B. cereus y B. subtilis. El control del vehículo (dimetilsulfóxido 100 %) no produjo efecto inhibitorio con ninguna especie. Los halos de inhibición sobre B. cereus yB. subtilis para los extractos de diferente polaridad de A. peruviana muestran que hay una diferencia estadísticamente significativa entre los extractos p< 0,05 (tabla). Se observó la inhibición del crecimiento sobre B. cereus y B. subtilis utilizando 500 µg, obteniendo halos de 11,0 y 9,5 mm de diámetro para el extracto de hexano (APExtH), 10,5 y 15,0 mm con diclorometano (APExtD), 9,0 y 11,5 mm con acetato de etilo (APExtA) y 9,5 y 10,5 mm con aceites esenciales (APExtAE). La inhibición del extracto etanólico (APExtE) sólo se observó en B. subtilis, con un halo de 9,5 mm. Los extractos probados con S. marcescens, P. mirabilis, E. cloacae y S. aureus no presentaron efecto inhibitorio a la concentración evaluada.
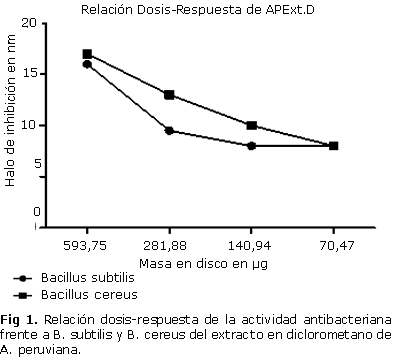
Los resultados de la relación dosis-respuesta para el extracto de diclorometano (APExtD) que fue el más activo, muestran que para una masa de (70,47 µg) se sigue presentando actividad antibacteriana sobre las dos cepas B. cereus y B. subtilis con un halo de inhibición de 8 mm (fig. 1).
Actividad larvicida
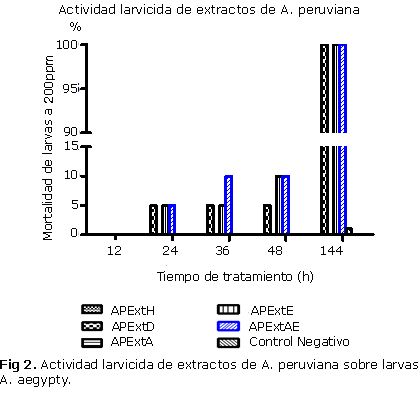
La actividad larvicida de los extractos de A. peruviana a una concentración de 200 ppm, evaluada sobre el tercer estadio de larvas de A. aegypty, de la cepa Rockefeller, que comprenden un intervalo de estadio III temprano, a V tardío y el paso de pupa a adulto se presenta en la fig 2.
Los porcentajes de mortalidad de las larvas se registraron después de 12, 24, 36 y 48 h de tratamiento. La mortalidad encontrada pasadas las 24 h de exposición del extracto de diclorometano (APExtD), etanol (APExtE) y aceites escenciales (APExtAE) fue del 5 %. A partir de las 36 h se generó un aumento en la tasa de mortalidad del 10 % para el extracto de aceites esenciales (APExtAE) y a las 48 h se observó el mismo comportamiento para el extracto en etanol (APExtE). Algunos larvicidas comerciales como el Temefos® o el Avate®, actúan en un rango de 12 a 24 h, acogiéndose dicho dato a un mayor efecto en este rango de tiempo por parte de los extractos evaluados. Aunque levemente, el extracto de aceites esenciales presentó la mayor mortalidad de las larvas con respecto al tiempo de exposición, pasadas las 72 h de tratamiento. El más notable resultado encontrado en este estudio fue al evaluar el paso de los insectos de pupas a adultos donde se observó una mortalidad del 100 % para todos los extractos a las 144 h, comparadas con los controles negativos que permitieron que más del 90 % de los insectos pasara a pupa y luego a adultos.
DISCUSIÓN
Varios autores han reportado la inhibición del crecimiento sobre cepas de Bacillus de especies del género Ambrosia. Wang et al.20 reportaron la actividad de los aceites esenciales de la especie Ambrosia trifida sobre B. subtilis, Solujic et al.,29 reportaron la inhibición del crecimiento del extracto de acetona del polen deAmbrosia artemisiifolia sobre Bacillus mycoides Flügge. Aunque la mayoría de las especies de Bacillus son inocuas, algunas son patógenas para las personas y los animales. B. cereus causa una intoxicación alimentaria similar a la estafilocócica. Se ha comprobado que B. cereus causa bacteriemia en enfermos inmunodeprimidos, además de síntomas como vómitos y diarrea. Otra especie, Bacillus anthracis Cohn puede producir carbunco en personas y animales.30 En cuanto a otros estudios específicos del potencial antimicrobiano de A. peruviana, Guauque et al.,24 han evaluado la actividad antibacteriana de los extractos etanólicos y acuosos de la planta sobre las bacterias Gram positivas S. aureus y Streptococcus pyogenes Rosenbach, y las Gram negativas Pseudomonas aeruginosa (Schroeter) Migula, E. cloacae, P. vulgaris, Escherichia coli Escherich y E. coli DH5α, los cuales no presentaron actividad. Al igual que Melendez & Capriles,23 quienes evaluaron extractos alcohólicos de A. peruviana y tampoco encontraron inhibición del crecimiento sobre E. coli y S. aureus. Sin embargo, otros autores han evaluado la actividad antibacteriana del aceite esencial por el método de difusión en agar con discos, obteniendo actividad contra S. aureus, E. faecalis, E. coli y Salmonella typhi (Eberth) Schroeter, con valores de CIM de 350-500 μg/mL. Yánes et al.,13 al igual que Bussmann et al.,31 donde determinaron la actividad antimicrobiana de A. peruviana, sobre S. aureus y E. coli con un extracto etanólico. Esto últimos resultados pueden relacionarse con las variaciones ambientales y ecológicas de los lugares de donde proviene la planta, condiciones que modificarán la producción de metabolitos secundarios, además de los cambios en la susceptibilidad -resistencia de las cepas bacterianas.
Estos resultados se correlacionan con la actividad biológica encontrada en este trabajo, en el cual se obtuvo la inhibición del crecimiento en las especies de B. subtilis y B. cereus al probar todos los extractos, consiguiéndose la mayor efectividad con el extracto de diclorometano (APExtD). Las demás especies bacterianas no sufrieron inhibición del crecimiento con ningún extracto. Se reitera la interesante actividad antimicrobiana encontrada de A. peruviana sobre bacterias Gram positivas del género Bacillus, lo que estimula seguir explorando su potencial antibacteriana dado que es el primer reporte de la evaluación de los extractos A. peruviana sobre especies del género Bacillus, lo que estimula continuar con los estudios a través de un análisis biodirigido, aislando y caracterizando metabolitos presentes en los extractos, dada la respuesta específica de los extractos en la inhibición del crecimiento de especies del género Bacillus.
Por otra parte, los diferentes extractos de la especie A. peruviana tuvieron un efecto levemente significativo como agentes larvicidas, sin embargo, se encontró que los extractos indujeron un defecto en el desarrollo de larva a adulto a 144 h presentando un 100 % de mortalidad. Aunque una tasa de mortalidad del 10 % no logra ser significativa con relación a la población total de prueba analizada, el defecto en el desarrollo de larva a adulto generado por parte de los extractos de A. peruviana indica la presencia de moléculas de interés principalmente en el extracto de aceites esenciales que inducen un defecto e inhibición de los ciclos de desarrollo de las larvas. Estudios en la literatura han descrito la actividad larvicida de monoterpenos presentes en los aceites esenciales de las plantas, donde se ha reportado actividad insecticida sobre diferentes especies de mosquitos.32 Los resultados de actividad larvicida sugieren la presencia de compuestos que actúan sobre los estadios de desarrollo de los insectos de A. aegypty, por lo que los hallazgos del presente estudio sugieren la posibilidad de nuevas investigaciones sobre la actividad larvicida de los compuestos presentes en los extractos, enfocados en el estudio de los modos de acción sobre los estadios de desarrollo del mosquito, que pueden generar la posibilidad de sustituir los larvicidas sintéticos que han perdido la eficacia y han generado resistencia, los cuales pueden ser incorporados en los programas de control integrado de vectores.
Esta investigación es el primer reporte de actividad larvicida sobre A. aegypty y de actividad antibacteriana sobre B. cereus y B. subtilis de varios extractos de A. peruviana, con promisorios resultados en estos modelos. Los hallazgos del presente estudio sugieren la posibilidad de nuevas investigaciones sobre la actividad larvicida de los compuestos presentes en los extractos a través de estudios fitoquímicos biodirigidos con la caracterización de metabolitos y enfocados en el estudio de los modos de acción sobre los estadios de desarrollo del mosquito. Estos resultados resaltan la importancia de obtener larvicidas naturales eficaces para el control de larvas de A. aegypty, especialmente en las zonas donde los vectores han desarrollado resistencia o susceptibilidad disminuida a los insecticidas convencionales de origen sintético.
AGRADECIMIENTOS
A la Universidad de Antioquia. Se agradece a los botánicos Francisco Javier Ossa y Ramino Fonnegra por su colaboración en la consecución e identificación de la especie, a Sebastián Zapata y Miguel Arana por sus aportes en la ejecución de este trabajo.
REFERENCIAS BIBLIOGR Á FICAS
1. WHO (World Health Organization). Enfermedades transmitidas por vectores. Nota descriptiva Nº387. 2016. [citado 10 may 2016]. Disponible en: http://www.who.int/mediacentre/factsheets/fs387/es/
2. Seccacini E, Juan L, Zebra E. Aedes aegypti (Diptera, Culicidae): Evaluation of natural long-lasting materials containing pyriproxyfen to improve control strategies. Parasitol Res. 2014;113:3355-60.
3. Berg HVD, Mutero CM, IchimorI K. GUIDANCE on policy-making for integrated vector manageme. WHO, Francia: Library Cataloguing-in-Publication. 2012.
4. Wahyuni D. New Bioinsecticide granules toxin from exctract of papaya (Carica papaya) seed and leaf modified against Aedes aegypti larvae. Procedia Environmental Sciences. 2015;23:323-8.
5. WHO (World Health Organization). Resistencia a los antibioticos. Nota descriptiva. [octubre 2015]. Disponible en: http://www.who.int/mediacentre/factsheets/antibiotic-resistance/es/ Acceso: 10 de mayo 2016. WHO (World Health Organization). Worldwide country situation analysis: response to antimicrobial resistance. WHO; Library Cataloguing-in-Publication Data: 2015.
6. Chaves TP, Clementino ELC, Felismino DC, Alves RRN, Vasconcellos A, Coutinho HDM, et al. Antibiotic resistance modulation by natural products obtained from Nasutitermes corniger (Motschulsky, 1855) and its nest. Saudi J Biol SCI. 2015;22:404-8.
7. Gupta MP. 270 Plantas Medicinales Iberoamericanas. Convenio Andrés Bello CYTED, Santa Fe de Bogotá: Editorial presencia ltda; 1995.
8. Fonnegra R. Medicina tradicional en los corregimientos de Medellín-historias de vidas y plantas. Medellín: Editorial Universidad de Antioquia. 2012.
9. Goldsby G, Basil AB. Sesquiterpene lactones and a sesquiterpene diol from jamaican Ambrosia peruviana. Phytochemistry. 1987;26(4):1059-63.
10. Nathan JP, Romo J. Isolation and structure of peruvin. Tetrahedron. 1966;22(6):1723-28.
11. Romo J, Nathan JP, Romo de Vivar A, Alvarez C. The structure of peruvinin-A pseudoguaianolide isolated from Ambrosia peruviana Willd, Tetrahedron. 1967;23(2):529-34.
12. Herz W, Anderson G, Gibaja S, Raulais D. Sesquiterpenelactones of some Ambrosia species. Phytochemistry. 1969;8(5):877-81.
13. Yánez CA, Ríos N, Mora F, Rojas L, Díaz T, Velasco J, et al. Composición química y actividad antibacteriana del aceite esencial de Ambrosia peruviana Willd. de los llanos venezolanos. Rev Peru Boil. 2011;18(2):149-215.
14. De leo M, Vera Saltos MB, Naranjo Puente BF, De tommasi N, Bracaa A. Sesquiterpenes and diterpenes from Ambrosia arborescens. Phytochemistry. 2010;71:804-9.
15. Kagan HB, Miller HE, Renold W, Lakshmikantham MV, Tether MV, Herz LR, et al. The structure of psilostachyin c, a new sesquiterpene dilactone from Ambrosia psilostachya DC. J. Organization of Chem. 1966;31(5):1629-32.
16. Zoran M. In vitro antioxidant activity of ragweed (Ambrosia artemisiifolia L. Asteraceae) herb. Industrial Crops and Products. 2008;28(3):356-60.
17. Buznego MT, Llanio Villate M, Fernandez MD, Alonso N, Acevedo ME, Pérez Saad H. Perfil neurofarmacologico de la Ambrosia paniculata (Willd.) O.E Schulz (Artemisa). Rev Cubana Plant Med. 1998;3(1):42-5.
18. Buznego MT, Pérez-Saad H. Acute effect of an extract of Ambrosia paniculata (Willd.) O. E. Schultz (mugwort) in several models of experimental epilepsy. Epilepsy Behav. 2004;5:847-51.
19. Chalchat JC, Maksimovic Z, Petrovic S, Gorunovic MS. Chemical composition and antimicrobial activity of Ambrosia artemisiifolia L. essential oil. J. Essential Oil Res. 2004;16:270-3.
20. Wang P, Hua Kong C, Xian Zhang C. Chemical composition and antimicrobial activity of the essential oil from Ambrosia trifida L. Molecules. 2006;11:549-55.
21. Aponte JC, Yang H, Vaisberg AJ, Castillo D, Málaga E, Verástegui M, et al. Cytotoxic and anti-infective sesquiterpenes present in Plagiochiladisticha (Plagiochilaceae) and Ambrosia peruviana (Asteraceae). Planta medica. 2010;76(7):705-7.
22. Abdel-malek S, Bastien JW, Mahler WF, Qi Jia, Reinecke MG, Edward Robinson W, et al. Drug leads from the Kallawaya herbalists of Bolivia. Background, rationale, protocol and anti-HIV activity. J. Ethnopharmacol. 1996;50:157-66.
23. Melendez PA, Capriles VA. Antibacterial properties of tropical plants from Puerto Rico. Phytomedicine. 2006;13:272-6.
24. Guauque MP, Castaño JC, Gomez M. Detección de metabolitos secundarios en Ambrosia peruviana Willd. y determinación de la actividad antibacteriana y antihelmíntica. Infectio. 2010;14(3):186-94.
25. Graham JG, Pendland SL, Prause JL, Danzinger LH, Schunke Vigo J, Cabieses F, et al. Antimycobacterial evaluation of peruvian plants. Phytomedicine. 2003;10:529-35.
26. Mesa AM, Zapata S, Arana LM, Zapata I, Monsalve Z, Rojano B. Antioxidant activity of different polarity extracts from Ageratum conyzoides L. BLACPMA. 2015;14(1):1-10.
27. Rojas JJ, García AM, López A. Evaluación de dos metodologías para determinar la actividad antimicrobiana de plantas medicinales. BLACPMA. 2005;4(2):28-32.
28. WHO (World Health Organization). Guidelines for laboratory and field testing of mosquito larvicides. Geneva: World Health Organization; 2005. Disponible en: http://whqlibdoc.who.int/hq/2005/who_cds_whopes_gcdpp_2005.11.pdfel 28/5/13 .
29. Solujić S, Sukdolak S, Vukovic N, Niciforovic N, Stanic S. Chemical composition and biological activity of the acetone extract of Ambrosia artemisiifolia L. pollen. J. Serb. Chem. Soc. 2008;73(11):1039-49.
30. Bartram J, Contruvo J, Exner M, Fricker C, Glasmacher A. Heterotrophic plate counts and drinking-water safety. World Health Organization. Londres (Reino Unido): IWA Publishing; 2003.
31. Bussmann RW, Glenn A, Sharon D, Chait G, Díaz D, Pourmand K, et al. Proving that traditional knowledge works: the antibacterial activity of northern peruvian medicinal plants. Ethnobotany Research & Applications. 2011;9:67-96.
32. Kweka EJ, Cardoso Lima T, Marciale CM, Pergentino de Sousa D. Larvicidal efficacy of monoterpenes against the larvae of Anopheles gambiae. Asian Pac J Trop Biomed. 2016;6(4):290-4.
Recibido: 17 de noviembre de 2016.
Aprobado: 27 de enero de 2017.
Ana María Mesa Vanegas. Facultad de Ciencias Exactas y Naturales, Instituto de Biología. Medellín, Colombia. Correo electrónico: amaria.mesa@udea.edu.co