Introducción
Los tumores del estroma gastrointestinal (GIST), son las neoplasias de origen mesenquimático más frecuentes del tracto digestivo, sin embargo, representan menos del 1% de todos estos tumores. Su incidencia se estima en alrededor de 10 a 20 casos por millón de personas, teniendo una prevalencia superior debido al curso clínico prolongado de la enfermedad, el cual puede extenderse entre 10 a 15 años. En países desarrollados como Estados Unidos se diagnostican alrededor de 2000 a 5000 nuevos casos, entre 7 y 20 casos por millón de habitantes cada año, mientras que entre 1998 y 2004 Suecia, Irlanda y Reino Unido mostraron altas tasas de incidencia de 14,5; 11 y 10 casos por cada millón de habitantes. Esta entidad no se encuentra asociada a localizaciones geográficas, grupos étnicos, ocupación, razas o sexo; aunque algunos autores plantean una frecuencia superior en hombres de raza negra. Generalmente se diagnostican en pacientes mayores de 40 años de edad, con una edad promedio que oscila entre los 50 a 60 años, es rara en niños y adultos jóvenes, en los cuales de aparecer se asocia a la triada de Carney 000 o algún tipo de predisposición genética. 1-4
Hace dos décadas Golden y Scout describieron por vez primera los GIST como neoplasias derivadas de músculo liso (Leiomiomas, leiomioblastomas, sarcomas, entre otras); o de tejido neural (schwannomas, neurofibromas, ganglioneuromas), Mazur y Clarks fueron los primeros en utilizar el término de tumor estromal gastrointestinal. No sería hasta la utilización de la inmunohistoquímica, microscopía electrónica y biología molecular y la subsiguiente demostración de la ausencia de marcadores musculares y la presencia ocasional de marcadores neurales lo que les permitiría a Mazur y Clarks ser los primeros en utilizar el término de tumor del estroma gastrointestinal para definirlos. Estos tumores eran apenas comprendidos hasta que en 1998 Kindblom plantea su origen a partir de las células de Cajal, ubicadas en los plexos mientéricos de la pared gastrointestinal, las cuales responden al oncogén CD117, c-KIT (receptor de tirosina quinasa); de tal forma que hoy en día se denomina GISTs a aquellos tumores mesenquimales, fusiformes o epitelioides, primarios del tracto gastrointestinal, epiplón, mesenterio y retroperitoneo, a diferencia de otros de origen muscular liso y neural.3,5-7
Presentación del caso
Paciente masculino de 60 años de edad, con antecedentes de hipertensión arterial lleva tratamiento con captopril 50 mg al día, acude a consulta de medicina interna por cansancio, inapetencia, refiere que un mes antes de la consulta comenzó con malestar al ingerir alimentos, intolerancia a las grasas y nauseas. Niega dolor abdominal.
Examen Físico: mucosas: hipocoloreadas y húmedas.
Aparato respiratorio: murmullo vesicular audible en ambos campos pulmonares, no se auscultan estertores. Presión Arterial: 140/90 mm Hg.
Abdomen: simétrico, blando, depresible, no doloroso, se palpa un tumor en zona de epigastrio y en hipocondrio izquierdo, fijo, no doloroso, no mesurable.
Tejido celular subcutáneo: no edemas
Sistema nervioso: sensorio libre.
Coagulograma Completo:
Glicemia: 3.5 mmol/l
Creatinina: 66 mmol/l
Proteínas totales: 72 mmol/l
Colesterol: 2,5 mmol/l
TGP: 16.0 mmol/l
TGO.8 .0 mmo/l
GGT.11.0 mmol/l
Fosfatasa alcalina: 116 mmol/l
Triglicéridos: 1.8mmo/l
Colesterol: 2, 5 mmol/l
Ultrasonido Abdominal: hígado de tamaño normal, homogéneo. Páncreas de tamaño normal, Vesícula, vías biliares intra y extra hepáticas normales. Llama la atención imagen tumoral que se proyecta en hipocondrio izquierdo, de 20 x 15 com, ecogénica, en íntima relación con hilio esplénico, por delante de cuerpo y cola del páncreas.
Tomografía Axial Computarizada (TAC) de abdomen: LOE gástrica que infiltra, bazo, lóbulo izquierdo del hígado, presencia de adenopatías del tronco celiaco y borde superior del páncreas. Con densidad variable, contornos bien definidos, sin variación luego de la administración de contraste. (Fig. 1)
Endoscopia oral: esófago mucosa normal, estomago con mucosa que muestra eritema en cuerpo alto y cardias, de la cual se toman varios ponches para biopsia. Piloro y bulbo duodenal normales. Conclusión gastritis Crónica.
Laparoscopia: se observa gran LOE de estómago, fija, irregular, crecimiento posterior, de superficie irregular, con vasos de neoformación, infiltración esplénica.
Biopsia gástrica: gastritis crónica severa.
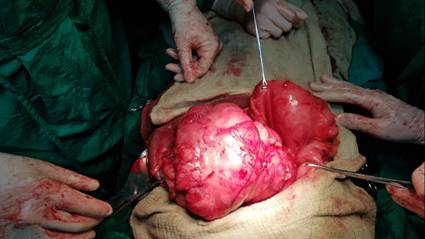
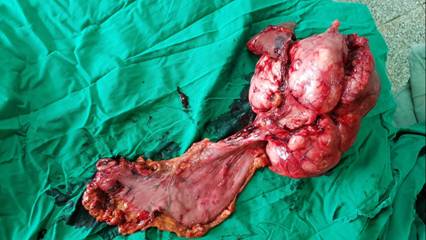
Teniendo en cuenta los exámenes realizados se plantea una LOE gástrica, origen mesenquimal. Se discute el paciente en consulta multidisciplinaria y se decide la intervención quirúrgica. Se realiza laparotomía exploratoria encontrando una gran masa tumoral, localizada en fundus gástrico con crecimiento exófitico, fija, adherido al bazo, con adenopatías peripancreaticas y peritumorales. Se realiza gastrectomia total + Linfadenectomia + esplenectomía+ esofagoyeyunostomia en Y de Roux + yeyunostomia para nutrición precoz. (Fig. 2 y Fig. 3)
Evolución favorable postoperatoria: inicio de la nutrición por sonda de yeyunostomia a las 48 horas de la intervención. A los 5 días comienza la nutrición por vía oral. Evolución favorable, es egresado a los 9 días sin complicaciones.
Informe histológico: pieza quirúrgica, bazo, estomago con LOE, adenopatías nivel I, II y suprapancreaticas.
Tumor del estroma gastrointestinal (GIST) de bajo potencial maligno de localización gástrica que mide 25x15x13cm , peso 5 kg, de bordes bien delimitados con áreas de necrosis
Bordes quirúrgicos no infiltrados. Se examina 10 ganglios que miden entre 0.5- 2 cm que muestra moderada reacción inflamatoria, sin atipicidad.
Se envían bloques y láminas al centro nacional de Oncología INOR; se realiza marcadores tumorales e inmunohistoquimica.
Se informa: tumor fusocelular del estroma gastrointestinal (GIST) de pared gástrica, de bajo potencial de malignidad, comportamiento agresivo.
Índice Mitótico de 1 mitosis por 50 HPF.
Alfa Actinina: negativo.
K167: positivo en el 2% de los medios tumorales.
Se interconsulta con oncología para seguimiento, decidiéndose no administrar tratamiento con citostáticos.
Discusión
La localización más frecuente del tumor es el estómago en su parte media, seguida del antro (60-70%), intestino delgado (25-35%), colon y recto (5%), esófago y apéndice (menos del 2%); pueden surgir además desde el omento e intestino mesentérico, así como retroperitoneales, estos reportes son excepcionales y suelen asociarse a lesiones primarias en estómago o intestino. 1,5,7
Hace dos décadas Golden y Scout describieron por vez primera los GIST como neoplasias derivadas de músculo liso (leiomiomas, leiomioblastomas, sarcomas, entre otras); o de tejido neural (schwannomas, neurofibromas, ganglioneuromas), Mazur y Clarks fueron los primeros en utilizar el término de tumor estromal gastrointestinal. No sería hasta la utilización de la inmunohistoquímica, microscopía electrónica y biología molecular y la subsiguiente demostración de la ausencia de marcadores musculares y la presencia ocasional de marcadores neurales lo que les permitiría a Mazur y Clarks ser los primeros en utilizar el término de tumor del estroma gastrointestinal para definirlos. Estos tumores eran apenas comprendidos hasta que en 1998 Kindblom plantea su origen a partir de las células de Cajal, ubicadas en los plexos mientéricos de la pared gastrointestinal, las cuales responden al oncogén CD117, c-KIT (receptor de tirosina quinasa); de tal forma que hoy en día se denomina GISTs a aquellos tumores mesenquimales , fusiformes o epitelioides, primarios del tracto gastrointestinal, epiplón, mesenterio y retroperitoneo, que a diferencia de otros de origen muscular liso y neural, expresan en el 95% de los casos el receptor de transmembrana para el factor derivado de stem cells con actividad sobre el receptor tirosina-quinasa conocido como CD117 o c-KIT, ubicado en el cromosoma 4(4q11-q12) positivo, el cual se cree controla la proliferación celular y la apoptosis; en 1998 Hirota et al, demostraron el papel de la mutación de este protoncogen en la aparición de esta enfermedad. Otros marcadores frecuentemente positivos, pero no específicos, incluyen CD34 (60-70% de los casos) y actina músculo liso (30-40% de los casos), menos común S-100 (5%), desmina (raro) y marcadores neuroendocrinos (enolasa neuronal específica y cromogranina). 2,3,5,7
Anatomopatológicamente, su aspecto depende del tamaño, el cual oscila entre 0.8 y 38 cms, los pequeños aparecen como nódulos serosos intramurales o submucosos, entretanto los grandes pueden llegar a tener crecimiento exofítico hacia la luz y se ulcera la mucosa hasta 20-30% de los casos. Además, pueden llegar a protruir hacia la superficie serosa, con gran componente extraparietal que enmascara su origen digestivo. Su aspecto microscópico es variable debido a los diferentes tipos celulares que pueden aparecer y dentro de os cuales se pueden distinguir tres categorías: de células fusiformes (77%), epitelioides (8%) y mixtas (15%). Otros rasgos estructurales característicos son la presencia de estroma hialino, rico en fibras colágenas, el infiltrado inflamatorio linfocitario o la existencia de estroma mixoide, con cambios microquísticos, que recuerdan, junto a las empalizadas a los schwannomas. Con microscopio electrónico se detectan células con diferenciación muscular lisa (vesículas de pinocitosis, cuerpos densos subplasmalémicos y abundantes microfilamentos), diferenciación neural (uniones intercelulares primitivas, numerosos microtúbulos y gránulos de tipo neurosecretor), ambos tipos de diferenciación o ninguno de ellos. 4)
Estas características fueron la causa de que se propusiera una clasificación de los GISTs de acuerdo al grado de diferenciación en cuatro grupos: GISTs con diferenciación muscular lisa, GISTs con diferenciación neural, GISTs con diferenciación dual muscular y neural y GISTs sin diferenciación. Esta clasificación ha perdido vigencia hoy en día pues consideraba a todas las neoplasias con diferenciación neural, dual o sin diferenciación, como malignas o potencialmente malignas y porque no contemplaba la histogénesis de los GISTs. 4
La presencia de síntomas dependerá del tamaño y localización del tumor y puede variar desde formas asintomáticas a casos que se presenten como una emergencia quirúrgica por perforación gástrica o sangramiento digestivo. La presentación clínica más común es la hemorragia gastrointestinal, signos y síntomas importantes constituyen además el dolor abdominal (54% de los casos), masa palpable (29% de los casos) y otros menos específicos pero importantes también para establecer el diagnóstico como: náuseas, vómitos y pérdida de peso. (5
Muchos de estos tumores solían ser de difícil diagnóstico preoperatorio, incluso muchas veces se llegaba a este post mortem. La introducción de la Ultrasonografía, la Tomografía Axial Computarizada (TAC) simple y contrastada y la endoscopia digestiva facilitan su diagnóstico; aunque el diagnóstico definitivo y con valor pronóstico, además, de este tumor, lo constituye el estudio inmunohistoquímico CD117 (95% de positividad). (1,3,5,8
El tratamiento es esencialmente quirúrgico, ya sea cirugía abierta, endoscópica o laparoscópica o reducción preoperatoria con embolización del tumor. La quimioterapia y la radioterapia convencional son muy poco eficaces. En el año 2000 se usó por vez primera un agente oral inhibidor selectivo del receptor kit de la tirosincinasa, el Mesilato de Imatinib, para tratar un paciente con GIST metastásicos y se comprobó su efecto benéfico. Parece tener resultados esperanzadores para tumores no resecables o metastásicos, por ello en 2002 la Food and Drug Administration (FDA) estadounidense aprobó su uso para GIST metastásicos o irresecables y en 2006 aprobó el Sunitinib para los casos resistentes al Imatinib. (2,5
El recuento mitótico y tamaño tumoral son los principales factores pronósticos identificados relacionados con progresión de la enfermedad y supervivencia, resultando en ocasiones, sin embargo, difícil de predecir su comportamiento biológico (benigno/maligno), motivo por el cual las principales clasificaciones actuales recomiendan más bien catalogarlos de acuerdo al riesgo asociado a metástasis y supervivencia, existiendo actualmente según la clasificación propuesta por la OMS 8 grupos pronósticos, lo cual demuestra el comportamiento variable de esta neoplasia, y por tanto lo complejo que resulta intentar definir si estos tumores presentarán un comportamiento benigno, incierto (bordelinde) o maligno. Otras variables morfológicas pronósticas consideran el compromiso de la mucosa, presencia de necrosis, hipercelularidad, pleomorfismo celular y localización anatómica. 5
El patrón histológico de estos tumores, corresponden al tipo fusiforme: tipo epitelioide y tipo mixto (mezcla de fusiforme y epitelioide). En una revisión respecto al tema, refiere que tanto en los casos gástricos, de intestino delgado y colon predomina el tipo fusiforme (70 a 80%) y epitelioide (20 a 30%), correspondiendo este patrón histológico del tipo fusiforme como nuestro caso. 9
La oncoproteína CD117/c-kit se ha convertido, por tanto, en un marcador imprescindible en el diagnóstico de estos tumores. Además de la expresión de CD117/c-kit, en los tumores GIST se observa positividad para CD34 entre un 60-70% de los casos, actina de músculo liso (30-40%) y alrededor de un 5% para proteína S100. Ninguno de estos marcadores es específico para los GIST. Sólo un pequeño porcentaje de casos (1-2%) presentan positividad para la desmina de forma focal. La inmunotinción para CD34 es más frecuente en tumores de colon y esófago y para actina de músculo liso en tumores de intestino delgado. (10