Introducción
Los hongos comestibles constituyen una rica fuente de nutrientes que poseen sustancias activas con efectos medicinales sobre el organismo y, de manera particular, sobre el sistema inmunológico.
La micoterapia comprende el uso de extractos derivados de hongos y compuestos bioactivos utilizados como productos funcionales, con potencial para promover la salud.1) Preparaciones derivadas del micelio y los cuerpos fructíferos de especies del género Pleurotus, tales como decocciones o extractos en agua caliente, se han utilizado como medicina complementaria para tratar trastornos inmunológicos.2 Muchas formulaciones orales se promueven en todo el mundo como productos de venta libre y algunas son sometidas a evaluación clínica.3) Las moléculas bioactivas presentes en estos productos comprenden compuestos de alto peso molecular, principalmente polisacáridos.1
Los β-glucanos son una familia de polisacáridos con estructura química heterogénea, presentes en la pared celular de algas, plantas, levaduras, hongos y algunas bacterias, que poseen notable capacidad para activar la respuesta inmunitaria.3) Estudios sobre las propiedades de la pared celular de levaduras, han sugerido que su composición de azúcares, principalmente β-glucanos, son responsables de sus propiedades anticancerígenas y antineoplásicas. Saccharomyces cerevisiae (var. Boulardii) y K. marxianus son levaduras conocidas con diversas aplicaciones y propiedades biológicas relevantes.4 Los β-glucanos también pueden proporcionar efectos saludables, al promover selectivamente el crecimiento de bacterias beneficiosas (probióticos) en el tracto gastrointestinal.
Al igual que otros componentes de la fibra dietética, los polisacáridos del Pleurotus pueden actuar como prebióticos, estimulando el crecimiento de microorganismos probióticos; también, se ha demostrado que el material de la pared celular de levadura, rico en oligosacárido manano, es un prebiótico valioso.5
Por otra parte, se ha comprobado que los β-glucanos exacerban las toxicidades mediadas por endotoxinas y se sinergizan con impurezas inmunológicamente activas, contribuyendo a efectos inmunes adversos.3) Los componentes de la pared celular bacteriana, como los lipopolisacáridos (LPS) actúan como endotoxinas. Estos componentes desencadenan reacciones inmunes en humanos, caracterizadas por la inducción de fiebre y se denominan pirógenos.6
Según las buenas prácticas para la fabricación de productos biológicos del 2020, del Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED), es importante la realización de la prueba de pirógenos en conejos durante el proceso de validación del producto y en el control de calidad de la producción de los mismos.7) Durante décadas, este ensayo ha sido el estándar de oro de pruebas de pirógenos8) y consiste en medir el aumento de temperatura corporal en el conejo, provocado por la inyección intravenosa de una solución estéril de la sustancia a examinar.7
El objetivo del presente estudio fue evaluar, in vivo, la pirogenicidad de extractos acuosos obtenidos del micelio y cuerpos fructíferos de P. ostreatus y de un biopreparado de la levadura K. marxianus, para garantizar que los efectos inmunomoduladores de estos candidatos prebióticos, respondan solo a la presencia de los polisacáridos que contienen y puedan aplicarse en tratamientos inmunonutricionales sin riesgo alguno.
Método
Microorganismos utilizados
Se utilizaron cepas de P. ostreatus (CCEBI-3024) y K. marxianus (CCEBI-2011), de la Colección de Cultivos Microbianos del Centro de Estudios de Biotecnología Industrial (CCEBI).
Obtención de bioproductos
Extracto de cuerpos fructíferos de P. ostreatus:
Los cuerpos fructíferos se obtuvieron de la planta de producción de setas comestibles del Centro de Estudios de Biotecnología Industrial (CEBI). El ciclo productivo se desarrolló bajo condiciones de cultivo sanitarias, por la tecnología de fermentación en estado sólido (FES), sobre sustrato pulpa de café. Se obtuvo el extracto por decocción de 500 g de cuerpos fructíferos, cortados en piezas de 1 cm2, aproximadamente. Se procedió a la extracción con 5 mL de agua destilada por gramo, a 90-100 ⁰C durante 10 horas. El bioderivado obtenido fue concentrado hasta la tercera parte del volumen y centrifugado (3 000 rpm) durante 10 minutos en centrífuga (HealForce®, Neofuge 15, China). Luego se filtró con membranas de 0,2 μm (Merck Millipore, Alemania) y se liofilizó en liofilizador (Alpha 1-2 LD Plus, Alemania).
Extracto de micelio de P. ostreatus:
Se usaron placas Petri, con un crecimiento micelial total, del cuarto de colonización y cultivo del CEBI. El inóculo de las placas, se cultivó por fermentación sumergida (FS) en medio extracto de levadura peptona glucosa (YPG), a 22 ⁰C con agitación (120 rpm) en zaranda (HDL, China) durante 10 días. La biomasa obtenida fue separada del medio de cultivo, lavada con agua destilada estéril y pesada en balanza digital (Scout Pro, SPUt23, China). A 200 g de biomasa húmeda, se les añadió 5 mL de agua destilada por gramo de peso y se procedió al tratamiento térmico durante 6 h con agua hirviendo (90-100 ⁰C). El extracto obtenido fue concentrado hasta la tercera parte del volumen y centrifugado (3 000 rpm) durante 10 min en centrifuga (HealForce®, Neofuge 15, China). Luego se filtró con membranas de 0,2 μm (Merck Millipore, Alemania) y se liofilizó en liofilizador (Alpha 1-2 LD Plus, Alemania).
Biopreparado de levadura K. marxianus:
La levadura, previamente propagada en medio YPG, se sembró en placas Petri para obtener el inóculo que posteriormente fue sembrado en tubos con agar nutritivo. Del crecimiento obtenido, se inoculó en medio YPG y se incubó durante 12 h a 35 ⁰C con agitación constante (150 rpm) en zaranda modelo Mizard 2001. El resultado se centrifugó (7 500 rpm) en centrífuga (Heal Force®, Neofuge 15, China). Fue desechado el sobrenadante y el sedimento se lavó con 40 mL de agua destilada estéril. Se repitió tres veces el proceso de centrifugación y lavado. La biomasa resultante fue liofilizada en liofilizador (Alpha 1-2 LD Plus, Alemania).
Contenido de carbohidratos totales en los extractos de Pleurotus:
La concentración de carbohidratos en los extractos fue determinada por la técnica del fenol sulfúrico.9 Se elaboró una curva de calibración con una solución patrón de glucosa (concentración 100 ug/mL). Las absorbancias fueron leídas (490 nm) en espectrofotómetro (Thermo Fisher Scientific, G10S UV-Vis, China).
Caracterización del biopreparado de K. marxianus:
Se realizó el análisis bromatológico (proximal) según los métodos utilizados por Serrat y col. (En: IX Congreso Internacional sobre Azúcar y Derivados. ICIDCA. La Habana, 2006). Se centrifugó un cultivo en operación continua (Beckman J2-MC, rotor JCF-Z, Estados Unidos) a 10 000 rpm y 10 ⁰C, con flujo de alimentación de 250 mL/min. La biomasa sedimentada se colectó y secó (80 ⁰C) en un horno a vacío (TECNAL, TE-395, Brasil). Posteriormente, se pulverizó y se tamizó (malla 0,5 mm). La humedad y las cenizas se determinaron mediante secado a 105-110 ⁰C e incineración a 550-600 ⁰C, respectivamente. El contenido de proteína bruta se estimó del nitrógeno total según método de Kjeldahl. La grasa bruta se determinó a partir de la pérdida de peso de la muestra seca, después de la extracción continua con éter etílico durante 4 h. Los ácidos nucleicos se estimaron de la diferencia de las absorbancias a 270 nm y 290 nm. El contenido de carbohidratos se calculó mediante la siguiente ecuación:
% carbohidratos = 100 - % cenizas - % grasa bruta - % proteína bruta - % ácidos nucleicos.
Animales
Se utilizaron conejos de Nueva Zelanda F1 hembras (peso 2-2,3 kg) obtenidos del Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB) La Habana, Cuba. Fueron mantenidos en el vivario del Centro de Toxicología y Biomedicina (TOXIMED), de Santiago de Cuba, en condiciones de temperatura (22 ± 3 ⁰C) y humedad relativa (70 %). Se alimentaron con pienso peletizado proveniente de CENPALAB y agua esterilizada a libre demanda. Los animales permanecieron 7 días, en período de aclimatación a las condiciones del local de experimentación y se distribuyeron a razón de 1 conejo por caja. Las observaciones clínicas durante el ensayo incluyeron, fundamentalmente, el comportamiento y el estado físico general. Se prestó especial atención a los cambios en la piel y el pelaje, así como a los sistemas respiratorio, circulatorio, nervioso central y autónomo y a la actividad somatomotora.
La metodología y el diseño experimental cumplieron las buenas prácticas de laboratorio (BPL) según lo establecido por el International Council for Laboratory Animals Science (ICLAS) y se realizó de acuerdo a lo previsto en los procedimientos normalizados de trabajo de los departamentos de Farmacología y Vivario de TOXIMED.
Prueba de Pirogenicidad:
Se administraron las sustancias de ensayo por vía endovenosa, inyectando lentamente la solución en la vena marginal de la oreja de los conejos, durante un período no superior a 4 minutos.
El volumen inyectado (1 mL) de cada sustancia, a las concentraciones 1,0 y 10,0 mg/mL, se determinó por el peso individual del animal para que recibieran dosis de 0,5 y 5,0 mg/kg de peso respectivamente. Se conformaron 6 grupos de estudio, de 3 animales cada uno, correspondientes a las sustancias a ensayar (Tabla 1).
Se determinó la temperatura inicial y máxima de cada animal, empleando un termómetro digital RG Medical Diagnostic, Estados Unidos (Sensibilidad 0,01 ⁰C). La temperatura inicial de cada conejo es la media de dos lecturas realizadas, en un intervalo de 30 minutos, en los 90 minutos anteriores a la inyección del producto a examinar. Se retiran del ensayo aquellos animales con una temperatura inicial superior a 39,8 ⁰C o inferior a 38,0 ⁰C. La temperatura máxima de cada conejo, es la temperatura más alta registrada en las 3 horas siguientes a la inyección. Se registró la temperatura de cada conejo a intervalos de 30 minutos, comenzando 90 minutos antes de la inyección del producto a examinar y continuando 3 horas después de dicha inyección. Se tomó como respuesta del animal, la diferencia entre la temperatura máxima y la temperatura inicial registrada. Cuando esta diferencia es negativa, el resultado se toma como respuesta cero.
Según la Farmacopea de Estados Unidos (USP), se toma como muestra positiva a pirogenicidad o a la presencia de endotoxinas, si la sumatoria del incremento de temperatura de los animales en cada grupo, es superior a 3,30 ⁰C. Se toma como sustancia libre de pirógenos, si presenta un aumento promedio inferior a 0,5 ⁰C. Al concluir las 24 horas de administración única y observación, se realizó el sacrificio humanizado mediante administración de una sobredosis del anestésico ketamina (vía intraperitoneal).
Los resultados fueron expresados como la media aritmética ± desviación estándar. El procesamiento se realizó utilizando el paquete de software estadístico Graph Pad Prism 7 (Windows, V. 7.04, 2017).
Resultados
Se obtuvieron 900 mL de extracto de cuerpos fructíferos de Pleurotus, a partir de 500 g de biomasa. A los 10 días de cultivo en medio YPG líquido, se observó la formación de masas miceliares de P. ostreatus en forma de pellets. Se obtuvo una biomasa fresca total de 336 g, en todo el volumen de medio utilizado. Se obtuvieron 200 mL de extracto concentrado del micelio, partiendo de 120 g de la biomasa húmeda.
La masa de levadura seca liofilizada, obtenida de 3 450 mL de cultivo, fue de 15,788 g.
Contenido de carbohidratos totales
La concentración de carbohidratos presentes, en función dela materia seca, fue de 70,8 % en el extracto de micelio y 35,7 % en el de cuerpos fructíferos.
Caracterización del biopreparado de levadura
En la composición bromatológica del biopreparado de levadura, se apreció un contenido de humedad y cenizas de 9,62 y 12,7 g/100 g, respectivamente. Mientras, el porcentaje de proteína bruta fue del 49,2 % y el de grasa bruta del 5,5 %. Así mismo, el contenido de ácidos nucleicos reportó un valor de 6,21 % y los carbohidratos totales resultaron en un 26,39 %.
Ensayo de pirogenicidad
El comportamiento de la temperatura en cada uno de los grupos estudiados, se muestra en el gráfico 1. Como se puede apreciar, las variaciones de temperatura fueron similares en todos los grupos experimentales. La temperatura bajó ligeramente, en los primeros 30 minutos posteriores a la administración de las sustancias de ensayo, luego con ligeras variaciones individuales fueron recuperando su temperatura basal, llegando en algunos casos a superar la inicial. En el caso del grupo L-KM (5,0 mg/kg), el aumento de temperatura alcanzó valores de 40,25 ⁰C a las 3 horas posteriores a la administración.
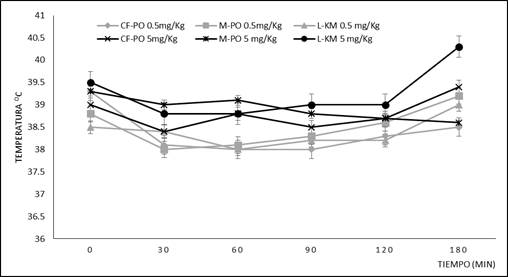
Gráfico 1 Comportamiento de la temperatura en los grupos experimentales. Los resultados se expresan como las medias aritméticas ± desviación estándar.
En la tabla 2 se observan los valores de temperatura inicial y máxima de cada grupo, así como los incrementos de las mismas. Como se puede apreciar, los grupos experimentales CF-PO (0,5 mg/kg) y M-PO (5,0 mg/kg) no registraron incremento, ya que las temperaturas máximas alcanzadas durante las 3 horas posteriores a la administración fueron menores que la temperatura inicial.
En los grupos M-PO (0,5 mg/kg), L-KM (0,5 mg/kg) y CF-PO (5,0 mg/kg) hubo ligeros incrementos de temperatura que oscilaron entre 0,34-0,45 ⁰C. En el caso del grupo L-KM (5,0 mg/kg) el aumento de la temperatura máxima con respecto a la inicial fue de 0,76 ⁰C.
En cuanto a la sumatoria de los incrementos de temperatura, los animales de los grupos M-PO (0,5 mg/kg), L-KM (0,5 mg/kg) y CF-PO (5,0 mg/kg), tuvieron incrementos entre 1,02-1,34 ⁰C. Mientras, en el grupo L-KM 5,0 (mg/kg), la sumatoria se elevó hasta los 2,29 ⁰C.
Discusión
La producción de biomasa P. ostreatus se realiza por fermentación en estado sólido o en estado líquido. La fermentación sumergida (en estado líquido) permite la producción de biomasa fúngica en condiciones controladas, espacio y tiempo reducidos y con menores probabilidades de contaminación.10 La fermentación en medio sólido es una tecnología que permite obtener bioproductos de gran utilidad para el desarrollo de las industrias alimentaria y médico-farmacéutica.
Los procedimientos de obtención de extractos, a partir del micelio y de cuerpos fructíferos de P. ostreatus, así como, de la biomasa húmeda de levadura K. marxianus, han sido desarrollados en diferentes estudios, por investigadores del Centro de Estudios de Biotecnología Industrial como Ferrer, et al.10, Beltrán, et al.11 y Serrat, et al. Los bioproductos obtenidos en este estudio, exhibieron la calidad necesaria y permitieron disponer del material necesario para los ensayos.
Evaluar la presencia de carbohidratos, en los bioderivados fúngicos, garantiza su valor de uso como prebióticos. En estudios realizados por Morris, et al.12, los extractos acuosos del micelio y cuerpos fructíferos de P. ostreatus, presentaron valores de carbohidratos en un intervalo de 36-70 %. Además, de la presencia de polisacáridos (1,3)-(1,6)-β-glucano, que aportan la mayor parte de la actividad biológica.12) Estos valores de carbohidratos, se encuentran en el rango descrito para hongos comestibles-medicinales, al igual que los obtenidos en este estudio. En la composición bromatológica del biopreparado de K. marxianus, se apreció un rico contenido nutricional que incluyó a los carbohidratos, similar a lo reportado por Serrat, et al.
La pirexia o fiebre es una respuesta compleja del organismo, que puede producirse por la acción de organismos infecciosos o durante procesos inflamatorios no infecciosos. La elevación de la temperatura ocurre cuando la concentración de prostaglandina E2 (PGE2) se incrementa en determinadas zonas del cerebro. Este aumento de la PGE2 afecta las neuronas que controlan el centro de termorregulación del hipotálamo. En el modelo clásico de la patogenia de la fiebre, la inducción de esta respuesta se asocia con la liberación de citoquinas pirogénicas a la sangre en presencia de un pirógeno exógeno.13
Las levaduras han sido ampliamente estudiadas como agentes pirogénicos, investigaciones con Candida albicans y Saccharomyces cerevisiae, demuestran que estos hongos son capaces de producir pirexia en conejos por la administración endovenosa de extractos del microorganismo, y preparados de su pared celular. La mismal puede aparecer a los 30 minutos y permanecer hasta 10 horas.14 Dentro de las levaduras, S. cerevisiae ha sido uno de los modelos de pirexia mejor caracterizados. Constituyentes de su pared celular (polisacáridos y manano-oligosacáridos), se asocian con el incremento en el plasma de Interleucina-1β, Interferón-γ y factor de necrosis tumoral-α. Estos mediadores actúan en el sistema nervioso central a nivel del organum vasculosum de la lámina terminalis, donde inducen la síntesis de prostaglandinas (mediador primario de la fiebre).15
Por estas razones, se podría esperar en esta investigación que la administración endovenosa del biopreparado de levadura K. marxianus fuera capaz de provocar pirexia. Sin embargo, a la luz de los resultados obtenidos y de estudios anteriores en estos hongos, se puede decir que, a la concentración 1,0 mg/mL (dosis 0,5 mg/kg) no se presentaron signos y síntomas de pirexia en los animales.
La pirexia inducida por S. cerevisiae y otras levaduras, ha sido descrita a concentraciones elevadas de las mismas. Según estudios de Ahmad (15, dosis de 600 mg/kg de peso de S. cerevisiae, administrada en conejos por vía subcutánea, es capaz de provocar incrementos de temperatura entre 0,5-2,0 ⁰C durante 4 horas.15) Otros autores emplean dosis de hasta 2,0 g/kg, en ratas como biomodelo de pirexia para la evaluación de propiedades antipiréticas de diferentes sustancias.16
Si se tiene en cuenta que, las dosis empleadas en este estudio fueron de 0,5 y 5,0 mg/kg, se podría dar respuesta a la no aparición de un aumento de temperatura significativo. En los cinco primeros grupos evaluados, la diferencia de temperatura no excedió los 0,5 ⁰C, lo que sitúa a estos extractos en la categoría de libre de pirógenos, a esas concentraciones. En el caso del grupo L-KM (5,0 mg/kg), el incremento de temperatura excede los 0,5 ⁰C y no puede ser clasificado como sustancia libre de pirógenos. Sin embargo, al analizar la sumatoria de los incrementos de cada conejo en el grupo, el valor no excede los 3,30 ⁰C y tampoco se puede afirmar que contenga endotoxinas. En este caso, la USP sugiere que debe repetirse del estudio, incrementando el número de animales de experimentación hasta lograr su clasificación definitiva.
Los LPS constituyen inmunoestimulantes fuertes, su efecto inductor de fiebre es bien conocido y la sangre humana es extremadamente sensible a estos pirógenos. Por eso, la mayoría de las pruebas pirogénicas se realizan para evitar la contaminación de productos administrados por inyección. Sin embargo, recientemente, se ha cuestionado la seguridad de los complementos alimenticios que contienen LPS y los fármacos probióticos como inmunoestimulantes, aunque estos productos se toman por vía oral y no llegan al torrente sanguíneo sin digerir.8
Según la Farmacopea Europea, no hay límite disponible para las endotoxinas en productos de administración oral. No existe una dosis oral segura de LPS, en alimentos o complementos alimenticios, porque no resulta tóxico cuando se ingiere. Por vía oral, la ingesta no produce fiebre ni otros efectos conocidos. Sin embargo, un sistema inmunológico débil aumenta la posibilidad de que se desarrollen complicaciones. Los bebés, particularmente recién nacidos, cuyo sistema inmunológico aún no está completamente desarrollado, los pacientes ancianos y graves, así como individuos inmunodeprimidos, corren mayor riesgo, especialmente si sus superficies mucosas están perforadas. También, un intestino dañado, canceroso o inflamado, puede permitir que las bacterias ingresen al torrente sanguíneo.8
Por estas razones, resulta importante que los biopreparados para aplicaciones inmunonutricionales estén libres de endotoxinas. El estudio realizado garantiza que los extractos de Pleurotus puedan aplicarse como prebióticos en investigaciones sucesivas, sin riesgos para la salud o de mostrar un efecto potenciado por la presencia de impurezas. Sin embargo, una posible limitación, es que solo se utiliza un método de evaluación indirecto.
Conclusiones
Los extractos de P. ostreatus y el biopreparado de K. marxianus (0,5 mg/kg), no indujeron un aumento de temperatura significativo en los animales, según lo establecido por la USP, lo cual sugiere, que en estos bioproductos no existen niveles de endotoxinas que puedan provocar pirogenicidad.