Introducción
Las sustancias antioxidantes constituyen un blanco importante de la investigación científica médica de la actualidad. Este hecho está avalado por el elevado número de enfermedades asociadas al desequilibrio oxidativo en el organismo. Patologías como la inflamación crónica y desórdenes cardiovasculares y neurodegenerativos, diabetes tipo 2, cáncer y osteoporosis son algunas de las que describe la bibliografía con una mayor frecuencia, aunque no son las únicas.
Entre las causas generadoras de estrés oxidativo se encuentran la exposición a agentes externos como las radiaciones ionizantes, la contaminación ambiental, el humo del tabaco, tóxicos por ingestión, infecciones microbianas, el estrés, entre otras. Estas causas, a menudo, logran rebasar la capacidad de defensa del organismo (sistema enzimático endógeno) generando lo que se conoce como estrés oxidativo. En esos casos, la ingestión de suplementos antioxidantes puede resultar una buena alternativa para restituir el equilibrio alterado. Existen muchos tipos de antioxidantes, tanto naturales como sintéticos. Las plantas constituyen un reservorio importante de sustancias antioxidantes, pues estos compuestos juegan un papel importante en el proceso de aclimatación y adaptación de los vegetales a los cambios medioambientales. Entre los más conocidos e importantes se encuentran las vitaminas C y E, carotenos, licopenos, flavonoides y polifenoles, en general.1
Spondias mombin L. es una planta silvestre perteneciente a la familia Anacardiaceae con una amplia distribución tropical. Tradicionalmente, las hojas de la especie han sido empleadas como antifúngico e hipocolesterolémico2, así como anticolinesterásicas.3) Según Cabral, et al., los extractos de Spondias mombin L. disminuyen la concentración de radicales libres y actúan previniendo la inflamación.4 Desde un punto de vista fitoquímico, la especie Spondias mombin L. resulta una gran productora de compuestos fenólicos como la quercetina, ácido elágico, catequinas y rutina, además, de flavanonas, taninos, saponinas y quinonas.5,6
A pesar de estos antecedentes, en la revisión realizada, la inmensa mayoría de los estudios de actividad antioxidante consideran al fruto como su objeto de estudio, aportando pocas evidencias del efecto antioxidante de las hojas. Además, aquellos trabajos donde se evalúa este órgano (hojas), lo hacen para uno o dos ensayos solamente, dejando inconclusa una evaluación objetiva e integral del poder antioxidante de extractos preparados a partir de las hojas de esta especie. Es por ello, que en el presente trabajo se traza como objetivo la evaluación del potencial antioxidante mediante seis ensayos del extracto hidroalcohólico al 70 % de hojas de Spondias mombin L.
Método
Material vegetal. Preparación del extracto
Las hojas de Spondias mombin L. fueron colectadas en el poblado de “El Caney”, en la provincia de Santiago de Cuba (latitud 20,05; longitud: 75,77), procedentes de una población de la especie formada por al menos seis individuos adultos y aparentemente sanos. Luego de colectadas, las hojas fueron lavadas y secadas en estufa hasta peso constante a 40 °C. Posteriormente, se trituraron mecánicamente 50 g del material seco, añadiendo 150 mL de solvente (etanol 70 %) en un matraz aforado con tapa de 250 mL y dejando macerar por 48 horas. El extracto así obtenido fue concentrado hasta un volumen de 50 mL por rotoevaporación a una temperatura de 40 ± 2 °C, auxiliados de un rotoevaporador (IKA RV Basic, Alemania). De tal forma, el extracto fluido obtenido presentó una concentración equivalente de un 1 g de material vegetal por mL de extracto.
Caracterización de los extractos. Determinación de los sólidos totales
Considerando que el método, solvente y proporción de preparación del extracto de S. mombim, han sido caracterizados recientemente por el grupo de investigación6, se decidió monitorear la calidad del mismo solamente mediante la determinación de los sólidos totales, como expresión de la cantidad y calidad del proceso extractivo. Para ello se empleó la metodología descrita por el grupo de investigación6, realizando el ensayo por triplicado y expresando los resultados en puntos porcentuales calculados a partir de la siguiente ecuación:
St= (Pr-P)/Vx100 (Ecuación 1)
Donde:
Actividad antioxidante
La actividad antioxidante del extracto fluido en etanol al 70 % de S. mombim fue evaluada a partir de seis ensayos descritos en la literatura. Considerando que la acción antioxidante de una sustancia o extracto puede ser ejercida por diferentes mecanismos químicos, los ensayos fueron divididos en tres bloques o grupos. En un primer grupo se colocaron los ensayos que evalúan directamente la reducción del agente oxidante por cambios en los grados de oxidación de la sustancia evaluada (índice de oxidación y poder reductor). El segundo grupo estuvo conformado por aquellos ensayos en los que se inactiva un radical libre (de origen químico) por acción directa del extracto (inhibición del radical 1,1-difenil-2-picryl-hydrazylo (DPPH), inhibición del radical ácido 2,2-azino-bis-(3-etil benzotiazolin-6-sulfónico (ABTS)), mientras que en el tercer grupo se consideraron aquellos sistemas que generan y neutralizan radicales libres de igual naturaleza a los que se producen durante el estrés oxidativo en humanos (inhibición del H2O2, y la capacidad reductora del peróxido de hidrógeno u ORAC como se conoce internacionalmente).
Preparación de las diluciones de ensayo
Para evaluar la actividad antioxidante del extracto se preparó una disolución concentrada de 1 000 µg/mL, en base a los sólidos totales y se empleó etanol al 70 % como disolvente. A partir de esta se realizaron diluciones seriadas 1:2, 1:4, 1:8, 1:16. De esta forma, se evaluaron concentraciones entre 1000 y 62,5 µg/mL. Este mismo proceder y concentraciones fueron empleados en los seis ensayos realizados.
Reactivos y equipos empleados
El permanganato de potasio (KMNO4), ferricianuro de potasio y el ácido tricloroacético procedieron de la firma alemana Riedel-de Haën. De Alemania también, pero de la firma Fluka procedió el ácido ascórbico y el cloruro férrico (FeCl3). La quercetina, fluoresceína; ácido 6-hidroxi-2,5,7,8-tetrametilcromano-2-carboxílico (TROLOX); radical 1,1-difenil-2-picryl-hydrazylo (DPPH); ácido 2,2-azino-bis-(3-etil benzotiazolin-6-sulfónico) (ABTS); 2,2-azobis- 2-amidinopropano (bicloruro) (AAPH) y el ácido tiobarbitúrico (TBA) proceden de la compañía Sigma-Aldrich, Estados Unidos. El ácido sulfúrico (H2SO4) de la BDH, Inglaterra, mientras que el peróxido de hidrógeno (H2O2) y el buffer fosfato de UniChem, China.
La centrífuga empleada fue modelo Tehtnica ŽELESNI (República Checa), el espectrofotómetro modelo T60 (China), y el vortex Heidolph REAX 2000; el lector de microplacas TECAN GENiosy el baño termostatado Carl Roth SC 150 fueron de procedencia alemana.
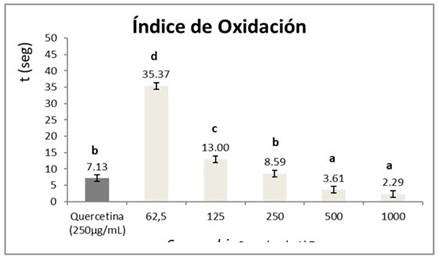
Determinación del índice de oxidación
Este índice permite definir el tiempo de decoloración, medido en segundos, de una solución de KMNO4 (0,1 N) por acción de los compuestos antioxidantes a evaluar. El fundamento químico de este ensayo, es la reducción del ion permanganato (color violeta y estado de oxidación +7) en medio ácido hasta el catión Mn2+ (incoloro y estado de oxidación +2). Se siguió la técnica descrita por Guanche Gallardo, et al.7 Brevemente: a 0,50 mL de las disoluciones del extracto a evaluar se le añadió 1 mL de H2SO4 al 20 % se agitó y se mantuvo la mezcla en un rango de temperatura entre 18 y 20 °C. Posteriormente, se le adicionaron 50 µL de solución de KMnO4 al 0,1 activando simultáneamente el cronómetro. El tiempo de decoloración se midió cada 20 segundos, empleando como control positivo una solución de quercetina (250 µg/mL).
Determinación del poder reductor
El poder reductor se determinó según experiencias previas del grupo de investigación.8 Brevemente: a 2,5 mL de los extractos a evaluar se le añadió 2,5 mL de ferricianuro de potasio (10 g/mL), incubándose por 20 minutos a 50 °C. Una vez frescas las muestras, se añadieron 2,5 mL de ácido tricloroacético (100 g/mL) para luego centrifugar (2 000 rpm) por 10 minutos. Posteriormente, se tomaron 5 mL del sobrenadante al cual se le añadieron 5mL de agua destilada y 1 mL de FeCl3 (1 g/L). Se midió en espectrofotómetro la absorbencia a 700 nm contra un blanco preparado con agua destilada. El poder reductor se expresó como la concentración del extracto al cual se alcanza el 50 % de la absorbencia máxima (IC50). Se empleó ácido ascórbico como control positivo.
Inhibición del radical DPPH
El radical DPPH es un radical de relativa estabilidad química, pero que en solución es reducido por la acción de sustancias con actividad antioxidante. Este método fue desarrollado siguiendo las experiencias del grupo de investigación.8 Brevemente: a 0,25 mL de los extractos a evaluar se les añadió 1,5 mL de solución de DPPH (0,1 mM). La mezcla fue mezclada con vortex y mantenida en la oscuridad por 20 minutos. Luego se midió la absorbencia a 517 nM. El ácido ascórbico (1 mg/mL) fue empleado como control positivo. El porcentaje de inhibición del DPPH fue calculado empleando la siguiente ecuación (Ecuación 2), informándose la concentración necesaria para lograr inactivar el 50 % del radical añadido expresado como IC50. Se empleó ácido ascórbico como control positivo.
% inhibición = ((Abs control-Abs muestra)/Abs control) × 100 (Ecuación 2)
Inhibición del radical ABTS
La inhibición del radical ABTS se realizó siguiendo la estandarizada por el grupo de investigación.8) Brevemente: 50 μL de cada extracto a evaluar fueron añadidos a 3 mL de la solución diluida de ABTS, dejándolos reposar por 90 minutos. Transcurrido este tiempo, se midió la absorbencia a 734 nm. Una solución de ácido ascórbico (1 mg/mL) fue empleado como control positivo. La capacidad de secuestro del radical ABTS fue expresada en porciento de inhibición del 50 % del radical añadido, expresado como IC50 y calculados por la Ecuación 2. Se empleó ácido ascórbico como control positivo.
Capacidad reductora del peróxido de hidrógeno
Se realizó siguiendo la metodología referida en la literatura.4 Brevemente: se preparó una solución de H2O2(10 mM) en buffer fosfato (pH 7,4), y se determinó su concentración inicial por medición espectrofotométrica a 230 nm, utilizando una absortividad molar de 81 cm-1. mol-1 L. A 3 mL de las muestras se le adicionó 1,8 mL de la solución tamponada deH2O2 recién preparada. Transcurridos 10 minutos, nuevamente es medida la absorbencia del H2O2 remanente a 230 nM contra un blanco de reactivos. Se empleó ácido ascórbico como control positivo.
Capacidad de neutralización del radical oxígeno (ORAC)
Se basó en la inhibición del radical piróxilo producido por la descomposición térmica del AAPH. Este ensayo se realizó siguiendo la metodología descrita por Mirghani, et al.9) y condiciones controladas de temperatura a 37 °C y pH 7,4. Brevemente: luego de preparadas las soluciones de AAPH (700 mM) y fluoresceína (4 x 10-6 M) se añadió a cada pocillo 20 µL de la muestra a ensayar o el control (TROLOX) y 120 µL de la solución de fluoresceína, incubándose a 37 0C. Posteriormente se añadieron 60 µL de solución de AAPH recién preparada para luego de 8 minutos medir en el lector de microplacas a una longitud de onda excitatoria de 493 nm y de emisión de 515 nm. EL valor ORAC se expresó en micromoles equivalentes de TROLOX por L ((M Tx/L), de acuerdo con la ecuación siguiente (Ecuación 3):
ORAC= (ABCmuestra - ABCcontrol)/ (ABCTrolox - ABCcontrol) ʄ[TROLOX] (Ecuación 3)
Donde: ABC significa área bajo la curva.
Análisis estadístico
Cada ensayo se realizó por triplicado y se determinaron su media y su desviación estándar. Los datos fueron procesados estadísticamente con el programa Statgraphics® versión 5,1. La significación estadística entre muestras se calculó por el test de T student cuando se trataba de comparación de dos muestras y análisis de varianza de un factor (ANOVA) cuando se trató de tres o más muestras. En este último caso, las diferencias significativas (p <0,05) entre ellas fueron determinadas por el método de las mínimas diferencias significativas de Fischer (LSD). En todos los cálculos e inferencias se realizaron con un 95 % de confianza. Regresiones lineales simples y logarítmicas fueron establecidas para la estimación de los IC50.
Resultados
Cuantificación de sólidos totales (St)
En la presente investigación el contenido de sólidos totales se determinó como una medida de las sustancias disueltas en el extracto y, en función de ello, expresar las concentraciones de las soluciones a evaluar. Los resultados obtenidos permiten definir una media de 50,4 ± 0,29 mg/mL de sólidos totales disueltos. Estos valores resultan superiores a los informados en estudios anteriores donde los valores oscilaban entre los 34 y 38 mg/mL.6 Dos factores podrían ser los responsables de este comportamiento: a) un proceso extractivo más eficiente y b) una muestra con mayor productividad metabólica generalmente asociada al metabolismo primario.
Determinación del índice de oxidación
El índice de oxidación se calculó a través de la medición del tiempo en segundos en que los compuestos presentes en el extracto y/o el patrón tardaron en decolorar la solución de permanganato. Un tiempo menor es indicativo de una mayor capacidad reductora del extracto sobre la solución de permanganato. La Figura 1 muestra los resultados obtenidos para este ensayo, apreciándose como el extracto evaluado a la concentración de 250 µg/mL consigue decolorar la solución de permanganato en un período de tiempo estadísticamente igual al que lo hace la sustancia patrón quercetina a esa misma concentración.
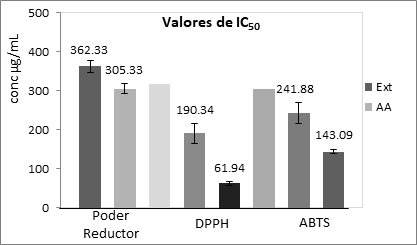
Determinación del poder reductor
Este ensayo está basado en la capacidad de los compuestos presentes en el extracto de reducir las especies de Fe3+ a Fe2+ por una transferencia electrónica directa. El incremento de la absorbencia a 700 nm (máxima para Fe2) es proporcional a la cantidad de Fe3+ reducido por los fitocompuestos. Para este ensayo, se tuvo una buena correlación lineal (R2= 0,960) entre los valores de absorbencia y las concentraciones empleadas, permitiendo con ello la determinación de las concentraciones inhibitorias medias o IC50. Para estimar los valores de IC50 se consideró en la variable dependiente en la ecuación matemática obtenida el valor de absorbencia de 0,700. Estos resultados se muestran en la Figura 2, en la que se observa que el ácido ascórbico presentó un IC50 inferior estadísticamente (Pvalor = 0,008) al extracto de S. mombin, no obstante, se pudo considerar bastante efectivo el extracto, visto que las diferencias matemáticas no fueron muy elevadas.
Inhibición del radical DPPH
El DPPH es un radical libre estable que es neutralizado mediante un mecanismo de transferencia de hidrógeno principalmente. Si el extracto evaluado posee actividad antioxidante directa, entonces será capaz de reducir al radical DPPH por acción directa sobre él, ya sea por transferencia de un electrón o de un radical hidrógeno. Dicho radical absorbe significativamente a 517 nm, por lo que la disminución de la absorción a esta longitud de onda se interpreta como la desaparición del mismo, producto de la acción del antioxidante de la sustancia evaluada. Para este ensayo, el valor aceptable del coeficiente de determinación permitió poder estimar los IC50 del extracto (R2= 0,806) y la sustancia control (R2= 0,898).
La Figura 2 muestra cómo el valor de la IC50 del extracto de S. mombines significativamente superior (Pvalor = 0,002) al obtenido para la sustancia control ácido ascórbico presentó un IC50 inferior estadísticamente al extracto de S. mombin. A diferencia del ensayo del poder reductor, las diferencias matemáticas entre las IC50 del extracto y el control fueron bastante más elevadas.
Inhibición del radical ABTS
El ABTS es un radical catiónico que puede ser reducido por compuestos que tengan un potencial redox inferior a 0,68 V, pudiendo reaccionar con facilidad varios compuestos fenólicos con un potencial de oxidación más bajo. Aunque con valores de coeficientes de determinación más bajos que los ensayos anteriores (R2= 0,761 y 0,846) para el extracto y la sustancia control respectivamente, fue posible estimar los valores de IC50. Los resultados de este experimento se muestran igualmente en la Figura 2, donde nuevamente la sustancia patrón (ácido ascórbico) resultó estadísticamente superior (Pvalor = 0,003) al extracto de S. mombim con valores de IC50 de casi la mitad con respecto al extracto ensayado.
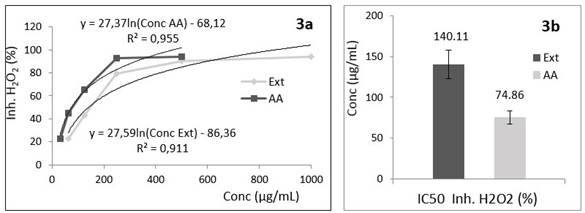
Capacidad reductora del peróxido de hidrógeno
El peróxido de hidrógeno como especie química clasifica como un oxidante débil. No obstante, posee una alta permeabilidad en las membranas biológicas y es capaz de generar el más nocivo y reactivo radical hidroxilo (OH▪) por reacción con Fe2+. Además, puede actuar desactivando algunas enzimas por reacción con los grupos tioles (-SH). Es generado endógenamente por el organismo y una de las especies químicas que más abundan cuando desarreglos metabólicos conducen al conocido estrés oxidativo. Estas características particulares hacen de este ensayo muy importante, pues a diferencia de los anteriores, la sustancia o extracto a evaluar deberá de ser capaz de neutralizar una de las especies reactivas de oxígeno que se genera en el funcionamiento de los seres vivos.
Los resultados obtenidos en este ensayo se muestran en la Figura 3. Nuevamente el extracto de S. mombim en etanol al 70 % clasificó como menos activo que el ácido ascórbico empleado como sustancia antioxidante de referencia (p=0,002). En este caso específico, no se logró una ecuación de una recta que describa con calidad estadística el fenómeno de captación del radical ni para el extracto ni para el ácido ascórbico. En consecuencia, una regresión logarítmica fue realizada (Figura 3a), calculando a partir de ella los valores de IC50 estimados en 140,11 y 74,86 µg/mL para el extracto y el ácido ascórbico respectivamente.
Capacidad de neutralización del radical oxígeno (ORAC)
De los métodos empleados, el ORAC es el único que combina el tiempo total de inhibición con el porcentaje de neutralización del radical en una misma cifra o valor numérico. Con ello, se ofrece la posibilidad de que, en una mezcla compleja, como resulta un extracto de planta, todos los antioxidantes presentes puedan reaccionar con los radicales generados, realizándolo en un gradiente equivalente a su potencial de oxidación-reducción o potencial Redox. En el presente experimento se calculó el valor ORAC para cada una de las concentraciones evaluadas, así como el comportamiento de las mismas a los 8 y 20 minutos, datos que se muestran en la Tabla 1.
Tabla 1 Capacidad de neutralización del radical oxígeno (ORAC) estimados para el extracto de Spondias mombim a los 8 y 20 minutos

Como se puede apreciar en la tabla, para ambos tiempos de medición existió una relación directamente proporcional entre la neutralización de los radicales de oxígeno y la concentración de los extractos, por lo que se puede afirmar que es un proceso concentración dependiente, tal y como ocurre en cinco test antioxidantes anteriormente presentados. De igual manera, y a juzgar por el p-valor calculado, se demuestra que a concentraciones cercanas a los 1 000 µg/mL del extracto de hojas de S. mombim se logró el máximo de neutralización para este extracto, pues los valores de ORAC obtenidos a esta concentración no difirieron estadísticamente entre sí. Sin embargo, a concentraciones inferiores se observaron diferencias significativas entre los tiempos de medición (las que son más marcadas a medida que la concentración disminuye), indicando que el proceso de neutralización de los radicales de oxígeno por el extracto de hojas de S. mombim ocurrió rápidamente a concentraciones elevadas, pero a medida que la concertación disminuyó, este proceso se enlenteció requiriendo de tiempos superiores a los 20 minutos para alcanzar el equilibrio Redox del sistema.
Discusión
Spondias mombin, es un árbol al que se le reportan estas propiedades antioxidantes, basados en su capacidad de síntesis de varios compuestos polifenólicos, carotenos de diversos tipos y, también, de la propia vitamina C. No obstante, la mayoría de estos reportes están relacionados con el fruto (de apreciable valor nutricional) y no con las hojas que es el órgano en estudio.
Los resultados obtenidos en el presente trabajo mostraron un extracto que presenta una cantidad de sólidos totales elevada y una buena actividad antioxidante, aun cuando en cinco de los seis test ensayados logró un poder superior a la sustancia de referencia. Es generalmente desaconsejable realizar comparaciones entre los resultados obtenidos en los test antioxidantes y, a su vez, entre el mismo test, pero en diferentes contextos, pues la variabilidad entre experimentos resulta importante. Además, también existen importantes diferencias entre las sustancias controles y las concentraciones de estas empleadas. La única excepción lo constituye el ensayo ORAC. En el mismo, se combinan en un único valor numérico el tiempo total de inhibición con el porcentaje de neutralización del radical. Este hecho y el de utilizar como único estándar valores equivalentes de TROLOX ha permitido realizar comparaciones entre muestras diversas.
Zapata, et al.10 exploraron la actividad antioxidante por el método ORAC de 24 frutas y 18 hortalizas colombianas de las de mayor interés comercial. Ellos mismos definen tres grupos según su capacidad antioxidante: 1) bajo poder antioxidante (menor de 1 000 (M Tx/L), 2) poder antioxidante medio (entre 1 000 y 5 000 (M Tx/L) y 3) elevado poder antioxidante (más de 5 000 (M Tx/L). Atendiendo a estos hechos, los valores obtenidos en la presente investigación (16 736,5 (M Tx/L) permitieron ubicar al extracto etanólico de Spondias mombin en una posición privilegiada, siendo superado entre las hortalizas solamente por la espinaca y con valores superiores a especies de frutas muy reconocidas como antioxidantes como la uva, la mora y la guayaba, por solo mencionar algunas.
Estudios precedentes demuestran que los extractos etanólicos de S. mombin están compuestos por una mezcla compleja de derivados fenólicos simples como los ácidos elágico y caféico, así como algunos flavonoides con núcleo base de quercetina y rutina.5,6,11) Además, se ha informado la presencia de otros compuestos antioxidantes como carotinoides12, aunque la concentración de los mismos es relativamente baja en consecuencia a su condición de metabolitos secundarios.
Esta mezcla heterogénea de compuestos anteriormente mencionados, unido a otros no determinados pero que integran la matriz de la mayor parte de los extractos vegetales (carbohidratos, proteínas etc.), es la que una vez retirado el solvente de extracción (expresados como sólidos totales) conforman la masa a partir de la cual se preparan las soluciones a evaluar. Por ello, los valores de IC50 determinados para el extracto evaluado resultaron coherentes y halagüeños. Cada uno de estos compuestos anteriormente mencionados posee un potencial de oxidación diferente y casi la totalidad de ellos inferior al del ácido ascórbico (sustancia de referencia en la mayor parte de los ensayos). Este aspecto le confiere desventajas a la hora de “valorar” el potencial antioxidante por comparación mera de las IC50, pero a su vez se convierte en una ventaja si se analiza el fenómeno del estrés oxidativo en los seres vivos como proceso.
El estrés oxidativo origina una cadena de reacciones en las que las especies oxidantes oxidan a componentes celulares, los cuales una vez oxidados se convierten en nuevas especies oxidantes que dañarán a otros componentes, generando un ciclo de reacciones Redox. Es por ello, que las sustancias con valor práctico como antioxidantes, deberán poseer no solo la capacidad de ser blanco de oxidación, sino también de “acomodar” la pérdida del electrón sin convertirse ella misma en una sustancia oxidante. La velocidad y eficiencia de cada reacción Redox está condicionada a la diferencia de potencial de oxidación entre el agente oxidante y la sustancia oxidada. Es precisamente en este punto, donde la coexistencia en el mismo extracto de varias sustancias con capacidad antioxidante (de diferentes potenciales de oxidación) se convierte en una ventaja práctica en sistemas complejos como lo son los seres vivos.
Esta característica del extracto etanólico de S. mombin podría ser una de las causas del por qué extractos de hojas de la especie resultan tan efectivos en biomodelos experimentales en donde el efecto antioxidante juega un papel central. Recientes evidencias in vivo sobre la actividad anti-angiogénica13, anticancerígena12, antiinflamatoria14) y en disfunciones del sistema nervioso autónomo15, dan fe de ello.
Conclusiones
El extracto de hojas de Spondias mombin L. en etanol al 70 % presenta una elevada acción antioxidante en los seis modelos experimentales ensayados, aun cuando en la mayor parte de casos con valores inferiores al de la sustancia de referencia empleada. Estos resultados conjuntamente con la diversidad estructural de metabolitos presentes en el mismo resaltan su valor como potencial antioxidante natural.