Introducción
Los hongos constituyen fuentes de compuestos con propiedades inmunofarmacológicas, que han resultado de mucho interés para la medicina tradicional de diferentes civilizaciones desde la antigüedad.1) Las setas comestibles-medicinales poseen una variedad diversa y robusta de moléculas bioactivas que ejercen más de 200 funciones medicinales diferentes.2) En las últimas décadas, los hongos medicinales se han utilizado en el desarrollo de importantes suplementos para la salud. Se ha informado que los consorcios de compuestos bioactivos y sus extractos son específicos para este objetivo.3
Existe un interés progresivo en la investigación de compuestos inmunomoduladores, a partir de fuentes naturales, que carezcan de consecuencias adversas y tengan utilidad en la práctica inmunoterapéutica. Desde un punto de vista clínico, los nuevos procedimientos para el desarrollo de inmunocéuticos obtenidos de setas, podrían constituir respuestas a diversas demandas de la inmunoterapia. La biotecnología de los alimentos basada en el aprovechamiento de los hongos comestibles, resulta una alternativa muy sugerente para la obtención de bioderivados con efectos inmunomoduladores y antitumorales.1
El Pleurotus se encuentra entre los géneros más estudiados como fuente de moléculas bioactivas con capacidad para modular la respuesta inmunológica. Pero, únicamente el 3% de las investigaciones sobre bioproductos naturales que arriba a las fases preclínica y/o clínicas están orientadas al trabajo con las setas comestibles. Un área menos estudiada, es el uso del Pleurotus en la estimulación del sistema inmune en relación a tratamientos nutricionales, que es el propósito fundamental de la “inmunonutrición”. Lo cual evidencia la importancia de la “micoterapia” como un área novedosa y promisoria.1
La salud está fuertemente relacionada con un equilibrio adecuado de las funciones inmunitarias que pueden ser mediadas directamente por las dietas, denominada "modulación inmunitaria por los alimentos". Estos estudios han ganado utilidad debido al uso de líneas celulares. Los compuestos alimentarios suelen estar integrados en diferentes matrices. Después del consumo oral, una matriz alimentaria pasa por el tracto gastrointestinal donde sus bioactividades podrían haberse modificado. Por lo tanto, se hace necesaria una simulación de la digestión gástrica in vitro para estudiar la estimulación de las células inmunitarias in vivo y ex vivo (Chanput W. En: Tesis para el título de doctor. Universidad de Wageningen, Wageningen, NL, 2012).
Por otra parte, el cultivo celular tiene un rol relevante en la investigación de nuevos tratamientos en un gran número de padecimientos.4) La línea celular Caco-2, se deriva de un adenocarcinoma colorrectal humano y se caracterizan por ser células de tipo epitelial. Es frecuentemente empleada en los estudios sobre la absorción de compuestos ya que exhiben particularidades propias de células intestinales maduras (Romero y Zabaleta. En: Trabajo para optar por el título de Químico Farmacéutico. Universidad de Cartagena, Cartagena de Indias, 2020).
Las THP-1 monocíticas se corresponden con una línea celular cancerígena, cuyas células pueden diferenciarse a macrófagos exponiéndolas a reactivos como el forbol-12 miristato-13-acetato (PMA).Por lo cual, ha sido utilizada para estudiar los monocitos y macrófagos en diferentes procesos inflamatorios (Gonzaga JF. En: Tesis de Maestría. Centro de Investigación y de Estudios Avanzados del Instituto Politécnico Nacional. Irapuato, México, 2016).
Por su parte, las células RAW 264.7pertenecen a una línea celular de macrófagos derivados de monocitos de ratones con leucemia. La utilización de esta línea de macrófagos murinos también es un modelo celular de inflamación, empleado de forma habitual (Arranz EM. En: Tesis doctoral. Universidad Autónoma de Madrid, 2013).
Para evaluar la citotoxicidad, generalmente se utilizan diversas técnicas de tinción celular con el objetivo de calcular, de forma indirecta, la cantidad de células vivas con posterioridad a un tratamiento. Un ensayo correcto para valorarla viabilidad celular y la citotoxicidad debe ser sencillo, rápido, eficiente, económico, sensible, reproducible, seguro y efectivo para la población celular viable, además de no mostrar interferencias con los compuestos evaluados.5
El método de resazurina resulta básico para apreciarla proliferación de las células después de ser tratadas y permite complementar los estándares utilizados para la evaluación del efecto citotóxico con la posterior determinación de la proliferación celular.5
El objetivo del presente trabajo fue evaluar, a través del ensayo de reducción del colorante resazurina, la actividad citotóxica sobre diferentes líneas celulares de extractos acuosos de Pleurotus ostreatus para garantizar su aplicación en futuros estudios inmunonutricionales.
Método
Preparación de muestras
Los extractos acuosos se obtuvieron, previamente, en la planta de setas comestibles y el laboratorio de cultivos del Centro de Estudios de Biotecnología Industrial de la Universidad de Oriente. A partir de la biomasa húmeda del micelio y de los cuerpos fructíferos de Pleurotusostreatus (P. ostreatus)se realizó la decocción (90-100 °C) y se liofilizaron.6) Los liofilizados fueron pesados en una balanza(METTLER TOLEDO, New Classic MS, España)y se resuspendieron (100 mg/mL) en agua ultrapura. Posteriormente, se obtuvieron los biopreparados en los medios de cultivo correspondientes, a concentraciones seriadas (512, 256, 128, 64, 32 y 16 µg/mL) y se conservaron hasta su utilización.
Cultivos celulares
En el Laboratorio de Microbiología, Parasitología e Higiene (LMPH) de la Facultad de Ciencias Farmacéuticas, Biomédicas y Veterinarias de la Universidad de Amberes, Bélgica, se realizaron los cultivos celulares y los ensayos para evaluar la citotoxicidad de los bioproductos.
Los extractos fúngicos se evaluaron en tres líneas celulares diferentes: células no adherentes THP-1 (pre-monocitos de leucemia humana),células adherentes Caco-2 (epitelio de adenocarcinoma de colon humano) y células adherentes RAW 264.7 (macrófagos murinos). Las líneas fueron adquiridas de la Colección Americana de Cultivos de Tejidos Tipo (ATCC, por sus siglas en inglés)(Manassas, VA, EE. UU.). Las células se sembraron en cabina de flujo laminar (clan LAF®, VFRS 1806, Holanda),se cultivaron en medios de acuerdo a sus especificaciones y en incubadora (BINDER, Alemania) a 37 °C con atmósfera húmeda (CO2 al 5%).
Las células THP-1 en medio RPMI 1640 (1X)(Gibco®, EE. UU.), suplementado con suero fetal bovino (iFBS, por sus siglas en inglés) (Gibco®, EE. UU.)al 10 %, L-glutamina (2 mM), higromicina (75 mg/mL) y Penistrep (1 %) (Sigma-Aldrich, EE. UU.).La línea celular Caco-2 se cultivó en DMEM(1X) (Gibco®, EE. UU.), suplementado con iFBS (Gibco®, EE. UU.)al 10 %, L-glutamina al 2 %,D-glucosa (4,5 g/L) y Penistrep (1 %) (Sigma-Aldrich, EE. UU.).Los macrófagos RAW 264.7 se mantuvieron a 37 °C, atmósfera de CO2 al 5 % en medio DMEM con FBS (Gibco®, EE. UU.)(10 %), L-glutamina (2 %) y 4,5 g/L de D-glucosa.7
Ensayo para evaluar la citotoxicidad
Se evaluó el efecto citotóxico por el ensayo de reducción del colorante resazurina sobre la viabilidad celular. Se utilizó la sal sódica de resazurina (Sigma-Aldrich, EE. UU.) como control estándar. El tamoxifeno se incluyó como fármaco de control de referencia para la citotoxicidad y se utilizó un lector de placas (TECAN GENios, Suiza) para la lectura.7
Las células adherentes crecidas (Caco-2) se retiraron con Tripsina-EDTA 0,05 %y centrifugaron a 130 g durante 10 mina 4 °C en centrífuga (Allegra®, X-15R, EE. UU.). Para el ensayo fueron sembradas 200 µL del inóculo de células (5 x 105 células/pocillo) en microplacas estériles de 96 pocillos e incubadas en incubadora (BINDER, Alemania) por 24 h a 37 °C yCO2 al 5 %.
Las células no adherentes (THP-1) se centrifugaron a 1 800 rpm/10 min y 4 °C. Se añadieron (5x105 células/pocillo) con 200 µL del medio fresco para ser incubadas.
Se agregaron 10 µL de tamoxifenoa los pocillos del control positivo. Las células de control negativo se incubaron únicamente con 200 µL del medio correspondiente. Al resto de los pocillos se añadieron los extractos en sus diferentes concentraciones y se incubaron las placas durante 24-48 h a 37 °C en CO2al 5 %.Transcurrido el tiempo de incubación, se añadieron 50 µL de resazurina (2,2 µg/mL) a cada pocillo y se midió la fluorescencia después de 4 h a 37 °C (excitación λ 550 nm, emisión λ 590 nm).
Se realizaron dos experimentos independientes y las muestras se ensayaron por triplicado en cada uno de ellos.
Procesamiento de datos
Se expresaron los resultados como la media aritmética ± desviación estándar, a partir del análisis estadístico realizado con el software Graph PadPrism 7 (Windows, V.7.04, 2017).Los resultados corresponden al Proyecto VLIR-UOP-3Natural Products and Pharmaceutical Services to improve the patient quality of life in Eastern Cuban Hospital´s.
Resultados
Los extractos ensayados en este estudio constituyeron un material con la calidad adecuada para su evaluación.
El efecto de los extractos fúngicos fue evaluado sobre la viabilidad celular de tres líneas celulares secundarias: línea de leucocitos humanos (THP-1), línea epitelial intestinal (Caco-2) y línea de macrófagos murinos (RAW 264.7) (Gráfico 1, Gráfico 2 y Gráfico 3). Se aplicó el ensayo de reducción resazurina como prueba indicativa de posibles daños a nivel de la mitocondria y, por tanto, en los procesos de respiración celular o actividad metabólica.7
El coloranteresazurina (azul no fluorescente) es reducido a resofurina (rosado muy fluorescente) por las oxidorreductasas presentes, fundamentalmente, en las mitocondrias de células vivas. La resofurinase excreta al medio y permite la observación de la proliferación celular o la citotoxicidad de compuestos sobre diferentes tipos celulares, incluidas las de hongos.5
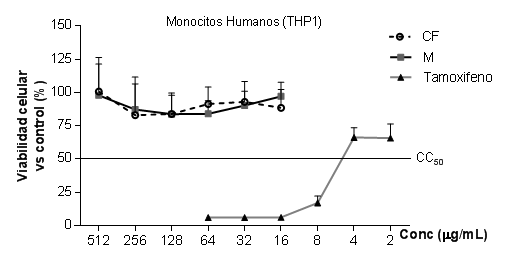
Gráf. 1 Efecto de extractos de Pleurotus (Cf y M) en la viabilidad celular de monocitos humanosTHP1. Resultados expresados como la media ± DE de 6 réplicas (n=6).Cf (cuerpos fructíferos). M (micelio). Tamoxifeno (control de referencia para la citotoxicidad).

Gráf. 2 Efecto de extractos de P. ostreatus en la viabilidad celular de células epitelialesde adenocarcinoma intestinal humano Caco-2. Resultados expresados como la media ± DE de 6 réplicas (n=6). Cf (cuerpos fructíferos). M (micelio). Tamoxifeno (control de referencia para la citotoxicidad).
Discusión
Los extractos de P. ostreatus ensayados resultan bioderivados con capacidad para potenciar la respuesta inmune.8Los carbohidratos y otros compuestos bioactivos presentes en ellos8,9,10,11podrían ser responsables de sus potenciales efectos prebióticosy garantizar sus posibles aplicaciones inmunonutricionales, una vez comprobada la ausencia de citotoxicidad sobre células del sistema gastrointestinal y del sistema inmune seleccionadas.
Diferentes líneas celulares han sido comúnmente utilizadas como modelos en ensayos de cocultivos y sistemas de monocultivos, diseñados para explorar efectos toxicológicos12y como estrategia para evaluar interacciones entre el microorganismo y el hospedero.13) En nuestras investigaciones, uno de los primeros estudios a realizar, consiste en descartar un posible efecto citotóxico de los bioderivados fúngicos sobre células implicadas en el estudio de candidatos prebióticos, capaces de estimular la inmunidad local en el intestino (ej. fagocitosis) o interferir en los mecanismos de adherencia de patógenos y favorecer la adhesión de bacterias beneficiosas al epitelio intestinal.
La línea celular monocítica THP-1, es la que se utiliza con mayor frecuencia para investigaciones sobre las funciones de los macrófagos humanos. La incapacidad de expandir las poblaciones de macrófagos ex vivo y su vida útil limitada en cultivo, han convertido a las células THP-1 en el modelo in vitropara rebasarlos inconvenientes del empleo de macrófagos primarios y ha resultado la línea más utilizada para determinar la respuesta de los macrófagos humanos a los estímulos proinflamatorios.14
Los cultivos de células Caco-2 y HT-29, han sido muy utilizados como modelos para el estudio de funciones específicas en células del epitelio intestinal. Estas líneas celulares permiten reproducir el fenotipo de células absortivas y mucosecretoras.15
Por otra parte, el método de reducción del colorante resazurina resultó adecuado y reproducible para la evaluación de la citotoxicidad de los bioderivados fúngicos. Se pudo comprobar la actividad metabólica expresada en los niveles de viabilidad de las células tratadas con las sustancias experimentales(extractos), en comparación con los efectos negativos observados sobre la viabilidad celular del compuesto (tamoxifeno), utilizado como control de referencia.
Según Escobar, et al.5) el colorante resazurina es poco tóxico para las células y permite la continuidad de estudios en las mismas células, lo que economiza tiempo y dinero, especialmente en cultivos primarios donde las células son muy escasas y preciadas. Además, el método es sensible y altamente reproducible.
Los resultados de este estudio sugieren que ninguno de los extractos evaluados ocasionó daño en los procesos metabólicos de las células, ya que estos no provocaron la disminución de la viabilidad celular. Por el contrario, se aprecia una ligera tendencia a la estimulación de la proliferación celular, dependiente de la concentración en las líneas de monocitos humanos (THP-1) y células epiteliales (Caco-2). Mientras, en los macrófagos murinos (RAW 264.7) se observó una tendencia de viabilidad muy estable en las diferentes concentraciones aplicadas. Lo anterior evidencia el efecto no citotóxico de los bioderivados fúngicos sobre estas poblaciones celulares.
La reducción de resazurina se ha descrito como un método variable según la línea celular valorada. Un estudio identificó cómo esto ocurre al evaluar CuSO4 a diferentes concentraciones en tres líneas celulares (hepatocitos de ratón, HepG2, y HeLa). Aquí el método detectó una citotoxicidad más rápida en las primeras líneas; sin embargo, en la línea celular HeLa, el resultado fue contrario. Esto puede indicar una sensibilidad diferente de esta línea. Por esta razón, algunos autores exponen la importancia de valorar individualmente las líneas celulares, ya que cada una posee propiedades metabólicas únicas que deben ser caracterizadas para determinar parámetros experimentales diferentes.5
Llauradó, et al.8 evaluaron la citotoxicidad de un extracto de P. ostreatus (HW-Pm) obtenido a 95 °C. El efecto se determinó mediante el ensayo de reducción del colorante resazurina, con la utilización de varias concentraciones (2, 4, 8, 16, 32, 64, 128, 256, 512 y 1024 µg/mL) del producto. El resultado arrojó que HW-Pm no fue citotóxico para las células RAW 264.7, ya que se observó una estabilidad en la viabilidad de las células a las diferentes concentraciones ensayadas.
En una investigación realizada para evaluar la actividad antimicrobiana de un extracto acuoso de la microalga Phorphyridiumcruentum se demostró, además, que este no ejerció actividad citotóxica sobre monocitos humanos THP-1 y macrófagos murinos RAW 264.7. El método de reducción de resazurina y las mismas concentraciones (512, 256, 128, 64, 32 y 16 µg/mL) utilizadas para evaluar el producto de nuestro ensayo fueron utilizadas por estos autores.16
En el presente estudio también se puede observar que los porcentajes de supervivencia celular obtenidos fueron muy parecidos entre las células tratadas con los diferentes extractos. Mientras, en la evaluación de la citotoxicidad de tres compuestos sintéticos sobre célulasHEp-2, HT-29 y HeLa, los resultados indicaron que en ninguna de las líneas celulares los compuestos causaron disminución significativa de la supervivencia celular con el empleo del método de resazurina. También se halló que las respuestas de porcentaje de supervivencia obtenidas fueron semejantes al evaluar los diferentes compuestos.5
Es importante que los biopreparados para aplicaciones inmunonutricionales no muestren citotoxicidad. Este estudio garantiza que los extractos de Pleurotus puedan aplicarse en investigaciones sucesivas, sin riesgos de posibles efectos adversos. Sin embargo, una probable limitación, es la utilización de un solo método para la evaluación de la viabilidad celular.
Conclusiones
Los extractos de Pleurotus ostreatus evaluados no afectaron la viabilidad de las células humanas (leucocitos y epiteliales intestinales), así como la de células inmunitarias murinas (macrófagos). Estos resultados avalan su empleo como posibles candidatos prebióticos y garantizan su seguridad para estudios inmunonutricionales posteriores, como pueden ser los ensayos de cocultivos entre leucocitos, células epiteliales y bacterias beneficiosas o patogénicas.















