Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
MEDISAN
versión On-line ISSN 1029-3019
MEDISAN vol.16 no.6 Santiago de Cuba jun. 2012
ARTÍCULO DE REVISIÓN
Sepsis y trastornos relacionados
Sepsis and related disorders
Dra. Andrea Hortensia Fariñas Vilela y Dra. Amarilis Dáger Haber
Hospital Infantil Norte "Dr. Juan de la Cruz Martínez Maceira", Santiago de Cuba, Cuba.
RESUMEN
La sepsis en el paciente pediátrico constituye unas de las principales causas de morbilidad y mortalidad a nivel mundial, representando un gran agobio para los sistemas de salud y la sociedad, hasta hace muy poco tiempo interpretada bajo las evidencias de lo descrito en el paciente adulto, pero dado los avances en su entendimiento fisiopatológico, hoy se reconoce como una entidad que adopta características propias en cuanto a su epidemiología, formas clínicas de presentación, patrones hemodinámicos y pronóstico. Su reconocimiento y manejo temprano es el reto que enfrentan los profesionales, con el objetivo de mejorar su pronóstico.
Palabras clave: sepsis, paciente pediátrico.
ABSTRACT
Sepsis in the pediatric patient constitutes one of the main causes of mortality at world scale, representing a great burden for health systems and for society, until recently interpreted under the evidences of descriptions in the adult patient, but taking into account its pathophysiological understanding, it is today recognized as an entity which adopts its own characteristics regarding its epidemiology, clinical presentation, hemodynamic patterns and prognosis. Its finding and early treatment is the challenge faced by professionals, with the objective of improving its prognosis.
Key words: sepsis, pediatric patient.
INTRODUCCIÓN
Uno de los principales problemas a lo que se enfrenta el pediatra en los servicios de urgencia y terapia intensiva es la sepsis, cuya fisiopatología compleja y rápidamente progresiva puede conducir a la muerte.
En épocas anteriores existió gran confusión terminológica sobre los conceptos de infección bacteriana, sepsis, septicemia, síndrome séptico y estado de choque séptico. La falta de una definición precisa para estos términos creó gran dificultad para valorar la gravedad de los procesos infecciosos y poder diferenciar las etapas clínicas producidas por estos. Como es lógico, este hecho generó inconformidad en la comunidad médica en general. 1- 4
No fue hasta agosto de 1991 que los miembros del Americam Collage of Chest Physicians (ACCP) celebraron, en los Estados Unidos, una conferencia de consenso donde delinearon los objetivos y acuerdos para una conceptualización uniforme que pudiera ser aplicada a la sepsis y sus trastornos relacionados.
En el marco de dicha conferencia, Roger Bone resumió en diferentes etapas evolutivas y con criterios clínicos simples, la relación sepsis-choque séptico, la que quedó estratificada en los estadios siguientes: 1) Infección; 2) Liberación de endotoxinas y productos microbianos; 3) Liberación de mediadores de la inflamación; 4) Sepsis;5) Síndrome séptico (SS) con disfunción multiorgánica (DMO) o sin esta; 6) Choque séptico con DMO o sin esta; 7) Recuperación o muerte como estado final.
Todos ellos constituyen distintas fases en el curso de un mismo proceso y en este contexto se debe valorar, tanto desde el punto de vista fisiopatológico y diagnóstico, como desde las acciones terapéuticas que cabe proponer ante una situación determinada. 3-9
De acuerdo con lo anterior, la sepsis y el estado de choque séptico se incluyen entre las condiciones fatales más frecuentemente encontradas en los hospitales pediátricos del mundo. Casi una tercera parte de los niños atendidos en las unidades de terapia intensiva son admitidos con el diagnóstico de sepsis y de 20- 40 % de estos presentan choque séptico. A pesar de los avances tecnológicos logrados en el cuidado especializado de estos pacientes y del advenimiento de una gran cantidad de fármacos antimicrobianos potentes, la letalidad atribuida a estas infecciones sistémicas severas no ha sido reducida de forma sustancial, oscilan entre 20 y 60 % de los niños afectados. Esta paradoja terapéutica tiene su explicación en los nuevos conocimientos fisiopatológicos obtenidos en años recientes. 1-6
En varias series publicadas sobre pacientes con síndrome séptico, los peores pronósticos estuvieron asociados con la edad, la adquisición de microorganismos virulentos resistentes a los antibióticos y el deterioro del estado inmunológico del huésped, previo al comienzo de la infección. Luego de establecido el proceso séptico, la hipotensión intratable, la leucopenia, la coagulación intravascular diseminada y la depresión de la función miocárdica, fueron factores que provocaron la muerte de muchos enfermos. 10 En Cuba, a pesar de los logros alcanzados en la prevención y control de las enfermedades infectocontagiosas, esta entidad nosológica constituye un problema de salud. Año tras año es responsable de una cifra no despreciable de muertes, especialmente en niños menores de un año.
I. CONSIDERACIONES GENERALES Y TERMINOLOGÍA
La sepsis representa un conjunto de manifestaciones sistémicas causadas por la respuesta inmune que ofrece el huésped a la infección, la cual está destinada, en un principio, a favorecer su defensa. El reconocimiento del diagnóstico de esta entidad clínica en el niño, ha transitado por un largo camino que comenzó hace más de 2 décadas, con la aparición de los trabajos de Bone et al 4, en relación con una terminología unificada para designar los procesos relacionados con el síndrome séptico 1-6, 9 (figura1), vigentes actualmente como sigue:
| TÉRMINOS | DEFINICIONES |
| Infección | Respuesta del huésped a la presencia o invasión, por un microorganismo patógeno, de un tejido normalmente estéril. |
| Bacteriemia | Presencia de bacterias viables en la sangre. |
| SRIS | Síndrome de respuesta inflamatoria sistemática de origen multifactorial. Se caracteriza por dos o más de los hallazgos siguientes. |
| Sepsis | SRIS debido a una infección. |
| Sepsis severa | Sepsis con hipovolemia y/o hipoperfusión tisular. Acidosis láctica, oliguria, hipoxemia, pulsos distales débiles, pobre llenado capilar, frialdad distal, alteración neurológica aguda e hipotensión arterial. ***Estas anormalidades se revierten rápidamente con la cargas de fluidos parenterales (<1 hora). |
| Sock séptico | Sepsis severa que no responde rápidamente a la reposición de volumen requiere del uso de drogas vasoactivas o inotrópicas. |
| MODS | Síndrome de disfunción orgánica múltiple. Es un fallo progresivo de tres o más sistemas orgánicos básicos, que mantienen entre sí una gran interdependencia. Las alteraciones en los mismos ocurren de forma aguda y coincidente en el tiempo, descartándose la afectación de aparatos o sistemas con enfermedad previa. La disfunción en estos casos es de tal magnitud que la homeostasis no es posible sin la actuación terapéutica. Los sistemas tomados en consideración son ocho. Respiratorio, circulatorio digestivo, hepático, renal, hemolinfopoyético, endocrinometabólico y nervioso (cuadro 1). |
El consenso internacional de Pediatría para la sepsis 5 plantea que el SRIS se caracteriza por:
- presencia de al menos 2 de los criterios
- temperatura central: > 38,5ºC o < 36ºC
- taquicardia o bradicardia
- polipnea (PaCO2 < 32 Toor
- conteo anormal de leucocitos
Se considera que existe disfunción orgánica si algunos de los criterios anteriormente enumerados están presentes. 3, 5, 11
Estos criterios, ampliamente reconocidos en el ámbito internacional, han sido adecuados a los diferentes grupos de edades por Fisher y Fanconi, convirtiéndose en un instrumento de incalculable valor para todos los médicos, pero en particular para los que tratan niños 12 (cuadro 2). Con el propósito de elaborar definiciones aplicables al paciente pediátrico, varias modificaciones fueron propuestas, hasta que aparece "La Conferencia Internacional de Consenso de Sepsis en Pediatría" 5, que amplió otras variables, según grupos de edades (cuadro 3).
El concepto de hemodinámicamente estable es impreciso y subjetivo, por lo que resulta imprescindible la toma y descripción de estos parámetros.
II. ETIOLOGÍA
La sepsis puede ser causada por diferentes agentes infecciosos. Entre los más frecuentes predominan las bacterias (Staphylococcus aureus, Streptococcus pneumoniae o Neisseria meningitidis), seguidas por los virus (adenovirus, citomegalovirus), parásitos (Toxoplasma gondii) y, con menor frecuencia, los hongos (Candida sp.), entre otros, de acuerdo con las características del huésped, la edad y el lugar de adquisición de la infección. 13, 14 Todos estos microorganismos pueden producir el mismo cuadro clínico y el motivo de ello será expuesto más adelante.
III. EPIDEMIOLOGÍA
La sepsis, a escala mundial, es la principal causa de muerte en niños y consumidora de sustanciales recursos de salud. Anualmente se notifica que 1,6 millones de neonatos mueren por infección 15 y 60 % de este total corresponden a enfermedades notificables en países en desarrollo. 16 El panorama mundial en relación con la sepsis no es homogéneo, en los países desarrollados como los EE.UU., las vacunas redujeron 99 % de las muertes a causa de las enfermedades que previene; mientras que la problemática de los países en desarrollo es otra, lo cual está en relación con la no aplicación de intervenciones relativamente simples que han demostrado ser efectivas en la disminución de la sepsis.
Según Manzano et al, 17 la sepsis ocurre aproximadamente en 1 de cada 10 000 pacientes hospitalizados, pero el estado de choque séptico solo sucede en una minoría de ellos.
La sepsis severa y el choque séptico constituyen la etapa final común de muchas enfermedades que llevan a la incapacidad o a la muerte a millones de niños en el mundo. Parafraseando lo señalado por la Organización Mundial de la Salud (OMS), la mayoría de las muertes de menores de 5 años sigue siendo provocada por una pequeña cantidad de afecciones, entre ellas: neumonía, enfermedad diarreica aguda, malaria y sarampión; asimismo, 80 % de las defunciones por esas causas podría atribuirse a sepsis. El problema adquiere suma importancia cuando se considera que un gran número de esos niños vive en diferentes partes del planeta, sobre todo en países tercermundistas, donde la disponibilidad de recursos para proporcionarles un tratamiento eficaz es muy limitada. 18 La mortalidad incrementa de 5 por ciento en SRIS al 55 por ciento en el Choque. Cada hora que el niño permanece en choque aumenta en doble la mortalidad.
En Cuba, desde hace varios años, una buena cantidad de defunciones consecutivas a infecciones en niños menores de un año ocurren en un cuadro de choque séptico. En el 2010, según informe del Anuario Estadístico de Salud, 19 la sepsis ocupó el quinto lugar entre las causas de muerte en los niños menores de 1 año y de 1 a 4 años, con tasas de 0,1 x 1 000 nacidos vivos y 0,1 x 10 000 habitantes, respectivamente. Por la trascendencia que tiene la muerte a estas edades, esta entidad clínica se mantiene como un problema de salud.
Como puede apreciarse, el proceso séptico constituye un verdadero problema de salud a escala mundial y a él contribuyen diferentes factores, entre los más importantes se encuentran: la poca accesibilidad a los servicios de asistencia médica, la no unificación de criterios relativos a la sepsis en años anteriores, el aumento de la supervivencia de los pacientes debilitados, crónicos e inmunodeprimidos, la mayor resistencia de los microorganismos patógenos a los agentes antimicrobianos empleados, el uso de procedimientos de diagnóstico y tratamientos más agresivos y la poca voluntad política de algunos gobiernos para mejorar las condiciones que perpetúan este fenómeno.
Entre los factores de riesgo de la sepsis figuran los biológicos y los sociales
- Biológicos
- Prematuridad (cobra importancia en el menor de 3 meses)
- Desnutrición proteicocalórica
- Enfermedades crónicas subyacentes
- Egreso hospitalario de menos de 7 días
- Antibioticoterapia inespecífica de menos de 48 horas de impuesta
- Factores genéticos (véase más adelante)
- Sociales
- Bajo nivel socioeconómico familiar
- Bajo nivel cultural familiar
- Mala calidad de la atención familiar al niño
- Poca accesibilidad a la asistencia médica
- Imposibilidad del seguimiento sistemático por el médico de familia
Dichos factores deberán buscarse siempre durante la evaluación individual de cada paciente y serán determinantes en la conducta final tomada con este. 10
IV. FISIOPATOLOGÍA
En los últimos años ha quedado establecido que el síndrome clínico de la sepsis es el resultado de la liberación, por el huésped injuriado, de mediadores endógenos fosfolipídicos y proteicos de la respuesta inflamatoria, la cual es inducida por los microorganismos invasores. Sea cual fuere el foco infeccioso inicial, lo más probable es que el inicio de la sepsis se deba a las toxinas liberadas por los agentes microbianos hacia el torrente circulatorio. Se ha demostrado que las toxinas circulantes activan los sistemas inmunológicos humoral y celular. Los leucocitos, a su vez, liberan mediadores muy potentes, entre los que se destacan el factor de necrosis tumoral, otras citoquinas, la histamina, las anafilotoxinas y los eicosanoides, por citar algunos.
La activación coordinada de esta cascada inmunológica tiene por objeto la defensa del organismo contra la infección, pero en algunos casos esta respuesta es exagerada y causa lesión celular al huésped y desencadena el síndrome clínico de la respuesta inflamatoria sistémica; esta última se hace evidente de 4 a 6 horas después que las primeras citoquinas alcanzan concentraciones plasmáticas suficientes.
Una vez iniciada la producción de los mediadores mencionados, el microbio infectante desempeña una función menor; por tanto, "la sepsis es una enfermedad del metabolismo intermediario, adquirida tras la exposición a agentes infecciosos que causan deficiencias en al aporte energético celular. Sus manifestaciones clínicas no solo están determinadas por la hipoperfusión hística, sino también por la incapacidad de las células para emplear con eficiencia los sustratos metabólicos existentes". 20-23
Hoy día se asume que en la sepsis clínica la respuesta temprana del hospedero se caracteriza por una hiperinflamación sistémica, la cual es seguida por una fase de hiporreactividad e inmunodepresión. La primera puede ser breve y causa mortalidad temprana; la segunda fase es refractaria, más larga y se desarrolla generalmente en el curso de la hospitalización por infección secundaria o enfermedades subyacentes, que provocan depresión del sistema inmune. 24
1. FACTORES GENÉTICOS
Se piensa que tanto el riesgo de adquirir la infección como el riesgo de desarrollar complicaciones graves, están determinados por factores genéticos del huésped. Estos incluyen defectos de genes únicos que afectan a receptores celulares; variantes genéticas que alteran la función de distintos mediadores inmunológicos, fisiológicos, y metabólicos, polimorfismos del ADN, específico de determinadas regiones genéticas. 25
2. CASCADA INFLAMATORIA
En condiciones normales, cuando se produce una invasión microbiana del organismo, el sistema inmune pone en marcha una secuencia de acontecimientos denominado cascada inflamatoria. El desarrollo patogénico del síndrome ocurre en el endotelio vascular, que se convierte entonces en el "escenario del drama" de la sepsis. Los actores principales son las endotoxinas y exotoxinas por parte del microorganismo patógeno, así como el macrófago y el neutrófilo, por parte del huésped. 26-28
Las bacterias gramnegativas poseen, en su pared celular, estructuras como el lipopolisacárido y el peptidoglicano; en tanto las granmpositivas contienen los ácidos lipoteicoico y murámico. En ellas existen patrones de ordenamiento molecular identificados por el sistema inmune a través de receptores denominados de reconocimiento de patógeno (RRP), entre los cuales se encuentran: el receptor de membrana CD14 y los receptores de familia Toll (TLRS, por sus siglas en inglés) como el TLR2 y el TLR4, los cuales reconocen los componentes estructurales de las bacterias grampositivas y gramnegativas. La interacción del agente patógeno con dichos receptores, sobre la membrana de los monocitos y macrófagos, inicia la liberación de citoquinas que activan la respuesta inmune e inflamatoria. 29, 30
Por otra parte, la activación celular que resulta de esta respuesta inmune conlleva a la diferenciación de estas células T en 2 tipos de poblaciones celulares: Th1, que secretan citoquinas proinflamatorias como interferón gamma (IFN-gamma), interleuquina 1b (IL 1b), interleuquina 12 (IL 12) e interleuquina 8 (IL 8); y Th2, productoras de citoquinas antiinflamatorias como interleuquina 4 (IL 4), interleuquina 10 (IL 10) e interleuquina 13 (IL 13). 26, 28 - 30
Las células Th1 y Th2 amplifican y dirigen la respuesta inmune adaptativa que media la adaptación del hospedero durante la infección. La proporción en la cual estas citoquinas son liberadas depende de las infecciones circundantes, de la susceptibilidad genética y de las condiciones coexistentes del paciente. 26
Asimismo, las citoquinas proinflamatorias como la IL6, el factor de necrosis tumoral alfa (TNF-alfa), la IL 8 y el IFN-gamma son detectadas en el plasma en las primeras 24 horas de su emisión. Desde el punto de vista clínico, existe un período silente que dura de 4 a 6 horas, a partir del cual comienzan los síntomas y signos sutiles de la respuesta inflamatoria sistémica (RIS): cambios en las frecuencias cardíaca y respiratoria, aparente estado gripal y alteración de la temperatura. 26, 30
La activación de los macrófagos, que sintetizan el TNF-alfa en el pulmón, los riñones y el hígado, estimula la producción por los linfocitos, los macrófagos y las células endoteliales de las siguientes citoquinas: interleuquinas, INF, factor estimulante de las colonias de neutrófilos (FECN) y factor activador plaquetario (PAF). El INF y la IL 1 estimulan la síntesis y liberación del óxido nítrico; al respecto, todos estos mediadores junto con el complemento activado (fracciones C5a y C3a) inducen la quimiotaxis de neutrófilos segmentados en los órganos diana (pulmón, hígado, y riñón) y dan lugar a su activación. El complemento activado provoca, además, la degranulación de los mastocitos, con liberación de histamina y serotonina, así como la activación del sistema de la kalicreína (kk), con la producción de bradiquinina. 26, 30-36
En relación con lo anterior, la activación de los neutrófilos tiene 2 consecuencias: su degranulación con la consiguiente liberación de enzimas proteolíticas y la producción de radicales libres de oxígeno. Estos últimos originan la peroxidación de los fosfolípidos de la membrana celular, cuya consecuencia es la formación de leucotrienos y protanoides como última estación de la cascada inflamatoria. 26, 33, 34
Los mediadores inflamatorios mencionados causan las disfunciones orgánicas que caracterizan el cuadro clínico: 26, 37
- Disfunción de la termorregulación debida a las interleuquinas IL 1 e IL 6, al tromboxano A2 (TxA2), la prostaglandina E2 (PGE2) y la prostaciclina.
- Disfunción respiratoria donde la taquipnea y la hiperventilación son provocadas por el TxA2, la PGE2 y la prostaciclina. El aumento de la permeabilidad alveolocapilar es causada por el TNF-alfa, IL1, IL8, PAF, las fracciones activadas del sistema de complemento C3a y C5a, la bradiquinina, la histamina, la serotonina, la elastasa de los leucotrienos y el TxA2.
- Disfunción cardiovascular en la que la taquicardia obedece a la acción de la PGE2, la prostaciclina y el TxA2. La hipotensión se debe a la caída del gasto cardíaco generada por el PAF y por factores depresores del miocardio como el NO, el TNF-alfa, al IL1 y al IL6.
- Disfunción metabólica dependiente del óxido nítrico que inhibe la respiración mitocondrial y produce una alteración en la utilización tisular del oxígeno. El estado de choque, junto con las acciones del TxA2, la PGE2 y la prostaciclina, son los responsables de la acidosis láctica. Al mismo tiempo, el TNF-alfa desencadena la liberación de hormonas del estrés (GH, ACTH y cortisol) determinantes de la hiperglucemia en la fase inicial del choque séptico. La IL1 estimula la síntesis de ACTH, cortisol e insulina.
- Disfunción renal, gastrointestinal y hepática que tienen su origen en la hipoperfusión tisular, la citoxicidad de NO, la citólisis producida por la activación del sistema de complemento y el edema intersticial. Este último es consecuencia del aumento de la permeabilidad capilar producido por el TNF-alfa, la IL1, la IL8, el PAF, las fracciones del complemento C3a y el C5a, la bradiquinina, los leucotrienos LTB4 y LTC4 y el TxA2. Por otro lado, el sistema reticuloendotelial del hígado, que actúa como filtro mecánico e inmunológico de la sangre portal en los pacientes sépticos, suele ser disfuncional y esto trae como consecuencia el paso de neutrófilos y citoquinas desde la microcirculación hepática hasta la circulación sistémica donde se produce la adhesión, acumulación y degranulación de los mismos órganos diana con la consecuente potenciación de la respuesta inflamatoria sistémica.
- Disfunción hematológica en la IL1 y el FECN estimulan la liberación de neutrófilos por la médula ósea que deriva en leucocitosis y desviación izquierda. Por otra parte, la acumulación de los neutrófilos en los órganos diana, seguida de su activación y degranulación, es responsable de la leucopenia. Esta adhesión de los neutrófilos segmentados es propiciada por el TNF-alfa por la unión de las fracciones activadas del sistema de complemento a sus receptores, por la IL1, la IL8 y el PAF. Además, la IL1 estimula la producción de linfocitos.
- Disfunción del SNC respecto a la cual, aunque existen datos que sugieren que las citoquinas proinflamatorias suprimen directamente la función de este sistema, los efectos acumulativos de la hipotensión y la hipoxemia pueden ser los responsables de los cambios agudos en el estado mental.
3. COAGULACIÓN Y SEPSIS
Las más recientes investigaciones sobre la fisiopatología de la sepsis, han demostrado la importante relación entre esta y los eventos asociados al proceso de la coagulación, como generadores y perpetuadores de los daños provocados por ésta en los diferentes órganos de la economía.
La expresión del factor tisular en el endotelio del paciente con sepsis, induce el fenómeno de la coagulación intravascular y lleva a la formación de grandes cantidades de trombina, que representa el elemento clave que inicia las reacciones de la coagulación asociada a la inflamación. Ella induce la activación leucocitaria, produce quimiotaxis activa para los macrófagos, altera la permeabilidad del endotelio capilar, disminuye los niveles fisiológicos de antitrombina 3, lo cual merma la fibrinólisis. La unión de la trombina a la trombomodulina produce la activación de la proteína C, que juega un papel fundamental junto a la antitrombina 3, en la disminución de la formación de la trombina y ayuda en la activación de la fibrinólisis para compensar los efectos del exceso de trombina circulante. En la sepsis, las células endoteliales no pueden sintetizar la trombomodulina normalmente, por lo que sus niveles decrecen y la proteína C no se activa. De esta manera, la trombina actúa sin retroalimentación negativa en la cascada de la inflamación, impide la fibrinólisis y desplaza el equilibrio hacia la coagulación. Ello genera éxtasis sanguíneo, microtrombosis, anoxia tisular, lesión endotelial y fuga capilar. Todos estos fenómenos perpetúan la respuesta inflamatoria en los distintos niveles del organismo. 39
4. APOPTOSIS
En 1972, Kerr describió la apoptosis como una forma de muerte celular que se considera el punto final de una secuencia de acontecimientos moleculares que ocurren por determinados estímulos. Esta se caracteriza por la fragmentación nuclear y la condensación de la cromatina en las células aisladas con el citoplasma retraído. Desde el punto de vista bioquímico, se destaca la acción de las caspasas (enzimas que hidrolizan proteínas), transglutaminasas (enlazan las proteínas fragmentadas), endonucleasas (fragmentan el ADN) y fosfatidil serina y trombospondinas (glicoproteínas de la membrana celular). 39
VI. VIGILANCIA DE LA MORBILIDAD
A pesar del uso de antibióticos cada vez más potentes y efectivos, de regímenes de combinación de antibióticos y de la introducción de amplios avances tecnológicos que sostienen el estado hemodinámico y las funciones orgánicas, la tasa de mortalidad por sepsis no ha cambiado significativamente en los últimos 30 años. Ello significa que aún utilizando las mejores terapéuticas disponibles, muchos pacientes con sepsis morirán y solo el diagnóstico precoz y el tratamiento oportuno podrán asegurar una mayor supervivencia. Estos constituyen los pilares esenciales de una nueva estrategia. Comenzar las acciones terapéuticas más enérgicas en etapas iniciales del fenómeno, con vistas a evitar o minimizar las lesiones orgánicas. 40, 41
Con el objetivo de conocer el comportamiento de la morbilidad, para que el hospital y sus áreas de atención puedan actuar precoz y correctamente, sin esperar el análisis de la mortalidad - siempre provechoso pero tardío se plantea estructurar la vigilancia de la sepsis en los hospitales de la forma siguiente:
- En el cuerpo de guardia
| Qué | SRIS |
| Cómo | Hoja de cargo (identificación con siglas) |
| Cuándo | Durante la evaluación del paciente en el cuerpo de guardia |
- En la Unidad de Terapia Intensiva
| Qué | SRIS |
| Cómo | Libro de egresos de la terapia |
| Cuándo | Al egreso de la unidad de terapia |
| Importante | Se debe recoger para cada paciente si tuvo focalización específica y cuál, si hubo bacteriemia comprobada, así como también se precisará si el paciente llegó a la terapia procedente del cuerpo de guardia o de un servicio de hospital. |
La clave del éxito para la identificación temprana de la sepsis radica en la búsqueda exhaustiva de los signos de respuesta inflamatoria sistémica. Según el análisis efectuado sobre la fisiopatología e independientemente de la existencia de patrones fulminantes y de progresión muy diferentes de un paciente a otro, la posibilidad de que un individuo pase de un estado de total normalidad a la gravedad extrema es realmente excepcional. 11 No existe prueba diagnóstica específica, la sospecha basada en la clínica es el mejor diagnóstico y resulta difícil en los estadios iniciales.
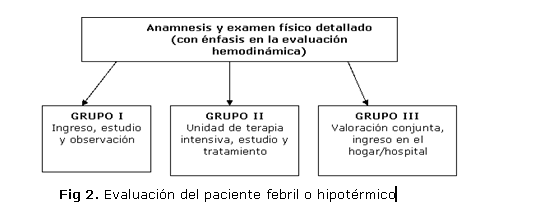
Si se logra una consulta de calidad, con la aplicación consecuente de todo lo anterior, una vez finalizada se puede ubicar al paciente en uno de los grupos siguientes:
- GRUPO I: con SRIS
- GRUPO II: con sepsis, sepsis severa, SOC o SDMO
- GRUPO III: no completa los criterios de SRIS
En relación con el paciente febril o hipotérmico según grupo, se expone la propuesta en la figura 2.
VII. TRATAMIENTO
La conducta ideal frente a un paciente con sepsis, estado de choque séptico o ambos, involucra 3 aspectos terapéuticos diferentes (cuadro 4). 1, 40- 43
VII. PRONÓSTICO
La sepsis constituye una respuesta inmunológica exagerada del huésped ante la presencia de un microorganismo o sus componentes tóxicos. Es la magnitud y la duración de la respuesta inflamatoria lo que determina el pronóstico del proceso séptico. Este último dependerá, por tanto, de lo precoz y adecuada que resulte la intervención terapéutica y de las características, así como de los factores de riesgo de cada paciente. 1, 11, 41
CONCLUSIONES
"Conocer la sepsis" es conocer los cuidados de la medicina crítica, por lo que consideramos que "conocer y prevenir" el avance de los diferentes estadios evolutivos de la sepsis es preservar la vida con calidad. Un incremento en el conocimiento de estos elementos por los profesionales, y el cumplimiento de protocolos de acción en cada institución que propicien su diagnóstico precoz y manejo oportuno es la única vía de mejorar el pronóstico final.
REFERENCIAS BIBLIOGRÁFICAS
1. Meneghello J, Fanta E, Paris E, Puga TF. Pediatría. T1. 5 ed. Buenos Aires: Editorial Médica Panamericana;1997. p. 647-9.
2. Amaya Tapia G, Ortega Gómez J, Aguirre Avalos G, López Guillén P. Sepsis: nuevos conceptos y terapia actual. Rev Iberolat C Int. 1994;3(4):173-81.
3. Levy MM, Fink JC, Marshall JC, Abraham E, Angus D, Cook D, et al. SCCM/ ESICM/ACCP/ATS/SIS international sepsis definitions conference. Crit Care Med. 2003;31:1250-6.
4. Bone RC. Sepsis, the sepsis syndrome, multi-organ failure: aplea for comparable definitions. Ann Intern Med. 1991;114(4):332-3.
5. Goldstein B, Giroir B, Randolph A, International Consensus Conference on Pediatric Sepsis. International pediatric sepsis consensus conference: definitions for sepsis and organ dysfunction in pediatrics. Pediatr Crit Care Med. 2005;6(1):2-8.
6. Fischer J, Fanconi S. Systemic inflammatory response syndrome (SRIS). Crit Care Med. 1997;(24):239-54.
7. Fiser R, Darville T. Systemic inflammatory response syndrome. En: Levin DL. Essential of pediatric intensive care. 2 ed. New York: Churchill Livingstone; 1997. p. 266-79.
8. Roca Goderich R, Smith Smith VV, Paz Presilla E, Losada Gómez J, Bertha Serret Rodríguez, Llamos Sierra N. Temas de medicina interna. 4 ed. La Habana: Editorial Ciencias Médicas; 2002, t3. p. 538-50.
9. Bone RC. Sepsis, sepsis síndrome, and the systemic inflammatory response syndrome (SRIS). JAMA. 1995;273(2):155-6.
10. Hall JB, Schmidt GA, Wood LD. Principle of critical care. New York: Mc Graw-Hill; 1992. p. 1159-85.
11. Velázquez Acosta JC. Diagnóstico y manejo inicial de la sepsis. Taller Territorial sobre la Sepsis y Salud Reproductiva (PAMI). La Habana: MINSAP; 1998.
12. Bone RC, Balk RA, Cerra FB, Dellinger RP, Fein AM, Knaus WA, et al. Definitions for sepsis and organ failure and guidelines for the use of innovate therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. Chest. 1992;101(6):1644-55.
13. Brahm Goldstein MD, Brett Giroir MD, Adrienne Randolph MD, and the members of the International Consensus Conference on Pediatric Sepsis. International pediatric sepsis consensus conference: definitions for sepsis and organ dysfunction in pediatrics. Pediatr Crit Care Med. 2005;6(1):2-6.
14. Nelson WE, Behrman RE, Kliegman RM, Arvin AM. Tratado de pediatría. 15 ed. Madrid: Mc Graw-Hill Interamericana; 1997. p. 881-4.
15. Paganini HR. Tratamiento de la sepsis en pediatría: ¿qué debemos hacer? Arch Argent Pediatr. 2003;101(5):406-14.
16. World Health Organization. The World Health report 2004. Geneva: WHO; 2004.
17. Paganini HR. The World Health report 2006. Geneva: WHO; 2006.
18. Manzano JL, Manzano JJ, Medina D. Sock séptico (I). Fisiopatología, monitorización. Med Clin (Barc). 1993;100(7):266-74.
19. Montalván González GL. Sepsis severa y shock séptico en el niño. Aún no todo está dicho. Rev Panam Salud Pública. 2009 [citado 23 Abr 2012];26(6). Disponible en: http://www.scielosp.org/scielo.php? 1020-49892009001200014arttext
20. Cuba. Ministerio de Salud Pública. Anuario Estadístico de Salud 2010. La Habana: MINSAP;2011.
21. Bogossiann R, Concalves M, Bogossiann A. Septic shock: recent acquisition of the physiopathology. J Bras Med. 1989;57(5/6):16-28.
22. Glauser MP, Heumann D, Baumgarther JD, Cohen J. Pathogenesis and potential strategies for prevention and treatment of septic shock: an update. Clin Infect Dis. 1994;18(Suppl 2):s205-s16.
23. Parrillo JE. Pathogenetic mechanisms of sptic shock. N Engl J Med.1993;328: 1471-7.
24. Hack CE, This LG. The orchestra of mediators in the pathogenesis of septic shock. A review. In: Vincent JL. Update in intensive Care an Emergency Medicine. Berlin: Springer-Verlag; 1991. p. 246.
25. Darville T, Giroir B, Jacobs R. The systemic inflammatory response syndrome (SRIS): immunology and potential immunotherapy. Infection. 1993;21(5):279-88.
26. Boldrick JC, Alizadeh AA, Diehn M, Dudoit S, Liu CL, Belcher CE, et al. Stereotype and specific gene expression programs in human innate immune responses to bacteria. Proc Natl Acad Sci. 2002;99(2):972-7.
27. Glauser MP. Sepsis and cytokines. Kansenshogaku Zasshi. 1996;70(10):1054-61.
28. Saavedra Quintanilla J, Ramírez Chirino J. Fisiopatología de la sepsis. Rev Med (Bolivia). 1994;(1):32-3.
29. Guzmán Rodríguez E, Fernández Reverón F, Guzmán Rubín E, Callejo Hernández MF, Valázquez Acosta JC, Prado González E. Pediatría. T6. La Habana: Editorial Pueblo y Educación; 2000. p. 70-91.
30. Astiz M, Saha D, Lustbader D, Lin R, Rackow E. Monocyte response to bacterial toxins, expression of cell surface receptors, and release of anti-inflamatory cytokines during sepsis. J Lab Clin Med. 1996;128(6):594-600.
31. Van Deventer SJH. Cytoquine and cytoquine receptor polymorphismis in infectious disease. Intensiv Car Med. 2000;26(13):S98-S102.
32. Foex BA, Shelly MP. The cytokines response to critical illness. J Accid Emerg Med. 1996;13(3):154-62.
33. Avontuur J, Bruinig H, Ince C. Sepsis and nitric oxide. Adv Exp Med Biol. 1996;388: 551-67.
34. Fujishima S, Aikawa N. Neutrphil-mediated tissue injury and its modulation. Intensiv Car Med. 1995;21(3):277-85.
35. Marshall JC, Vincent JL, Fink MP, Cook DJ, Rubenfeld G, Foster D, et al. Measures, markers and mediators: toward a staging system for clinical sepsis. A report of the Fifth Toronto Sepsis Roundtable, Toronto, Ontario, Canada, October 25-26, 2000. Crit Care Med. 2003;31(5):1560-7.
36. Luckett P. The endothelium. En: Levin DL. Essential of pediatric intensive care. 2 ed. New York: Churchill Livingstone;1997. p. 313-26.
37. Freeman BD, Buchman TG. Gene in haystack: tumour necrosis factor polymorphisms and outcome in sepsis. Crit Care Med. 2000;28(8):3090-1.
38. Wiliams G, Toro Figueroa L. Multiple organ system failure: A continuum of multiple organ dysfunction syndrome. En: Levin DL. Essential of pediatric intensive care. 2 ed. New York: Churchill Livingstone; 1997. p. 302-12.
39. Bernard Gr, Vincent JL, Laterre PF. Efficacy and safety of recombinant human activated protein C for severe sepsis. N Engl J Med. 2000;344:699-709.
40. Ayala A, Urbanich MA, Herdon CD, Chaudry IH. Is sepsis_induced apoptosis associated with macrophage dysfunction? J Trauma. 1996;40(4):568-73.
41. Riedemann NC, Guo RF, Ward PA. Nobel strategies for the treatment of sepsis. Nat Med. 2003;9:517-24.
42. Manzano JL, Bolaños J, González B. Shock séptico (II): tratamiento. Med Clin (Barcelona). 1993;100:305-15.
43. Polderman KH, Girbes AR. Drug intervention trial in sepsis: divergent results. Lancet. 2004;363:1721-3.
Recibido:2 de mayo de 2012
Aprobado: 16 de mayo de 2012
Andrea Hortensia Fariñas Vilela. Hospital Infantil Norte "Dr. Juan de la Cruz Martínez Maceira", calle 8, entre 9 y 11, reparto Fomento, Santiago de Cuba, Cuba. Correo electrónico:andrea.farinas@medired.scu.sld.cu