Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
MEDISAN
versión On-line ISSN 1029-3019
MEDISAN vol.17 no.2 Santiago de Cuba feb. 2013
ACTUALIZACIÓN DE TEMA
Ecoinmunonutrición en el tratamiento de pacientes con enfermedades inflamatorias intestinales
Ecoimmunonutrition in the treatment of patients with inflammatory bowel diseases
MsC. Daisy Marten Marén y MsC. María Caridad Ramírez Arias
Hospital General Docente "Dr. Juan Bruno Zayas Alfonso", Santiago de Cuba, Cuba.
RESUMEN
La enfermedad inflamatoria intestinal, con un evidente predominio en los países más industrializados, comprende un grupo de afecciones con similitud en sus cuadros clínicos, histopatología, complicaciones, respuestas terapéuticas (incluida la dietoterapia convencional) y evolución hacia la desnutrición producida por la malabsorción. En el tratamiento a los pacientes con dichas entidades clínicas resulta eficaz la ecoinmunonutrición, pero ello es poco conocido en la práctica médica y ha motivado la presente actualización bibliográfica sobre el papel de las dietas y los alimentos funcionales ecoinmunoórgano-específicos, así como sus acciones en los tejidos, las manifestaciones clínicas y el desarrollo nutricional. Se ofrecen informes alentadores respecto a la atención a estas personas, en la cual los alimentos funcionales poseen gran importancia y las restricciones dietéticas de ciertas comidas o el uso de otras, modifican la evolución clínica.
Palabras clave: enfermedad inflamatoria intestinal, ecoinmunonutrición, econutrición, regeneración de mucosa intestinal, inmunidad intestinal, alimentos funcionales.
ABSTRACT
Inflammatory bowel disease, with a clear predominance in most industrialized countries, involves a group of conditions with similar clinical patterns, histopathology, complications, and therapeutic responses (including conventional diet therapy) and progression to malnutrition caused by malabsorption. In treating patients with these conditions the ecoimmunonutrition is effective, but it is little known in medical practice and has led to this updated literature survey on the role of diets and ecoimmunoorgan-specific functional foods, as well as their actions in tissues, clinical manifestations and nutritional development. Encouraging reports regarding care of these people are provided, in which the functional foods are very important and dietary restrictions of certain foods or use of others modify the clinical course.
Key words: inflammatory bowel disease, ecoimmunonutrition, econutrition, intestinal mucosa regeneration, intestinal immunity, functional foods.
INTRODUCCIÓN
La enfermedad inflamatoria intestinal (EII) es el término para definir un grupo de afecciones con similitud en sus cuadros clínicos, histopatología, respuestas terapéuticas, complicaciones, evolución clínica hacia la desnutrición causada por la malabsorción y reacción a la dietoterapia convencional. Dichas enfermedades afectan a individuos de todo el mundo, pero tienen un evidente predominio en los países más industrializados del Occidente, en los que existe una incidencia variable de 15 a 25 pacientes anualmente por cada 100 000 habitantes.1
En cambio, en las instituciones sanitarias de la provincia de Santiago de Cuba se han registrado2 pocos datos de prevalencia y los afectados son atendidos tradicionalmente en consultas especializadas de medicina interna, proctología, gastroenterología y, desde hace poco tiempo, nutrición. Este enfoque multidisciplinario va "ganando adeptos" entre el personal de la salud y la población, en general.
Por otra parte, la colitis ulcerosa se caracteriza por lesiones difusas, generalmente superficiales, de la pared del intestino grueso, que dañan casi siempre al recto, al extenderse de manera continúa hasta el propio fondo del ciego (figura 1); de igual forma, está determinada por períodos recurrentes de inflamación y destrucción del tejido, los cuales varían según la persona afectada, y aunque todavía no se han especificado sus causas, en este trastorno inflamatorio crónico influyen el código genético, los factores medioambientales e higiénico-dietéticos y el sistema inmunitario.3
En lo que se refiere a la enfermedad de Crohn (figura 2), se distingue por lesiones discontinuas, lineales y profundas que afectan a uno o más segmentos de todo el tubo digestivo, predominantemente el íleon terminal, pero puede extenderse desde el esófago hasta el recto.4
Las causas más frecuentes de diarreas crónicas suelen ser: el síndrome de mala absorción (cualquiera que sea su origen), la intolerancia al gluten o la lactosa y la insuficiencia de disacaridasas; sin embargo, este cuadro clínico también puede ser producido por afecciones inflamatorias intestinales, como la colitis ulcerosa y la enfermedad de Crohn.5
Otras EII que difieren en cuanto a la causa y fisiopatogenia, pero poseen elementos clínicos comunes, son la colitis isquémica, la rectitis actínica y la colitis seudomembranosa -- conocidas como colitis indeterminadas --, que causan un daño establecido en la mucosa intestinal, atrofia de las microvellosidades, aplanamiento o reducción de la mucosa y malabsorción que produce desnutrición y disminución de la inmunidad, lo cual empeora por el abuso del reposo intestinal durante los episodios de agudización o crisis, o ambos. Igualmente, la predisposición genética, las alteraciones inmunitarias y las bacterias patógenas interactúan como agentes desencadenantes y perpetuos de la enfermedad inflamatoria intestinal.6,7
DESARROLLO
Resulta oportuno referir que las enfermedades inflamatorias intestinales evolucionan con diarreas crónicas que alternan en episodios o crisis agravadas. Estas lesiones son causantes de la inflamación local y sus efectos deletéreos sobre la capacidad de absorción y el resto de las funciones del intestino, contribuyen a empeorar el estado de desnutrición como elemento distintivo de su cuadro clínico.
Todos coinciden en que con los avances en las ciencias de los alimentos y nutrientes, ciertas restricciones dietéticas o el uso de otros alimentos considerados funcionales: prebióticos, probióticos y simbióticos, modifican la evolución del paciente. Se plantea, además, que la econutrición y modulación inmunológica a través de la dieta órgano-específica ofrece resultados alentadores en el tratamiento de personas con estas enfermedades. Sin embargo, el papel de la ecoinmunonutrición y los alimentos funcionales en la terapia de pacientes con diferentes enfermedades inflamatorias intestinales está poco difundido en la práctica médica de los profesionales cubanos.
Numerosos autores8-12 han validado la atención dietoterapéutica a los afectados con enfermedades inflamatorias intestinales, que evolucionan básicamente con inflamaciones y lesiones tisulares, así como desequilibrio de la flora y sus consecuencias, lo cual puede ser prevenido y tratado con la administración de cultivos microbianos vivos prebióticos o sustancias prebióticas de origen vegetal.
Se ha demostrado la capacidad absorbente de la mucosa intestinal y su funcionamiento como órgano que produce hormonas, inmune y de barrera contra los gérmenes; no obstante, su actividad inmunoprotectora muchas veces es ignorada en la práctica médica, de tal manera que no se ha comprendido ni se ha tenido en cuenta para la prevención y el control de estados morbosos relacionados.13
Las defensas inmunológicas están formadas por la inmunoglobulina (Ig) A secretora, los linfocitos, los macrófagos y los neutrófilos presentes en la mucosa y submucosa, así como los ganglios linfáticos mesentéricos y las células de Kupffer, localizadas en el hígado, como extremo final entre el sistema porta y la circulación sistémica. En efecto, el intestino es metabólica e inmunológicamente activo.
Adicionalmente, se teoriza que es el órgano más precozmente afectado por la isquemia y el precursor del fallo multiorgánico, determinado por la tormenta de mediadores inflamatorios, con el consiguiente daño a las EII, en las cuales los procesos locales inflamatorios producen la pérdida de la barrera mucosa que impide la proliferación de elementos patógenos. Por ello, el conocimiento del ecosistema intestinal permite aplicar medidas de intervención dietético-nutrimentales que modifiquen los efectos fisiológicos y terapéuticos.14-16
Función de la flora intestinal17
El tubo digestivo de los recién nacidos está completamente libre de microorganismos, pues la flora bacteriana se comienza a adquirir inmediatamente después del nacimiento y, progresivamente, se establece un microsistema en el que se observa un predominio de las bacterias anaeróbicas obligadas. En la flora intestinal humana existen especies de microorganismos que conviven en armonía y simbiosis: unas especies viven de los productos generados por otras y, a su vez, la actividad metabólica de las primeras beneficia la proliferación de unas terceras que sintetizan vitaminas, contribuyen a la absorción de nutrientes y el metabolismo colónico de la fibra, de modo que mejoran la digestibilidad y neutralizan sustancias potencialmente patogénicas, con lo cual se permite que la flora promueva una mejor función intestinal, también con substratos no absorbidos de la dieta.
La flora dominante son las bífidobacterias, bacteroides y eubacterias; y la subdominante la conforman los lactobacilos, colibacilos y estreptococos.
Igualmente, los efectos beneficiosos de la modulación de la flora intestinal son los siguientes:
1. Modificación cualitativa del contenido intestinal
2. Degradación de nutrimentos no absorbidos por el intestino (glúcidos, lípidos y aminoácidos)
3. Síntesis de vitaminas
4. Producción de ácidos grasos de cadena corta (AGCC), combustible por excelencia de los colonocitos, y reabsorción
de metabolitos bacterianos
5. Síntesis de aminas y poliaminas con actividad biológica
6. Intervención activa en la producción de gases intestinales
7. Acción sobre el metabolismo de las sustancias xenobióticas
La flora intestinal se modifica en determinadas condiciones o en presencia de factores como la alimentación, los genes, el hábitat, la etnia, la cultura, la demografía, la antibioticoterapia, el estrés, los medicamentos, las infecciones virales, parasitarias o bacterianas; el ayuno prolongado; la edad; el clima; las intervenciones quirúrgicas en el estómago o intestino; las enfermedades hepáticas o renales; el cáncer; las radiaciones y los agentes químicos. También los procesos inmunológicos e inflamatorios se señalan como causa y efecto de los cambios observados en la flora intestinal.18
Alimentos funcionales
En el siglo XX comenzaron a desarrollarse conceptos en nutrición, como consecuencia de los nuevos estilos de vida y la preocupación por elevar la calidad de vida de los individuos. Las disciplinas como Biología Molecular, Biotecnología e Informática, así como la nanotecnología, las ciencias básicas aplicadas y los descubrimientos en la fisiología y la bioquímica de la nutrición, entre otros, permitieron a las industrias alimentarias el desarrollo de nuevos productos con funciones adicionales a las del alimento original, a través del diseño de formulaciones con acciones órgano- específicas.19
Sin embargo, sus antecedentes están más allá, en la misma génesis del género humano; los alimentos funcionales ya se conocían desde la antigüedad, pues Hipócrates (460-377 a.C), el médico griego considerado el creador de la verdadera medicina, decía: "Haz que tus alimentos sean tus medicinas y que tus medicinas sean tus alimentos". Más recientemente, Elie Metchnikoff (1845-1916), zoólogo y microbiólogo ruso, ganador del Premio Nobel de Medicina, mediante la observación a una población longeva de más de 100 años de edad, concluyó que la dieta puede proteger el cuerpo de la invasión de agentes patógenos y, en consecuencia, mejorar y prolongar la calidad de vida. Estudiando a estos ancianos, llegó a descubrir que los microorganismos del yogur (alimento básico de dicha población) eran los "responsables" de la baja morbilidad y mortalidad, y la elevada longevidad de estos. Asimismo, utilizando lactobacilos, desarrolló un preparado terapéutico para ingerir en forma de cápsula, denominado lactobacillin.20,21
Por tanto, definiendo que alimento sano es aquel libre de riesgo para la salud que conserva su capacidad nutricional, su "atractivo" a los sentidos, su pureza y frescura, resulta más actual el concepto de alimento funcional, que es aquel producto, sustancia nutritiva modificada o ingrediente alimenticio, que pueda proveer beneficios a la salud superiores a los ofrecidos por los alimentos tradicionales. De hecho, el alimento funcional puede mantener el estado de salud de la persona y reducir el riesgo de padecer una enfermedad, incluso puede modificar o modular sistemas y funciones; de ahí su definición. Un alimento puede ser funcional para una población en general o para grupos particulares de ella, definidos por sus características genéticas, el sexo, la edad u otros factores. Este debe tener, además, valor nutritivo.22
Clasificación de los alimentos funcionales
• Alimentos naturales
• Alimentos con adición de un componente fitoquímico, prebiótico, probiótico o péptido, ínas bioactivas, fibra dietética y ácidos
grasos omega-3
• Alimentos con supresión de un componente (alergenos)
• Alimentos con modificación de la naturaleza de uno o varios de sus componentes
• Alimentos con modificación de uno o más de sus componentes
• Cualquier combinación de las posibilidades anteriores
Componentes prebióticos23
Son las fibras dietéticas que llegan al intestino grueso sin haber sido transformadas digestivamente. Estos compuestos modulan positivamente la fisiología del sistema gastrointestinal, fundamentalmente en cuanto al aumento del peso de las heces y la frecuencia de evacuación intestinal, y entre los principales están la inulina, la pectina y el almidón resistente, que estimulan selectivamente el crecimiento o la actividad (o ambos) de uno o más tipos de bacterias en el colon, las que tienen, a su vez, la propiedad de elevar el potencial de salud del hospedero.
Al respecto, las bacterias del colon, con sus numerosas enzimas digestivas de gran actividad metabólica, pueden digerir las fibras dietéticas en mayor o menor medida en dependencia de su composición química y su estructura. Las más abundantes son los fructo-oligosacáridos y galacto-oligosacáridos. Estos alimentos o sustratos sirven a los componentes probióticos de fuente nutriente para sus procesos metabólicos y se caracterizan por ser de origen alimentario vegetal. No son digeridos ni absorbidos en el tracto gastrointestinal superior y son fermentados total o parcialmente en el intestino grueso; además, estimulan el crecimiento de la flora microbiana y producen sustratos para la mucosa del colon y el organismo. Fundamentalmente son fibras dietéticas, osmóticamente activas.
La fermentación de substratos no digeribles de la dieta (prebióticos), en su gran mayoría carbohidratos, pueden proporcionar cantidades óptimas de substancia para la nutrición y el desarrollo de las bacterias del colon, con la consecuente activación de la producción de AGCC, ácido láctico, energía (hasta 30 % de las necesidades energéticas de una persona sana) y moco procedente del epitelio intestinal.
Con referencia a lo anterior, la fibra soluble se produce a través de la fermentación bacteriana y la elaboración de ácidos grasos de cadena corta (particularmente butirato):
- Estimula el trofismo intestinal y colónico.
- Reduce la inflamación de la mucosa.
- Favorece la reabsorción de agua y sodio en el colon (efecto antidiarreico).
Los cereales integrales son alimentos prebióticos por excelencia, a saber: la soya, la manzana, el plátano verde, los cítricos, los vegetales, las frutas, las leguminosas y muchos más. Los compuestos que le otorgan el valor prebiótico son fundamentalmente las fibras solubles, en especial la pectina, que es protector de la mucosa, antioxidante, medio para el transporte de bacterias ácido-lácticas (BAL) a través del tracto gastrointestinal, y un sustrato muy adecuado para la fermentación bacteriana. Se ha demostrado su acción contra las úlceras pépticas, y para prevenir la oxidación y estimular o alimentar la flora microbiana (grado de recomendación A).
Acciones de la pectina en el intestino
• Aumenta la producción de AGCC.
• Desarrolla la barrera intestinal y previene la traslocación bacteriana.
• Previene la destrucción de la microflora intestinal prebiótica.
• Estimula el sistema de defensa inmunológica.
• Ofrece protección antioxidante.
• Retrasa el vaciamiento gástrico.
• Incrementa el tiempo de tránsito intestinal.
• Es un agente regulador intestinal, general y detoxificante.
• Modifica la absorción intestinal, en especial de glucosa.
• Aumenta la absorción de hierro.
• Aumenta la producción de hormonas y enzimas gastrointestinales.
• Interfiere con el metabolismo lipídico intestinal y hepático.
• Estimula la síntesis de proteínas en la leche en animales, a través de la secreción de prolactina.
• Reduce la absorción de colesterol y ácidos biliares primarios.
• Disminuye la absorción de cobalamina.
• Incrementa el peso y la masa de las heces.
Componentes probióticos24
En 1965, Lilly y Stillwell utilizaron por primera vez el término para nombrar a los productos de la fermentación gástrica: probióticos. Dicha palabra se deriva de 2 vocablos, del latín -pro- que significa por o en favor de, y del griego -bios- que quiere decir vida. En 1989, Fuller definió a los probióticos como: "Aquellos microorganismos vivos, principalmente bacterias y levaduras, que son agregados como suplemento en la dieta y que afectan en forma beneficiosa al desarrollo de la flora microbiana en el intestino".
Huchetson planteó diferentes postulados para considerar un alimento como probiótico:
- Ser habitante normal del intestino.
- Tener tiempo corto de reproducción.
- Ser capaz de producir compuestos antimicrobianos.
- Ser estable durante el proceso de producción, comercialización y distribución para que pueda llegar vivo al intestino.
- Ser capaz de atravesar la barrera gástrica para poder multiplicarse y colonizar el intestino.
También se le conocen como: bioterapéuticos, bioprotectores o bioprofilácticos.
Efectos de los alimentos probióticos en diferentes afecciones25
Incluyendo la modificación de la flora al evitar la colonización patógena, los efectos de los componentes probióticos son varios: prevención del desequilibrio de la flora intestinal, reducción de la incidencia y la duración de las diarreas, mantenimiento de la integridad de las mucosas, modulación de la inmunidad al impedir la translocación bacteriana, producción de vitaminas como la B2, B6 y biotina, asimilación de oligoelementos y actividad antitumoral.
I. Intolerancia a la lactosa
Casi 70 % de la población mundial tiene intolerancia a la lactosa, relacionada con la disminución de la actividad de la lactasa en la mucosa intestinal, genéticamente determinada, por lo que los pacientes con enfermedad inflamatoria intestinal no están exentos de esta incapacidad. La lactosa no digerida es fermentada por la flora intestinal, con producción de agua, ácidos grasos y gas, que ocasionan síntomas como dolor abdominal, flatulencia y diarrea. No obstante, los alimentos probióticos contribuyen a mejorar la digestión de la lactosa y reducen las manifestaciones clínicas por la mala absorción, gracias a que los lactobacilos poseen una actividad enzimática (lactasa) que sigue funcionando en el intestino y permite la digestión del azúcar, lo cual posibilita que personas con intolerancia a la lactosa puedan consumir leche -- fuente rica en proteínas, vitaminas y calcio -- sin que se originen síntomas como la diarrea, el dolor abdominal, la flatulencia, entre otros. Los microorganismos probióticos que actúan en la fermentación del yogur como el Lactobacillus bulgaricus y Streptococcus thermophilus poseen la enzima. Los lactobacilos y las bifidobacterias poseen un efecto favorecedor en la digestión de la lactosa.
II. Reducción de los niveles de colesterol
Varios alimentos probióticos ejercen efectos hipocolesteromiantes, pues contribuyen a la disminución del colesterol sanguíneo de 3 maneras distintas:
A. Utilizando el colesterol en el intestino y reduciendo así su absorción.
B. Aumentando la excreción de sales biliares.
C. Produciendo ácidos grasos volátiles en el colon que pueden ser absorbidos e interferir en el metabolismo de los lípidos en el hígado.
III. Efectos protectores sobre la mucosa intestinal e inmunomoduladores de los alimentos prebióticos
Se utilizan para prevenir las infecciones entéricas y gastrointestinales. La protección de estos microorganismos se lleva a cabo mediante 2 mecanismos:
• El antagonismo: Impide la multiplicación de los agentes patógenos y la producción de toxinas que imposibilitan su acción patogénica.
Este antagonismo está dado en la competencia por los nutrientes o los sitios de ón.
• La inmunomodulación: Protege al huésped de las infecciones al inducir a un aumento de la producción de inmunoglobulinas
y un incremento de la activación de las células mononucleares y los linfocitos, que modifican la respuesta inmunitaria local del
hospedero y pueden estimular la inmunidad del individuo, tanto en el intestino como en todo el organismo, lo cual significa una
mayor producción de anticuerpos y una mejor defensa.
Algunos autores26 sugieren que el consumo de componentes probióticos podría ayudar a regular las alteraciones del sistema inmunitario, como en el caso de la alergia, y por lo tanto, a reducir los síntomas asociados a la afección (grado de recomendación A). Las bacterias ácido-lácticas son probióticas por excelencia y las más conocidas, contenidas en el yogur y el queso fresco prebiótico, y pueden colonizar transitoriamente el intestino y sobrevivir durante el tránsito intestinal por su adhesión al epitelio:
A. Compiten por el espacio físico y los nutrientes.
B. Producen sustancias antibióticas activas ante estos agentes patógenos.
C. Estimulan el sistema inmunitario del intestino.
D. Contribuyen a la acidificación del contenido del colon, lo cual es desfavorable para el crecimiento de microorganismos patógenos.
E. Inactivan ciertas toxinas liberadas por los microbios patógenos.
IV. Efectos anticarcinogénicos de los microorganismos prebióticos
Existen evidencias de que la EII está relacionada con la incidencia de cáncer digestivo, sobre todo de colon. Ahora bien, los alimentos probióticos demostraron tener actividad anticarcinogénica al producir determinadas sustancias durante su crecimiento, que actuarían disminuyendo las sustancias procarcinogénicas por acción directa sobre ellas, un ejemplo de esto son los nitritos en alimentos que se convierten en nitrosaminas -- sustancias carcinogénicas --. Las lactobacterias pueden actuar tanto química como enzimáticamente sobre los nitritos, y las bifidobacterias son capaces de extender a las nitrosaminas. Por consiguiente, dichos microorganismos probióticos disminuyen las sustancias carcinogénicas.
Por su parte, las sales biliares, producidas por la degradación de la bilis, han sido relacionadas como sustancias iniciadoras del cáncer de colon, pero un alto número de lactobacilos en el intestino pueden reducir la biotransformación de las sales biliares y, por tanto, disminuir el riesgo de padecer este tipo de cáncer. Asimismo, pueden actuar sobre las sustancias procarcinogénicas indirectamente a través del sistema enzimático, que las transforma en carcinogénicas, además de tener una acción antagonista sobre las células tumorales debido a la estimulación del sistema inmunitario, tanto localmente (intestino) como sistémica o generalmente.27
VI. Efectos de los microorganismos probióticos en las enfermedades gastrointestinales28
El efecto del microorganismo probiótico sobre la diarrea aguda suele ser:
• Producción de sustancias antibacterianas: bacteriocinas, lactocinas, helveticinas y bifidinas.
• Producción de ácidos grasos que acidifican el lumen intestinal, al inhibir bacterias y mantener el buen funcionamiento
de la mucosa intestinal.
• Disminución de la permeabilidad intestinal.
• Acción competitiva.
• Inmunomodulación: aumento de la Ig A, regulación de las citocinas y la respuesta inmunitaria.
Efecto en la enfermedad inflamatoria intestinal30
Su uso como terapia de antagonismo bacteriano se fundamenta en la capacidad de desplazar a las bacterias patógenas, al aumentar las bifidobacterias, modificar favorablemente la exagerada respuesta inflamatoria, mejorar el epitelio intestinal y la regeneración de la mucosa, facilitar la recuperación de las microvellosidades atrofiadas y acrecentar la producción de Ig A y de vitaminas del complejo B (B6, B12, ácido fólico, riboflavina, niacina, biotina y ácido pantoténico). También produce antibióticos naturales que ayudan en el control de bacterias patógenas intestinales y mejora la absorción del calcio, origina enzimas como la lactasa y alivia el cuadro clínico de los afectados con el síndrome de intestino inflamado, al favorecer la digestión y absorbencia de los alimentos, lo cual, por tanto, reduce sus síntomas.
• Se propone el microorganismo probiótico bioterapéutico en la dieta de pacientes con EII, presente en los yogures, que contienen Lactobacillus casei, Lactobacillus rhamnosus LGG, Bifidobacterium, Streptococcus thermophilus, Lactobacillus reuteri, Lactobacillus delbruckii, Lactobacillus plantarum, Lactobacillus brevis, Bifidobacterium adolecentis, Saccharomyces y Lactobacillus acidophilus (grado de recomendación A).
Alimentos simbióticos31
Son una mezcla de microorganismos prebióticos y probióticos que pueden afectar simbiótica y beneficiosamente al hospedero, así como producir e inducir a una inmunoestimulación en las mucosas, evitar la translocación microbiana y la alteración de la permeabilidad intestinal debido a una respuesta inflamatoria exagerada. Estos pueden interactuar con los sitios de inducción más importantes del intestino delgado (placas de Peyer) e intestino grueso (nódulos linfoides mesentéricos) y mantener la relación de linfocitos T CD4+ y CD8+, sin producir efectos secundarios o colaterales, tales como el incremento de la respuesta inflamatoria mediada por la actividad citotóxica de LT CD8+ (grado de recomendación A).
Otros nutrientes funcionales y el endotelio intestinal32,33
• La glutamina: Aminoácido más utilizado en situaciones de estrés. Tiene una función principal en el transporte de nitrógeno entre órganos y es el nutriente de las células inmunitarias. Además, por vía enteral, determina trofismo del enterocito. Como suplemento de la nutrición parenteral, mantiene la altura de la mucosa digestiva o la regenera, o realiza ambas funciones. No obstante, la ausencia de glutamina, causa la atrofia del intestino; por el contrario, su presencia mantiene la integridad del intestino y permite el funcionamiento inmunitario no específico de este, a pesar de no ser un inmunomodulador como tal. En situaciones de estrés la glutamina es el substrato más usado y "aumenta su capacidad bactericida".
• La arginina: Estímulo trófico sobre el timo, al incrementar la producción de los linfocitos T ayudador y grandes granulares. Se absorbe desde el intestino mediante el transporte activo sobre un sustrato específico y dependiente de sodio; además, tiene un potente efecto secretagogo en las glándulas endocrinas y neuroendocrinas (aumenta la secreción de insulina, glucagón, polipéptidos pancreáticos, somatostatina, catecolaminas, hormona del crecimiento, prolactina y factor de crecimiento análogo a la insulina I), la síntesis proteica y la activación de los nucleótidos.
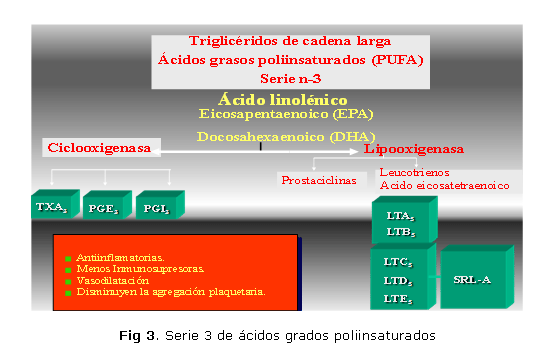
• Los ácidos grasos omega-3 (figura 3).
Funciones generales de los ácidos grasos
• Bloque de construcción celular: Los ácidos grasos son componentes estructurales importantes de las membranas celulares.
• Moduladores de procesos bioquímicos.
• Respuesta inflamatoria.
• Resistencia inmunológica.
• Dislipidemias: trastornos del metabolismo de los lípidos.
• Enfermedades cardiovasculares.
• Procesos trombóticos.
Los ácidos grasos omega-3 generan compuestos menos dañinos, en especial entre los metabolitos del ácido araquidónico, y son menos inmunosupresores y vasoactivos. Pueden citarse:34,35
- Ácido alfa-linolénico (C18: 3 omega-3)
- Ácido eicosapentanoico (C20:5 omega-3)
- Ácido docosapentanoico (C22:5 omega-3)
- Ácido docosahexanoico (C22:6 omega-3)
Características de los prostanoides
• De la serie 2: derivados de los ácidos grasos omega 6 (aceites vegetales)
- Mediadores proinflamatorios
- Vasoconstricción
- Broncoconstricción
- Activación de los polimorfonucleares
- Aumento de la permeabilidad vascular
• De la serie 3: derivados de los ácidos grasos omega 3 (aceites de pescado)
- Mediadores antiinflamatorios
- Disminución de la intensidad y extensión de la respuesta inflamatoria
- Reducción del efecto de la vasoconstricción
- Reducción del efecto de la broncoconstricción
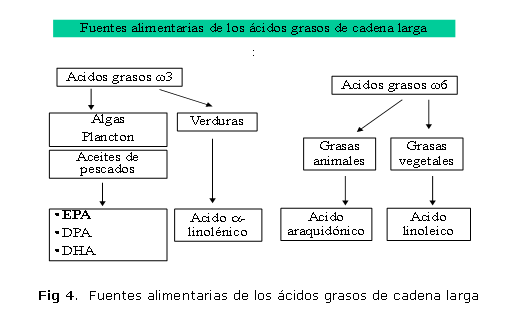
Las fuentes alimentarias de los ácidos grasos de cadena larga omega- 3 (ácido eicosapentaenoico) que se propone como parte de la dieta de los pacientes con enfermedades inflamatorias del intestino: atún, salmón, bacalao, macarela, sardinas, truchas y merluzas; además de otros peces azules como los arenques, y algunos mariscos: langostas y camarones (figura 4).
El consumo de aceite de pescado mejoraría el resultado clínico en pacientes que padecen diferentes tipos de afectaciones en la mucosa intestinal.37
• Otros beneficios
- Reducen los triglicéridos posprandiales en ayunas.
- Mejoran la sensibilidad a la insulina.
- Disminuyen la reactividad plaquetaria y leucocitaria, además de poseer acción vasodilatadora y antiagregante.
- Modifican y favorecen la recuperación del sistema inmunitario y mejoran las funciones inmunológicas, en particular en el intestino.
- Influyen en la capacidad de restitución del endotelio de la pared vascular.
- Mejoran las propiedades serológicas de la sangre.
- Inhiben las arritmias cardíacas (probado en animales).
- Son precursores directos de la síntesis de PGE3, TXA3 y LTB5.
- Tienen propiedades moduladoras sobre la respuesta inflamatoria.
- Reducen los efectos inmunosupresores de los eicosanoides derivados de la familia omega 6 (PGE2, LTB4).
CONCLUSIONES
Hechas las consideraciones anteriores, la bibliografía médica evidencia el empleo de alimentos funcionales como parte de la estrategia terapéutica dirigida a modular el ecosistema intestinal, y terapia coadyuvante en adultos (grado de recomendación A), que también puede ser combinada con fármacos en pacientes malnutridos y en aquellos con trastornos inflamatorios crónicos del intestino.
Los suplementos probióticos y prebióticos favorecen al paciente con EII, aún en ausencia de deficiencias nutricionales (grado de recomendación B). No obstante, no se recomienda el uso de fórmulas elementales ni modificadas con glutamina o arginina, a pesar de ser inmunomoduladoras en el caso de la colitis ulcerosa. Por su parte, los ácidos grasos omega-3, en dosis reguladas, tienen un papel importante entre los alimentos probióticos en el mejoramiento y la profilaxis de la EII crónica. Finalmente, el empleo de microorganismos probióticos en la nutrición debe ser considerado como un componente fundamental de la atención integral a los pacientes con enfermedades inflamatorias intestinales.
REFERENCIAS BIBLIOGRÁFICAS
1. Brullet E, Bonfill X, Urrútia G, Ruiz Ochoa V, Cueto M, Clofent J. Estudio epidemiológico de la incidencia de enfermedad inflamatoria intestinal en 4 áreas de España. Med Clin (Barc). 1998; 110(17): 651-6.
2. Podolsky DK. Inflammatory bowel disease. N Engl J Med. 2002; 347(6): 417-29.
3. Gassull MA, Cabré E. Nutrition in inflammatory bowel disease. Curr Opin Clin Nutr Metab Care. 2001; 4(6): 561-9.
4. Carter MJ, Lobo AJ, Travis SP. Guidelines for the management of inflammatory bowel disease in adults. Gut. 2004; 53(Supl. 5): 1-16.
5. Cabré E, Gassull MA. Nutrition in inflammatory bowel disease: impact on disease and therapy. Curr Opin Gastroenterol. 2001; 17(4): 342-9.
6. Cabré Gelada E. Nutrición y enfermedad inflamatoria intestinal. Nutr Hosp. 2007; 22 (Supl. 2): 65-73.
7. Ballesteros Pomar A, Vidal Casariego A, Calleja Fernández J, López Gómez A, Urioste Fondo A, Cano Rodríguez I. Impacto de la nutrición en la evolución de la enfermedad inflamatoria intestinal.
Nutr Hosp. 2010; 25(2): 181-92.
8. Pérez Tárrago C, Puebla Maestu A, Miján de la Torre A. Tratamiento nutricional en la enfermedad inflamatoria intestinal. Nutr Hosp. 2008; 23(5): 418-28.
9. Campos FG, Waitzberg DL, Teixeira MG, Mucerino DR, Kiss DR, Habr-Gama A. Pharmacological nutrition in inflammatory bowel diseases. Nutr Hosp. 2003; 18(2): 57-64.
10. O'Moráin C, Segal AW, Levi AJ. Elemental diet as primary treatment of acute Crohn's disease: a controlled trial. Br Med J (Clin Res Ed). 1984; 288(6434): 1859-62.
11. Zachos M, Tondeur M, Griffiths AM. Nutrición enteral para la inducción de la remisión en la enfermedad de Crohn. En: La Biblioteca Cochrane Plus. 2008 [citado 5 Ene 2012]; 2. Disponible en:http://www.update-software.com/BCP/BCPGetDocument.asp?DocumentID=CD000542
12. Griffiths AM. Enteral feeding in inflammatory bowel disease. Curr Opin Clin Nutr Metab Care. 2006; 9(3): 314-8.
13. Fell JM. Control of systemic and local inflammation with transforming growth factor beta containing formulas. J Parenter Enteral Nutr. 2005; 29(4): 126-8.
14. Fell JM, Paintin M, Arnaud-Battandier F, Beattie RM, Hollis A, Kitching P, et al. Mucosal healing and a fall in mucosal pro-inflammatory cytokine mRNA induced by a specific oral polymeric diet in pediatric Crohn's disease. Aliment Pharmacol Ther. 2000; 14(3): 281-9.
15. Dziechciarz P, Horvath A, Shamir R, Szajewska H. Meta-analysis: enteral nutrition in active Crohn's disease in children. Aliment Pharmacol Ther. 2007; 26(6): 795-806.
16. Sánchez-Valverde F. Tratamiento nutricional de la enfermedad inflamatoria intestinal. Acta Pediatr Esp. 2006; 64: 22-6.
17. Schlag G, Redl H. Mediators of injury and inflammation. World J Surg. 1996; 20(4): 406-10.
18. Scientific concepts of functional foods in europe consensus document. Br J Nutr. 1999; 81(Supl 1): 1-27.
19. Mombelli B, Gismondo MR. The use of probiotics in medical practice. Int J Antimicrob Agents. 2000; 16(4): 531-6.
20. Alexander JW. Barrier function of the intestine: role of inmunonutrition. En: Vincent JL. Yearbook of intensive care and emergency medicine. Brussels: Springer Berlin Heidelberg; 1995: V 1995. p. 676-83.
21. Palou A, Serra P. Perspectivas europeas sobre los alimentos funcionales. Alim Nutr Salud. 2000; 7(3): 76-90.
22. Schiffin EJ, Brassart D, Servin AL, Rochat F, Donnet-Hughes A. Immune modulation of blood leukocytes in humans by lactic acid bacteria: criteria for strain selection. Am J Clin Nutr. 1997; 66(2): 515-20.
23. Penna FJ. Diarrea y probióticos. Simposio sobre utilidad de los probióticos en el manejo de las diarreas. Rev Enfer Infec Ped. 1998; 11(6): 182.
24. Moore FA, Moore EE, Kudsk KA, Brown RO, Bower RH, Koruda MJ, et al. Clinical benefits of an immune-enhancing diet for early postinjury enteral feeding. J Trauma. 1994; 37(4): 607-15.
25. Beale RJ, Bryg DJ, Bihari DJ. Immunonutrition in the critically ill: a systematic review of clinical outcome. Crit Care Med. 1999; 27(12): 2799-805.
26. Braga M, Gianotti L. Preoperative immunonutrition: cost-benefit analysis. J Parenter Enter Nutr. 2005; 29(1 Suppl): 57-61.
27. Medici M, Vinderola CG, Perdigón G. Gut mucosal immunomodulation by probiotic fresh cheese. International Dairy J. 2004; 14(7): 611-18.
28. Perdigón G, Medina M, Vintiñi E, Valdez JC. Intestinal pathway of internalization of lactic acid bacteria and gut mucosal immunostimulation. Int J Immunopathol Pharmacol. 2000; 13(3): 141-50.
29. Adolfsson O, Nikbin Meydani S, Russell R. Yogurt and gut function. Am J Clin Nutr. 2004; 80(2): 245-56.
30. Alam NH, Ashraf H. Treatment of infectious diarrhea in children. Paediatr Drugs. 2003; 5(3): 151-65.
31. Rosenfeldt V, Michaelsen KF, Jakobsen M, Larsen CN, Moller PL, Tvede M, et al. Effect of probiotic Lactobacillus strains on acute diarrhea in a cohort of nonhospitalized children attending day-care centers. Pediatr Infect Dis J. 2002; 21(5): 417-9.
32. Shanahan F. Inflammatory bowel disease: immunodiagnostics, immunotherapeutics, and ecotherapeutics. Gastroenterology. 2001; 120(3): 622-35.
33. Furrie E, Macfarlane S, Kennedy A, Cummings JH, Walsh SV, O'neil DA. Synbiotic therapy (Bifidobacterium longum/Synergy 1) initiates resolution of inflammation in patients with active ulcerative colitis:
a randomised controlled pilot trial. Gut. 2005; 54(2): 242-9.
34. De Ley M, De Vos R, Hommes DW, Stokkers P. Aceite de pescado para la inducción de remisión en la colitis ulcerosa. En: La Biblioteca Cochrane Plus. 2008 [citado 14 Abr 2012]; 2. Disponible en:http://www.update-software.com/BCP/BCPGetDocument.asp?DocumentID=CD005986
35. MacLean CH, Mojica WA, Newberry SJ, Pencharz J, Garland RH, Tu W, et al. Systematic review of the effects of n-3 fatty acids in inflammatory bowel disease. Am J Clin Nutr. 2005; 82(3): 611-9.
36. Turner D, Steinhart AH, Griffiths AM. Ácidos grasos omega-3 (aceite de pescado) para el mantenimiento de la remisión en la colitis ulcerosa. En: La Biblioteca Cochrane Plus. 2008
[citado 14 Abr 2012]; 2. Disponible en:http://www.bibliotecacochrane.com/BCPGetDocument.asp?DocumentID=CD006443
Recibido: 11 de septiembre del 2012.
Aprobado: 20 de noviembre de 2012.
Daisy Marten Marén. Hospital General Docente "Dr. Juan Bruno Zayas Alfonso", avenida Cebreco, km 1½, reparto Pastorita, Santiago de Cuba, Cuba. Correo electrónico:maria62@medired.scu.sld.cu