Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
MEDISAN
versión On-line ISSN 1029-3019
MEDISAN vol.19 no.2 Santiago de Cuba feb.-feb. 2015
ARTÍCULO ORIGINAL
Neutropenia inducida por quimioterapia en pacientes con cáncer de mama
Neutropenia induced by chemotherapy in patients with breast cancer
MsC. María Cristina Céspedes Quevedo,I Dra. Yeris Leydis León Barrios,I MsC. Ana Margarita Vinent CéspedesII y Lic. Sarah Edwards SeringeI
I Hospital Oncológico Docente Provincial "Conrado Benítez García", Santiago de Cuba, Cuba.
II Clínica Estomatológica "30 de Noviembre", Santiago de Cuba, Cuba.
RESUMEN
Se realizó un estudio descriptivo, transversal y prospectivo de 201 pacientes con cáncer de mama atendidos en el Servicio de Quimioterapia del Hospital Oncológico Docente Provincial "Conrado Benítez García" de Santiago de Cuba durante un año (de junio del 2013 a igual mes del 2014), a fin de caracterizarles y determinar la presencia de neutropenia como reacción adversa al tratamiento. La información fue analizada estadísticamente mediante el cálculo porcentual y la prueba de la Χ2, con lo cual se obtuvo que 82 pacientes padecieran neutropenia (40,7 %), en quienes predominó el grupo etario de 41-60 años (50,0 %), el estadio clínico II del tumor maligno (65,8 %) y un único episodio de neutropenia (90,2 %). En cuanto a las pacientes diagnosticadas con neutropenia, se registraron 91 episodios, con mayor frecuencia de los grados moderado (52,7 %) y leve (39,5 %), y una reacción favorable al factor estimulante de colonias de granulocitos humano en 81,8 % de ellas. Por último, se demostró la existencia de neutropenia como efecto adverso a los citostáticos en casi 50 % de las pacientes, así como el resultado beneficioso del factor estimulante en estas; sin embargo, no se halló asociación entre las diferentes combinaciones de citostáticos y los episodios y grados de neutropenia.
Palabras clave: neutropenia, cáncer de mama, quimioterapia, citostáticos, factor estimulante de colonias de granulocitos humano.
ABSTRACT
A descriptive, cross-sectional and prospective study of 201 patients with breast cancer assisted in the Chemotherapy Service of "Conrado Benítez García" Teaching Provincial Oncological Hospital in Santiago de Cuba was carried out during a year (from June, 2013 to the same month of 2014), in order to characterize them and to determine neutropenia as adverse reaction to the treatment. The information was analyzed statistically by means of the percentage calculation and the test Chi squared test, with which it was obtained that 82 patients suffered neutropenia (40.7%) in whom the age group 41- 60 years prevailed (50.0%), the clinical stage II of the malignant tumor (65.8%) and just one neutropenia episode (90.2%). As for the patients diagnosed with neutropenia, 91 episodes were registered, with higher frequency of the moderated degrees (52.7%) and mild (39.5%), and a favorable reaction to the stimulating factor of human granulocytes colonies 81.8% of them. Lastly, the neutropenia existence as adverse effect to the cytostatic drugs in almost 50% of the patients was demonstrated, as well as the beneficial result of the stimulating factor in them; however, there was no association between the different combinations of cytostatic drugs and the episodes and neutropenia degrees.
Key words: neutropenias, breast cancer, chemotherapy, cytostatic drug, stimulating factor of human granulocytes colonies.
INTRODUCCIÓN
La quimioterapia es el tratamiento del cáncer a base de un medicamento antineoplásico o una combinación de dichas drogas en un régimen de tratamiento estándar. Los agentes de quimioterapia más comunes actúan destruyendo las células que se dividen rápidamente, lo cual significa que también pueden dañar las células normales con esta característica (células en la médula ósea, el tracto digestivo y el folículo piloso); los efectos secundarios más comunes son: mielosupresión e inmunosupresión, mucositis (inflamación del revestimiento del tracto digestivo) y alopecia.1,2
De hecho, la depresión del sistema hematopoyético es una de las reacciones adversas más frecuentes, que no en pocas ocasiones ha llevado a suspender el tratamiento y buscar alternativas sustitutivas como la transfusión de concentrados de eritrocitos, plaquetas y concentrados de leucocitos, lo que puede agravar y complicar aún más el cuadro clínico del paciente, y en ocasiones precipitar la muerte.3-5
Estudios recientes de pacientes con cáncer de mama o con linfoma no Hodgkin en estadios tempranos de la enfermedad, muestran que la neutropenia febril y grave es la mayor causa de reducción de la intensidad relativa de dosis, y ello disminuye el período libre de episodios y la sobrevida.6
El factor estimulante de colonias de granulocitos humano (G-CSF, por sus siglas en inglés) es una citosina, hormona glicoproteica producida por monocitos, macrófagos, fibroblastos y células endoteliales. Sus células diana son progenitores mieloides tardíos, vinculados con la serie granulocítica. Esta hormona aumenta los valores de neutrófilos en la sangre periférica en un período de 24 horas, a niveles que generalmente exceden los valores básicos; es producida por el organismo en pequeñas cantidades, pero la producción de G-CSF recombinante ha permitido disponer de las cantidades necesarias para tratar a los pacientes con neutropenia de diferentes causas. Así, la administración de esta hormona está indicada para reducir la duración de la neutropenia y la incidencia de la neutropenia febril en los pacientes con neoplasias, con beneficios que consisten en la prevención de infecciones, la disminución del período de hospitalización y del uso de antibióticos; además, se ha demostrado que desempeña una función fundamental en los diferentes procesos de reproducción humana.7-9
Por otra parte, en el sexo femenino la mortalidad por cáncer de mama ha ocupado el segundo lugar en Cuba, y en la provincia de Santiago de Cuba.10 Esta entidad es una de las neoplasias malignas por la que usualmente se aplica tratamiento citotóxico, y en el Hospital Oncológico de Santiago de Cuba resulta la más frecuente; sin embargo, aún no se había podido caracterizar las pacientes con mielodepresión, en especial con neutropenia inducida por esta terapéutica, así como el efecto del factor estimulante de colonia de granulocitos para contrarrestarlo. Lo anterior condujo a efectuar la presente investigación.
MÉTODOS
Se realizó un estudio descriptivo, transversal y prospectivo de 201 féminas con cáncer de mama, atendidas en el Servicio de Quimioterapia del Hospital Oncológico Docente Provincial "Conrado Benítez García" de Santiago de Cuba, de junio del 2013 a igual mes del 2014, con vistas a caracterizarles desde el punto de vista oncohematológico y determinar la presencia de neutropenia inducida por citotóxicos, antes y después del tratamiento con el G-CSF.
A tales efectos, se creó una planilla que permitió recoger las variables: edad, estadio clínico, esquema de citostáticos (según normas), conteo global de neutrófilos, pacientes con neutropenia, episodios de neutropenia en cada paciente, grados de los episodios de neutropenia, respuesta al tratamiento con el G-CSF, presencia de factores predisponentes a complicaciones y reacciones adversas al tratamiento con el G-CSF.
Para la realización de este estudio se tuvieron en cuenta los principios éticos básicos: beneficencia, no maleficencia, justicia y conservación la autonomía.
Criterios de evaluación
• Respuesta al G-CSF1
- Conteo absoluto de leucocitos: 4,5 x 109/L o más
- Conteo absoluto de neutrófilos: 2 x 109/L o más
• Criterios para evaluar la neutropenia1
- Neutropenia leve: conteo absoluto de neutrófilos de 1-1,9 x 109/L
- Neutropenia moderada: conteo absoluto de neutrófilos de 0,5-1 x 109/L
- Neutropenia grave (grado 4): conteo absoluto de neutrófilos de < 0,5 x 109/L
• Puntos de corte para la concentración de hemoglobina en sangre (establecidos por la Organización Mundial de la Salud para definir la anemia):11
- Mujeres adultas—————— 120 g/L
- Varones adultos—————— 130 g/L
• Diferentes grados de anemia (en g/L)
Mujeres adultas Hombres adultos
- Leve 90 a 119 90 a 129
- Moderada 70 a 89 70 a 89
- Grave <70 <70
Se consideró que el paciente presentaba factores predisponentes al incremento de complicaciones, si existía uno o varios de ellos antes o durante el tratamiento citotóxico, en el interrogatorio o en la historia clínica.
• Factores predisponentes a complicaciones
- Enfermedades crónicas intercurrentes
- Infecciones agudas o crónicas
- Anemia moderada o grave
- Edad mayor de 65 años
- Episodios previos de neutropenia o pancitopenia periférica
- Estadios clínicos III y IV
- Estado de actividad tumoral
- Infiltración medular (según informe de medulograma)
- Neutropenia febril (temperatura corporal de 38 grados o más)
- Tratamiento citostático combinado con la radioterapia (radioterapia previa a la quimioterapia)
La información fue procesada estadísticamente y se utilizó el porcentaje como medida de resumen; también se aplicó la prueba de independencia de la Χ2 y se prefijó como significativa la probabilidad de error obtenida (p) menor que 0,05, equivalente a un nivel de confianza de 95 %; es decir, si p<0,05 se rechaza la hipótesis nula y se acepta que existe relación entre las variables analizadas. Para todos los cálculos se utilizaron los sistemas estadísticos informatizados SPSS y EPIDAT.
RESULTADOS
De las 201 pacientes tratadas con citotóxicos, 82 presentaron neutropenia, que representó 40,7 % del total. En la tabla 1 se muestra que la mayoría de las pacientes padecieron solo un episodio de esta reacción adversa (90,2 %), y que el estadio clínico II fue el predominante, con 54 pacientes.
La mayor parte de las afectadas correspondieron al grupo etario de 41-60 años, con 41 de ellas, para 50,0 %; mientras que de las restantes, 32 eran del grupo de 61-80 años (39,1 %) y 9 del grupo de 21-40 años (10,9 %).
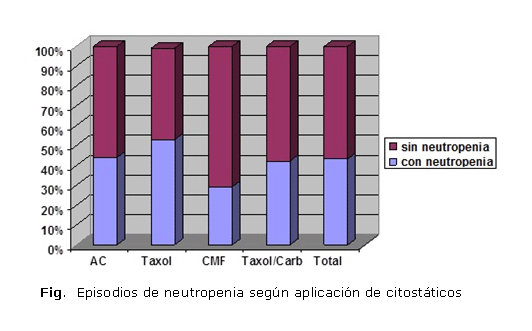
De los 201 ciclos de citotóxicos empleados, 152 se realizaron con el esquema Adriamicina®-ciclofosfamida (AC), 15 con Taxol®, 17 con ciclofosfamida-metotrexato-5 fluorouracilo (CMF) y 26 con Taxol®-carboplatino (TC). En las pacientes que padecieron un total de 91 episodios de neutropenia (43,3 %), la combinación de AC fue la más utilizada y, aunque el esquema CMF produjo un menor número de episodios (29,4 %) y el Taxol® una mayor cantidad (53,0 %), no se encontró asociación estadística entre ninguno de estos esquemas y la reacción adversa (figura).
Se observó que de los 3 grados de neutropenia padecidos por las pacientes (tabla 2), el moderado fue el más frecuente, seguido del leve. Aunque el Taxol® fue el citostático que mayormente produjo neutropenia moderada, no se encontraron diferencias significativas al aplicar X2, por lo que no hubo asociación entre los grados de leucopenia y los esquemas de quimioterapia aplicados.
En la tabla 3 se expone la respuesta positiva al tratamiento con el G-CSF de la mayoría de las afectadas con neutropenia y que esa respuesta fue similar en todos los grados de leucopenia, por lo que no se encontró asociación estadística.
Respecto a los factores de riesgo de complicaciones en las pacientes que recibieron el tratamiento con citotóxicos, se encontraron 175 en las 82 afectadas, con mayor frecuencia de las enfermedades crónicas no transmisibles (57), las neutropenias anteriores (40), la edad avanzada (26), los estadios clínicos avanzados (21) y la quimioterapia combinada con la radioterapia (15). De las 7 pacientes con neutropenia grave, 6 presentaron otras enfermedades crónicas no transmisibles asociadas (85,7 %) y 5 habían padecido anteriormente algún otro episodio de neutropenia (71,4 %). La neutropenia febril se halló en 2 féminas (2,4 % del total).
DISCUSIÓN
Los fármacos antineoplásicos utilizados tradicionalmente, inducen mecanismos de apoptosis o de muerte de las células mediante la inhibición de su crecimiento, o por los daños que provocan en su ácido desoxirribonucleico; sin embargo, esta acción no está dirigida de manera específica a las células tumorales y puede tener un efecto tóxico sobre los tejidos sanos, lo que limita la dosis que se debe administrar. La neutropenia es una de las reacciones adversas de la quimioterapia que con mayor frecuencia obliga a aplazar su administración o a reducir la dosis, lo que repercute desfavorablemente en la evolución de los afectados.12 En esta casuística casi la mitad de la muestra padeció neutropenia inducida por citostáticos, lo que no concordó con el menor número de pacientes que se obtuvo en un estudio3 efectuado en este mismo Hospital un año antes, probablemente por la existencia de un gran subregistro.
La mayor frecuencia de la enfermedad en pacientes del grupo etario de 40-60 años, en el estadio clínico II de la neoplasia y con el uso del esquema Adriamicina®-ciclofosfamida concordó con los resultados de otras series similares.3,4 Habitualmente algunos de estos pacientes padecen más de un episodio de neutropenia, lo que ha llevado al uso profiláctico del G-CSF.13-15
Por otra parte, en los estudios realizados por Sibylle et al14 de 351 pacientes con cáncer de mama seleccionados aleatoriamente, y por Zwick et al15 de 103 afectados con neoplasias malignas en diferentes localizaciones, en los cuales fue aplicado el tratamiento con el G-CSF durante 2 o 4 días después de la quimioterapia, se obtuvo una mayor efectividad en quienes fueron tratados profilácticamente con el G-CSF durante 4 días.
Asimismo, la gran mayoría de los pacientes en este estudio presentó solo un episodio de neutropenia, y al relacionar los esquemas de citostáticos usados con el número de episodios producidos, no se encontró asociación estadística, lo cual concordó con los formularios de medicamentos y los protocolos de vigilancia, que no señalan nada al respecto.1,2
Se demostró, además, que la neutropenia inducida por citotóxicos puede aparecer en diferentes grados en los pacientes, pero sin asociarse estadísticamente a ningún citostático en particular ni a la respuesta al tratamiento con G-CSF, pues más de 80 % de los episodios en los 3 grados clasificados respondieron positivamente, para así coincidir con todos los resultados notificados por otros investigadores.3,5,13,16
Algunos factores de riesgo de complicaciones hallados en los pacientes con neutropenia de este trabajo, fueron similares a los expuestos por Lami Casaus et al,4 y la neutropenia febril fue mucho menos frecuente que la encontrada en otros estudios6,8,14,15 de pacientes con linfoma no Hodgkin y con cáncer en otras localizaciones, en quienes se utilizaron esquemas de citotóxicos, al parecer más invasivos; en estas publicaciones se sugiere disminuir las neutropenias febriles con el uso del G-CSF. También Hershman et al17 demuestran beneficios mayores que los costos ocasionados por el uso de la hormona G-CSF en pacientes con cáncer de mama.
Según investigaciones18,19 realizadas en varios centros de salud de los Estados Unidos, algunos pacientes tratados con G-CSF (pegfilgrastim) refirieron dolores óseos o molestias, y como alternativa se disminuyó la dosis o fue administrado algún analgésico. De hecho, la hormona desarrollada en Cuba (Ior® LeukoCIM o Herbevital) puede producir ciertas molestias osteo-musculares; sin embargo, en la actual serie no se registraron reacciones adversas de esta índole.
Para dar por concluido, casi la mitad de las integrantes de la casuística presentaron episodios de neutropenia, cuya gran mayoría respondió de manera positiva al tratamiento con el G-CSF, independientemente del grado de gravedad; de igual modo, los esquemas terapéuticos produjeron un efecto similar en el sistema granulopoyético en cada grupo de pacientes. Las neutropenias graves correspondieron a un mayor número de los que padecían alguna enfermedad crónica no transmisible asociada o anteriormente habían presentado neutropenias.
REFERENCIAS BIBLIOGRÁFICAS
1. Alfonso Galbán P, Alonso Orta I, Alonso Carbonell L, Calvo Barbados DM, Cruz Barrios MA, Pérez Peña J, et al. Formulario de Medicamentos Cuba. La Habana: Editorial Ciencias Médicas; 2011.
2. González García MI, Salvador Garrido P, Piñeiro Iglesias MJ, Dominguez Hernández DV, Martínez Losada M. Protocolos de Vigilancia Sanitaria Específica. Agentes citostáticos Ministerio Salubridad y consumo. Madrid: Ministerio de Sanidad y Consumo; 2003 [citado 6 Sep 2013]. Disponible en: http://www.iaprl.org/images/contenidos/biblioteca-publicaciones-y-campanas/publicaciones/publicaciones-seriadas /protocolos_de_vigilancia_sanitaria_especifica_agentes_citostaticos.pdf
3. Céspedes Quevedo MC, Segura López D, Martínez Rodríguez E, Cobas Ramos Z, Bronfield Caballero D. Efecto del factor estimulante de colonias de granulocitos en pacientes con cáncer. MEDISAN. 2013 [citado 6 Jun 2014]; 17(1). Disponible en: http://bvs.sld.cu/revistas/san/vol17_1_13/san071713.htm
4. Lami Casaus L, Arbesú Michelena MA, Alsina Sarmiento S, Brito Iglesia R. Aparición de episodios de neutropenia febril tras la quimioterapia citostática en el paciente oncológico. Rev Cubana Farm. 2009 [citado 6 Jun 2014]; 43(4). Disponible en: http://scielo.sld.cu/scielo.php?pid=S0034-75152009000400008&script=sci_arttext
5. Mendoza Hernández I, Cachimaille Benavides Y, Guerra Chaviano PP, Robaina García M, Damaso Fernández J, Wilford de León M, et al. Impacto en la asistencia médica cubana de la extensión nacional del ior® LeukoCIM a través de ensayos clínicos. Rev Cubana Farm. 2010 [citado 10 Ago 2014]; 44(Sup. 2). Disponible en: http://bvs.sld.cu/revistas/far/vol44_sup2_10/Impacto%20en%20la%20asistencia%20medica% 20cubana%20de%20la%20extension%20nacional%20del%20ior%20LeukoCIM%20a%20traves%20de%20EC.pdf
6. Pettengell R, Schwenkglenks M, Bacon P, Lawrinson S, Duehrsen U. Pegfilgrastim primary prophylaxis in patients with non-Hodgkin lymphoma: results from an integrated analysis. Hematol Oncol. 2011; 29(4): 117-84.
7. Santibáñez Morales A, Bagnarello F, Sánchez Serrano AP, de la Jara JF. Factor estimulante de colonias de granulocitos y su efecto en el ámbito reproductivo. Rev Mex Med Reprod. 2012; 4(4): 147-52.
8. Tan H, Tomic K, Hurley D, Daniel G, Barron R, Malin J. Comparative effectiveness of colony-stimulating factors for febrile neutropenia: a retrospective study. Curr Med Res Opin. 2011; 27(1): 79-86.
9. Herbst C, Naumann F, Kruse EB, Monsef I, Bohlius J, Schulz H, Engert A. Profilaxis con antibióticos y G-CSF para prevenir las infecciones y mejorar la supervivencia de los pacientes con cáncer que reciben quimioterapia. Biblioteca Cochrane Plus. 2014 [citado 29 Ago 2014]; (1). Disponible en: http://www.update-software.com/BCP/BCPGetDocument.asp?DocumentID=CD007107
10. Cuba. Ministerio de Salud Pública. Dirección Nacional de Registro Médicos y Estadísticos de Salud. Anuario Estadístico de Salud 2012. La Habana: MINSAP; 2013 [citado 6 Jun 2014]. Disponible en: http://files.sld.cu/dne/files/2013/04/anuario_2012.pdf
11. Suardíaz Pareras J, Cruz Rodríguez C, Colina Rodríguez A. Laboratorio clínico. La Habana: Editorial Ciencias Médicas; 2004.
12. Pérez Ruiz L, Fernández Águila JD, Ramos Cedeño AM. Factor estimulante de colonias de granulocitos en el tratamiento ambulatorio de la neutropenia posterior a la quimioterapia. Rev Panam Salud Publica. 2009 [citado 10 Ago 2014]; 26(3). Disponible en: http://www.scielosp.org/scielo.php?script=sci_arttext&pid=S1020 -49892009000900013
13. Rondón Ayala JA, Concepción Pérez ML, Negrín Marrero R, Ruiz Calabuch H, Rodríguez Castañeda H. Evaluación del tratamiento con el factor estimulante de colonias granulocíticas en pacientes oncológicos con riesgo de neutropenia. Hospital General de Sancti Spíritus. Año 2008 -2009. Gaceta Médica Espirituana. 2009 [citado 10 Ago 2014]; 11(3). Disponible en: http://bvs.sld.cu/revistas/gme/pub/vol.11.%283%29_05/ vol.11.3.05.pdf
14. Loibl S, Mueller V, von Minckwitz G, Bettina C, Koehne CH, Kremers S, et al. Comparison of pegfilgrastim on day 2 vs. day 4 as primary prophylaxis of intense dose-dense chemotherapy in patients within node-positive primary breast cancer within the prospective, multi-center GAIN study: (GBG 33). Support Care Cancer. 2011; 19(11): 1789-95.
15. Zwick C, Hartmann F, Zeynalova S, Pöschel V, Nickenig C, Reiser M, et al. Randomized comparison of pegfilgrastim day 4 versus day 2 for the prevention of chemotherapy-induced leukocytopenia. Ann Oncol. 2011; 22(8): 1872-7.
16. Arencibia Núñez A. Neutropenia febril: convertir el bajo riesgo en cero riesgo. Rev Cubana Hematol Inmunol Hemoter. 2009 [citado 3 Jun 2014]; 25(2). Disponible en: http://www.bvs.sld.cu/revistas/hih/vol25_2_09/hih04209.htm
17. Hershman DL, Wilde ET, Wright JD, Buono DL, Kalinsky K, Malin JL. Uptake and economic impact of first-cycle colony-stimulating factor use during adjuvant treatment of breast cancer. J Clin Oncol. 2012; 30(8): 806-12.
18. Paba C, Sachdev J, Kronish L, Jahanzeb M, Waheed S. Empiric dose reduction of pegfilgrastim in breast cancer patients receiving cytotoxic chemotherapy. J Clin Oncol. 2008; 26(15): 20636.
19. Gregory SA, Schwartzberg LS, Sierra J, Vogel C. Evaluation of reported bone pain in cancer patients receiving chemotherapy in pegfilgrastim clinical trials: a retrospective analysis. Commun Oncol. 2010 [citado 29 Ago 2014]; 7(7): 297-308. Disponible en: http://www.oncologypractice.com/co/journal/articles/0707297.pdf
Recibido: 9 de septiembre de 2014.
Aprobado: 4 de noviembre de 2014.
María Cristina Céspedes Quevedo. Hospital Oncológico Docente Provincial "Conrado Benítez García", Avenida Los Libertadores, Santiago de Cuba, Cuba. Correo electrónico: maria.cespedes@medired.scu.sld.cu