Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
MEDISAN
versión On-line ISSN 1029-3019
MEDISAN vol.22 no.5 Santiago de Cuba mayo 2018
ARTÍCULO ORIGINAL
Características humorales de los tumores de cabeza y cuello en pacientes tratados con nimotuzumab
Humoral characteristics of head and neck tumors in patients treated with nimotuzumab
Dra. Lisandra Roca Serra, I Dra. María Cristina Céspedes Quevedo, I Lic. María Caridad Ricardo Cobas, I Dra. Leonor Serra Pérez II y Dra. Ana Margarita Vinent Céspedes III
I Hospital Oncológico Docente Provincial "Conrado Benítez García", Universidad de Ciencias Médicas, Santiago de Cuba, Cuba.
II Policlínico Universitario "Julián Grimau García", Universidad de Ciencias Médicas, Santiago de Cuba, Cuba.
III Hospital Provincial Docente Clinicoquirúrgico "Saturnino Lora Torres", Universidad de Ciencias Médicas, Santiago de Cuba, Cuba.
RESUMEN
Se efectuó un estudio observacional, descriptivo y retrospectivo de 36 pacientes incluidos en el ensayo clínico (fase IV) "Seguridad y efectividad del nimotuzumab en tumores de cabeza y cuello", desarrollado en el Hospital Oncológico "Conrado Benítez" de Santiago de Cuba, desde enero de 2013 hasta diciembre de 2016, con vistas a identificar las características humorales de dichos tumores en los afectados. Se utilizó la prueba t de Student con una significación estadística de p <0,05. Predominaron el sexo masculino en mayores de 60 años de edad, los efectos adversos clínicos y el tumor de faringe; el estadio clínico III y el carcinoma epidermoide bien diferenciado fueron los más frecuentes. No existieron diferencias estadísticamente significativas entre los parámetros de laboratorio antes del tratamiento combinado con nimotuzumab y durante este. Dicho medicamento constituyó una alternativa terapéutica segura, ventajosa y factible como parte del plan terapéutico convencional en las condiciones asistenciales.
Palabras clave: anticuerpo monoclonal, nimotuzumab, cáncer, atención secundaria de salud.
ABSTRACT
An observational, descriptive and retrospective study of 36 patients included in the (phase IV) clinical trial "Security and effectiveness of nimotuzumab in head and neck tumors" was carried out. It was developed at "Conrado Benítez" Oncological Hospital in Santiago de Cuba, from January, 2013 to December, 2016, aimed at identifying the humoral characteristics of these tumors in the affected patients. The Student t test was used with a statistical significance of p <0.05. There was a prevalence of the male sex in older than 60 years, the clinical adverse effects and the pharynx tumor; the clinical stage III and the well differentiated epidermoid carcinoma were the most frequent findings. There were no statistically significant differences among the laboratory parameters before and during the combined treatment with nimotuzumab. This medication constituted a sure, advantageous and feasible therapeutic alternative as part of the conventional therapeutic plan in assistance conditions.
Key words: monoclonal antibody, nimotuzumab, cancer, secondary health care.
INTRODUCCIÓN
El cáncer es una afección conocida desde la antigüedad; tiene un carácter multifactorial debido al efecto combinado de factores ambientales y genéticos.1,2 Las neoplasias de cabeza y cuello se encuentran localizadas en los senos paranasales, la faringe (nasofaringe, orofaringe, hipofaringe), la laringe, la cavidad bucal, el labio y las glándulas salivares.3
Como es sabido, la patogénesis de esta enfermedad es multifactorial, pues involucra desde cambios genéticos y epigenéticos de la mucosa escamosa normal hasta lesiones premalignas que finalmente se convierten en tumores malignos. Se han descrito múltiples alteraciones citogenéticas en este tipo de neoplasias. El gen del receptor del factor de crecimiento epidérmico ha sido implicado en esta patogénesis y en las manifestaciones agresivas de los cánceres de cabeza y cuello. De esta forma dicho gen constituye una diana adecuada para el tratamiento de estos cánceres.4
La inmunoterapia pasiva para las enfermedades malignas asociadas al sistema factor de crecimiento epidérmico/receptor del factor de crecimiento epidérmico se fundamenta en la utilización de anticuerpos monoclonales contra este último.4
El nimotuzumab es un anticuerpo humanizado antireceptor del factor de crecimiento epidérmico, tipo IgG1, desarrollado en el Centro de Inmunología Molecular de la Habana a partir de moléculas biológicas del propio organismo, a diferencia de los otros fármacos de química sintética. Dicho producto biotecnológico tiene baja toxicidad y alta tolerancia, por lo que puede utilizarse en tratamientos de larga duración. Se ha aprobado su uso en carcinomas de células escamosas de cabeza y cuello (CCECC), en países tales como Cuba, la India, Colombia, Argentina, Costa de Marfil, Gabón, Ucrania, Perú y Sri Lanka.5,6
Al respecto, en el Hospital Oncológico Provincial "Conrado Benítez García" se realizó el ensayo clínico multicéntrico fase IV, para evaluar la seguridad y la efectividad del nimotuzumab, durante 3 años, en tumores malignos de cabeza y cuello, de nuevo diagnóstico o recurrentes, que se encontraban en estadios avanzados. Hasta el momento del estudio, no se habían descrito las variaciones en los valores de las variables hemoquímicas de los pacientes incluidos, antes del tratamiento y durante este, por lo cual se decidió realizar esta investigación.
MÉTODOS
Se efectuó un estudio observacional, descriptivo y retrospectivo de pacientes incluidos en el ensayo clínico (fase IV) "Seguridad y efectividad del nimotuzumab en tumores de cabeza y cuello", desarrollado en el Hospital Oncológico Provincial "Conrado Benítez García", durante de 3 años, a fin de identificar las características humorales de dichos tumores en los afectados. El universo estuvo constituido por 36 pacientes cubanos de ambos sexos.
Para la realización de este estudio se analizaron las siguientes variables: edad, sexo, localización del tumor, estadio clínico, tipo histológico, esquema de tratamiento, concentración de hemoglobina en sangre, grados de anemia, conteo global de leucocitos, conteo absoluto de neutrófilos, glucemia, creatinina, alanino aminotransferasa, aspartato aminotransferasa, fosfatasa alcalina, proteínas totales, albúmina, efectos adversos y lactato deshidrogenasa.
Los exámenes de laboratorio se desarrollaron según los procedimientos normalizados de operación, actualizados, de cada una de las determinaciones que utilizaba el Departamento de Laboratorio Clínico de dicho hospital.
Para la obtención de la información se revisaron las historias clínicas de los pacientes y los datos fueron vaciados en una planilla de recolección diseñada al efecto, la cual incluyó las variables en estudio. La información obtenida se procesó mediante el paquete estadístico SPSS-11.5.1 y se utilizó el porcentaje como medida de resumen. Se aplicó la prueba t de Student para establecer la comparación de medias, con una significación estadística de p <0,05.
RESULTADOS
La tabla 1 muestra un predominio de los pacientes mayores de 60 años de edad (22 para 55,6 %) y del sexo masculino (32 para 88,9 %).
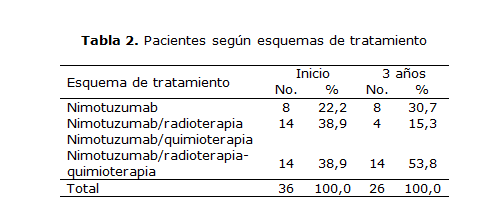
De un total de 14 pacientes incluidos en el esquema nimotuzumab/radioterapia-quimioterapia (Nimo/RT-QT), al término del estudio se mantuvo la totalidad de estos, con un incremento de la supervivencia (53,8 %). En los otros 2 grupos de afectados que recibieron los esquemas nimotuzumab/radioterapia (Nimo/RT) y nimotuzumab, la respuesta objetiva fue de 4 (15,3 %) y 8 pacientes (30,7 %), respectivamente (tabla 2).
Como se observa en la tabla 3, tanto la media de los parámetros hematológicos y de función hepática como la de otras variables del metabolismo se encontraron en el rango de referencia para cada una de las determinaciones antes del tratamiento y durante este; por tanto, no existieron diferencias significativas para los parámetros de laboratorio, todo lo cual demuestra que desde los puntos de vista hematológico y bioquímico el metabolismo de estos pacientes, a pesar de su enfermedad, no se alteró de forma evidente con el tratamiento indicado.
En cuanto a los efectos adversos según tipo de tratamiento (tabla 4), 60,2 % correspondieron a los efectos clínicos, con un predominio del esquema Nimo/RT-QT (59,2 %), siendo de igual manera los más notificados, seguidos del esquema que utilizó solamente el nimotuzumab donde, igualmente, primaron los efectos clínicos (61,9 %) y posteriormente, los hematológicos (31,1 %) que también tuvieron supremacía en el esquema Nimo/RT-QT (35,8 %).
De los 124 efectos hemoquímicos, la anemia ocupó 47,5 %. Resulta oportuno señalar que durante el periodo de estudio esta reacción adversa estuvo presente en un mismo individuo varias veces (tabla 5).
DISCUSIÓN
El resultado obtenido con respecto al sexo y grupos etarios fue similar al hallado en las investigaciones de Suárez et al7 y Pérez et al8 donde predominaron el sexo masculino (72,0 y 56,6 %, respectivamente) y los afectados mayores de 60 años de edad.
Respecto a los esquemas de tratamiento, hubo coincidencia con un estudio realizado en la India donde la tasa de respuesta objetiva en los grupos tratados con nimotuzumab combinado con radioterapia fue de 76 % y en quienes recibieron el medicamento combinado con quimioterapia y radioterapia de 100 %.7,9
De hecho, múltiples ensayos donde se evaluó el nimotuzumab combinado con radioterapia y quimioradioterapia en pacientes con diagnóstico histológico de carcinoma avanzado (estadio III o IV) de células escamosas de cabeza y cuello, mostraron que la adición del monoclonal a la terapia oncoespecífica incrementó significativamente la supervivencia.10
Bacallao et al11 refieren que ciertas características del nimotuzumab y la interacción con su Diana pudieran tener relación con la ausencia de diferencias significativas entre los parámetros humorales, debido a que dicho medicamento es un anticuerpo monoclonal que originalmente fue aislado como un anticuerpo murino Ig G2, el cual posteriormente fue humanizado y con ello se consiguió disminuir su inmunogenicidad, así como ralentizar su aclaramiento del organismo, lo que explica la escasa toxicidad de dicho fármaco con respecto a los de su clase (EGFR inhibidores).
El predominio de los efectos clínicos sobre los hematobioquímicos coincide con lo notificado en bibliografía médica consultada.12,13 De igual forma, en otros estudios14-16 se notifica que estos efectos fueron escalofríos, náuseas, cefalea, vómitos, anemia, hipotensión arterial o hipertensión arterial y fiebre con intensidad leve o moderada.
Ahora bien, en relación con las reacciones adversas hematológicas y bioquímicas, varios autores encontraron que la anemia tuvo mayor frecuencia, seguida del aumento de las enzimas hepáticas aspartato aminotranferasa y la fosfatasa alcalina,17,18 lo cual concuerda parcialmente con lo hallado en esta investigación. Asimismo, un ensayo clínico realizado en China para evaluar la seguridad y la efectividad del nimotuzumab combinado con cisplastino o paclitaxel en pacientes con cáncer esofágico de células escamosas en estadio avanzado, arrojó los siguientes resultados (en orden de frecuencia): leucopenia 41 (73,2 %), neutropenia 40 (71,4 %), anemia 21 (37,5 %), elevación de las enzimas hepáticas 7 (12,5 %) y trombopenia 6 (10,7 %),19 dichos resultados también coinciden parcialmente con este estudio.
El análisis de las variables estudiadas y la comparación con investigaciones tanto nacionales como extranjeras reveló que los parámetros hematobioquímicos obtenidos no mostraron diferencias significativas antes del tratamiento combinado con nimotuzumab y durante este. Se confirmó que dicho medicamento puede ser una alternativa terapéutica segura, ventajosa y factible como parte del tratamiento convencional en las condiciones asistenciales.
REFERENCIAS BIBLIOGRÁFICAS
1. Fernández Pérez MD, Regueira Betancourt SM, Torres Fernández M. Factores de riesgo modificables en algunos tipos de cáncer. Revista Electrónica Dr. Zoilo E. Marinello Vidaurreta. 2016 [citado 8 Feb 2017]; 41 (11). Disponible en: http://revzoilomarinello.sld.cu/index.php/zmv/article/view/940/pdf_349
2. Suarez García R, Pérez Martínez CY, Fernández Rojas L, Pérez Pupo A. Caracterización de adultos mayores con cáncer de cabeza y cuello. CCM. 2013 [citado 20 Nov 2016]; 17 (2). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1560-43812013000200002
3. Mehanna H, Paleri V. Epidemiología, presentación y prevención de cáncer de cabeza y cuello. Revisión de las presentaciones frecuentes, estudios comunes y nuevas técnicas de diagnóstico. Detección y prevención. BMJ. 2010; 341:4684.
4. Zerecero Carreón O, Valle Mendiola A, Weiss Steider B, Soto Cruz I. El receptor para el factor de crecimiento epidérmico (EGFR) y su relación con el cáncer. Revista Especializada en Ciencias de la Salud. 2012 [citado 8 Feb 2017]; 15 (1). Disponible en: http://www.medigraphic.com/pdfs/vertientes/vre-2012/vre121b.pdf
5. Fuenmayor J, Gamez Hoyos R, Montaño Ramón F. Anticuerpos monoclonales en el tratamiento del cáncer. Terapia dirigida para tumores sólidos. Rev Venez Oncol. 2013; 25 (4): 236-54.
6. Alfonso Orta I, Alonso Carbonell L, Alonso Garbán P, Broche Villareal L, Calvo Barbado DM, González Ricardo Y, et al. Formulario Nacional de Medicamentos. 4 ed. La Habana: ECIMED; 2014. p. 325-6.
7. Pérez Delgado N, Urgellés Rodríguez E, Acosta Calderín MM, Álvarez González A. Comportamiento clínico-epidemiológico de cáncer de cabeza y cuello en provincia de Guantánamo. Rev Inf Cient. 2014 [citado 20 Nov 2016]; 83 (1). Disponible en: http://www.revinfcientifica.sld.cu/index.php/ric/article/view/981/1936
8. Ramakrishnan MS, Eswaraiah A, Crombet T, Piedra P, Saurez G, Iyer H, et al. Nimotuzumab, a promising therapeutic monoclonal for treatment of tumors of epithelial origin. MAbs. 2009 [citado 25 Mar 2015]; 1 (1). Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2715181/
9. Osorio Rodríguez M, Cruz Rivero T, del Castillo Bahi R, Roca Muchuli C, Azcue Bilbao M, Neninger Vinageras E, et al. Nimotuzumab plus radiotherapy for unresectable squamous-cell carcinoma of the head and neck. Cancer Biol Ther. 2010;9(5):343-9.
10. Huang XD, Yi JL GL, Xu GZ JJ, et al. Multi-center phase II clinical trial of humanized anti-epidermal factor receptor monoclonal antibody h-R3 combined with radiotherapy for locoregionally advanced nasopharyngeal carcinoma. Zhonghua Zhong Liu Zhi. 2007; 29 (3):197-201.
11. Bacallao Méndez RA, Crombet Ramos T, Dávalos Iglesias JM, Mañalich Comas R, Llerena Ferrer B, Gutiérrez García F. Niveles séricos de magnesio en pacientes oncológicos tratados con nimotuzumab. Rev Cubana med. 2015 [citado 14 Jun 2017]; 54 (2): 139-150. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75232015000200005
12. Cimaher (nimotuzumab). Resumen de las características del producto. La Habana: CIMAB S. A; 2013.
13. Nimotuzumab. Rev Cubana Farm. 2012 [citado 14 Jun 2017]; 46(3). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75152012000300011
14. Saurez Martínez G, Salva Camaño SN, Piedra Sierra P, Iglesias Castillo B, Toledo Jiménez C, Salomón Cardona MT, et al. Seguridad y efectividad del nimotuzumab en los pacientes con tumores gliales malignos. Rev Cubana Neurol Neurocir. 2015; 5 (2):123-32.
15. Diaz Miqueli A, Saurez Martinez G. Nimotuzumab as a radiosensitizing agent in the treatment of high grade glioma: challenges and opportunities. Onco Targets Ther. 2013 [citado 25 Mar 2015]; 6. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3729249/
16. Solomón MT, Selva JC, Figueredo J, Vaquer J, Toledo C, Quintanal N, et al. Radiotherapy plus nimotuzumab or placebo in the treatment of high grade glioma patients: results from a randomized, double blind trial. BMC Cancer. 2013 [citado 25 Mar 2015];13. Disponible en:https://bmccancer.biomedcentral.com/articles/10.1186/1471-2407-13-299
17. Aguilera Calvo N, del Cristo Domínguez IS, Muñoz Morejón Y, Palomino Machado L, Macías Abraham A. Evaluación de la seguridad del nimotuzumab en pacientes con cáncer de pulmón de células no pequeñas portadores de metástasis cerebral. Rev Electrónica Dr. Zoilo E. Marinello Vidaurreta. 2015 [citado 14 Ene 2017]; 40(9). Disponible en: http://revzoilomarinello.sld.cu/index.php/zmv/article/view/311/html_87
18. Okamoto W, Yoshino T, Takahashi T, Okamoto I, Ueda S, Tsuya A, et al. A phase I, pharmacokinetic and pharmacodynamic study of nimotuzumab in Japanese patients with advanced solid tumors. Cancer Chemother Pharmacol. 2013; 72 (5):1063-71.
19. Lu M, Wang X, Shen L, Jia J, Gong J, Li J, et al. Nimotuzumab plus paclitaxel and cisplatin as the first line treatment for advanced esophageal squamous cell cancer: A single centre prospective phase II trial. Cancer Sci. 2016 [citado 14 Ene 2017]; 107 (4). Disponible en: https://onlinelibrary.wiley.com/doi/pdf/10.1111/cas.12894
Recibido: 27 de diciembre de 2017.
Aprobado: 10 de abril de 2018.
Lisandra Roca Serra. Hospital Oncológico Docente Provincial "Conrado Benítez García", Avenida Los Libertadores, Santiago de Cuba, Cuba. Correo electrónico:leonorse@infomed.sld.cu
 Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons
Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons