Introducción
A escala internacional ocurren más de 15 millones de casos de isquemia cerebral por año, 35 % de ellos causados por oclusión de un gran vaso arterial, en algunos casos invalidantes. Guerra, citado por Fariñas,1 expresa que en Cuba las enfermedades cerebrovasculares constituyen la tercera causa de muerte, después del cáncer y las enfermedades cardiovasculares, con una tasa bruta de alrededor de 82,9 por cada
100 000 habitantes.
El cerebro recibe 15 % del flujo cardiaco y utiliza 20 % del oxígeno que consume el organismo. La interrupción del flujo sanguíneo al cerebro, así como la falta de oxígeno y glucosa, resultan una alteración rápida del metabolismo y las funciones cerebrales,2,3) donde prima el catabolismo sobre el anabolismo.
A pesar del desarrollo tecnológico alcanzado en los últimos años, en que la medicina ha incrementado los conocimientos relacionados con la patogenia, el diagnóstico y la terapéutica de las enfermedades cerebrovasculares, aún quedan algunos problemas por resolver, que dependen del desarrollo actual en el campo de la tecnología, los ensayos clínicos y la experimentación, tanto en humanos como en animales, respectivamente. Investigaciones relacionadas con las enfermedades cerebrovasculares, se han realizado en diferentes biomodelos;4,5 sin embargo, el más utilizado es el gerbil de Mongolia (Meriones unguiculatus),6,7,8,9) por presentar ventajas anatómicas especiales, al poseer un polígono de Willis incompleto, cada hemisferio recibe sangre casi independiente uno del otro y las lesiones se localizan en el mismo hemisferio cerebral de la isquemia. No obstante, Subiros et al7) plantean la necesidad de incluir las características del polígono de Willis de cada biomodelo en las investigaciones con este tipo de animal, debido a la variabilidad que presenta este polígono de Willis en su estructura, según el vaso sanguíneo afectado.
En tal sentido, Lopes et al10 estudiaron el efecto de la isquemia unilateral en gerbils durante las primeras 72 horas y encontraron extensas lesiones en todos los casos. Según Rodrigues et al,11) y Yan-ru et al12) los cambios morfofuncionales en las neuronas se pueden observar a los pocos minutos tras el inicio de la isquemia. Los resultados de estos estudios muestran, que la actividad metabólica decrece durante el proceso isquémico en el tejido cerebral del gerbils, con alteraciones en el metabolismo durante las primeras 6 horas después de la isquemia cerebral. Cuando esta es transitoria, dichos eventos pueden considerarse reversibles si se establece una terapia eficaz y precoz, en las primeras 5 horas de los síntomas iniciales.13,14,15
Por su parte, Xue et al16 estudiaron el efecto de la arginina vasopresina sobre el edema de la corteza cerebral durante la isquemia, que ocurre en las primeras 6 horas después de la oclusión de la arteria carótida en gerbils. Rivera et al17 refieren que es importante el diagnóstico y tratamiento dentro de las primeras 72 horas en caso de isquemia cerebral transitoria, debido a los cambios inmediatos que ocurren desde las primeras horas de producido el trauma, que puede evolucionar hacia un estado de daño irreversible y muerte celular.
Dado que los accidentes vasculares encefálicos constituyen una de las primeras causas de muerte en Cuba y existe un incremento de esta enfermedad en los últimos años, resulta necesario profundizar en los conocimientos básicos sobre las enfermedades cerebrovasculares y describir algunas de las características morfométricas de las neuronas de la fascia dentada del hipocampo, bajo el efecto de un daño isquémico permanente. Por ello, con este estudio se pretende identificar las particularidades de la secuencia de muerte neuronal en la fascia dentada durante las primeras horas, después de una isquemia permanente.
Métodos
Se realizó un estudio prospectivo y experimental, a partir de la producción de un trauma isquémico cerebral permanente en 24 gerbils de Mongolia, machos, de
65-70 gramos, procedentes del Centro Nacional para la Producción de Animales de Laboratorio (Cenpalab). Durante la investigación los animales se mantuvieron en un ambiente controlado, a temperatura de 22-24 °C, humedad relativa de 60-65 % y ciclo de 12 horas de luz / oscuridad, con libre acceso para consumir agua y alimento.
Ahora bien, para producir la isquemia, los animales fueron anestesiados por vía intraperitoneal con ketamina, a dosis de 45 mg/kg de peso. Se expuso la carótida derecha que fue ligada en 2 puntos y se seccionó entre las ligaduras; luego se cerró la herida por planos. Se utilizaron 24 animales, 3 en cada periodo de tiempo y 3 como control, a los cuales no se le produjo el trauma.
El sacrificio de los animales se realizó a las 2, 4, 6, 12, 24, 48, y 72 horas posteriores a la lesión. Antes de la extracción del encéfalo se realizó perfusión transcardiaca con suero fisiológico y solución de formalina neutra al 10 %. Una vez extraído el encéfalo, se fijó en formalina y se incluyó en parafina; los cortes de unos 6 µm se colorearon con hematoxilina/eosina. Las láminas histológicas fueron ordenadas cronológicamente según el diseño de la toma de muestra.
Para el estudio morfométrico se utilizó un microscopio Olimpus con aumento de 400X, al cual se le colocó una plantilla de puntos. El conteo del número de neuronas se realizó en un área constante de 5 660,48 µm² en el hemisferio derecho, que corresponde a la densidad neuronal de cada variable. Se realizaron varias lecturas en toda la longitud de la fascia dentada. Las variables estudiadas fueron: población de neuronas con signos de muerte celular, población de neuronas aparentemente normales y población de neuronas según cantidad de nucléolos.
Se calculó la media aritmética y la desviación estándar. La relación y diferencia entre las variables se evaluó mediante el coeficiente de correlación de Pearson y el análisis de varianza (ANOVA), respectivamente. Los valores de p < 0,05 fueron considerados estadísticamente significativos.
Resultados
Las primeras observaciones microscópicas se realizaron a las 2 horas de producida la lesión, el número de neuronas aparentemente normales en la fascia dentada aún era elevado, aunque ya existía 9,83 % de muerte neuronal. La figura 1 muestra las dinámicas de la cantidad de neuronas aparentemente normales (NN) y aquellas con signos de muerte celular (NM) en la fascia dentada de los animales con isquemia.
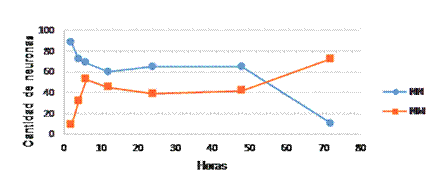
Fig. 1 Se observa la dinámica de las neuronas normales y con signos de muerte celular en la fascia dentada durante la isquemia permanente.
En las NN se muestra una tendencia general hacia la disminución progresiva hasta el final de la experimentación, debido al incremento del número de muerte neuronal. Se muestra que durante las primeras 4 a 6 horas disminuyeron las neuronas aparentemente sanas y aumentaron aquellas con signos de muerte celular.
Obsérvese en la tabla 1 la celeridad con que murieron las neuronas entre 2 y 6 horas (más de 30 %) con 9,83 y 43,44 %, respectivamente. En esta etapa los animales sometidos a isquemia presentaron disminución de movimientos, erráticos e incordiándoos; falta de equilibrio y temblores.
Entre las 6 y las 48 horas fluctuó el número de neuronas NN, pero se mantuvo cercano a la media general (nivel medio) de 61,41 ± 6,73. De igual manera sucedió con la cantidad de neuronas NM, cuyas cifras oscilaron cercanas al nivel medio de 41,77 ± 7,36 con poca variación en el porcentaje de muerte neuronal. En esta etapa, y más notable entre las 24 y 48 horas después de producida la isquemia, los animales trataban de adoptar una posición más cómoda, pero con movimientos muy limitados. Se observaban movimientos incoordinados al tratar de sostener con las patas un pellet de alimento para llevárselo a la boca, pero sin lograrlo. La respuesta al dolor era débil.
Entre las 48 - 72 horas de ocurrida la lesión, se produjo una brusca disminución de las neuronas aparentemente sanas hasta valores mínimos al final de la investigación. Al mismo tiempo, hubo un incremento del número de neuronas con signos de muerte, entre las 48 y 72 horas con 39,2 y 87,9 %, respectivamente. En esta etapa, el cuadro se deterioró, pues hubo una disminución importante de neuronas NN, debido a esta segunda oleada de muerte celular, que duplicó la ocurrida en las primeras 6 horas. Ya no hubo respuesta al dolor.
Además, entre las 48 y 72 horas se incrementó notablemente el número de neuronas NM, lo cual coincidió con la reducción de las neuronas aparentemente sanas, dichos procesos ocurren al mismo tiempo y en sentido inverso, con alto grado de correlación y coeficiente (r) de -0,88.
Se estudiaron las proporciones de neuronas con 1, 2 y 3 nucléolos; según la cantidad de estos en el grupo de control, las neuronas presentaron medias de 73,00; 20,28 y 4,71, respectivamente. A las 2 horas del trauma isquémico, aunque las dinámicas de dichas neuronas mostraron igual patrón en las proporciones (figura 2) se produjo un desplazamiento de las cifras hacia las neuronas con 2 y 3 nucléolos, que presentaron valores de 42,75; 28,25 y 15,75, respectivamente, en relación al grupo de control.
También se observó una disminución de las neuronas que presentaron un nucléolo y se incrementaron las que tenían 2 y 3. A las 6 horas de la isquemia ocurrió un incremento de neuronas con 3 nucléolos y disminución de aquella que mostraba uno solo. Se presentaron diferencias altamente significativas entre las dinámicas de las neuronas con 1 y 3, con p= 0,008; sin embargo, no existió correlación entre aquellas con diferentes cifras de nucléolos, esto demostró que el número de nucléolos en las neuronas constituye un proceso independiente.
Entre las 6 y 48 horas las cifras de las neuronas con 1, 2 y 3 nucléolos oscilaron, pues se mantuvieron cercanas al nivel medio o media general de 29,12; 19,21 y 9,88, respectivamente. No obstante, pasadas las 48 horas y hasta las 72, se produjo la disminución de los nucléolos en general.
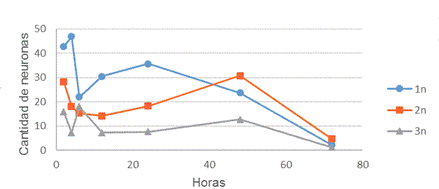
Fig. 2 Se muestra la dinámica de la cantidad de neuronas de la fascia dentada según número de nucleolos.
La tabla 2 muestra una considerable dispersión de los datos con respecto a la media. Se observan diferencias considerables entre los máximos y mínimos de todas las variables.
Discusión
Desde las primeras horas de producirse la lesión isquémica ocurrió una disminución importante de la población de neuronas en la fascia dentada, que pasó de 102,05 ± 8,19 neuronas en el grupo de control hasta 89,10 ± 7,51 a las 2 horas de producida la lesión en el grupo con trauma, esta tendencia continuó hasta las 6 horas. Debido a la gran disminución inicial es que se recomienda la inmediata aplicación del tratamiento en las primeras y hasta las 24 horas posteriores al diagnóstico de isquemia,2,16,17 teniendo en cuenta la vulnerabilidad celular isquémica atribuible a las características especiales del tejido nervioso, muy sensible a la falta de oxígeno y glucosa. Si se extendía la duración de la isquemia, se produciría la muerte de las neuronas ante la falta de nutrientes.
Hasta las 6 primeras horas postrauma la tendencia general fue a la disminución de las neuronas con 1 y 2 nucléolos, con ligero incremento del número de neuronas con 3. Esto coincide con la primera oleada de muerte neuronal en esta misma etapa, donde murieron más de 40 % de las neuronas a las 6 horas posteriores al trauma, lo que puede explicar el incremento de neuronas con 3 nucléolos y la disminución del resto. Este resultado se explica, como la reacción inicial de las neuronas ante una isquemia cerebral, puesto que al disminuir el flujo sanguíneo en el sitio de la lesión, se producen alteraciones del metabolismo celular, con mecanismos compensatorios en los primeros momentos del trauma. A pesar de que el metabolismo disminuye,14,15 la neurona sigue funcionando, con mayor actividad en el proceso catabólico, que depende de la lejanía o no de dichas neuronas en relación con los vasos sanguíneos.
En la segunda etapa de la isquemia (entre las 6 y 48 horas), las variaciones en las dinámicas de las NN y NM fueron de menor intensidad y fluctuaron cerca de los niveles medios o media general. Esta sería la etapa más larga, desde las 6 hasta las 48 horas.
La última etapa, desde las 48 hasta las 72 horas, presentó cambios notables en las dinámicas, caracterizados por aumento de las NM y disminución brusca de las NN, con un deterioro evidente de la actividad motora en los animales de experimentación sometidos a la lesión isquémica; esta etapa también ha sido descrita en los casos de pacientes con isquema.8,17
El análisis de las dinámicas de las variables estudiadas en su conjunto, muestra la posible existencia de 3 etapas o momentos dentro del periodo isquémico objeto de estudio, que pueden estar íntimamente relacionados con los daños progresivos del tejido nervioso producidos por la isquemia permanente, demostrados, además, por el deterioro progresivo de la actividad motora en cada etapa. Para confirmar y caracterizar las etapas propuestas, se continuará y ampliará la investigación, teniendo en cuenta estos resultados.
Resulta evidente entonces que las variables estudiadas presentaron cierto grado de variabilidad, dada por la dispersión expresada en la desviación estándar y el coeficiente de variación. Dicha variabilidad puede relacionarse con un conjunto de factores asociados a la evolución de los cambios en las neuronas ante la isquemia permanente, tales como reacción inflamatoria y muerte celular.
Es importante tener en cuenta las características individuales de los biomodelos descritas por algunos autores7 con respecto a la isquemia, la cual se instala progresivamente en la porción del encéfalo dañado, con incremento o disminución de los valores promedios de las variables y principalmente la rapidez con que se producen estos cambios. En la bibliografía consultada se describen diferentes variantes del polígono de Willis incompleto, teniendo en cuenta la arteria que falte,7,9 lo que no es posible conocer en los gerbils antes de ser utilizados en la investigación. Aun así, se considera el biomodelo ideal para este tipo de investigaciones y es utilizado en la actualidad.
Por otro lado, se estudia la instalación progresiva de una isquemia cerebral permanente en las primeras 72 horas después de producido el trauma. En este tiempo se ocurren cambios relativamente rápidos de una hora a otra, no solo desde el punto de vista morfológico, sino por la repercusión y sintomatología que aparece en los individuos con isquemia. Todo depende de la velocidad con que se produzcan los cambios o modificaciones de las neuronas de la fascia dentada y de las características individuales de cada animal ante la isquemia, lo cual se expresa en la dispersión observada en la desviación estándar, en cada una de las diferentes horas estudiadas.
Otro factor importante que puede influir en la variabilidad de los resultados se relaciona con el patrón de la vascularización o forma de distribución de los vasos sanguíneos en el hipocampo y la fascia dentada, lo cual puede incidir en la forma que ocurre la muerte de las neuronas en la fascia dentada,9) debido a que existirán zonas de tejidos sometidas a mayor grado de isquemia, como las que dependen o están más cerca de la arteria afectada. En tal sentido, se describe que el daño en esta estructura inicialmente se presenta de forma focal en sitios aislados, aunque finalmente alcance dicha estructura en su totalidad. Esto significa que el daño en la fascia dentada no es progresivo a lo largo de la estructura; por tanto, dentro de la misma zona con daño isquémico pueden existir unas de aparente normalidad sin cambios notables al microscopio óptico y, al mismo tiempo, otras con daño celular evidente, en dependencia de la cercanía o no a los vasos sanguíneos presentes en el área dañada, lo que puede incidir en los resultados con tal nivel de variabilidad.
Los trastornos que aparecen en el tejido nervioso producto de una isquemia prolongada ocurren de forma secuencial, aunque no organizada, pero dependen de diferentes factores relacionados con las características de la lesión y las propias del individuo, que pueden influir en la forma de expresión y características de la lesión isquémica; por tanto, desde el punto de vista morfológico y funcional, no siempre la misma forma de lesión produce iguales daños, ni se expresa y evoluciona de la igual forma.
Se concluye que la fascia dentada del hipocampo en gerbils muestra daño irreversible de las neuronas desde las primeras horas de la lesión isquémica, con mayor intensidad a partir de las 48 horas posterior al trauma isquémico. El proceso de degeneración y muerte de las neuronas es progresivo en el tiempo y abarca la totalidad de la estructura. En el periodo estudiado fue posible reconocer 3 etapas durante el progreso de la lesión isquémica, con características morfométricas y funcionales propias para cada una: la primera, hasta las 6 horas; la segunda, entre las 6 y 48; la tercera, entre las 48 y 72, lo que indica la existencia de periodos durante la instalación y desarrollo del proceso isquémico. De ahí la necesidad de continuar el estudio de dicho proceso, que permita establecer el mejor momento para tratar de manera inmediata este tipo de enfermedad y su evolución satisfactoria.