Introducción
La asociación de leiomioma uterino y embarazo se observa con relativa frecuencia (1-3 %). A menudo coexisten sin que aparezcan complicaciones en dependencia del tamaño y la localización, pero un tercio puede crecer en el primer trimestre del periodo de gestación. La miomectomía, como observara Víctor Bonney, cirujano inglés, logra el mayor ideal de la cirugía: la curación sin deformación ni pérdida de la función. La primera miomectomía abdominal fue realizada por el Dr. Jean Zulema Amussat en Francia en 1840.1
Ahora bien, los avances en técnicas quirúrgicas para controlar el sangrado durante la miomectomía, junto a los progresos en anestesia y hemoterapia, han convertido este proceder en una alternativa segura de la histerectomía. Desde el inicio del siglo pasado algunos ginecólogos opinaban que dicho procedimiento resultaba tan peligroso y difícil que no debía ni pensarse, excepto en condiciones de desesperación.2) De hecho, la miomectomía electiva en embarazadas no ha sido un procedimiento habitual en las instituciones de esta provincia por el alto riesgo materno-fetal.
Según Howard et al,2) Verkauf en una revisión encontró, que el riesgo quirúrgico de la miomectomía no excede el de la histerectomía; sin embargo, ellos2 refieren que una miomectomía múltiple extensa es una operación compleja con potencial para una morbilidad mayor que la hallada con la histerectomía. Las principales complicaciones posoperatorias de una miomectomía son la morbilidad febril y la hemorragia.3 La fiebre puede estar relacionada con un extenso traumatismo tisular o una infección por varios motivos. La hemorragia, por lo común, se debe a que no se logra la hemostasia de los vasos miometriales y en la paciente operada puede ser de difícil diagnóstico, enmascarada por la analgesia y el dolor posoperatorio. Los signos vitales pueden permanecer estables durante varias horas antes de deteriorarse rápidamente influenciado por los cambios fisiológicos durante la gestación; se consiguen acumular hasta 3 000 mL de sangre hacia la cavidad abdominal con un aumento de solo 1cm del radio abdominal. Estas complicaciones pueden resultar devastadoras y frustrar el objetivo conservador de la cirugía.2
La atención a gestantes con mioma uterino debe ser preferentemente conservadora, tal como se manifiesta en la bibliografía consultada;4,5 por tanto, se deben evitar las miomectomías perigravídicas. Cuando existe un mioma sin complicación, no se indica retirarlo mediante cirugía durante el embarazo o en el curso de la operación cesárea. La miomectomía en este periodo se realizará en casos complicados muy específicos, tales como degeneración roja con dolor localizado en el lugar del mioma que no cede al reposo ni a la administración de analgésicos y antiinflamatorios; abdomen agudo por torsión de un mioma subseroso pediculado o como causa de cuadros compresivos, que a la postre, podrían derivar en graves complicaciones de los sistemas obstruidos (sistemas urinario y gastrointestinal).
Se indica la resolución quirúrgica favorable de las masas pélvicas durante la gestación a partir de las 12 semanas, lo cual proporciona un margen de inocuidad amplia sin afectar la evolución del embarazo ni los resultados perinatales. También, se ha observado que resulta prudente realizar laparotomía entre las 16 y 20 semanas de gravidez.6
El leiomioma puede producir alteraciones en la morfología y función del útero, pues altera la pared y cavidad uterina, así como la permeabilidad tubaria y el ascenso de los espermatozoides al perturbar la contractilidad de dicho órgano. A nivel endometrial, alterna fragmentos atróficos e hiperplásicos y produce alteraciones vasculares (dilatación, congestión, obstrucción), lo cual dificulta la implantación del blastocisto y su ulterior desarrollo, siendo un importante factor de riesgo de abortos a repetición; causa frecuente de parto pretérmino, rotura prematura de membranas y presentaciones viciosas; hematoma retroplacentario, placenta previa, acretismo placentario, alteraciones del crecimiento fetal, muerte fetal, así como infertilidad, compresión de estructuras vecinas, encarcelación del útero y alteraciones en la contractilidad de este. En el alumbramiento pueden existir inconvenientes atribuibles a deficiencias en su mecanismo y en el puerperio hemorragia puerperal por la deficiente retracción que producen retraso en la involución uterina, así como obstrucción del flujo loquial. Además, pueden ser más frecuentes las infecciones puerperales y flebotrombosis.7,8
Resulta importante señalar que, a partir de los 30 años de edad, una de cada 3 mujeres presenta algún tipo de mioma. Durante el embarazo, en 60 % no se modifica significativamente su tamaño, mientras que en 40 % se experimenta crecimiento. También se produce cambio de forma y localización, pues los miomas de las porciones inferiores del útero son atraídos hacia el fondo por la tracción que hacen las fibras musculares del cuerpo uterino y en ocasiones producen torsión de un pedículo que, de ser muy voluminoso, puede rotar completamente el útero.8
Estos tumores son objeto de gran variedad de fenómenos degenerativos como resultado de alteraciones circulatorias, infecciones o por cambios hormonales. Durante el periodo de gestación, la más frecuente es la degeneración roja, también llamada síndrome del mioma doloroso, infarto hemorrágico o necrobiosis aséptica. Es una forma de necrosis producida por el crecimiento acelerado del tumor, influenciado por la producción estrogénica en breve tiempo, lo cual ocasiona congestión o infarto muscular agudo debido a la insuficiencia circulatoria de los vasos del mioma, que comienza por una necrosis focal en el centro del tumor de consistencia pastosa y evoluciona hacia una necrosis difusa que afecta a todo el mioma y adquiere color y aspecto de carne cruda, rojo oscuro o negro (ocasionado por la trombosis y extravasación de sangre hacia el tejido miomatoso), así como cierto olor a pescado. Microscópicamente se aprecia necrosis muscular, cariorrexis, inflamación aguda y hemorragia. Sucede de forma típica en el segundo trimestre del embarazo (12-22 semanas), pero puede ocurrir en cualquier momento de este y generalmente en miomas superiores a 5 cm de diámetro. La degeneración roja ocurre en aproximadamente 10 % de los miomas. Desde el punto de vista clínico se presenta con dolor abdominal e irritación peritoneal, febrícula, náuseas, vómitos y leucocitosis; puede desencadenar irritación uterina.2,6,8
Los miomas se clasifican según su tamaño en pequeños (menores de 2 cm), medianos (2-5 cm), grandes (6-20 cm) y gigantes (mayores de 20 cm). La escuela inglesa define como gigantes los que pesan más de 11 Kg. Se plantea que el crecimiento rápido de un útero leiomiomatoso ha sido definido por Buttram y Reiter como un aumento de tamaño gestacional de 6 semanas o más en 1 año o menos. Al inicio del embarazo, los leiomiomas menores de 5 cm de diámetro, con frecuencia resultan indetectables.6,9
Caso clínico
Se presenta el caso clínico de una gestante de 27 años de edad, con 17,2 semanas de embarazo, primigesta, quien se mantenía en seguimiento por consulta de Ginecología, pues presentaba un mioma uterino sintomático. En octubre de 2018 se le realizó ultrasonido (USD) y se observó que dicho mioma se encontraba hacia la cara posterior y medía 57 por 50 mm. Al efectuar el examen físico durante la captación del embarazo se constató un útero con mioma de aproximadamente 15 cm, el cual llegaba a la región umbilical.
El ultrasonido realizado a las 13,6 semanas confirmó un mioma submucoso que llegaba hasta la región umbilical y medía 161 por 124 por 154 mm y otro en cara posterior de 44 por 47 mm.
Antecedentes patológicos personales (APP): fibroma uterino
Reacción adversa a medicamentos (RAM): no refiere
Transfusiones: no
Antecedentes patológicos familiares (APF): padres con hipertensión arterial (HTA)
Operaciones: no
Evaluación nutricional: normopeso
Índice de masa corporal (IMC): 24,9 Kgm2sc
En enero de 2019, la paciente acude al cuerpo de guardia por segunda ocasión, con cuadro doloroso abdominal agudo que había comenzado 2 días atrás hasta llegar a ser muy intenso.
Mucosas hipocoloreadas y húmedas
Frecuencia respiratoria (Fr): 18 resp/min
Frecuencia cardiaca (Fc): 80 lat/min
Tensión arterial (TA): 110/70 mmHg
Abdomen: útero grávido, se palpa tumor fijo que ocupa flanco e hipocondrio derecho, muy doloroso espontáneo y a la palpación con defensa muscular.
Espéculo: previas medidas de asepsia y antisepsia. Cuello posterior 1,5 cm, orificio cervical externo cerrado, no secreción vaginal.
Hemoglobina (Hb): 93 g/L
USD: útero fibromatoso con mioma gigante que ocupa hipocondrio derecho, áreas de necrobiosis. Feto único, buena vitalidad con longitud cefalo - rabadilla de 13 cm-18,2 semanas. Placenta anterior homogénea de 31 mm y líquido amniótico normal.
Se valora el caso por la comisión hospitalaria de casos graves y se discute con expertos del Programa de Atención Materno Infantil (PAMI) provincial. Se traslada al salón de obstetricia para laparotomía de urgencia luego de entrevista a familiares y consentimiento informado.
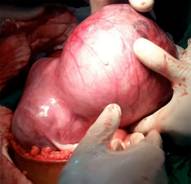
Se realiza incisión longitudinal paramedia izquierda de 4 cm supraumbilical. Se constata útero grávido de aproximadamente 16 semanas con gran mioma subseroso de base ancha hacia el fondo y la cara posterior del útero, que medía 20 cm de diámetro (fig.1).
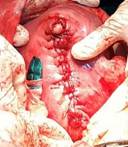
De inmediato se efectuó la ligadura de dicha base y luego la extirpación del mioma con compresas húmedas, previo aislamiento del útero grávido. Dicho proceder se realizó con la menor manipulación posible sobre el útero grávido. Luego de la miomectomía se constató una delgada capa muscular que mantenía íntegra la cavidad uterina (fig. 2); se dieron puntos con catgut cromado, 1 en 2 planos (fig. 3).
Comprobada la hemostasia sin accidentes quirúrgicos, se retiraron las compresas aislantes y se regresó el útero a la cavidad abdominal; se observaron anejos sin alteraciones y cierre por planos.
Tiempo quirúrgico (TQ): 1hr
TA: 110/70 mmHg
FC: 89 latidos/min
FR: 20/min
Saturación de oxígeno (SO): 100 %
Sangrado: 700 mL
Diuresis: 200 mL
Se transfundieron 500 mL de glóbulos rojos durante el periodo peroperatorio y se obtuvo Hb postransfusional de 105 g/L.
La evolución posoperatoria transcurrió sin complicaciones. Las primeras 24 horas acontecieron en el salón de obstetricia; luego 72 horas en el Servicio de Cuidados Perinatales donde se realizó USD que mostró vitalidad fetal e integridad de la histerorrafia. La paciente egresó después de 4 días de estancia en la sala de cirugía. Posteriormente, a las 24 semanas, ingresó con riesgo de prematuridad debido a un ligero dolor bajo vientre; a las 36,1 semanas, en espera de la terminación del embarazo, se programó cesárea electiva para las 39 semanas. Se obtuvo un recién nacido masculino, con un peso de 3550 g y apgar 9/9.
En el informe operatorio se describen miomas intramurales y subserosos, así como adherencias de asas delgadas y epiplón en la zona de histerorrafia anterior, que se liberaban sin accidentes quirúrgicos, con buena hemostasia y útero bien contraído. En el periodo de puerperio se mantuvo estricta vigilancia debido al riesgo de hemorragia.
La paciente egresó con orientaciones para el periodo de puerperio mediato y tardío, así como seguimiento posterior por consulta de Ginecología.
Comentarios
Algunos autores2 plantean que la vascularización de los miomas fue estudiada por Vasserman y sus colaboradores, para lo cual emplearon: arteriografía femoral, angiografía intraoperatoria selectiva, radiografía e inyección de muestras quirúrgicas. Demostraron que los leiomiomas tienen una irrigación rica, con inclusión de lagos sanguíneos dentro de los tumores; también, hallaron más de un vaso nutricio por mioma. Los vasos venosos fueron predominantemente periféricos; los vasos arteriales, internos y periféricos. En general, el ancho de las arterias uterinas aumenta con el tamaño del útero, pero cuando este es creciente existe cierta tendencia a disminuir la vascularidad. En sus investigaciones, los leiomiomas de más de 20 cm presentaban pocos o ningún vaso intrínseco. Refieren que el flujo sanguíneo total de un útero miomatoso es mayor que el de un útero normal. En los miomas, dicho flujo está reducido en comparación con el del miometrio normal en el mismo útero. El flujo sanguíneo dentro de un mioma varía de un sitio a otro.
Por otro lado, existe un dilema en cuanto al uso de tocolíticos para estos casos; los autores de esta investigación consideran no utilizarlos por el riesgo de hemorragia y sugieren mantener la vigilancia ante cualquier signo de irritabilidad uterina. Al respecto, diversos investigadores10) recomiendan el uso de los antagonistas de los receptores de la oxitocina, empleados con éxito como terapia de mantenimiento hasta alcanzar las 32 semanas, así como los inhibidores de las prostaglandinas.
La cantidad de soluciones cristaloides a administrar se valoran individualmente teniendo en cuenta las enfermedades asociadas, entre las cuales figuran: hipertensión arterial, cardiopatías, obesidad y daño renal. En otros pacientes, según el tipo de intervención, se ha requerido el uso de hidrocortisona, dimenhidrinato, cimetidina, así como sonda de levine u otros medicamentos y cuidados especiales.
Cabe destacar que en el Hospital Provincial Ginecoobstétrico Mariana Grajales Coello se sigue un protocolo para realizar la miomectomía, que incluye: oxitocina, antimicrobianos y analgésicos, pero como la gestante de este caso tenía 17 semanas no se indicó: