Introducción
Los vasos sanguíneos son estructuras altamente reguladas e involucradas en el trasporte de la sangre y, en esta, de los nutrientes y el oxígeno a los tejidos. Por su parte, la pared vascular está compuesta por células endoteliales, células de músculo liso vascular (MLV) y fibroblastos. El diámetro vascular está determinado principalmente por la contracción del MLV y determina el aporte de sangre a cada tejido y la permeabilidad capilar. El grado de contracción del MLV es resultado de la interacción dinámica entre los componentes celulares de la pared vascular (principalmente el endotelio), la inervación motora visceral (porción simpática) y los componentes celulares y humorales que interactúan con este desde la luz vascular.1
En el ser humano la arteria carótida externa (ACE) emerge de la bifurcación carotídea, en el borde superior del cartílago tiroides, a la altura de la cuarta vértebra cervical en el denominado triángulo carotídeo, y se localiza anterior y medial a la arteria carótida interna (ACI) en 80 % de los casos.2
La ACE es una arteria muscular que irriga con sus ramas todos los elementos que componen el sistema masticatorio, la cavidad nasal y los senos paranasales, el meato acústico externo y la oreja, el epicráneo y las vísceras de la cabeza y el cuello. Constituye un vaso importante para especialidades como estomatología, otorrinolaringología y cirugía maxilofacial, al proporcionar flujo sanguíneo a los diferentes órganos de la cabeza y el cuello.3
El control morfofuncional de los ciclos de contracción/relajación del MLV por el endotelio, así como por la acción de fármacos y sustancias endógenas vasoactivas, es imprescindible para la regulación del flujo sanguíneo tisular local, ajustado de forma precisa a las necesidades metabólicas, que abarcan desde la disponibilidad de oxígeno y nutrientes hasta la eliminación de desechos metabólicos; factores claves para garantizar una correcta homeostasis.
En condiciones fisiopatológicas, como una inflamación aguda, la interacción endotelio-músculo liso vascular tiene una función primordial en la modulación de la respuesta inflamatoria, desde las reacciones vasculares y celulares, así como en los mecanismos de reparación tisular. Resulta vital la adquisición de estos conocimientos básicos-clínicos relacionados con enfermedades bucales y de cabeza y cuello, teniendo en cuenta que muchos de los medicamentos antisépticos o antimicrobianos empleados intraconducto en el tratamiento de pacientes con afecciones pulporradiculares se utilizan de forma empírica y no realizan su acción solo localmente, sino que se difunden a los tejidos vecinos, incluidos los vasos sanguíneos; así como la existencia de efectos sistémicos aún poco caracterizados que podrían explicar muchos de los fallos terapéuticos.4
A partir de estas consideraciones sobre la actividad contráctil del musculo liso vascular en la arteria carótida externa, y tomando como punto de partida los escasos informes científicos sobre el tema, surgió la necesidad de realizar el presente estudio.
Métodos
Se realizó una investigación experimental en el Instituto de Fisiología Oscar Langerdorff de la Facultad de Medicina, en la Universidad de Rostock, Alemania, de octubre a diciembre del 2018, con el propósito de caracterizar la dinámica contráctil espontánea del músculo liso vascular de la arteria carótida externa.
La muestra se obtuvo de 20 arterias carótidas externas, de ambos lados, de 10 ratas Wistar adultas, de ambos sexos, con un peso de 200-250 g, procedentes del bioterio de la propia institución y seleccionadas mediante un muestreo aleatorio simple.
En la investigación se determinó:
El trazado de contracción espontáneo (dinámica contráctil) mediante un registro gráfico de la tensión muscular desarrollada por el músculo liso vascular de la arteria carótida externa, el cual se evaluó de regular o irregular según su amplitud durante cuatro intervalos de tiempo: 1, 3, 5 y 10 minutos, que correspondió a 40 % del tiempo total.
La tensión muscular, dada por la fuerza ejercida por el músculo liso contra una carga, medida en milinewton (10-3 N) por gramo de músculo (mN/g). Esta se evaluó como mínima si era menor de 5 mN/g, media si osciló entre 5-10 y máxima cuando superó los 10 mN/g.
Durante todo el período experimental los animales se mantuvieron en un ambiente controlado, a temperatura de laboratorio de 22-24 °C y humedad relativa de 65 % aproximadamente, con un ciclo de 12 horas alternas de luz/oscuridad, y agua y alimento a voluntad.
Para extraer la muestra, las ratas fueron sacrificadas mediante decapitación. Tras la toracotomía, se procedió a la disección de las carótidas externas separando el tejido conectivo periarterial y colocándolas en una placa de Petri con solución Krebs-Lösung (Präparierlösung): NaCl, KCl y CaCl2 + 2H2O de 5,9; 143 y 3,6 milimoles, respectivamente.
Cada segmento de arteria fue seccionado en 3 anillos concéntricos de unos 5 mm aproximadamente, y a cada anillo se le realizó un corte en espiral (helicoidal) siguiendo la organización histológica de las células musculares lisas vasculares en la pared arterial.
Los segmentos arteriales cortados en espiral fue colocados en baño de órganos [tissue bath station, BIOPACTM] con 30 mL de solución Krebs-Lösung (Physiologische Salzlösung) que en milimoles contenía NaCl: 112; NaHCO3: 25; KH2PO4: 1,2; KCl: 4,7; MgCl2 + 6H2O: 1,2; CaCl2 + 2H2O: 3,6; glucosa: 11,5, a 36,5 grados Celsius, manteniendo un suministro continuo de carbógeno (95 % de O2 y 5 % de CO2).
Las muestras se fijaron al baño de órganos, utilizando un transductor isométrico de 50 g [TSD125, BIOPACTM] conectado a dos equipos amplificadores de datos: WPI (World Precision Intruments), modelo TMB4, y otro ADInstruments. Ambos equipos se acoplaron a un computador ASUS con sistema operativo Windows 7.
Instalada la muestra en el baño de órgano, fijada la temperatura y la perfusión gaseosa continua, se aplicó la carga de 1 g, se realizaron ajustes de calibración y se comenzó a registrar la actividad espontánea muscular lisa vascular (tensión) durante 10 minutos, utilizando el software Lab Chart 7.2 de ADInstruments.
Para el procesamiento estadístico se empleó el paquete SPSS (Statistical Package for Social Sciences) versión 22.0. Asimismo, fueron calculados la media aritmética y desviación estándar, y se compararon los valores promedios de tensión registrados en los diferentes intervalos de tiempo con los de la tensión de base inicial, con la prueba de la T de Student. Los valores de p<0,05 se consideraron estadísticamente significativos.
Resultados
La figura 1 muestra las características de la dinámica contráctil espontánea desarrollada por el músculo liso vascular de la arteria carótida externa durante los intervalos de tiempo estudiados. Existió una progresión irregular mantenida con respecto a la amplitud en cada intervalo. Fue evidente la presencia de algunos picos máximos de tensión que no se repitieron con regularidad, sino que aparecieron de forma aislada durante la observación. Resulta interesante que los registros de la actividad contracción/relajación espontánea fluctuaron en un rango estrecho de valores de tensión, donde los máximos fueron de 8,48 ± 0,03 y los mínimos de 8,33 ± 0,03, con una diferencia de 0,15 mN/g.
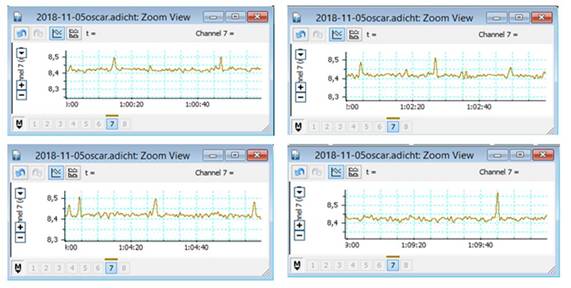
Fig. 1 Registro gráfico de la tensión espontánea desarrollada por el MLV en los intervalos de tiempo estudiados
Los valores promedios de tensión registrados en cada uno de los intervalos de tiempo se ilustran en la figura 2. Se evaluaron de medios porque estuvieron en el rango entre 5-10 mN/g de músculo, y se observó un incremento leve de tensión de 8,42 ± 0,012 mN/g al final de los 10 minutos. La tensión media general registrada fue de 8,40 ± 0,032 mN/g.
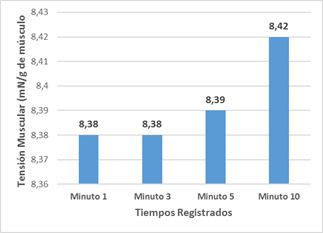 Fuente: registros LabChart 7.2
Fuente: registros LabChart 7.2Fig. 2 Valores promedios de tensión espontánea registrados en el tiempo
En cuanto a la comparación de las medias de tensión promedio registradas en cada uno de los intervalos de tiempo respecto a la media de la tensión de base inicial, se comprobó que no existieron diferencias significativas entre estas (p>0,05).
Las medias obtenidas en cada intervalo de tiempo presentaron valores muy cercanos, con desviaciones estándar que evidenciaron muy poca dispersión de los datos con respecto a la media, lo que estuvo representado, además, por la media general de todo el periodo de tiempo (10 min).
Discusión
Como se pudo constatar en los resultados, el MLV de la arteria carótida externa posee una actividad espontánea irregular, con fluctuaciones en un rango estrecho entre los valores máximos y mínimos de tensión. Es probable que este tipo de dinámica sea el resultado de la interacción de muchos factores tales como factores dependientes del endotelio vascular, acción de agonistas sobre receptores, con implicación de segundos mensajeros y mecanismos de transducción de señales que regulan la concentración intracelular de iones de calcio; oscilaciones del potencial de membrana en reposo, entre otros, por lo que podría ser necesario, en futuras investigaciones, precisar mejor cuáles son los determinantes en la progresión de la dinámica contráctil de dicho vaso sanguíneo en el tiempo, teniendo en cuenta la función del músculo liso vascular en el mantenimiento del tono a ese nivel.
El músculo liso de la carótida externa no muestra una actividad espontánea de tipo marcapaso (rítmica), como la poseen los músculos lisos del intestino, el útero, el vaso deferente y la vena porta, que son capaces de generar ondas lentas de despolarización y, eventualmente, descargas de potenciales de acción en forma de espiga. Este atributo observado en la arteria carótida externa demuestra la progresión irregular de la tensión espontánea en el tiempo, de manera que se coincidió con los criterios de investigadores, como Consolini y Colareda,1 Martin5) y Brozovich et al,6 quienes refieren que el MLV carotídeo no descarga potenciales de acción, sino que muestra una despolarización gradual de la membrana en respuesta a la interacción de agonistas con receptores acoplados a una proteína de tipo Gq en las células de MLV (acoplamiento farmacomecánico), que por una cascada intracelular de transducción origina el influjo de calcio (Ca2+), a través de los canales de tipo L operado por el receptor (ROC). Al respecto, Goodman y Gilman7 demostraron que estos canales de Ca2+ se abren a un umbral de -30 a -40 milivoltios (mV) y se inactivan a los 50 milisegundos.
Otro hecho comprobado es que la entrada de Ca2+ a través de los ROC es amplificada por un proceso de liberación de Ca2+ inducida por Ca2+ desde el retículo sarcoplásmico (RS).8,9,10 Para desplegar esta fuente, los músculos lisos utilizan el mecanismo dependiente de agonista que produce la liberación de Ca2+ intracelular por acción del segundo mensajero inositol-3-fosfato (IP3).10,11,12 En ese caso, el agonista promueve la activación de dos tipos de canales presentes en el RS, los sensibles a IP3 (IP3R) y los sensibles a la rianodina,13,14,15,16 que además pueden relacionarse entre sí y permitir la producción de picos máximos de tensión como los registrados en los diferentes intervalos de tiempo durante la presente investigación.
En resumen, la dinámica contráctil del músculo liso vascular de la arteria carótida externa en este grupo de ratas Wistar mostró una progresión irregular en el tiempo; las cifras tensionales registradas durante los diferentes intervalos de tiempo, así como la general, se evaluaron como media contra una carga de 1 gramo al estar comprendidas entre los 5-10 mN/g de músculo.














