Introducción
El nacimiento de personas con hemoglobinas SS y SC promovió la creación en Cuba de un programa de prevención que incluye el diagnóstico prenatal de estas hemoglobinopatías. Aun así, la morbilidad por esta causa continúa siendo un problema de salud tanto en niños como en adultos. Lo anterior indica la necesidad de enfocarse cada día más en desarrollar estrategias que permitan elevar la cultura genética de la población, trabajar en el riesgo preconcepcional y en la atención prenatal a nivel primario de salud, a través del médico de la familia y los asesores genéticos.1,2,3
La anemia de células falciformes, también llamada anemia drepanocítica, no es más que el conjunto de alteraciones monogénicas hereditarias de la molécula de hemoglobina, donde se deforman los hematíes en un ambiente pobre de oxígeno y los glóbulos rojos adquieren una apariencia de hoz, lo cual entorpece la circulación sanguínea y ocasiona microinfartos en múltiples órganos y hemólisis. En otras palabras, es una anemia grave resultante de la mutación genética de un aminoácido polar (ácido glutámico) por otro no polar (la valina) en la sexta posición de la cadena beta de la hemoglobina, de tal manera que disminuye la unión con el oxígeno causando una crisis vasooclusiva, con dolores, hemólisis, entre otras manifestaciones.4,5,6
En el caso de la hemoglobina C ocurre un cambio del aminoácido lisina en la sexta posición de la cadena beta, que por lo general también produce síntomas más leves (como dolores), aunque pueden aparecer dolores musculoesqueléticos, retinopatía proliferativa, hiperemia traumática, como complicaciones, entre otros.7,8,9)
Dado que es muy frecuente el nacimiento de niños con hemoglobinas SS y SC en la población cubana, lo que implica un grave cuadro clínico en ellos, se realizaron grandes esfuerzos por crear un programa dirigido a instruir y brindar a la población la oportunidad de detectar prenatalmente dichas hemoglobinopatías e interrumpir el embarazo entre las semanas gestacionales 16 y 26 si los padres lo deseaban.
Los niños con drepanocitosis reciben un seguimiento clínico-terapéutico por expertos, habitualmente hematólogos. Se refiere8,9 que lo ideal es realizar el diagnóstico antes de que aparezcan los síntomas, pues si no se hace antes de los seis meses de edad o, mejor aún, en la etapa de recién nacidos, pueden presentar una gravedad extrema con mayor frecuencia que los niños que han sido diagnosticados y atendidos tempranamente, los que evolucionan mejor porque llevan tratamiento profiláctico, y esto conduce a menos ingresos hospitalarios, con estadías más cortas.10,11,12
El éxito para la prevención comienza en la etapa prenatal, si se sospecha el riesgo de aparición de la enfermedad por el tipo de hemoglobina de ambos padres (PAR). Algunas gestantes han optado por realizarse el diagnóstico prenatal (DPN) y otras no lo han deseado; de las que han recibido el diagnóstico de fetos con hemoglobinas SS o SC, la mayor parte ha decidido interrumpir el embarazo; pero si determinaran no hacerlo, se considera este elemento al nacimiento para la prevención temprana y el asesoramiento.
Sin embargo, la concepción independiente en embarazadas solteras, la avanzada edad gestacional y la paternidad dudosa, han conducido a diagnósticos tardíos, perjudicando la prevención. Al respecto, la estrategia preventiva permite mantener el seguimiento a la familia e identificar la enfermedad en los recién nacidos antes de que comiencen los síntomas clínicos, además de efectuar el diagnóstico más rápido y comenzar a administrarle antibióticos de manera profiláctica antes de los 4 meses de vida.
En ese sentido, la indicación del médico de la familia de realizar un hemograma a todos los niños a los 5 meses, ayuda en el diagnóstico clínico.
Métodos
Se realizó un estudio descriptivo, retrospectivo, de corte transversal, en el Centro Provincial de Genética Médica del Hospital Docente Infantil Sur Dr. Antonio María Béguez César de Santiago de Cuba, de los 713 fetos y niños en los que se detectó anemia de células falciformes o enfermedad heterocigótica compuesta SC, a fin de mostrar el impacto del diagnóstico prenatal en la incidencia de estas dos hemoglobinopatías.
Para establecer dicho diagnóstico, se realizó electroforesis de hemoglobina a todas las embarazadas y a todos los niños de seis meses de edad con anemia en la provincia, cuyos padres optaron por el DPN o no desearon la interrupción. A las parejas vulnerables que habían recibido el diagnóstico prenatal se les brindó la opción de interrumpir el embarazo antes de sus 26 semanas, después de asesorarles y de haber firmado el consentimiento informado, sobre la base del respeto a la autonomía de la pareja en el momento de tomar cualquier decisión.
La extracción de la muestra de sangre para la electroforesis de hemoglobina fue realizada durante el primer trimestre de gestación por personal calificado de laboratorio clínico en todos los policlínicos de la provincia.
El procedimiento consiste en extraer entre 2-3 mL por punción venosa en un vial con 50 µL (1 gota) de EDTA a 10 % como anticoagulante y conservarlo a una temperatura entre 4-8 oC. Primeramente las muestras eran procesadas por el equipo Habana, pero después del año 2012 comenzaron a ser analizadas por el método Hydrasys.
Los glóbulos rojos de las muestras recolectadas fueron lavados 3 veces con 1 mL de solución salina de NaCl a 0,9 %. Las corridas de electroforesis se realizaron en gel de agarosa preempacado, utilizando la tecnología semiautomatizada Hydrasys 2 de la firma Sebia (Francia). El colorante negro amido se utilizó para la tinción de las bandas de Hb.1
Se confeccionó una base de datos con el programa de Microsoft Office Access, utilizando un período de estudio de tres decenios y un sexenio (de 1984 al 2019), para mantener la pesquisa activa en la atención primaria de salud de cada municipio, con el objetivo de identificar y confirmar el diagnóstico por electroforesis de hemoglobina en los niños de seis meses de edad cuyos padres no aceptaron el diagnóstico prenatal u optaron por no interrumpir el embarazo.
Entre los datos utilizados para poder seguir la evolución del niño figuran: número de la historia clínica, nombre y apellidos de la gestante, fecha de consulta, fenotipo, dirección particular, municipio, área de salud, causa del no estudio al padre (paternidad dudosa, temor a la prueba, no presencia en el país, entre otras), nombre del niño, fenotipo del niño, fecha de nacimiento, fecha del diagnóstico, edad y fecha probable de parto, familiares enfermos con hemoglobinopatía (primer, segundo o tercer grados).
El Comité de Ética del Centro Nacional de Genética Médica aprobó el procedimiento seguido, aseguró la autonomía de los pacientes y la confidencialidad de la información. Todo ello se hizo constar en el modelo de consentimiento informado entregado al paciente durante la visita, previa a la entrevista, el cual fue debidamente firmado.13
De igual forma, fue necesaria la operacionalización de las variables, que se muestra a continuación:
Electroforesis de hemoglobina, clasificada como SS o SC.
Electroforesis de hemoglobina a todo niño que a los seis meses de edad, en el periodo 1984-2019, presentara anemia (diagnosticada), nacido de parejas vulnerables con diagnóstico prenatal molecular o no, de madre portadora de hemoglobinopatía o padre al que no se le realizó la electroforesis de hemoglobina por diversas causas en el periodo prenatal.
Fueron citados a consulta de genética y de hematología, y luego se les realizó el examen físico, el interrogatorio y el asesoramiento genético.
Resultados
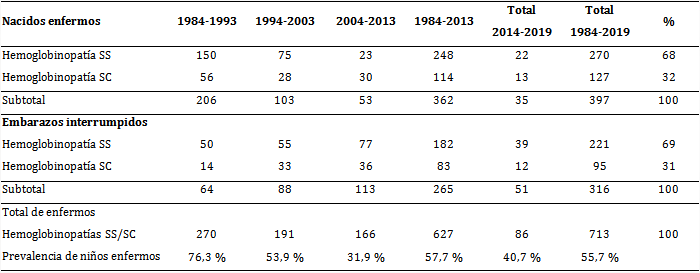
Se diagnosticaron 713 enfermos (fetos y niños) con hemoglobinopatías SS y SC en la provincia, de 1984 a 2019. Se previó el nacimiento de 316 fetos enfermos (44,3 %) con la interrupción deseada por parte de la pareja en la etapa fetal, y nacieron 397 niños afectados, que representaron 55,7 % del total de diagnosticados (tabla).
En el período 1984-1993 fueron diagnosticados 270 fetos y niños, para 76,3 %, y en el período 1994-2003 nacieron enfermos 53,9 %; después, en el próximo decenio se redujo este nacimiento a 31,5 %, para volver a aumentar a 40,7 % en el último sexenio. Todo esto ocurrió por la tendencia a variar en los últimos años la decisión de la pareja con la conducta reproductiva de interrumpir el embarazo frente a un feto enfermo.
Tabla Fetos y niños enfermos con hemoglobinopatías SS y SC y conducta reproductiva de sus padres en el embarazo
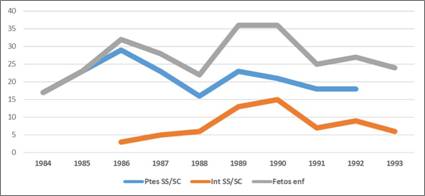
En el primer decenio del programa de prevención se observó un predominio del nacimiento de niños enfermos sobre las interrupciones (fig. 1), ya que las parejas no tuvieron como prioridad interrumpir el embarazo (1984-1993).
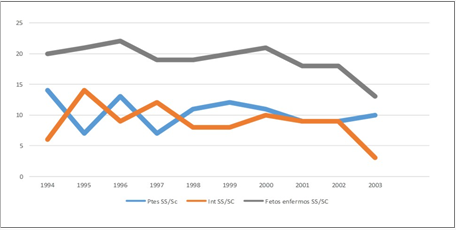
En la figura 2 se muestra cómo se elevó el número de parejas que decidieron interrumpir el embarazo (1994-2003), pues 41,1 % de los fetos enfermos diagnosticados fueron abortados. Se mantuvo una estabilidad en los resultados, con un aumento predominante en el año 1995 y un descenso a causa del nacimiento.
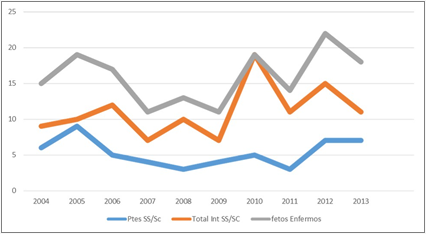
En el tercer decenio (2004-2013), la línea azul, que representa los niños enfermos, se despegó por debajo de las interrupciones de embarazo, lo que quiere decir que las interrupciones de nacimiento de fetos enfermos incrementó la opción de esas parejas durante estos años, principalmente en el año 2010 (fig. 3).
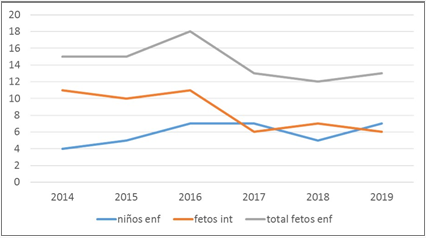
En el sexenio 2014-2019 se observó en las PAR una tendencia a disminuir la aceptación para interrumpir el embarazo de fetos enfermos diagnosticados como SC, sobre todo en el año 2017 (fig. 4).
En los 36 años de desarrollo del programa de prevención nacieron 55,7 % de los pacientes diagnosticados como SS y/o SC. Las causas que motivaron el nacimiento de niños enfermos fueron las siguientes: decisión de la pareja de no querer interrumpir el embarazo de fetos diagnosticado con hemoglobinopatía (58,0 %), estado soltero de algunas madres, por lo que se les diagnosticó como PAR (19,0 %); PAR que no se pudieron realizar diagnóstico prenatal por AEG (13,0 %), paternidad dudosa (8,0 %), PAR con diagnóstico del feto (DPN) fallido por haberse contaminado la muestra del líquido amniótico con sangre materna (2,0 %).
Se evaluó el impacto del diagnóstico prenatal en la incidencia de las hemoglobinopatías SS o SC en Santiago de Cuba, y se obtuvo que esta fue disminuyendo en cada período con respecto a los anteriores: en el primero decenio (1984-1993) nació 76,3 % de todos los enfermos diagnosticados, en el segundo (1994-2003), 53,9 % y en el tercero (2004-2013), 31,9 %. En el sexenio 2014-2019 ascendió ligeramente la incidencia a 40,3 % a causa principalmente de no desear interrumpir el embarazo.
Discusión
La hemoglobina S es la más frecuente de las hemoglobinopatías diagnosticadas en el mundo, sobre todo en los Estados Unidos, donde aproximadamente 8 % de la población afronorteamericana presentan hemoglobina AS y una de cada 600 personas poseen hemoglobina SS; mientras que 50 % de los afectados con hemoglobinopatía SS residen en Nigeria, la India y la República Democrática del Congo.13,14
En los países latinoamericanos no se puede predecir el tipo de hemoglobina (como se hace en otros países sin temor a cometer errores con facilidad) por el color de la piel o los rasgos faciales, puesto que es común decir que existe una sola raza, por ejemplo, en Cuba, existen muchas mezclas. Los portadores para las células falciformes AS, el rasgo falciforme (genotipo β S), correspondiente al estado portador, es muy habitual y afecta a millones de personas en el mundo.15,16,17 Al respecto, en Cuba se encuentra en 3 % de sus habitantes y en la provincia de Santiago de Cuba se eleva a 5,6 % y a 3 % el AC. Por su parte, en la provincia de Guantánamo también la cifra es elevada, mientras que en Camagüey, Sancti Spíritus y las otras provincias la incidencia de la variante AS es aproximadamente de 2 a 3 %. Cabe señalar que Santiago de Cuba es una de las provincias cubanas donde fue traído un mayor número de esclavos de África, lo que justifica la más alta frecuencia de dicha enfermedad.1
Los portadores de hemoglobina AS no se asocian a anomalías clínicas hematológicas, aparte de la presencia ocasional de células anormales, la falciformación in vivo que solo se presenta en altitudes muy elevadas y cuando la presión de oxígeno es baja. La hematuria espontánea por la falciformación en las papilas renales se encuentra en alrededor de 1 % de estos pacientes, quienes presentan sepsis urinarias más asiduamente.
En este estudio se encontraron variantes de hemoglobina con la electroforesis alcalina que, en general, resultaron ser los mismos modelos de separación en las hemoglobinas S, D y G, al igual que en las hemoglobinas C, O y E; a pH ácido, el patrón de migración ayuda también a diferenciar la hemoglobina S de la D/G y la hemoglobina C de la E y O (Arabia), que ha sido diagnosticada en ocasiones en esta provincia.4
Muchas variantes de las hemoglobinas son silentes desde el punto de vista hematológico y clínico, porque la mutación subyacente no causa alteraciones en la función, solubilidad y estabilidad de la molécula, pero otras no se separan y permanecen sin detectar. Algunas variantes estructurales se asocian con fenotipos clínicos graves en estado homocigótico, incluso heterocigótico; estas mutaciones afectan las propiedades físicas o químicas de la molécula de hemoglobina, produciendo cambios en la solubilidad, la estabilidad o las propiedades de fijación de oxígeno a la hemoglobina.4
Las hemoglobinopatías en la población latinoamericana causan 3,4 % de las muertes en niños menores de cinco años de edad, mientras que en este trabajo no se registraron estos casos por las acciones de salud que se ofrecen en el programa nacional.
Afortunadamente, las variantes de la hemoglobina común con importancia clínica o genética (por ejemplo: hemoglobinas S, C, D y hemoglobinas E y O-Arab) son fácilmente detectables con las técnicas electroforéticas y cromatográficas.
Resulta oportuno señalar que la variante de la hemoglobina más habitual es la falciforme o hemoglobina S. Esta tiene una escasa solubilidad en estado desoxigenado; el eritrocito muestra un cambio característico en su forma debido a la formación de polímeros y se vuelve rígido y distorsionado, dando lugar a la denominada célula en hoz. Además, los polímeros intracelulares ocasionan cambios en la membrana eritrocitaria.18,19)
En cuanto a la hemoglobina C, es la segunda variante estructural de la hemoglobina más habitual en las personas de origen africano y en el presente estudio se detectó en 1,3 % de las gestantes, todas asintomáticas. En los Estados Unidos se diagnostica en 2 % de los norteamericanos de raza negra. La sustitución del ácido glutámico en la posición 6 de la cadena β por la lisina produce una molécula de hemoglobina con una carga altamente positiva, una solubilidad reducida y una tendencia a la cristalización.
Sin embargo, la hemoglobina C no da resultado positivo en la prueba de solubilidad como lo hace la S. Los portadores de la hemoglobina AC son asintomáticos, y pueden hallarse extensiones sanguíneas, células en diana y células irregularmente contraídas. Los homocigotos CC pueden tener una anemia hemolítica leve, con numerosas células en diana y células irregularmente contraídas. La herencia simultánea del gen β C con el de la hemoglobina β S produce un estado heterocigótico mixto de la hemoglobina S y C. La abreviatura “enfermedad SC” del término enfermedad de la hemoglobina SC es aceptable; esta produce en general menor sintomatología que en los homocigóticos SS, aunque presentan variabilidad clínica a veces graves.6,17,20
En el transcurso de los últimos 36 años, las acciones preventivas al nacimiento de niños con hemoglobinopatías SS y SC en la provincia de Santiago de Cuba, ha reducido la incidencia de estas enfermedades. El programa de diagnóstico prenatal de la anemia de células falciforme SS y SC continúa siendo el pilar fundamental para la prevención, dando fe de los esfuerzos asistenciales y sanitarios que se efectúan en el país en torno a la instrucción en el tema.