Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicentro Electrónica
versión On-line ISSN 1029-3043
Medicentro Electrónica vol.19 no.3 Santa Clara jul.-set. 2015
ARTÍCULO DE REVISIÓN
Ácidos grasos omega-6 y omega-3 de la dieta y carcinogénesis mamaria: bases moleculares y celulares
Dietary omega-3 and omega-6 fatty acids and mammary carcinogenesis: molecular and cellular bases
Dra. C. Otmara Guirado Blanco
Doctora en Ciencias Médicas. Especialista de Segundo Grado en Fisiología Normal y Patológica. Master en Educación Médica. Profesora Auxiliar. Unidad de Investigaciones Biomédicas. Universidad de Ciencias Médicas. Santa Clara, Villa Clara. Cuba. Correo electrónico: otmaragb@ucm.vcl.sld.cu
RESUMEN
Los lípidos polinsaturados omega-6 y omega-3 constituyen componentes esenciales de la dieta. Los patrones dietéticos con elevado consumo en omega-6 se han asociado con un mayor riesgo de cáncer de mama. La ingesta de omega-3 parece tener un efecto protector al estar involucrado en mecanismos biológicos que favorecen la inhibición de la carcinogénesis mamaria. Los ácidos grasos omega-6 pueden actuar como inhibidores competitivos de los omega-3 en el metabolismo lipídico y, de esta forma, podrían inhibir los efectos antinflamatorios y citoprotectores de los omega-3. Dicha hipótesis indicaría la importancia de mantener una razón n-3/n-6 adecuada para la prevención del cáncer de mama. Este hecho contrasta con el elevado consumo de ácidos grasos polinsaturados omega-6 en los países occidentales. Actualmente, la evidencia científica acumulada es suficiente para proponer políticas públicas en relación con el consumo y tipo de lípidos presentes en la dieta para disminuir el riesgo de cáncer de mama.
DeCS: neoplasias de la mama/prevención & control, ácidos grasos omega-3.
ABSTRACT
Omega-3 and omega- 6 polyunsaturated lipids constitute essential components of the diet. Dietary patterns with high omega-6 consumption have been associated with a higher risk of breast cancer. Omega-3 intake seems to have a protective effect since it is involved in biological mechanisms that favor inhibition of mammary carcinogenesis.Omega-6 fatty acids can act as competitive inhibitors of omega-3 in lipid metabolism and, in this sense, they could inhibit cytoprotective and anti-inflammatory effects of omega-3.This hypothesis will indicate the importance to keep an adequate n-3/n-6 ratio for the prevention of breast cancer. This fact contrasts with the high consumption of omega-6 polyunsaturated fatty acids in Western countries. Nowadays, the cumulative scientific evidence is sufficient to propose public policies regarding consumption and type of lipids present in the diet in order to decrease the risk of breast cancer.
DeCS: breast neoplasms/prevention & control, fatty acids, omega-3.
El cáncer de mama constituye la primera causa de muerte por tumores malignos en el sexo femenino y es la neoplasia más frecuente en las mujeres de todo el mundo, a excepción del cáncer de piel. La prevalencia de la enfermedad y su repercusión en los sistemas sanitarios nacionales hacen que sea un importante problema de salud.1 Aparte de los factores genéticos y hormonales relacionados con el desarrollo de este tipo de cáncer, también influyen factores de tipo ambiental y del estilo de vida.2 Entre estos últimos, la dieta es uno de los más importantes contribuyentes al riesgo de cáncer.
Algunos autores sugieren estudiar los patrones dietéticos de la población en general, en lugar de grupos de alimentos de forma individual, lo cual permitiría evaluar las interacciones entre diferentes factores dietéticos. Aun así, la evidencia sobre posibles asociaciones entre patrones dietéticos y el riesgo de cáncer de mama no es concluyente.3
De los grupos de nutrientes relacionados con el cáncer de mama, los lípidos constituyen uno de los más estudiados, aunque sus mecanismos de acción no son bien conocidos. Durante los últimos 20 años, se han realizado numerosos estudios epidemiológicos para establecer la posible asociación entre los diferentes lípidos presentes en la dieta y el riesgo de cáncer mamario. Sin embargo, en muchos casos no se ha logrado demostrar esta relación, y los resultados de los estudios de cohortes son contradictorios.4,5 La mayoría de estas investigaciones se basan en datos de ingesta dietética (encuestas o cuestionarios de consumo) o en estimaciones basadas en consumos nacionales, con lo cual estas evaluaciones se correlacionan pobremente con las mediciones directas de los ácidos grasos en los individuos. Por tanto, las contradicciones encontradas en los diferentes estudios pudieran atribuirse a problemas metodológicos, a las dificultades que se presentan en la valoración dietética de la población, a la presencia de polimorfismos genéticos o al hecho de que el cáncer de mama humano es una enfermedad muy heterogénea, con distintas asociaciones genéticas y diferentes bases moleculares.6,7
Las investigaciones con modelos biológicos han logrado demostrar, de forma consistente, el efecto de los lípidos sobre el cáncer de mama. Este depende, tanto del tipo como de la cantidad de grasa ingerida con la dieta.8 Los ácidos grasos polinsaturados del tipo n-6 (omega-6) presentes en aceites vegetales de semillas, son los promotores más efectivos de la carcinogénesis mamaria experimental.9,10 El resto de los lípidos de la dieta puede tener desde un efecto inhibidor del crecimiento tumoral, como el de los ácidos grasos polinsaturados n-3 (omega-3),11 hasta un débil efecto promotor o protector de los ácidos grasos monoinsaturados (ricos en ácido oleico),12 o francamente promotor de las grasas saturadas de origen animal. Este último, menos potente que el de las grasas polinsaturadas de origen vegetal.13
El objetivo de este trabajo es profundizar en las bases moleculares y celulares por las cuales los ácidos grasos polinsaturados omega-3 y omega-6 de la dieta pueden modificar los procesos de carcinogénesis mamaria.
Origen, síntesis y metabolismo de los ácidos grasos n-6 y n-3 de la dieta
Los ácidos grasos polinsaturados son componentes importantes de la dieta y aportan cerca de un 7-10 % de la energía total suministrada por los alimentos diariamente. Un adecuado ingreso de estos nutrientes es esencial para cumplir sus diferentes funciones biológicas como componentes estructurales de la membrana celular y en los procesos del metabolismo, la inflamación, la señalización celular y la regulación de la expresión génica.14
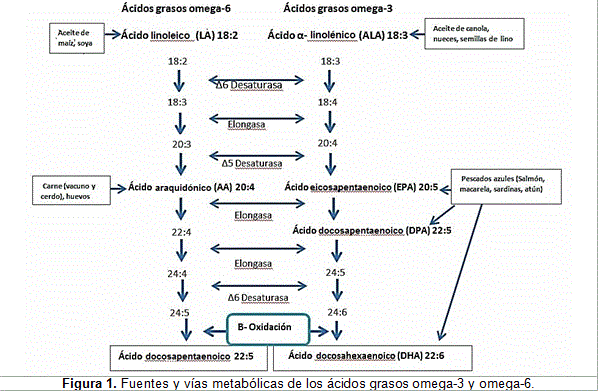
El organismo humano carece de la maquinaria enzimática para sintetizar ciertos ácidos grasos polinsaturados, los cuales deben ser aportados por la dieta; por tanto, son considerados ácidos grasos esenciales. Estos son los ácidos grasos omega-3 (C18:3, Ä9, 12, 15), omega-6 (C18:2, Ä9, 12) y los respectivos ácidos grasos polinsaturados de cadena larga derivados de ellos. Los vegetales, especialmente aquellos con alto contenido de lípidos, pueden sintetizar el primer precursor de los omega-6: el ácido linoleico (AL). Los aceites de girasol, soja y maíz, entre otros, constituyen una buena fuente de ácido linoleico Por otro lado, el primer precursor de los omega-3, el ácido alfa-linolénico (ALN), es más abundante en los aceites de canola, nuez y linaza, entre otros, y en menor proporción se encuentra en el aceite de soja.15
Los ácidos grasos polinsaturados omega-3 de mayor importancia son el eicosapentaenoico (EPA) y el docosahexaenoico (DHA). Estos solo están presentes en algunos vegetales y en animales de origen marino, particularmente, en los peces de aguas frías o de aguas profundas, quienes los obtienen del fito- y zooplancton.16,17
Algunos autores sostienen que la dieta occidental actual es deficiente en ácidos grasos omega-3, con una relación omega-3/omega-6 de 1:15 a 1:20, en lugar de 1:1 como se piensa pudo haber sido en las poblaciones prehistóricas; a esto se añaden los cambios radicales producidos durante la segunda mitad del siglo XX, a favor del consumo del aceite de soja y otros aceites vegetales.En consecuencia, se producen los eicosanoides derivados del ácido araquidónico en mayores cantidades, lo que pudiera influir en los mecanismos de la carcinogénesis.15
Mecanismos por los cuales los ácidos grasos omega-6 y omega-3 pueden modular los procesos que influyen en la carcinogénesis mamaria.
Una de las funciones más importantes de los ácidos grasos polinsaturados omega-3 y omega-6 es la producción de eicosanoides. Estos son compuestos formados por 20 átomos de carbono con una vida media corta, son biológicamente potentes y poseen múltiples funciones, entre las que se encuentran la modulación de la respuesta inflamatoria e inmune, el crecimiento celular, la diferenciación celular y la agregación plaquetaria.18,19
Los ácidos grasos omega-3 y omega-6, que se ingieren normalmente con la dieta, se incorporan a la membrana plasmática donde son metabolizados por elongasas y desaturasas celulares. Estas enzimas aumentan el tamaño de la cadena de carbonos e introducen nuevos dobles enlaces a los precursores: el ácido linoleico y el ácido á-linolénico. Mientras el ácido linoleico es metabolizado a ácido araquidónico (AA), el ácido á-linolénico (ALN) es convertido en EPA y DHA. Los ácidos grasos omega-3 poseen mayor afinidad por las enzimas desaturasas (Ä-4 y Ä-6) que los omega-6. Debido a la ausencia en sus células de la enzima ù-3 desaturasa, los mamíferos no pueden convertir los omega-6 en omega-3. Tanto el AA, el EPA y el DHA como sus precursores, el LA y el ALN, son importantes componentes de las membranas celulares, pero son funcionalmente distintos y a menudo presentan funciones biológicas opuestas.20,21(Figura 1)
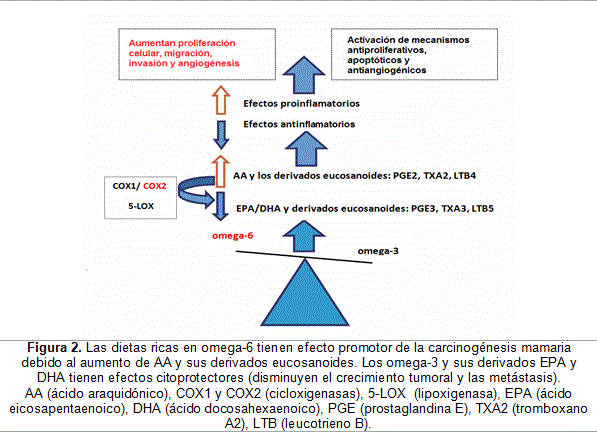
El AA y el EPA son los componentes iniciales de la síntesis de eicosanoides. La producción de estos comienza con la liberación de ácidos grasos polinsaturados desde la membrana lipídica, por la acción de varias fosfolipasas. La proporción relativa de cada uno de estos lípidos en la membrana celular podría determinar el tipo de eicosanoide que se producirá. El ácido graso polinsaturado más abundante en las membranas celulares es el AA. Los eicosanoides derivados del AA más importantes son los prostanoides de la serie 2 (prostaglandinas y tromboxanos) que se obtienen a partir de la acción de las cicloxigenasas 1 y 2 (COX1 y COX2) y los leucotrienos de la serie 4 (LTB4) que se producen por la acción de las lipoxigenasas (5-LOX). Los eicosanoides generados a partir del AA, las prostaglandinas E2 (PGE2), el tromboxano A2 (TXA2) y el leucotrieno B4 (LTB4) se han relacionado con la carcinogénesis en modelos biológicos y desempeñan una función en la progresión del cáncer a través de la estimulación de los mecanismos de angiogénesis, la proliferación celular, la inhibición de apoptosis y las metástasis.20-22
En tejidos normales, la enzima COX1 está expresada constitutivamente a bajos niveles, mientras la COX2 es indetectable, pero es inducible mediante la respuesta inflamatoria. En las células cancerosas, la COX2 está frecuentemente sobrexpresada, lo que provoca altos niveles de PGE2. La sobrexpresión de COX2 ha sido detectada en varios tipos de cáncer, incluido el de mama. Varios estudios demuestran que el efecto promotor de las dietas con alto contenido en ácido linoleico está relacionado con sobrexpresión de la COX2 y una elevada producción de las prostaglandinas proinflamatorias derivadas del AA (PGE2), además del TXA2 y el LTB4. Este último estimula la liberación de especies reactivas del oxígeno (ERO) y el nitrógeno (NO), las cuales pueden lesionar al ADN y contribuir a la iniciación de la carcinogénesis.21,23
Es posible que la PGE2, inducida por la COX2, además, pueda potenciar la síntesis de estrógenos en el tejido del estroma mamario. Se ha demostrado que la PGE2 es capaz de incrementar el ARN mensajero y los niveles de la enzima aromatasa, la cual convierte los andrógenos en estrógenos en las células de cáncer de mama. Estos efectos ocurren a través de los receptores E2 y E4 que activan la vía AMPc/PKA/CREB, lo que resulta en un incremento de la transcripción del gen de la aromatasa y el aumento de la síntesis de estrógenos a nivel del tejido mamario.24 La PGE2 también es capaz de modular la progresión del cáncer a través de mecanismos epigenéticos. Se ha demostrado en modelos biológicos de cáncer, que esta prostaglandina inhibe la expresión de genes supresores por hipermetilación en la región promotora.25
Los lípidos derivados del ácido á-linolénico (omega-3) tienen efectos protectores, ya que originan eicosanoides con efectos antinflamatorios (PGE3, TBX3 y LTB5). El mecanismo antiproliferativo más importante por el cual los omega-3 pueden disminuir la progresión del cáncer es a través de la supresión de los efectos de la biosíntesis de eicosanoides derivados del AA, por regulación decreciente de la enzima COX2 y de las cinasas ERK1/ERK2, pertenecientes a la cascada de señales mitogénicas hacia el núcleo.22,26
Los omega-3 también pueden ser metabolizados a resolvinas y protectinas. Estos compuestos poseen acciones inmunorreguladoras y desempeñan una importante función en la inflamación y el desarrollo tumoral.27
Por otra parte, se ha observado que el DHA induce sobrerregulación del proteoglicano Syndecan-1 en células de cáncer de mama, el cual está involucrado en el proceso de la apoptosis.28
La producción de citocinas inflamatorias depende de la disponibilidad de eicosanoides derivados del AA, y este proceso puede ser modulado por la ingesta de omega-3. Estos ácidos grasos pueden modificar la expresión de genes de citocinas y moléculas de adhesión celular. Además, los omega-3 afectan directamente las vías de señalización intracelular asociadas con la activación de factores de transcripción, como el factor nuclear kB (NFkB) y los PPAR (receptor activado por el proliferador de peroxisomas) que regulan la expresión de genes cuyos productos son proinflamatorios y angiogénicos: interleucinas 1 y 6 (IL-1, IL-6), factor de necrosis tumoral-á (TNF-á) y factor de crecimiento endotelial vascular (VEGF).29
Los PPAR constituyen receptores nucleares que pueden ser regulados por ciertos ácidos grasos polinsaturados y los eucasonoides. La activación de estos receptores está implicada en la regulación del metabolismo lipídico y la homeostasis; además, participan en los procesos de proliferación, diferenciación celular y en la respuesta inflamatoria. La familia de los PPAR está constituida por tres tipos diferentes de receptores: PPARá, PPARä y PPARã. Por un lado, la activación de los PPARá y PPARã parece estar relacionada con reacciones antinflamatorias y podrían contribuir a la supresión de la carcinogénesis a través de la inhibición de las dianas corriente abajo de la vía del factor NFkâ. Por otro, se ha sugerido que el PPARä actúa como inductor de la proliferación celular y promotor de la progresión de ciertos tipos de cánceres.30
En las células de cáncer de mama humano, los ácidos grasos polinsaturados pueden regular la expresión de los genes a través de rutas metabólicas que involucran el factor de transcripción PPAR.31 La activación del PPARã puede ocurrir como respuesta a una elevada ingesta de grasas o a un elevado contenido de DHA o EPA en la dieta. La modulación de la actividad del PPARã tiene actualmente mucha aplicación en el campo de la quimioprevención, debido a su capacidad de inducir la diferenciación e inhibir la proliferación de líneas celulares de cáncer. No obstante, existen numerosos estudios experimentales que tratan de explicar sus efectos, tanto antineoplásicos como tumorigénicos. Se ha propuesto que los efectos del PPARã en el desarrollo tumoral dependen del compartimiento celular en el cual es activado: si se produce en células estromales, estimula las funciones de los fibroblastos relacionadas con el cáncer. En cambio, si es activado en las células epiteliales, inhibe el crecimiento tumoral por la activación de un programa de autofagia e inhibición de la angiogénesis.32
Los ácidos grasos omega-3 y omega-6 modifican la peroxidación lipídica a nivel de la membrana e influyen sobre el crecimiento de las células de cáncer de mama. La peroxidación lipídica es una de las consecuencias más estudiadas de las acciones de las especies reactivas del oxígeno (ERO) sobre la estructura y la función de la membrana. Los productos de la peroxidación lipídica y las ERO pueden influenciar en la transducción de señales, el control de la proliferación, la diferenciación celular y el mecanismo de la apoptosis.33
Varios estudios experimentales han asociado la peroxidación lipídica con arresto del ciclo celular y apoptosis. Se ha observado que la supresión del crecimiento de los tumores mamarios con omega-3 es potenciada por los proxidantes y eliminada por antioxidantes.34 En este sentido, se ha demostrado que el DHE y el EPA aumentan la peroxidación lipídica en la membrana celular y la producción de ERO, por lo que poseen un efecto citotóxico sobre las células cancerosas. Por otro lado, estudios en modelos biológicos de cáncer de mama informan que la dieta rica en omega-6 disminuye la concentración de productos de la peroxidación lipídica derivados de los omega-3, y que a menor concentración de dichos productos, tiende a ser mayor el volumen del tumor mamario inducido por la dieta de omega-6. Asimismo, se ha observado que los ácidos grasos omega-6 pueden ser inhibidores competitivos de los omega-3 en el metabolismo lipídico. Los resultados descritos reflejan la importancia de mantener una razón adecuada de omega-3/omega-6 en la dieta. (Figura 2)
Resultados de estudios y ensayos preclínicos que demuestran otros efectos de los omega-3 y los omega-6 sobre la carcinogénesis mamaria.
En modelos in vivo e in vitro de cáncer mamario, se ha observado que los ácidos grasos omega-3 reducen el crecimiento tumoral y las metástasis. Los omega-3 alteran la estructura biofísica y la composición de la membrana a nivel de ciertos dominios denominados «balsas lipídicas», los cuales están asociados a eventos de señalización celular y contienen numerosas moléculas que intervienen en este proceso. En una línea celular de cáncer de mama, que expresa altos niveles del receptor del factor de crecimiento epidérmico (EGFR), se demostró que el tratamiento con EPA y DHA produjo una reducción selectiva de los niveles del receptor en estos microdominios con un incremento a nivel celular del EGFR fosforilado y de la cinasa (p38 MAPK), asociada a interrupción de la vía de señalización celular mitogénica y a la inducción de apoptosis.35
También se ha observado en líneas celulares tratadas con EPA y DHA, una disminución en las «balsas lipídicas» del receptor de quimiocinas CXCR4. Este último es un factor fundamental de las metástasis expresado en las células de cáncer de mama, con lo cual se inhibe la respuesta migratoria y la diseminación metastásica.36
En un modelo biológico al que se le suministró una dieta enriquecida con DHA, se produjo una reducción del tamaño de los tumores mamarios. Al mismo tiempo, se observó un aumento de un 60 % en los niveles plasmáticos de la proteína supresora de tumores BRCA1. Otro estudio encontró que el ALN suprimió la sobrexpresión del receptor HER2 en adenocarcinomas mamarios positivos.29
Por otra parte, en animales que recibieron dietas enriquecidas con omega-3, se observó un aumento en la eficacia de los fármacos citotóxicos doxorrubicina y mitomicina C, así como incremento del efecto inhibitorio del fármaco tamoxifeno en modelos estrógeno-dependientes.37 Lo anterior permitiría plantear su potencial uso como adyuvantes en la quimioterapia estándar.
Los estudios in vivo han aportado suficientes datos que muestran cómo los ácidos grasos omega-3 también pueden brindar protección contra la tumorigénesis.38 Actualmente, los suplementos de omega-3 se utilizan para aliviar los síntomas y signos de los pacientes con caquexia relacionada con el cáncer, debido a que el aumento en los niveles plasmáticos de las citocinas proinflamatorias está asociado con la anorexia, la pérdida de peso y el hipermetabolismo presentes en los estadios terminales.39,40
En relación con los ácidos grasos omega-6, se ha demostrado en diferentes modelos biológicos que estos se incorporan a la membrana plasmática de las células tumorales y modifican la fluidez de la membrana, lo que está asociado a un incremento de la proliferación celular. El AA y otros eucasonoides derivados de él incrementan la proliferación, la invasión y la migración. Además, aumentan el estrés oxidativo, el daño al ADN y disminuyen la capacidad antioxidante.41
Se ha informado que el contenido de AA correlaciona positivamente con la carcinogénesis en tejidos de tumores mamarios humanos. Datos provenientes de estudios in vitro demostraron que el AA estimuló la tasa de crecimiento, tanto en líneas celulares triple negativas como positivas para el receptor de estrógenos (RE+), lo que estuvo relacionado con mayor actividad y expresión del PPARá. Asimismo, el ácido linoleico, al igual que el AA, estimuló la proliferación, migración e invasión en líneas celulares de cáncer mamario, por aumento de la expresión del inhibidor-1 del activador del plasminógeno (API-1), inducción de la cinasa de adhesión focal (FAK), activación del NFkâ y secreción de las metaloproteinasas de la matriz 2 y 9 (MMP-2 y MMP-9).14,29
En la experiencia de trabajo de la autora con el grupo del profesor E. Escrich, en un modelo de cáncer de mama en ratas, se estudió el efecto de una dieta con alto contenido en aceite de maíz (rico en omega-6) sobre la carcinogénesis mamaria y la expresión de p21 Ha-Ras. Los resultados corroboraron lo que se había descrito previamente:42 que esta dieta influye sobre la biología tumoral y produce una menor diferenciación y características morfológicas de mayor malignidad en los carcinomas mamarios, sin producir un incremento en la expresión de la proteína p21 Ha-Ras en las células tumorales.43
Los cambios experimentados en la dieta del ser humano han provocado una profunda alteración en los procesos metabólicos que repercuten negativamente en la salud. En relación con los lípidos, la balanza se ha inclinado progresivamente, en los países occidentales, a favor de patrones de elevado consumo de ácidos grasos omega-6, lo que da lugar a un estado proinflamatorio constante. La evidencia científica acumulada de numerosos estudios experimentales permite proponer algunas políticas públicas relacionadas con el consumo y tipo de lípidos de la dieta para la prevención del cáncer de mama.
REFERENCIAS BIBLIOGRÁFICAS
1. Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013. CA: Cancer J Clin [internet]. 2013 Jan.-Feb. [citado 2 feb. 2015];63(1):[aprox. 20 p.]. Disponible en: http://onlinelibrary.wiley.com/doi/10.3322 /caac.21166/full
2. de Lorgeril M, Salen P. Helping women to good health: breast cancer, omega-3/omega-6 lipids, and related lifestyle factors. BMC Med. 2014;12(1):54.
3. Castelló A, Buijsse B, Ruiz A, Casas AM, Baena-Cañada JM, Lope V. A, et al. La dieta Mediterránea y otros patrones dietéticos y riesgo de cáncer de mama: estudio EpiGEICAM de casos y controles Br J Cancer. 2014;111(7):1454-62.
4. Gerber M. n-3 fatty acids and cancers: a systematic update review of epidemiological studies. Br J Nutr. 2012;107(Suppl. 2):S228-39.
5. Schatzkin A, Subar AF, Moore S, Park Y, Potischman N, Thompson FE, et al. Observational epidemiologic studies of nutrition and cancer: The next generation (with better observation). Cancer Epidemiol Biomarkers Prev. 2009;18(4):1026-32.
6. Thiébaut AC, Kipnis V, Schatzkin A, Freedman LS. The role of dietary measurement error in investigating the hypothesized link between dietary fat intake and breast cancer: a story with twists and turns. Cancer Invest [internet]. 2008 [citado 5 mar. 2015];26(1):[aprox. 6 p.]. Disponible en: http://informahealthcare.com/doi/abs/10.1080/07357900701527918
7. Natarajan L, Pu M, Fan J, Levine RA, Patterson RE, Thomson CA, et al. Measurement error of dietary self-report in intervention trials. Am J Epidemiol [internet]. 2010 [citado 8 feb. 2015];172(7):[aprox. 9 p.]. Disponible en: http://aje.oxfordjournals.org/content/172/7/819.full
8. Khodarahmi M, Azadbakht L. The association between different kinds of fat intake and breast cancer risk in women. Int J Prev Med [internet]. 2014 [citado 22 feb. 2015];5(1):[aprox. 10 p.]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3915474/
9. Escrich E, Solanas M, Moral R. Olive oil and other dietary lipids in breast cancer. Cancer Treat Res. 2014;159:289-309.
10. Solanas M, Moral R, Colomer R, Escrich E. Effects of dietary (n-6) polyunsaturated lipids on experimental mammary carcinogenesis. J Women's Cancer. 2000;2:67-72.
11. Alexander DD, Morimoto LM, Mink PJ, Lowe KA. Summary and meta-analysis of prospective studies of animal fat intake and breast cancer. Nutr Res Rev [internet]. 2010 Jun. [citado 26 mar. 2015];23(1):[aprox. 10 p.]. Disponible en: http://journals.cambridge.org/action /displayFulltext?type=6&fid=7828561&jid=NRR&volumeId=23&issueId=01&aid=7828560&bodyId=&membershipNumber=&societyETOCSession=&fulltextType=RV&fileId=S095442241000003X
12. Escrich E, Solanas M, Moral R, Escrich R. Modulatory effects and molecular mechanisms of olive oil and other dietary lipids in breast cancer. Curr Pharm Des [internet]. 2011 Mar. [citado 5 mar. 2015]; 17(8):[aprox. 18 p.]. Disponible en: http://www.ingentaconnect.com/content/ben/cpd/2011/00000017/00000008/art00007
13. Pouchieu C, Chajès V, Laporte F, Kesse-Guyot E, Galan P, Hercberg S, et al. Prospective Associations between Plasma Saturated, Monounsaturated and Polyunsaturated Fatty Acids and Overall and Breast Cancer Risk_Modulation by Antioxidants: A Nested Case-Control Study. PloS one. 2014;9(2):e904-42.
14. Azrad M, Turgeon C, Demark-Wahnefried W. Current evidence linking polyunsaturated fatty acids with cancer risk and progression. Front Oncol [internet]. 2013 sep. 4 [citado 10 feb. 2015];3:[aprox. 12 p.]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3761560/
15. MacLennan M, WL Ma D. Role of dietary fatty accids in mammary gland development and breast cancer. Breast Cancer Res [internet]. 2010 [citado 8 feb. 2015];12:[aprox. 10 p.]. Disponible en: http://www.biomedcentral.com/content/pdf/bcr2646.pdf
16. Fabian JC, Kimler FB. Marine-derived omega-3 fatty acids: Fishing for clues for cancer prevention. Am Soc Clin Oncol Educ Book. 2013:97-101.
17. Stephenson JA, Al-Taan O, Arshad A, Morgan B, Metcalfe MS, Dennison AR. The multifaceted effects of omega-3 polyunsaturated fatty acids on the Hallmarks of Cancer. J Lipids [internet]. 2013 [citado 27 mar. 2015];2013:[aprox. 13 p.]. Disponible en: http://www.hindawi.com/journals/jl/2013/261247/
18. Corsetto PA, Montorfano G, Zava S, Jovenitti IE, Cremona A, Berra B, et al. Effects of n-3 PUFAs on breast cancer cells through their incorporation in plasma membrane. Lipids Health Dis [internet]. 2011 [citado 12 feb. 2015];10:[aprox. 16 p.]. Disponible en: http://www.biomedcentral.com/content/pdf/1476-511X-10-73.pdf
19. Comba A, Maestri DM, Berra MA, García CP, Das UN, Eynard AR, et al. Effect of ù-3 and ù-9 fatty acid rich oils on lipoxygenases and cyclooxygenases enzymes and on the growth of a mammary adenocarcinoma model. Lipids Health Dis [internet]. 2010 [citado 10 ene. 2015];9:[aprox. 8 p.]. Disponible en: http://www.biomedcentral.com/1476-511X/9/112
20. Comba A, Lin YH, Eynard AR, Valentich MA, Fernandez-Zapico ME, Pasqualini ME. Basic aspects of tumor cell fatty acid-regulated signaling and transcription factors. Cancer Metastasis Rev [internet]. 2011 Nov. 3 [citado 20 ene. 2015];30(3-4):[aprox. 18 p.]. Disponible en: http://link.springer.com/article/10.1007/s10555 -011-9308-x/fulltext.html
21. Fritz V, Fajas L. Metabolism and proliferation share common regulatory pathways in cancer cells. Oncogene [internet]. 2010 May 31 [citado 20 ene. 2015];29:[aprox. 9 p.]. Disponible en: http://www.nature.com/onc/journal/v29/n31/full/onc2010182a.html
22. Calder PC. Mechanisms of Action of (n-3) Fatty Acids. J Nutr [internet]. 2012 Jan. 25 [citado 30 ene. 2015];142(3):[aprox. 8 p.]. Disponible en: http://jn.nutrition.org/content/142/3/592S.full.pdf+html
23. Patterson WL, Georgel PT. Breaking the cycle: the role of omega-3 polyunsaturated fatty acids in inflammation-driven cancers. Biochem Cell Biol [internet]. 2014 Jul. 8 [citado 21 feb. 2015];92(5):[aprox. 8 p.]. Disponible en: http://www.nrcresearchpress.com/doi/full/10.1139/bcb-2013-0127
24. To SQ, Takagi K, Miki Y, Suzuki K, Abe E, Yang Y, et al. Epigenetic mechanisms regulate the prostaglandin E receptor 2 in breast cancer. J Steroid Biochem Mol Biol [internet]. 2012 Nov. [citado 20 ene. 2015]; 132(3-5):[aprox. 8 p.]. Disponible en: http://www.sciencedirect.com/science/article/pii/S0960076012001446
25. Burdge GC, Lillycrop KA. Fatty acids and epigenetics. Curr Opin Clin Nutr Metab Care [internet]. 2014 Mar. [citado 20 ene. 2015];17(2):[aprox. 6 p.]. Disponible en: http://journals.lww.com/co-clinicalnutrition/Abstract/2014/03000/Fatty_acids_and_epigenetics.9.aspx
26. Wendel M, Heller AR. Anticancer actions of omega-3 fatty acids: current state and future perspectives. Anticancer Agents Med Chem [internet]. 2009 May [citado 15 ene. 2015];9(4):[aprox. 14 p.]. Disponible en: http://www.ingentaconnect.com/content/ben/acamc/2009/00000009/00000004/art00007
27. Maskrey BH, Megson IL, Rossi AG, Whitfield PD. Emerging importance of omega-3 fatty acids in the innate immune response: molecular mechanisms and lipidomic strategies for their analysis. Mol Nutr Food Res. 2013;57(8):1390-400.
28. Sun H, Hu Y, Gu Z, Owens RT, Chen YQ, Edwards IJ. Omega-3 fatty acids induce apoptosis in human breast cancer cells and mouse mammary tissue through syndecan-1 inhibition of the MEK-Erk pathway. Carcinogenesis. 2011;32(10):1518-24.
29. Chénais B, Blanckaert V. The janus face of lipids in human breast cancer: how polyunsaturated Fatty acids affect tumor cell hallmarks. Int J Breast Cancer. 2012;2012:7125-36.
30. Chang NW, Chen-Teng W, Dar-Ren C, Chung-Yi Y, Chingiu L. High levels of arachidonic acid and peroxisome proliferator-activated receptor-alpha in breast cancer tissues are associated with promoting cancer cell proliferation. J Nutr Biochem [internet]. 2013 Jan. [citado 19 ene. 2015];24(1):[aprox. 8 p.]. Disponible en: http://www.sciencedirect.com/science/article/pii/S095528631200160X
31. Kotta-Loizou I, Giaginis C, Theocharis S. The role of peroxisome proliferator-activated receptor-ã in breast cancer. Anticancer Agents Med Chem. 2012;12(9):1025-44.
32. Avena P, Anselmo W, Whitaker-Menezes D, Wang C, Pestell RG, Lamb RS, et al. Compartment-specific activation of PPARã governs breast cancer tumor growth, via metabolic reprogramming and simbiosis. Cell Cycle. 2013;12(9):1360-70.
33. Barrera G. Oxidative stress and lipid peroxidation products in cancer progression and therapy. ISRN Oncol [internet]. 2012 [citado 10 ene. 2015];2012:[aprox. 21 p.]. Disponible en: http://www.hindawi.com/journals/isrn/2012/137289/?viewType=Print&viewClass=Print
34. Manni A, Richie JP Jr, Xu H, Washington S, Aliaga C, Cooper TK, et al. Effects of fish oil and Tamoxifen on preneoplastic lesion development and biomarkers of oxidative stress in the early stages of N-methyl-N-nitrosourea-induced rat mammary carcinogenesis. Int J Oncol. 2011;39(5):1153-64.
35. Schley PD, Brindley DN, Field CJ. (n-3) PUFA alter raft lipid composition and decrease epidermal growth factor receptor levels in lipids rafts of human breast cancer cells. J Nutr [internet]. 2007 Mar. [citado 2 feb. 2015];137(3):[aprox. 6 p.]. Disponible en: http://jn.nutrition.org/content/137/3/548.full
36. Altenburg JD, Siddiqui RA. Omega-3 polyunsaturated fatty acids down-modulate CXCR4 expression and function in MDA-MB-231 breast cancer cells. Mol Cancer Res [internet]. 2009 Jun. 30 [citado 2 feb. 2015];7(7):[aprox. 8 p.]. Disponible en: http://mcr.aacrjournals.org/content/7/7/1013.full
37. Manni A, Xu H, Washington S. The impact of fish oil on the chemopreventive efficacy of tamoxifen against development of N-methyl-N-nitrosourea-induced rat mammary carcinogenesis. Cancer Prev Res. 2010;3:322-30.
38. Iyengar NM, Hudis CA, Gucalp A. Omega-3 fatty acids for the prevention of breast cancer: an update and state of the science. Curr Breast Cancer Rep. 2013;5(3):247-54.
39. Chen Z. mTORC1/2 targeted by n-3 polyunsaturated fatty acids in the prevention of mammary tumorigenesis and tumor progression. Oncogene. 2014;33(37):4548-57.
40. Siddiqui RA, Harvey KA, Xu Z, Bammerlin EM, Walker C, Altenburg JD. Docosahexaenoic acid: a natural powerfull adjuvant that improves efficacy for anticancer treatment with no adverse effects. Biofactors. 2011;37(6):399-412.
41. Serna-Marquez N, Villegas-Comonfort S, Galindo-Hernandez O, Navarro-Tito N, Millan A, Salazar EP. Role of LOXs and COX-2 on FAK activation and cell migration induced by linoleic acid in MDA-MB-231 breast cancer cells. Cell Oncol (Dordr). 2013;36(1):65-77.
42. Costa I, Moral R, Solanas M, Andreu FJ, Ruiz de Villa MC, Escrich E. High corn oil and extra virgin olive oil diets and experimental mammary carcinogenesis: clinicopathological and immunohistochemical p21 Ha-Ras expression study. Virchows Arch. 2011;458(2):141-51.
43. Guirado Blanco O. Efecto de la dieta con alto contenido en aceite de maíz sobre el grado de malignidad morfológica y la expresión de p21 Ha-Ras en la carcinogénesis mamaria experimental [tesis]. Santa Clara: Universidad de Ciencias Médicas; 2014.
Recibido: 10 de febrero de 2015
Aprobado: 14 de marzo de 2015
Dra. C. Otmara Guirado Blanco. Doctora en Ciencias Médicas. Especialista de Segundo Grado en Fisiología Normal y Patológica. Master en Educación Médica. Profesora Auxiliar. Unidad de Investigaciones Biomédicas. Universidad de Ciencias Médicas. Santa Clara, Villa Clara. Cuba. Correo electrónico: otmaragb@ucm.vcl.sld.cu