Introducción
El ADN fue descubierto en 1869 en núcleos celulares, pero no fue hasta 1944 cuando se demostró su capacidad de portar y trasmitir la información genética. En 1953, Watson y Crick esclarecieron su estructura molecular, con lo que se vislumbró la posibilidad de utilizar el conocimiento de su secuencia para el tratamiento de enfermedades, lo que posteriormente produjo la génesis del proyecto Genoma Humano, en un esfuerzo internacional con el fin de establecer su secuencia completa.
El proyecto Genoma Humano comenzó en 1990 y para 1998 se había secuenciado solo el 6% del genoma. La incorporación independiente de Craig Venter, con su empresa Celera Genomics, que utilizó el novedoso abordaje computarizado de método de disparo, produjo el primer boceto del genoma haploide humano, publicado en Science el 16 de febrero del 2001.1La secuencia completa del genoma diploide de un ser humano se informó en 2007.2
Quedó establecido posteriormente que, aunque el ADN codifica todo el RNA y las proteínas de un organismo vivo, el conocimiento de la secuencia completa no es suficiente para reconstruir el organismo, de la misma forma que la lista de palabras utilizadas por Shakespeare en una de sus obras no es suficiente para reconstruirla de la misma forma. 3
En ambos casos el problema es conocer cómo los elementos en el ADN o las palabras de la lista son utilizadas, bajo qué condiciones se sintetiza cada producto génico y, una vez sintetizado, cuál es su función.
Todas las células del organismo humano provienen de una sola célula, el cigoto, y tienen, salvo pocas excepciones, la misma información genética. Parte de esta información se bloquea durante el proceso de diferenciación, que produce los 200 tipos celulares del organismo, en los cuales más del 50% de la información genética está reprimida. 4,5 Cada una de nuestras células, diferenciadas o no, dispone de eficientes mecanismos de control de la expresión genética que determinan la síntesis de ARNs y proteínas específicas para ella y pueden cambiar en respuesta a señales externas. 3
Una vez diferenciada, la célula producirá una progenie celular similar, ya que conserva la memoria de dicho proceso. Estos mecanismos de memoria trasmiten los patrones de la expresión genética a las células hijas, sin alterar la secuencia de nucleótidos del ADN y permiten que señales transitorias del medio ambiente puedan ser recordadas permanentemente, lo que se ha denominado control epigenético, que constituye un mecanismo de control de la expresión genética.6,7
El término epigenética fue introducido por Conrad Waddington en 1942, definido como las interacciones causales entre los genes y sus productos que permiten la expresión fenotípica. Este concepto se ha redefinido varias veces y es consenso actualmente que los cambios heredables en el fenotipo no dependen de la secuencia del ADN. Esta herencia epigenética se creía limitada a las divisiones celulares; sin embargo, se ha demostrado que puede transferirse en organismos de una generación a la siguiente. Este fenómeno se describió primero en plantas y posteriormente se expandió a la levadura, mosca de la fruta, ratón y el hombre. (8,9
Muchas enfermedades tienen origen genético, entre ellas el cáncer, producido por una serie de mutaciones somáticas en genes específicos. (10Existen evidencias de la participación de mecanismos epigenéticos en la carcinogénesis, los que se consideran entre las cinco modificaciones más importantes en su producción.11,12
Actualmente se conoce la participación de mecanismos epigenéticos en la enfermedad de Alzheimer, diabetes mellitus, adrenoleucodistrofia, síndrome de Angelman, síndrome de Prader-Willi, pseudohipoparatiroidismo, desórdenes psicológicos, autismo, esclerosis múltiple, colitis ulcerativa, cirrosis biliar primaria, psoriasis, vitiligo, obesidad, aterosclerosis, hipertensión arterial y endometriosis, entre otras. (13,14
Se ha demostrado que la exposición a tóxicos, el estrés y la nutrición deficiente pueden promover la herencia transgeneracional de enfermedades y la variación fenotípica. Estos factores inducen la reprogramación de la línea germinal e incrementan la susceptibilidad de las subsiguientes generaciones de los ancestros. (15
OBJETIVO
Métodos
Se realizó la revisión bibliográfica en PubMed, en idioma inglés, con los descriptores: epigenetic molecular mechanisms, epigenetictherapy y epigeneticsregulation. La búsqueda abarcó desde 2000 hasta 2019, en la que se encontraron 73358 artículos en PubMed.
Posteriormente se seleccionaron las contribuciones más representativas que trataran los aspectos señalados en los descriptores. Debido al gran número de trabajos que abordan el tema en alguno de los aspectos específicos, se organizó el contenido de forma que abarque los mecanismos fundamentales y su participación en el desencadenamiento de enfermedades. Las publicaciones más representativas se organizaron en una carpeta en una computadora personal. Además, se revisaron algunas revistas médicas cubanas y libros de diversas especialidades de autores reconocidos, con el objetivo de obtener una visión más integradora del tema.
Desarrollo
El control epigenético comprende modificaciones del ADN o las proteínas asociadas (remodelación de la cromatina) que afectan la expresión genética.16
Modificaciones del ADN
El único factor epigenético que modifica directamente el ADN en mamíferos es la metilación del carbono 5 del anillo de citosina en los dinucleótidos simétricos CpG (cytosinephosphateguanine). 4,8,17 Como la citosina se aparea con la guanina, la cadena complementaria tendrá una secuencia CpG en sentido antiparalelo y la citosina será también metilada, lo que genera una estructura simétrica.
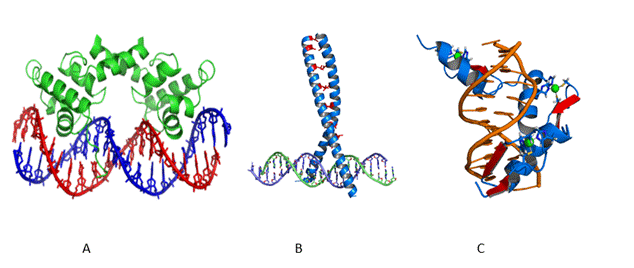
La incorporación del grupo metilo incrementa el carácter apolar en el surco mayor del ADN, que facilita la unión de proteínas específicas que se unen al mismo mediante diferentes motivos estructurales y pueden reclutar otras proteínas (fig. 1). (3,18
La metilación puede reclutar proteínas que se unen al sitio metilado, como la proteína de unión al metilCpG (methyl-CpG-binding protein 2 (MeCP2), que a la vez recluta enzimas del tipo histona deacetilasas (HDACs) e inactivan la transcripción. También reprime las secuencias parásitas y repetitivas, con lo cual se forma una heterocromatina altamente condensada en que no puede ocurrir la transcripción. 13
El motivo hélice-laso-hélice consiste en una alfa hélice conectada a través de un giro (bucle) a otra alfa hélice más larga. La flexibilidad del giro le permite a la hélice más larga asociarse al surco mayor del ADN y a una proteína formando homo o heterodímeros.
El motivo zípper de leucina consiste en dos alfa hélices que forman una cuerda, que se une al surco mayor del ADN de forma similar a una horquilla de tender ropa.
El motivo dedos de zinc presenta un átomo de zinc que une sectores en alfa hélice y en hoja plegada, de forma que la alfa hélice puede unirse al surco mayor del ADN. Forma agrupaciones de forma que las alfa hélices recubren un sector continuo del ADN.
El dinucleótido CpG se distribuye desigualmente en el genoma. Hay regiones con mayor contenido de CpG que el promedio del ADN, que se denominan islas CpG, que tienen entre 200 y varias kilobases, cercanas al extremo 5´ de los promotores. Se estima que el genoma humano contiene alrededor de 20000 islas CpG. 1,3
Alrededor del 70% de los genes humanos están ligados a islas CpG y el 4% de estas islas están metiladas en las células somáticas. Las islas que corresponden a promotores que se transcriben activamente, entre los que se encuentran los genes supresores tumorales y los que codifican proteínas constitutivas, no están metiladas, mientras que las de los genes silenciados están metiladas, en su mayoría secuencias repetitivas, elementos L1 y Alu. (4,17,19
Durante el desarrollo, una parte de las islas CpG está sometida a modificaciones dinámicas por metilación, relacionada con la diferenciación y formación del tejido. Una vez que la diferenciación se completa, la metilación específica de tejido se establece en cada tipo celular y generalmente se mantiene durante la vida de la célula.
La metilación mantiene estas secuencias silenciadas, lo que hace que la amplificación y su nueva inserción en el genoma sean poco probables. Se ha propuesto que la metilación ha evolucionado como un sistema defensivo que previene la inestabilidad cromosómica, las disrupciones y translocaciones.
El grupo metilo se incorpora a partir de la S-adenosilmetionina, el donador universal de estos grupos, en unareacción enzimática catalizada por las enzimas ADN metiltransferasas (DNMT), de las cuales la más abundante es la DNMT1 en las células somáticas. La DNMT1 participa en el desarrollo del embrión, el improntado de los genes y la inactivación del cromosoma X. Esta enzima es fundamental para el mantenimiento de las marcas epigenéticas y para el desarrollo del embrión. 6,17 Cuando se sintetiza una nueva hebra de ADN, el sitio CpGmetilado es copiado a un CpGantisentido en la otra hebra, creando un sitio hemimetilado, que es reconocido por la DNMT1 y transfiere un grupo metilo a la citosina no metilada, de manera que la metilación pueda ser trasmitida a ambas células hijas. Esto explica la estabilidad de la modificación, que la hace heredable en la división celular. 6
La metilación de novo la realizan la DNMT3a y la DNMT3b. Existe también la NMT3L, que no presenta actividad catalítica, pero activa la DNMT3A para la metilación alelo específica en las regiones improntadas del genoma. 17
La demetilación del ADN también es crucial para las células primordiales germinales y el desarrollo temprano del embrión, que puede ocurrir de forma pasiva, mediante la división celular, o activa, mediante los mecanismos de reparación por escisión. 17
Existen otros dos mecanismos que se basan en la metilación: la impronta genómica y la inactivación del cromosoma X.
Impronta genómica
La impronta genómica es una modificación química estable del ADN, que implica la formación de alelos no funcionales, en los que la transmisión es distinta, según el sexo. La impronta genómica ocurre en algunos genes que se expresan de forma diferente, en dependencia del progenitor del cual se heredan; son genes marcados o improntados y se expresan de forma monoalélica, lo que es resultado de la metilación del ADN del alelo no expresado, que lo hace inactivo. (17,19,20,21,22
Los genes que están marcados, “improntados”, en el alelo procedente de uno de los progenitores, son inactivos en ese alelo y se expresan solamente en ADN heredado del otro progenitor. Cuando la copia paterna es activa, la copia materna es silente y viceversa. Este fenómeno se denomina impronta genómica y se trasmite de generación en generación.
Existen diferentes estimados de la cantidad de genes improntados en el humano. Se estima entre 100 y 200. Debido a que solo una de las copias de los genes improntados se expresa, la impronta puede revelar mutaciones que normalmente serían cubiertas por otro grupo funcional. Un ejemplo lo constituyen el síndrome de Prader-Willi y el de Angelman, asociados a mutaciones en un grupo de genes improntados en el cromosoma 15, q11-q13.Esta región, de unos cuatro millones de pares de bases, codifica los genes SNRPN, NPN y UBE3A. En el sexo masculino se expresan SNRPN, NPN y se inactiva UBE3A, mientras que en el sexo femenino ocurre lo contrario. 17,20,21,22
En caso que la deleción sea en el cromosoma aportado por la madre, como en el cromosoma aportado por el padre el gen UBE3A está inactivado, se pierde su expresión, que codifica la E6-AP ubiquitín ligasa en el tejido nervioso, lo que afecta la degradación de proteínas.
Esto produce el síndrome de Angelman, que presenta prognatismo con lengua protuberante, retraso mental, no hablan, paroxismos de risa, movimientos espasmódicos atáxicos, aleteo de manos, microcefalia, mareos y electroencefalograma anormal; además, pueden tener piel, cabello y ojos hipopigmentados, sobre todo cuando se les compara con sus familias. (17,20,21,22,23
En caso que la deleción sea en el cromosoma aportado por el padre, como en el cromosoma aportado por la madre, los genes SNRPN y NPN están inactivados, no se expresan. Esto produce el síndrome de Prader-Willi, que se caracteriza por problemas de alimentación en la infancia, hiperfagia con obesidad de comienzo a los 1-2 años de edad, hipotonía, talla baja y retraso mental de medio a moderado. Otras alteraciones frecuentemente asociadas son: hipogonadismo, manos y pies pequeños y dismorfismo facial menor: diámetro bifrontal pequeño, ojos con forma de almendra, paladar arqueado y boca abierta en triángulo.20,21,24
La reversión de la inactivación de los genes improntados es una posibilidad terapéutica que se explicará posteriormente.
Inactivación del cromosoma X
La inactivación del cromosoma X es una forma de regulación epigenética esencial para el control de la expresión genética. (17,18
Para compensar la disparidad en la dosis de los genes ligados a X, el sexo femenino silencia uno de sus cromosomas X. (17,18
Los embriones que contienen más de un cromosoma X (XX, XXX y XXY) realizan la inactivación al azar en la etapa del blastocisto, lo que está regulado por el locus XIC (centro de inactivación de X), que regula la expresión del gen XIST (X-inactive specific transcript) y su transcripción antisentido TSIX. En el ratón, XIC detecta el número de cromosomas X e inactiva aleatoriamente a todos, menos a uno de ellos. (17,25
Modificaciones de las histonas. Código de histonas
Cuando el ADN que constituye un nucleosoma presenta una alta proporción de citosina metilada, un complejo proteico reconoce las citosinas metiladas y una enzima del complejo metila, las histonas.
Otra proteína se asocia con las histonas metiladas y la cromatina permanece en un estado altamente condensado, lo que se denomina heterocromatina constitutiva. Las regiones del ADN que contienen genes que se expresan se encuentran hipometiladas. 4,25
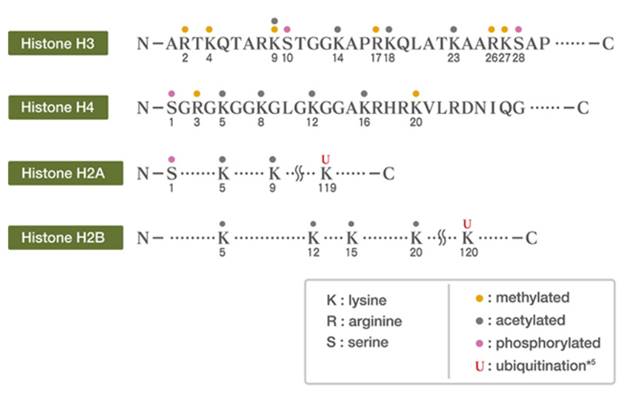
La unidad estructural básica de la cromatina consiste en un octámero de histonas, dos de cada uno de los tipos H2A, H2B, H3 y H4. El ADN se enrolla sobre este núcleo, que le confiere estabilidad estructural y capacidad de regular la expresión genética. Cada histona posee un dominio globular y una cola altamente dinámica N-terminal, que puede ser modificada post-traduccionalmente, lo que incluye: acetilación, metilación, fosforilación, ubiquitinación, sumoilación, ADP-ribosilación, isomerización de prolinas, citrulinación, butirilación, propionilación y glicosilación. (17,25
La modificación covalente de las histonas desempeña un importante papel en la regulación de la expresión genética, en una intrincada red que se entrelaza con el patrón de metilación del ADN. 3,6,7,16,25,26
Se conoce que la acetilación produce activación de la actividad transcripcional, mientras que la desacetilación la inhibe. En el caso de la metilación es más complicado, porque el proceso de metilación en ocasiones la activa y en otros la inhibe, lo que depende de otras modificaciones covalentes de las histonas, por lo que se le ha denominado el código de las histonas. (9
ARN no codificantes (ncRNAs)
Los ncRNAs participan en la regulación de la expresión genética por mecanismos epigenéticos. Aunque el genoma eucarionte se transcribe en el 75%, solo el 3% de este transcrito codifica proteínas. La mayoría del transcrito son ncRNAs. 17,25
Entre los ncRNAs se encuentran los ARN pequeños interferentes (siRNAs), microARNs (miRNAs) y los ARN no codificantes grandes (lncRNAs). Todos desempeñan importantes funciones en la regulación de la expresión genética en varios niveles: transcripción, degradación del ARN mensajero, empalme y traducción. (17,25
Los microARNs MiRNAs son moléculas pequeñas, de 18 a 24 nucleótidos, generadas por el clivaje de un ARN precursor. Estas moléculas marcan ARN mensajeros específicos para su degradación. También alteran la estructura de la cromatina, al reclutar complejos proteínicos que modifican la cromatina; su expresión en los blastocitos se corresponde con el mantenimiento de la pluripotencialidad en el desarrollo embrionario. 17,25
Plasticidad del epigenoma: reprogramación y epimutaciones
La cantidad de metilcitosina en el genoma cambia de forma diferente en tiempo y espacio. El cambio mayor ocurre durante el desarrollo embrionario, cuando el nivel de metilación disminuye en el proceso de reprogramación genética y se eliminan las marcas de metilcitosina de forma general, seguido del restablecimiento del patrón correspondiente al tipo celular. 27,28
Esto ocurre en diferentes momentos en las células germinales y las somáticas. A medida que disminuye la cantidad de metilcitosina, incrementa la modificación a hidroximetilcitosina, para posteriormente disminuir también. 27,28
El proceso es parte intrínseca del desarrollo de los mamíferos y es necesario para la transición desde el cigoto hasta el organismo totalmente desarrollado. También participa en la prevención de las epimutaciones entre generaciones, que pueden afectar el marcado epigenético característico de cada tipo celular. (27,28
Las epimutaciones, que no son parte del patrón programado de desarrollo epigenético, pueden ocurrir debido a errores de los mecanismos de mantenimiento o por la participación de agentes externos, como la edad, el medio ambiente y la dieta. Se ha estimado que su frecuencia es mayor que las mutaciones somáticas. No se conocen mecanismos de reparación de las epimutaciones, por lo que se mantienen hasta que se reprograman durante el desarrollo embrionario. (27,28
Los cambios epigenéticos pueden aumentar la frecuencia de mutaciones mediante la metilación del ADN, que aumenta el polimorfismo en esa región. La desaminación de la citosina es una de las fuentes más abundantes de daño en el ADN, ya que la citosina desaminada se convierte en uracilo, sustrato de la enzima uraciloglicosilasa y marcada para la reparación; sin embargo, la citosina se desamina a timina, que se reconoce con dificultad. Aunque hay mecanismos para remover el desapareamiento T-G, son menos eficientes y, por tanto, la desaminación de la citosina metilada es la principal fuente de mutaciones. 29
Factores que modifican el estado del epigenoma
Efecto de hábitos de comportamiento:
Existen numerosos reportes de cambios heredados en el epigenoma del sistema nervioso, relacionados con el comportamiento de los progenitores, dieta, exposición al abuso de drogas y los desórdenes endocrinos.
Por ejemplo, el cuidado maternal de los lactantes desencadena cambios en la metilación del ADN que codifica al receptor de los glucocorticoides en el sistema nervioso central, que persiste en los descendientes adultos y determina cambios de comportamiento. (30
Efecto del ejercicio físico:
El ejercicio físico produce cambios significativos en la concentración de NAD (nicotinamínadeníndinucleótido). Las desacetilasas de histonas de clase III, conocidas como sirtuinas, utilizan NAD como cofactor y responden a los cambios de concentración de NAD celular. El aumento de concentración de NAD inhibe la actividad de las sirtuinas, lo que explica los cambios producidos por el ejercicio físico y la restricción calórica en su actividad. 28
Modulación del epigenoma mediante la dieta:
Entre los mecanismos que modifican el epigenoma en respuesta a la dieta se encuentra la respuesta de las sirtuinas a las concentraciones celulares de NAD, como se explicó en el apartado anterior. El NAD se obtiene de la nicotinamida presente en la dieta. (28
La sirtuina 1 responde al estado nutricional (restricción calórica) y modifica el metabolismo mediante cambios en el estado de acetilación de las histonas, que actúa sobre la expresión de los genes que controlan la oxidación y movilización de los ácidos grasos, la gluconeogénesis y la secreción de insulina. 28
Los descendientes de las personas expuestas a la hambruna en Suecia cuando tenían 9 a 12 años de edad mostraron tasas de mortalidad por diabetes mellitus, lo que parece estar relacionado con bajos niveles de metilación del gen que codifica el factor de crecimiento similar a insulina 2, un gen improntado que se expresa normalmente en el desarrollo temprano. (27
Se ha demostrado que la genisteína y el resveratrol, polifenoles que se encuentran en la soja, la uva y el maní, disminuyen el riesgo de cáncer de próstata y mama, además de la proliferación de las células del cáncer de próstata. (31
El galato de epigalocatequina, presente en el té verde, es un polifenol con actividad antioxidante, inhibición de la angiogénesis, inducción de la apoptosis e inhibición de la producción de metástasis en el carcinoma de páncreas, mediante la inhibición de la metilación de genes específicos. (28,31
El selenio en la dieta se ha comprobado que disminuye el riesgo de cáncer de próstata y mama, mediante la inhibición de la desacetilación de las histonas. 31
Terapéutica epigenética
Han sido aprobadas drogas cuyo mecanismo de acción se basa en la modificación de los mecanismos epigenéticos para varias enfermedades, lo que refleja el potencial del estudio de este tema.
Hay tres clases principales: 23
Inhibidores de las desacetilasas de histonas: fenilbutirato, tricostatin A, ácido fenilbutírico, tricostatin A y ácido valproico.
Agentes metilantes del ADN:5-azacitidina, decitabina, zebularina, procainamida y procaina, hidralazina, galato de epigalocatequina 3 y oligonucleótidos antisentido de la metiltransferasaI.
MicroRNA.
El topotecam es un inhibidor de la topoisomerasa I y estimula la expresión de los genes improntados en el cromosoma 15, q11-q13, por lo que se utiliza en el tratamiento de los síndromes de Angelman y de Prader-Willi. 32
El romidepsin y el vorinostat inhiben la desacetilación de las histonas y se utilizan para el tratamiento del linfoma de células T.
Conclusiones
Los mecanismos epigenéticos desempeñan un importante papel en el desarrollo de muchas enfermedades y su conocimiento permite modificarlos a través de cambios en los hábitos de vida, dieta o agentes terapéuticos.
La dieta es un importante medio de modulación del epigenoma, mediante su efecto en los mecanismos relacionados con el metabolismo del grupo metilo y la modificación covalente de las histonas.
Se han desarrollado drogas para la terapéutica epigenética, aprobadas después de pasar los ensayos clínicos y que constituyen un área prometedora en varias enfermedades, principalmente el cáncer.