Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol v.12 n.1 Ciudad de la Habana ene.-abr. 2001
Instituto Nacional de Endocrinología
Glucemia, insulinemia y secreción de insulina en ratas prepúberes hiperandrogenizadas e hiperestrogenizadas
Lic. Aimée Álvarez Álvarez,1 Lic. Eulises Díaz Díaz,2 Lic. Elisa María Castells Martínez,3 Dra. Beatríz Huguéz Hernandorena4 y Dr. Roberto M. González Suárez5
Resumen
Se estudió el efecto de una sobredosis de enantato de testosterona y de benzoato de estradiol en ratas machos prepúberes, sobre el comportamiento de la glucemia y la insulinemia in vivo, durante una prueba de tolerancia a la glucosa. Adicionalmente se exploró, in vitro, la capacidad de secreción de insulina estimulada por glucosa de los islotes de Langerhans de estas ratas hiperandrogenizadas e hiperestrogenizadas. Se encontró que la hiperandrogenización se acompañaba de un deterioro de la sensibilidad a la insulina, con hiperinsulinemia, que no se corresponde con un aumento de la capacidad de secreción de insulina de los islotes de Langerhans. Sin embargo, se comprobó que la hiperestrogenización no indujo cambios en los perfiles de glucemia, ni de insulinemia, ni en la capacidad de secreción de insulina de los islotes de Langerhans de este grupo de ratas hiperestrogenizadas.
DeCS: HEPTANOATOS; ESTRADIOL; RATAS DE CEPAS CONSANGUINEAS; HIPERINSULINISMO; ISLOTES DE LANGERHANS; TEST DE TOLERANCIA A LA GLUCOSA.
Existen resultados de investigaciones clínicas y experimentales que demuestran la participación de los esteroides sexuales en el control del metabolismo energético, particularmente sobre la secreción y las funciones de la insulina. Dentro de estas evidencias podemos citar: la aparición del hiperinsulinismo y la disminución de la tolerancia a la glucosa por cambios en las concentraciones de estradiol y progesterona durante el embarazo,1 la disminución de las concentraciones de glucosa e insulina en ayunas así como la reducción de la incidencia de diabetes por efecto de la terapia hormonal de reemplazo en mujeres posmenopáusicas,2,3 la importante función que se le atribuye al 17 beta estradiol en el mantenimiento de la sensibilidad a la insulina,4 el hiperandrogenismo característico de las mujeres con el síndrome de ovarios poliquísticos (SOP),5,6 la aparición de resistencia a la insulina en hombres y mujeres sanos tratados con un exceso de hormonas androgénicas,7,8 la disminución de la sensibilidad a la insulina por un defecto del metabolismo periférico de la glucosa, durante la pubertad normal,9 el dimorfismo sexual en la incidencia de la diabetes encontrado en diferentes modelos experimentales en animales.10,11
A pesar del gran número de investigaciones realizadas en los últimos años, encaminadas a definir los mecanismos moleculares involucrados en la acción de los esteroides sexuales sobre el metabolismo energético, estos no han sido aún completamente dilucidados. En este trabajo nos propusimos estudiar el efecto de una dosis alta de enantato de testosterona o de benzoato de estradiol en ratas machos prepúberes in vivo, sobre las modificaciones de la glucemia y la insulinemia durante una prueba de tolerancia a la glucosa (PTG) y simultáneamente, in vitro, el efecto sobre la secreción de insulina de los islotes de Langerhans de estas ratas hiperandrogenizadas o hiperestrogenizadas.
Métodos
Para el estudio utilizamos ratas Wistar machos prepúberes que pesaban entre 70 y 80 g. Establecimos 3 grupos experimentales de al menos 6 ratas cada uno: I- ratas intactas, II- ratas tratadas con testosterona y III- ratas tratadas con estradiol. Para los tratamientos con testosterona y estradiol a las ratas se les suministró una dosis única de 5 mg/rata de enantato de testosterona o 200 µg/rata de benzoato de estradiol por inyección intramuscular utilizando como vehículo 1 mL de aceite vegetal. Los experimentos se realizaron 48 h después del tratamiento con testosterona y 24 h después del tratamiento con estradiol. Los experimentos para cada tratamiento se repitieron al menos 3 veces. Los valores de estradiol y de testosterona de cada grupo experimental se determinaron por radioinmunoensayo (RIA).
Prueba de Tolerancia a la Glucosa (PTG)
Para realizar la prueba administramos glucosa a razón de 3 g por kg de peso, por inyección intraperitoneal. La sangre para determinar insulina y glucemia la obtuvimos de la arteria retroorbital antes, 15, 30, 60 y 120 min después de administrar glucosa y la recogimos sobre heparina.12 Determinamos la glucemia por el método de la glucosa oxidasa.13 Cuantificamos la insulinemia por RIA.14
Obtención y estimulación de islotes de Langerhans
Aislamos los islotes según una modificación del método de Lacy.15 Extrajimos el páncreas de la rata e inmediatamente le eliminamos la grasa en una placa Petri con tampón Krebs-Ringer-bicarbonato (KRB) (NaCl 118 mM; KCl 6,2 mM; CaCl2 5,6 mM; MgSO4 1,5 mM; KH2PO4 1,5 mM; NaHCO3 32,2 mM; ph 7,4, suplementado con Hepes 10 mM, albúmina de suero bovino 0,2 % y glucosa 3,3 mM), sobre hielo.
Realizamos la digestión del páncreas en 5 mL de tampón KRB con 12 mg de colagenasa (Sigma), con agitación manual, durante 20-30 min. Una vez terminada la digestión hicimos 3 lavados con tampón KRB para eliminar la colagenasa y transferimos el tejido digerido a una placa Petri de fondo oscuro; aislamos los islotes libres de colágeno con una pipeta Pasteur bajo microscopio estereoscópico.
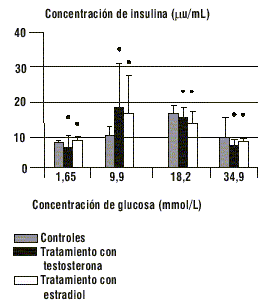
Para los experimentos de estimulación empleamos 20 islotes por tubo en 0,5 mL de tampón KRB. A cada tubo le añadimos 0,5 mL de tampón KRB con 3-isobutil-metilxantina (IBMX) 0,1 mM, que es un inhibidor de fosfodiesterasa de AMPc y es capaz de potenciar la respuesta secretora de los islotes, más glucosa en concentración final de 1,65; 9,9; 18,9 y 34,9 mmol/L. Incubamos los islotes a 37 °C con agitación, durante 1 h con atmósfera de carbógeno (95 % O2 - 5 % CO2). Tomamos 500 µL del sobrenadante para determinar la insulina por RIA.
Procesamiento estadístico de los datos
Procesamos los resultados con el uso del test no paramétrico de suma de rangos para 2 grupos de Wilconxon, mediante el programa de Software Microsta (Ecosoft, Inc, 1984), con un nivel de significación p < 0,05.
Resultados
Los niveles plasmáticos de testoste-rona en nmol/L fueron de 0,25 ± 0,09 para el grupo de ratas controles y de 18 ± 3,5 para el grupo de ratas tratadas con testosterona (48 h después del tratamiento), por lo que consideramos que en el momento en que realizamos los experimentos las ratas de este último grupo estaban hiperandrogenizadas, incluso con respecto a las ratas Wistar machos adultas para las que anteriormente se habían reportado valores normales de testosterona de 4 nmol/L.16
Los niveles plasmáticos de estradiol en nmol/L no fueron detectables en el grupo de ratas controles (la sensibilidad del RIA utilizado es de 6,1 pmol/L) y de 1 219 ± 57 para el grupo de ratas tratadas con estradiol, por lo cual consideramos que cuando se realizaron los experimentos, las ratas de este último grupo estaban hiperestrogenizadas.
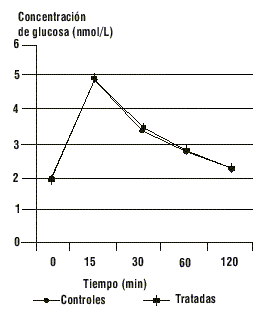
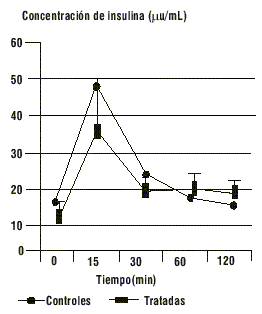
El comportamiento de la glucemia y la insulinemia durante la PTG en el grupo de ratas tratadas con testosterona se muestra en las figuras 1 y 2. Este grupo mantiene los niveles de glucosa de forma similar al grupo control (p > 0,05 para la diferencia de áreas bajo la curva), a costa de valores de insulinemia significativamente superiores al grupo control (p < 0,01 para la diferencia de áreas bajo la curva).
FIG. 1. Efectos del tratamiento con testosterona sobre la glucemia durante la PTG, p > 0,05 para la diferencia de áreas bajo las curvas.
FIG. 2. Efectos del tratamiento con testosterona sobre la insulinemia durante la PTG, p < 0,01 para la diferencia de áreas bajo las curvas.
Los valores de glucemia e insulinemia del grupo de ratas tratadas con estradiol se muestran en las figuras 3 y 4. En este grupo de ratas la hiperestrogenización no induce cambios en los perfiles de glucemia (p > 0,05) ni de insulinemia (p > 0,05) durante la PTG.
FIG. 3. Efectos del tratamiento con testosterona y estradiol sobre la secreción de insulina de los islotes de Langerhans, ns-diferencia no significativa.
FIG. 4. Efectos del tratamiento con estradiol sobre la glucemia durante la PTG, p > 0,05 para la diferencia de áreas bajo las curvas.
FIG. 5. Efectos del tratamiento con estradiol sobre la insulinemia durante la PTG, p > 0,05 para la diferencia de áreas bajo las curvas.
En la figura 5 se muestran los resultados del estudio in vitro de la capacidad de secreción de insulina de los islotes de Langerhans. Los islotes de las ratas tratadas con testosterona (hiperandrogenizadas) así como los de las ratas tratadas con estradiol (hiperestrogenizadas), tuvieron un comportamiento similar al de las ratas controles, para todas las concentraciones estimulatorias de glucosa utilizadas.
Discusión
Según el consenso general, los estrógenos tienen un efecto positivo en la sensibilidad a la insulina, mientras que el exceso de andrógenos se asocia a la disminución de la sensibilidad a la insulina y al desarrollo de la resistencia a la insulina. Posiblemente, la correlación entre estrógenos y andrógenos activos sea un factor importante para la sensibilidad al desarrollo de la diabetes.17 En ratas prepúberes, las concentraciones basales de andrógenos (0,25 ± 0,09 mmol/L) y de estrógenos (< 6,1 pmol/L) son muy bajos, por lo cual la utilización de estos modelos experimentales con ratas prepúberes nos permitió estudiar el efecto de la hiperandrogenización y de la hiperestrogenización prácticamente en ausencia de estrógenos y de andrógenos, respectivamente.
El comportamiento de las curvas de glucemia y de insulinemia durante la PTG de las ratas tratadas con testosterona (figs. 1 y 2) muestra un deterioro de la sensibilidad a la insulina caracterizado por un incremento estadísticamente significativo (p < 0,01) de los requerimientos de insulina (fig. 2) para mantener los niveles de glucemia similares a los de las ratas controles (fig. 1), o sea, que en estas ratas prepúberes hiperandrogenizadas, la disminución de la sensibilidad a la insulina es compensada con un aumento de los niveles de insulina circulante. Resulta interesante que en ratas adultas un esquema similar de hiperandro-genización se asocia no solo con una resistencia a la insulina con hiperinsulinismo, sino que también se produce intolerancia a la glucosa, ya que estas ratas adultas hiperandrogenizadas no mantienen los valores normales de glucosa durante la PTG.16 Por otra parte, la capacidad de secreción de insulina in vitro de los islotes de Langerhans de las ratas prepúberes tratadas con testosterona es similar a la de las controles (fig. 5), lo cual difiere del aumento de la capacidad de secreción de insulina in vitro de los islotes de ratas machos adultas hiperandrogenizadas16 y de islotes en cultivo tratados con 1 µg/mL de testosterona [Morimoto LS. Efecto de los esteroides sexuales sobre la síntesis y liberación de insulina en la rata. Estudios in vivo e in vitro (Tesis para obtener el grado de doctor en ciencias fisiológicas. México, Colegio de Ciencias y Humanidades, Colegio de Neurobiología, 1999)]. Parece ser que en el caso de las ratas prepúberes hiperandrogenizadas, el aumento de los niveles de insulina durante la PTG no se basa en un aumento de la capacidad secretora de los islotes de Langerhans, sino que en esta respuesta compensatoria intervienen otros mecanismos que actúan en el contexto del organismo y que no están presentes en el modelo in vitro de los islotes aislados.
A pesar de que de forma general a los estrógenos se les ha atribuido un efecto positivo en la sensibilidad a la insulina, en nuestro modelo de ratas machos prepúberes el tratamiento con estradiol (200 µg/rata) no indujo cambios en los perfiles de glucemia ni en los de insulinemia durante la PTG (figs. 3 y 4), ni tampoco en la capacidad de secreción de insulina de los islotes de Langerhans in vitro (fig. 5), de forma tal que en estas ratas prepúberes la hiperestrogenización no incide en la sensibilidad a la insulina. Pudiera ser que los mecanismos a través de los cuales los estrógenos operan en el metabolismo hidrocarbonado, estén modulados por la correlación entre las concentraciones de los estrógenos y los andrógenos circulantes.
La utilización de estos modelos experimentales de ratas machos prepúberes hiperandrogenizadas e hiperestrogenizadas pudiera servir para adquirir información útil para comprender el efecto de la terapia sustitutiva sobre el metabolismo energético.
Summary
The effect of an overdose of testosterone heptanoate and estradiol in male prepubescent rats on the behavior of glycemia and insulinemia was studied in vivo during a glucose tolerance test. The capacity of insulin secretion stimulated by glucose from the islets of Langerhans of these rats that were administered a high dose of androgens and estrogens was explored in vitro. It was found that the high level of circulating androgens was accompanied by a deterioration of sensitivity to insulin with hyperinsulinemia that does not correspond to an increase of the insulin secreting capacity of the islets of Langerhans. However, it was demonstrated that the high level of circulating estrogens did not produce changes either in the glycemia and insulinemia profiles or in the insulin secreting capacity of the islets of Langerhans in this group of rats that received an elevated dose of estrogens.
Subject headings: HEPTANOATES; ESTRADIOL; RATS, INBRED STRAINS; HYPERINSULINISM; ISLETS OF LANGERHANS; GLUCOSE TOLERANCE TEST.
Referencias bibliográficas
- Kuhl C. Serum insulin and plasma glucagon in human pregnancy. On the pathogenesis of gestational diabetes. Acta Diabetol Lat 1977;14:1-8.
- Barret-Connor E, Laasco M. Ischemic heart disease risk in postmenopausal women. Effects of estrogen use on glucose and insulin levels. Arteriosclerosis 1990;10:531-4.
- Hammond CB, Jelousek FR, Lee KL, Creasman WT, Parker RT. Effects of long term estrogen replacement therapy. Metabolic effects. Am J Obstet Gynecol 1979;133:525-36.
- Kumagai S, Holmang A, Bjorntorp P. The effect of estrogen and progesterone on insulin sensitivity in female rats. Acta Endocrinol Scand 1993;149:91-7.
- Poretsky L. On the paradox insulin-induced hyperandrogenism in insulin resistant states. Endocr Rev 1991;12:3-13.
- Buffington CK, Kitabchi A. Evidence for a defect in insulin metabolism in hyperandrogenis women with polycystic ovarian syndrome. Metabolism 1994;43:1367-72.
- Bjorntorp P. Metabolic effect of body fat distribution. Diabetes Care 1991;14:1132-43.
- Podelrman KH. Insulin induction of insulin resistance by androgen and estrogen. J Clin Endocrinol Metab 1994;79:265-71.
- Amiel SA, Caprio S, Sherwin RS, Plewe G, Haymond MW, Tamborlane WV. Insulin resistance of puberty: a defect restricted to peripheral glucose metabolism. J Clin Endocrinol Metab 1991;72:277-80.
- Shi K, Mizuno A, Sano T, Ishida K, Shima K. Sexual differences in the incidence of diabetes mellitus in Otsuka-Long-Evans-Tukushima- fatty rats: effects of castration and sex hormone replacement on its incidence. Metabolism 1994;43:1214-20.
- Efrat S. Sexual dimorphism of pancreatic beta cell degeneration in transgenic mice expressing an insulin-ras hybryd gene. Endocrinology 1994;128:897-901.
- Deás M, Menéndez R, Álvarez A, González RM. Efecto hipoglicemiante de la Albahaca morada sobre la glicemia y la insulinemia en modelos animales. Rev Cubana Invest Biomed 1988;7(1):53-9.
- Trinder P. Determination of glucose in blood using glucose oxidase with an alternative oxygen acceptor. Ann Clin Biochem 1969;6:24-7.
- Arranz MC, González RM. Utilización de un método rápido para la separación de la hormona libre y unida en el radioinmunoensayo de insulina. Rev Cubana Biomed 1989;17(3):150-6.
- Lacy PE, Kostianovsky M. Method for the isolation of intact islets of Langerhans from the rat pancreas. Diabetes 1967;16:15-23.
- Álvarez A, Díaz E, Huguez B, González RM. Glucemia, insulinemia y secreción de insulina en ratas hipoandrogenizadas e hiperandrogénicas. Rev Cubana Endocrinol 1999;10(2):133-9.
- Turevsky AA, Mozheiko LA. Morphological and morphometric characterization of pancreatic endocrine system in different levels of ovarian hormones. Probl Endocrinol 1990;36(6):1231-6.
Recibido: 2 de diciembre de 2000. Aprobado: 21 de febrero de 2001.
Lic. Aimée Álvarez Álvarez. Instituto Nacional de Endocrinología, Zapata y D, El Vedado, Ciudad de La Habana, Cuba.
1 Licenciada en Bioquímica. Investigadora Agregada.
2 Licenciado en Bioquímica. Aspirante a Investigador.
3 Licenciada en Bioquímica.
4 Médico Veterinario. Responsable del Vivario.
5 Doctor en Ciencias Médicas. Investigador. Profesor Titular.