Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol v.12 n.1 Ciudad de la Habana ene.-abr. 2001
Enfoque Actual
Instituto Nacional de Endocrinología
Centro de Atención al Diabético
Reguladores prandiales de la glucemia
Dr. José A. Mesa Pérez,1 Dr. Manuel Licea Puig,2 Dr. Arturo Hernández Yero3 y Dr. Pedro A. Perich Amador4
Resumen
Se hizo una revisión actualizada sobre un nuevo grupo de drogas que actúan por vías diferentes y por distintos mecanismos de acción regulan la hiperglucemia posprandial en los pacientes con diabetes mellitus. Se destacó la repaglinida, agente secretagogo insulínico independiente de las sulfonilureas, que ayuda a restaurar la fisiología del fallo en el pico secretor insulínico inicial, en pacientes con diabetes tipo 2 y de la acarbosa, agente inhibidor de las alfas glucosidadas intestinales. La hiperglucemia posprandial es determinante en la aparición de las complicaciones vasculares, por lo cual se concluyó que estos grupos de medicamentos ayudarían a alcanzar un mejor control metabólico y representan nuevas opciones medicamentosas en el arsenal terapéutico para la diabetes mellitus tipo 2.
DeCS: HIPERGLUCEMIA/complicaciones; AGENTES HIPOGLICEMICOS.
Es reconocido que la diabetes mellitus (DM) constituye en el momento actual un problema de salud en numerosos países, tanto desarrollados como aquellos en vías de desarrollo. Este fenómeno tiene una tendencia creciente, lo cual obliga a considerar su epidemiología como un factor importante en el milenio que dejamos y en el que acaba de comenzar, considerando necesarias medidas de pesquisa e intervención para modificar y revertir esta situación.
Aproximadamente, el 90 % de los diabéticos corresponden al tipo 2,1 grupo en el que a pesar de los grandes progresos obtenidos en los últimos años en la atención terapéutica, aun no se ha logrado revertir la morbilidad ni la mortalidad por complicaciones crónicas, en particular las de origen vascular.2
Algunas evidencias demuestran que el mal control metabólico se asocia significativamente a las complicaciones tardías de la DM,2 más recientemente se ha confirmado que la hiperglucemia posprandial se asocia significativamente a las complicaciones microvasculares y las macrovasculares de la DM y que la misma duplica el riesgo de mortalidad en estos pacientes.3
Con el propósito de lograr un control metabólico óptimo en el paciente diabético tipo 2 se han ensayado diferentes fármacos para corregir el efecto insulinosecretorio y controlar la hiperglucemia, tanto en ayunas como posprandial, así como la insulinorresistencia y la hiperinsulinemia. Estos agentes han sido denominados agentes reguladores prandiales de la glucemia.
Agentes reguladores prandiales de la glucemia
1. Repaglinida (derivado del ácido benzoico) AG-EE623ZW.
2. Nateglinida (derivado de la fenilalanina) A-4166.
3. BTS 67582 (derivado de la guanidina).
4. KAD 1229 (derivado del succinato).
5. CAS 60875-16-3 (derivado de la fenilalanina).
6. U-56324 (derivado del ácido nicotínico).
7. Adamantanamine.
8. Inhibidores de las alfaglucosidasas.
_ Acarbosa.
_ Miglitol (Bay m 1099).
_ Voglibosa (AO-128).
_ Catanospermine (mdl 7345).
_ Kotalanol (mld 7395).
9. Gomas, mucílagos y retardadores de la absorción de los carbohidratos.
Nos proponemos en este trabajo revisar los criterios actuales en relación con algunas drogas o compuestos orales que actúan por diferentes vías y mecanismos de acción y son capaces de regular la hiperglucemia posprandial. En particular, nos detendremos en la repaglinida y la acarbosa.
Repaglinida
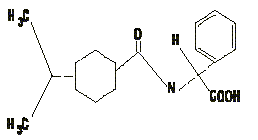
La repaglinida (RP) es un regulador prandial de la glucemia y el primero de una nueva clase de compuestos antihiperglucémicos con un claro y potente efecto estimulatorio sobre la liberación de insulina, estructuralmente relacionado con la meglitinida, y que tiene un peso molecular de 452,6 y una fórmula C27H36O4.4
En la figura 1 se muestra la estructura molecular de la RP.
FIG. 1. Estructura molecular de la repaglinida.
Mecanismos de acción
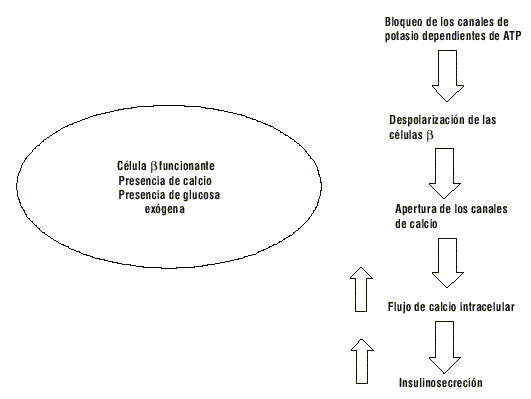
La RP disminuye la glucemia al estimular la liberación pancreática de insulina. Esta acción es dependiente del funcionamiento de las células b de los islotes y se logra a través de los canales de K dependientes de ATP en las membranas de estas células b por unión en los sitios de afinidad. Este bloqueo despolariza la célula b y determina una apertura de los canales de calcio; como resultante de este efecto se incrementa el flujo del calcio intracelular lo que ocasiona aumento de la insulino-secreción, mecanismo de acción similar al de las sulfonilureas. Se conoce que la especificidad de la respuesta de la repaglinida está dada en que estimula o tiene sitios de unión específica para una proteína de 36 kD diferente al sitio de las sulfonilureas.5,6
La RP requiere para su acción de la presencia de calcio en el espacio extracelular y de la glucosa exógena. Este fármaco no inhibe la síntesis de proinsulina, no tiene efecto comprobado sobre la secreción de glucagón ni sobre la liberación de somatostatina (fig. 2).7-9
FIG. 2. Mecanismo de acción de la repaglinida.
Absorción
Es rápida y completa a nivel del tracto gastrointestinal. El pico máximo de concentración en el plasma lo alcanza dentro de la primera hora después de su administración.4,7,10 La absorción no está relacionada con la ingestión de alimentos ni el ayuno,7,9,11 aunque algunos autores han observado que la velocidad de absorción es significativamente mayor durante la ingestión de comidas ricas en grasa.11 No parece que el factor racial interfiera en la absorción del producto.4,12,13
Metabolismo
La RP sufre una biotransformación oxidativa y es catabolizada en el hígado y excretada por la bilis (90 %) y el riñón (8 %), algunos autores sugieren su empleo en pacientes con disfunción renal sin comunicar efectos adversos.4,14,15
Ruckie y otros,15 estudiaron la acción de la RP en 19 pacientes con diferentes grados de insuficiencia renal los cuales compararon con un grupo control, sin encontrar variaciones significativas en relación con el aumento de la frecuencia de episodios de hipoglucemia. No obstante a lo señalado anteriormente, sugieren iniciar la terapéutica con dosis mínimas e incrementarlas gradualmente hasta lograr el control glucémico deseado. Algunos autores han evaluado la vida media en sangre de la RP y el aclaramiento renal de creatinina en pacientes con insuficiencia renal con dosis que oscilan entre 0,5 y 4 mg antes de cada comida. Al comparar los resultados con población sana, no se confirmaron diferencias significativas en los parámetros antes señalados,4,16 lo cual sugiere que el uso de la RP en estos pacientes no parece causar graves riesgos.
En pacientes cirróticos, el uso de la RP muestra una buena tolerancia a la droga ya que no incrementa la intensidad de los episodios hipoglucémicos.11,17 Jovanovic y otros18 en un estudio multicéntrico en 361 pacientes con diabetes tipo 2, no comprobaron hipoglucemia severa, en los casos en que esta se presentó, los valores de glucemia siempre se mantuvieron por encima de 45 mg/dL. Owens12 señala, entre otras ventajas del uso de la RP, que las hipoglucemias no son severas, incluso cuando se omite una comida.
Hatorp y otros,11 estudiaron el efecto de la RP en 24 sujetos con daño hepático y concluyeron que es bien tolerada, aunque aconseja utilizarla bajo vigilancia de la función hepática, y que los ajustes de dosis se efectúen a intervalos más largos que en los pacientes sin daño hepático.
Contraindicaciones
La RP está contraindicada en los casos siguientes:
1. Pacientes con diabetes mellitus tipo 1.
2. Pacientes con cetoacidosis diabética con estado de coma, o sin él.
3. Estado de hipersensibilidad a la droga.
Indicaciones
Muchos autores consideran la RP como una droga de elección de primera línea en pacientes diabéticos tipo 2 con reserva pancreática de insulina que no logran un buen control metabólico con dieta solamente.
Interacción con otros fármacos
Se ha comprobado in vitro que algunas drogas como el ketoconazol, el miconazol y la eritromicina son capaces de inhibir el metabolismo de la RP.4
Las drogas que inhiben el sistema de la citocromo oxidasa P-450 en el hígado aumentan el metabolismo de la RP, entre ellas se pueden mencionar la troglitazona, la rifampicina, los barbitúricos y la carbamazepina.4
Efectos indeseables
La RP es un fármaco que muestra buena tolerancia,19-21 no obstante, la hipoglucemia parece ser el efecto indeseable más importante demostrado hasta el momento.17,22 La literatura revisada comunica riesgos de hipoglucemia similares a los observados con las sulfonilureas.17,19,21
Dejgaard y otros en un estudio comparativo realizado en 157 pacientes diabéticos tipo 2 que usaban RP y 81 tratados con glipizida encontraron mayor incidencia de hipoglucemia en los tratados con glipizida. También señalan mayor frecuencia de hipoglucemia nocturna y en la madrugada con la glibenclamida que con el uso de RP.22
Otros efectos indeseables ocasionales y mucho menos frecuentes son cefaleas y mareos.17
Pudiéramos considerar que la aparición de fenómenos de hipoglucemia relacionada con el uso de la RP es menos frecuente, menos grave y de menor presentación nocturna que los informados con el uso de las sulfonilureas,4,17,19,21 además, los estudios realizados hasta el momento no encuentran una correlación positiva de la presencia de estos episodios con las edades avanzadas,4 por lo que no se limita su empleo en la tercera edad.
Dosis
El producto se presenta en tabletas de 0,5; 1 y 2 mg. Se recomienda comenzar con una dosis de 0,5 mg en pacientes sin tratamiento previo o que tenga niveles de HbA1c inferiores a 8 %, antes de cada comida. En pacientes previamente tratados o con valores de HbA1c superiores a 8 %, se sugiere iniciar el tratamiento con dosis de 1 mg o más, antes de las comidas.
El seguimiento y ajuste de la dosis se hará siempre atendiendo a los valores de glucemia y se recomienda esperar alrededor de 6 ó 7 d para evaluar la respuesta terapéutica y hacer nuevos reajustes de dosis.4,17 La dosis máxima recomendable es hasta 16 mg diarios aunque en estudios experimentales se ha llegado a dosis de 80 mg sin comprobarse efectos secundarios graves.17
Terapia combinada con la repaglinida
Se sugiere que la combinación más efectiva es la de RP con metformina; sobre todo en pacientes diabéticos tipo 2 que no logran un control efectivo con metformina y dieta sola.14,23,24
De Fronzo24 plantea que la RP es el medicamento de elección de la terapia inicial en pacientes con diabetes tipo 2, por su efecto corrector sobre el fallo del pico temprano insulinosecretor.
Nateglinida
La nateglinida es un derivado de la D-fenilalanina. En la figura 3 se muestra su estructura química.
FIG. 3. Estructura química de la nateglinida.
La nateglinida es también un regulador prandial de la glucemia, altamente fisiológico y que induce un rápido y breve efecto insulinosecretor cuando se administra antes de las comidas. Es un producto de reciente incorporación para su empleo en el tratamiento de la diabetes tipo 2 (A-4166).25,26
Hanefeld y otros27 comunican que la nateglinida es efectiva en controlar la hiperglucemia posprandial y el control glucémico en pacientes diabéticos tipo 2, al restaurar la fase temprana de la insulinosecreción.
Mecanismo de acción
El mecanismo de acción de esta droga es similar al de la RP. El tiempo para que produzca su acción es 3 veces más rápido que el de la RP.25,26 Se ha comprobado que con niveles de glucemia normales durante el ayuno, la NT produce una estimulación mínima sobre la insulinosecreción. Esto le confiere ventajas terapéuticas sobre la RP.26 La NT en concentración de 120 mg parece tener el mayor efecto estimulatorio sobre la célula b.26
En síntesis se acepta que la NT:
- Parece tener un efecto significativamente mayor sobre la célula b que la RP.
- Ejerce su acción máxima antes de la primera hora después de su administración (30-45 min).
- Alcanza su pico máximo en plasma antes que la RP y regresa los valores glucémicos a los iniciales alrededor de las 4 h después de su administración.
- Puede ser administrada en un momento más cercano al inicio de las comidas.
Otros agentes insulino secretagogos reguladores prandiales de la glucemia
Podemos mencionar agentes como el BTS 67582, el KAD 1229, El CAS 60875, el U-56324 y la adamantanamida. Estos productos están aun en diferentes fases de ensayo clínico. No existe experiencia suficiente en la literatura que permita profundizar en su farmacocinética y farmacodinámica, pero todos tienen como común denominador el ser secretagogos de la insulinosecreción y que tratan de corregir el fallo insulinosecretorio inicial.
Inhibidores de las alfa glucosidasas
Las amilasas (salivales y pancreáticas) y las alfa glucosidasas son enzimas que participan en la digestión de los almidones. Estas enzimas, atendiendo al tipo de sustrato sobre el que actúan, pueden ser clasificadas en oligosacaridasas y en disacaridasas; ejercen su acción escindiendo las cadenas de disacáridos y oligosacáridos.
Basados en esta cualidad, Puls y otros en el año 1969, sugirieron un nuevo concepto en el tratamiento de la diabetes tipo 2, propusieron que pudiera lograrse una reducción de la hiperglucemia y de la hiperinsulinemia posprandial, a través de la inhibición de las enzimas que degradan los carbohidratos localizados en el tracto digestivo. Es a partir de esa idea que otros iniciaron la búsqueda de estos inhibidores, entre los cuales el más conocido es la acarbosa (AC).28
Acarbosa
La AC es un pseudotetrasacárido inhibidor competitivo reversible de las alfa glucosidasas que están presentes en las células del borde de las vellosidades intestinales (fig. 4).29,30
FIG. 4. Estructura química de la acarbosa.
Mecanismo de acción
La AC produce una disminución de la hiperglucemia posprandial tanto en animales de experimentación como en seres humanos diabéticos y no diabéticos.30-33 En personas no diabéticas y con diabetes, la monoterapia con AC causa una significativa reducción en la liberación posprandial de la insulina.30,31,34,35
Estudios a largo plazo en diabéticos tipo 2 han demostrado que la AC mejora también los niveles basales de la glucemia ya sea como monoterapia o como tratamiento combinado con sulfonilureas;30,31,36,37 sin embargo, parece ser que la disminución de los niveles de hemoglobina glicosilada son ligeros,30,34 algunos autores incluso comunican no haber encontrado reducciones significativas de la misma en el curso del tratamiento con AC.30,31,34,36,38
En pacientes con diabetes tipo 1, el tratamiento a largo plazo con AC también ayuda a mejorar la hiperglucemia posprandial y basal, incluso es capaz de lograr pequeñas reducciones de las dosis de insulina y de HbA1c en grado modesto.30,31
Los inhibidores de las alfas glucosidasas logran estos efectos a través del bloqueo de la digestión de los carbohidratos, al parecer por inhibición selectiva de las disacaridasas en el borde del cepillo intestinal30 y en consecuencia, enlentecen la absorción de la glucosa. Esta acción reduce efectivamente los picos prandiales de la glucosa plasmática y también la concentración de insulina.39,40
Metabolismo
La AC es mayormente degradada en el intestino. Algunos de los productos de la degradación y cantidades mínimas de la droga pasan a la circulación, pero son eliminadas por la orina y por las heces fecales. La AC y sus metabolitos son excretados casi completamente en 1 ó 2 d.31,41
Indicaciones
En general se pudieran considerar como las principales indicaciones de la AC las siguientes:
- Como droga de primera línea en pacientes con diabetes tipo 2 de diagnóstico reciente.37
- Pacientes no bien controlados con otro tipo de tratamiento hipoglucemiante.42,43
- Tratamiento combinado con sulfonilureas, biguanidas o insulina.44,45
- Tratamiento alternativo con sulfonilureas o biguanidas para reducir el riesgo de aparición de hipoglucemias o acidosis láctica, respectivamente.37
- Prevención o retraso en la aparición de la diabetes mellitus tipo 2 en pacientes con tolerancia a la glucosa alterada (TGA).37,46
- Diabéticos tipo 1 para disminuir las necesidades de insulina.44
También podemos considerar una respuesta particularmente satisfactoria al tratamiento con AC en aquellos pacientes diagnosticados con diabetes mellitus con menos de 1 año de evolución de su diabetes y en pacientes no tratados al comienzo de su enfermedad.47
Otras indicaciones a partir de la acción de la acarbosa pueden ser en:
- Pacientes con obesidad exógena.37
- Pacientes con fibrosis quística del páncreas.48
- Tratamiento del síndrome de vaciamiento rápido.49
- Hipoglucemia funcional reactiva (comunicación personal).
- Pacientes con hipertrigliceridemia familiar.50
En un estudio de 2 años con el uso de AC, Mertes y otros51 observaron que la AC disminuye los niveles promedio de la glucemia en ayunas en 2,39 mmol/L, la glucemia posprandial a las 2 h en 3,56 mmol/L y la HbA1 y la HbA1c en 2,0 y 1,1 %, respectivamente.
Laube y otros informan que después de 3 meses de tratamiento con AC confirmaron que el índice proinsulina/insulina disminuyó significativamente. Estos resultados hacen sugerir que la AC es un medicamento protector de la célula b de los islotes pancreáticos.50,52
Muchos autores coinciden en afirmar que la AC ayuda a disminuir significativamente los lípidos sanguíneos, en particular los triglicéridos, después de 4 sem de tratamiento.43,53 Otros señalan que la AC disminuye también los niveles de las VLDL.43,50
Scott y otros53 estudiaron 105 pacientes con diabetes tipo 2 en edades comprendidas entre 36 y 71 años y afirmaron que la AC reduce los niveles de glucemia en ayunas, la hipertrigliceridemia, la HbA1c y limita la respuesta insulínica a la hiperglucemia posprandial.
Se ha comprobado que la AC aumenta y prolonga la liberación del péptido similar al glucagón (GLP-1). El GLP-1 es una hormona secretada en el eje enteroinsular con actividades insulinotrópica y glucagonostática. Es secretado después de la ingestión de nutrientes y producido básicamente por las células del intestino delgado. Es importante conocer que los carbohidratos simples son absorbidos en las porciones altas del aparato digestivo y que el efecto inhibidor de las alfa glucosidasas induce a un aumento y prolongación de la liberación del GLP-1 tanto en sujetos sanos como en diabéticos.54 La exagerada y mantenida liberación de GLP-1 que aparece cuando se administra sacarosa conjuntamente con AC pudiera desempeñar una función importante en la inhibición del vaciamiento gástrico. Una significativa demora en el vaciamiento gástrico pudiera ser otro factor añadido al mecanismo de acción de la AC.49
Contraindicaciones y efectos indeseables
Los inhibidores de las alfa glucosidasas bloquean la digestión de los carbohidratos y, en consecuencia, la absorción de la glucosa.30,55 El excesivo bloqueo de estas enzimas originará, a lo largo del paso por el tubo digestivo, que los azúcares no digeridos se expongan aun más a la fermentación bacteriana y se produzca dióxido de carbono, y mayores cantidades de glucosa osmóticamente activa. Lo señalado anteriormente es uno de los principales factores negativos invocados para explicar el origen de la flatulencia exagerada y las diarreas de los pacientes que utilizan este medicamento.30
Se ha comunicado que la AC induce a la aparición de eritema multiforme generalizado y a eosinofilia. Kono y otros comunican incluso eosinofilia hística y la confirmación de la reacción alérgica en estos casos.56 Otros efectos indeseables señalados son: meteorismo, molestias abdominales y efecto antabuse. Para disminuir los efectos digestivos de la AC se requiere de un manejo apropiado y una dosificación adecuada.30,31
Las molestias abdominales ya referidas, la flatulencia y, en algunos casos, los episodios diarreicos desaparecen frecuentemente en pocos días o semanas después de iniciado el tratamiento. Esta mejoría puede deberse entre otras causas a la mejoría adaptativa del paciente a la dieta, y a los cambios en la actividad enzimática intestinal.30 Aumentando lenta y progresivamente la dosis del medicamento y disminuyéndola con igual cuidado se pueden reducir al máximo, o suprimir incluso, los efectos colaterales digestivos indeseables.30,31,44
Se ha descrito la utilidad del beano en el control de los efectos indeseables de la AC al disminuir la producción de gas intestinal y aumentar la degradación de ciertos carbohidratos antes de alcanzar estos últimos el tracto intestinal inferior. El beano interfiere en la acción reductora de la glucemia determinada por la AC, por las razones antes expuestas se hace necesario una mejor evaluación del control glucémico al momento de usarlo.30,34
En resumen, los principales efectos indeseables o colaterales de la AC son:
- Flatulencia.
- Diarreas.
- Meteorismo.
- Molestias abdominales.
- Efecto antabuse.
- Reacción clínica e histológica a manera de eritema multiforme generalizado.
Recientemente Krahenbuhl 57 llama la atención sobre el efecto hepatotóxico de la combinación de la acarbosa con el acetaminophen, observación que necesita ser confirmada.
Contraindicaciones
- Cetoacidosis diabética.
- Procesos inflamatorios del intestino.
- Colitis.
- Oclusión intestinal o pacientes predispuestos.
- Enfermedades crónicas intestinales asociadas con marcados desórdenes de la digestión o la absorción y otras condiciones que puedan ser responsables de complicaciones dependientes del aumento de la formación de gases intestinales.
- Hipersensibilidad a la droga o alguno de sus componentes.
Dosis
La AC se presenta en tabletas de 50 y 100 mg. Al inicio del tratamiento se sugiere comenzar con dosis a razón de 50 mg inmediatamente antes de cada comida y aumentar la dosis progresivamente cada 6-7 d en cada comida principal, hasta lograr la dosis que permita el control deseado; generalmente la dosis efectiva es de 100 mg antes del desayuno, almuerzo y cena.
Tabla. Terapia combinada con acarbosa
| Tipo de DM | Asociación propuesta | Resultados |
|
Tipo 2 | Acarbosa + metformin | |
| Tipo 2 | Acarbosa + sulfonilureas + metformina | |
| Tipo 2 | Acarbosa + insulina | |
| Tipo 1 | Acarbosa + insulina | No cambios en lípidos No cambios en Hb A1c |
| Tipo 1 | Acarbosa + insulina | No cambios en Hb A1c |
| Tipo 1 | Acarbosa + insulina | No cambios en Hb A1c |
Terapia combinada con acarbosa
En la tabla se resumen las asociaciones propuestas de la AC con otros fármacos, y los resultados obtenidos.
Miglitol
Es un inhibidor competitivo y también reversible de las alfa glucosidasas, pero con una acción más breve que la AC por que la droga es mayormente absorbida desde el intestino delgado.58,59 Este compuesto también logra disminuir la hiperglucemia posprandial en forma efectiva, tanto en diabéticos tipo 1 como en los diabéticos tipo 2, así como en asociación con las sulfonilureas.2,30,31,58
Indicaciones y contraindicaciones
Está indicado en diabéticos tipo 2 con reserva pancreática de insulina conservada que no logran un buen control metabólico con dieta solamente.
Las contraindicaciones son potencialmente las mismas que se señalan para el uso de la AC.
Reacciones adversas
- Flatulencia.
- Diarreas.
- Dolor abdominal.
- Molestias abdominales.
- Rash cutáneo.
El miglitol reduce la absorción de medicamentos como la digoxina, el propranolol y la ranitidina.2,58
Las enzimas digestivas como la amilasa, la pancreatina y el charcoal pueden reducir el efecto del miglitol, por lo que no se recomienda tomarlas conjuntamente con el medicamento.58
Los otros inhibidores de las alfa glucosidasas se encuentran en diferentes etapas de ensayo clínico. La voglibosa es un potente inhibidor selectivo de las alfas glucosidasas.59 El kotalanol es un inhibidor natural extraído de la salasia reticulata, el cual tiene un potente efecto inhibidor para la sacarosa.60
En conclusión, con la introducción de estas drogas llamadas agentes reguladores prandiales de la glucemia aparece un grupo de nuevos medicamentos que tiende, por vías diferentes y diferentes mecanismos de acción, a restaurar la fisiología de la insulinosecreción y la hiperinsulinemia, elementos claves en nuestros días para lograr un mejor control metabólico en nuestros pacientes y en la profilaxis del daño microvascular y macrovascular. Con estos productos igualmente surgen nuevas opciones medicamentosas en el arsenal terapéutico de quienes luchamos junto a nuestros pacientes día a día por prolongar la vida y reducir las complicaciones del síndrome diabético.
Summary
An updated review on a new group of drugs that act by different ways and that regulate postprandial hyperglycemia in diabetic patiens by different mechanisms of action was made. The roles played by repaglinide, an insulin secretagogue agent independent of sulphonilureas that helps to restore the physiology of the failure in the initial insulin secreting peak in type 2 diabetics, and by acarbose, an intestinal alpha-glucosidase inhibitor, were stressed. As postprandial hyperglycemia is determinant in the appearance of vascular complications, it was concluded that these groups of drugs may help to attain a better metabolic control and that they represent new drug options to treat type 2 diabetes mellitus.
Subject headings: HYPERGLYCEMIA/complications; HYPOCLYCEMIC AGENTS.
Referencias bibliográficas
- Wolffenbuttel B, Graal M. New treatment for patients with type 2 diabetes mellitus. Postgrad Med J 1996;36:657-62.
- Bouhanick B, Borutt G, Frossinaud P. Type 2 diabetes: new therapeutic perspectives. Presse Med 1998;27:2015-24.
- Avignon A, Monier L. Las variaciones prandiales de la glucosa contribuyen significativamente al inadecuado control glicémico. Vol Educ Int 2000;2:3-4.
- Graul A, Castañer J. Repaglinide. Drugs 1996;21:694-9.
- Fuhlendorff J. Molecular identification of a specific binding site (36KDA) protein for repaglinide. Diabetes 1998;47(suppl. 1):1594.
- Bokvist K, Hoy M, Poulsen CR. A-4166, but not repaglinide, stimulates Ca+2 - evoked, Katp- channel-independent, secretion in rat pancreatic alpha and b-cells. Diabetologia 1998;41:543.
- Malaisse W. Repaglinide, a new oral antidiabetic agent: a review of recent preclinical studies. Eur J Clin Invest 1999;29(suppl2):21-9.
- Lins L, Brasseur R, Malaisse W. Conformational analysis of the calcium completes formed by meglitinides analogues. Res Commun Mol Pathol Pharmacol 1995;90:153-64.
- Louchami K, Jijakli H, Sener A, Malaisse W. Effect of repaglinide upon nutrient metabolism biosynthetic activity, cationic fluxes and insulin release in rat pancreatic islets. Res Commun Mol Pathol Pharmacol 1998;13:415-24.
- Cromada J. Effects of the hypoglicaemic drugs replaglinide and glibenclamide on ATP-Sensitive potassium-channels and citosolic levels in b TC3 cells and rat pancreatic b cells. Diabetologia 1992;35(Suppl. 1):447.
- Hatorp V, Bayer T. Repaglinide bioavailabilty in the fed or fasting. Diabetes Care 1999;21:102-13.
- Owens DR. Repaglinide-prandial glucose regulator: A new class of oral antidiabetic drug. Diabetic Med 1998;15(suppl 4): S 28, S 36.
- Strange P, Schwartz SL, Graf RG. Pharmacokinetics, pharmacodynamics and dose-response relationship of repaglinide in type 2 diabetes. Clin Ther 1998;20:301-12.
- Moses R, Slobodniuk R, Boyages S, et al. Effect of repaglinide addiction to mettformin monotherapy on glicaemic control in patients with type 2 diabetes. Diabetes Care 1999;22:119-24.
- Ruckie J, Hatorp V, Bayer F. Repaglinide pharmacokinetics in patients with renal impairment versus health volunteers. J Clin Pharmacol 1998;24:31-40.
- Bruce H. A 1 year multicenter randomized double blind comparison of repaglinide and glyburide for the treatment of type 2 diabetes. Diabetes Care 1999;22:463.
- Licea ME- Sulfonilures. En: Licea ME. Tratamiento de la diabetes mellitus. 2da ed. Brasilia:Ideal; 1995:41-8.
- Jovanovic L, Dailey G, Huang WC. Repaglinide in type 2 diabetes: a 24 weeks, fixed-dose efficacy and safety study. J Clin Pharmacol 2000;40:49-57.
- Goldberg RB, Brodows R, Damsbo P. A randomized placebo-controlled trial of repaglinide. Diabetes Res Clin Pract 1998;41:164-69.
- Tronier-B, Marbury T, Damsbo P. A new oral hypoglycaemic agent, repaglinide, minimises risk of hypoglicaemic in well-controlled NIDDM patients. Diabetologic 1995;38 (Suppl 1): A 195.
- Oliver S, Ahmad S, Windfeld K. Pharmacokinetics and bioavailability of repaglinide with type 2 diabetes (NIDDM). Diabetologia 1997;26:101-7.
- Dejgaard A, Kilhoyd B, Lager I. Comparisi on of repaglinide and glipizide in the treatment of type 2 diabetic patients (NIDDM). Diabetes Care 1998;19:121-26.
- Bailey CJ, Turner R. Mettformin. N Engl J Med 1996;334:574-9.
- De Fronzo RA, Goodman A. Efficacy on mettformin in patients with non insulin dependent diabetes mellitus. The Multi-Center Mettformin Study Group. N Engl J Med 1995;333:541-9.
- Karara AH, Dunning BE, Mcleod JR. The effect of food on the oral bioavailability and the pharmacodynamic actions of the insulinotropic agent nateglinide in healthy subjects. J Clin Pharmacol 1999;39:172-9.
- Devineni D, Mcleod F, Prasad P. The pharmacokinetics and pharmacodynamics of nateglinide in relation to meal timing in non insulin dependent diabetes mellitus (niddm) subjects. Diabetes 1998;(Suppl 1): S 143.
- Hanefeld M, Bouter KP, Dickinson S. Rapid and short-acting mealtime insulin secretion with nateglinide control both prandial and mean glycaemia. Diabetes Care 2000;23:202-7.
- Puls W, Keup U. Metabolic studies with an alpha amylase inhibitor (Bay q 7791) on blood glucose, serum insulin and mefa in starch loading test in rat, dogs and man. Diabetologia 1973;9:97-101.
- Chiasson JL, Gomes R, Hanefeld M. The stop-NIDDM trial: an international study on the efficacy of and alpha-glucosidase inhibitors to prevent type 2 diabetes in a population with impaired glucose tolerance: rationale, design, and preliminary screening data. Study to prevent non-insulin dependent diabetes mellitus. Diabetes Care 1998;21:1720-5.
- Pickup J, Williams G. New drugs in the management of diabetes mellitus and its complications. En: Text book of diabetes. 2 ed. 1998;aul 2:84.10-84.29.
- Taylor RH. Alpha-glucosidase inhibitors. En: Bailey CJ, Flatt PR. New antidiabetic drugs. London:Smith-Gordon, 1990:119-32.
- Clissold SP, Edwards C. Acarbose, a preliminary review of its pharmacodynamic and pharmacokinetic properties and therapeutic potencial. Drugs 1988;35:214-43.
- Hillebrand I, Boehme K, Frank G, Fink H, Brechtold P. The effect of the alpha glucosidose inhibitor Bay q 5421 (acarbose) on meal-stimulate elevations of circulating glucose, insulin and triglyceride levels in man. Res Exp Med 1979;175:81-6.
- Lettieri JT, Dain B. Effect of beano on the tolerability and pharmacodinamics of acarbose. Clin Ther 1998;20:497-504.
- Ricarddi G, Giacco R, Parillo M. Efficacy and safety of acarbose in the treatment of type 1 diabetes mellitus: a placebo controlled, double find multicentre study. Diabet Med 1999;16:228-32.
- Hanefeld M, Fischer S, Schulze J. Therapeutic potentials of acarbose as first line drug in NIDDM insufficiently treated with diet alone. Diabetes Care 1991;14:732-7.
- Hoffman J, Spengler M. Efficacy of 24 week monotherapy with acarbose, gibenclamide or placebo in NIDDM patients, the ESSEM study. Diabetes Care 1994;17:561-6.
- Lindstrrom J, Tuomilehto J, Spengler M. Acarbose treatment does not change the habitual diet of patients with type 2 diabetes mellitus. Diabetic Med 2000;17:20-5.
- American Diabetes Association. Standards of medical care for patients with diabetes mellitus (Position Statement). Diabetes Care 1998;21(Suppl 1):523-9.
- Meyer BH, Muller Fo, Clur BK. Effects of tendamistate (alfa Amylase inactivator) on starch metabolism. Br J Clin Pharmacol 1983;16:145-8.
- Hanefeld M. Acarbose efficacy review. Pract Diabetes Suppl 1993;10:521-7.
- Putter J, Keup U, Krause H. Pharmacokinetics of acarbose. Diabetes Care 1981;59:38-48.
- Malaguarnera M, Giugno I, Panebianco MP, Pistone G. Beneficial effect of acarbose on familiar hypertriglyceridemias. Int J Clin Pharmacol Ther 1998;36:441-5.
- Dimitradis GD, Karaiskos C, Raptis S. Effects of prolonged (6 months) alfa glucosidase inhibitors on blood glucose control and insulin requirements in patients with insulin-dependent diabetes mellitus. Horm Metab Res 1986;18:253-5.
- Reaven GM, Landinosis CK, Greenfield MS, Schuartz H, Vreman HJ. Effect of acarbose on carbohydrate and lipid metabolism in NIDDM patients poorly controlled by sulphonilureas. Diabetes Care 1990;13(Suppl 3): 32-6.
- Kado S, Murakami T, Aoki A. Effect of acarbose on posprandial lipid metabolism in type 2 diabetes mellitus. Diab Res Clin Pract 1998;41: 49-55.
- Buse J, Hart K, Mirati L. The project study: final result of a carge multicenter post marketing study in patients with type 2 diabetes. Precose resolution of optimal titration to enhance current therapies. Clin Ther 1998;20:257-69.
- Kentrup H, Bronqers H, Spengler M, Kusembach G, Skopnik H. Efficacy and safety of acarbose in patients with cystic fibrosis and impaired glucose tolerance. Eur J Pediatr 1999;158:455-9.
- Hasegawa T, Yoneda M, Nakamira K. Long term effect of alpha-glucosidase inhibitors on late dumping syndrome. J Gastroenterol Hepatol 1998;13:1201-6.
- Laube H, Linn T, Heyen P. The effect of acarbose on insulin sensitivity and proinsulin in overweight subjects with impaired glucose tolerance. Exp Clin Endocrinol Diabetes 1998;106:231-3.
- Mertes G. Efficacy and safety of acarbose in the treatment of type 2 diabetes: data from a 2 years surveillance study. Diabetes Res Clin Pract 1998;40(1):63-70.
- Miura T, Koide T, Ohichi R, Kako M. Effect of acarbose (alpha-glucosidase inhibitor) on disaccharase activity in small intestine in KK- Ay and DDY mice. J Nutr Sci Vitaminol Tokyo 1998;44(3):371-9.
- Scott R, Lintott CJ, Zimmet P, Campbell L, Bowen K, Welbora T. Will acarbose improve the metabolic abnormalities of insulin-resistant type 2 diabetes mellitus. Diabetes Res Clin Pract 1999;43:179-85.
- Seifarth C, Bergmann J, Holst JJ, Ritzel R, Schmiegel W, Nauck MA. Prolonged and enhanced secretion glucagon like peptide 1(7-36 amide) after oral sucrose due to alpha-glucosidase inhibition (acarbose) in type 2 diabetes patients. Diabet Med 1998;15:485-91.
- Hanefeld M. The role of acarbose in the treatment of non insulin-dependent diabetes mellitus. J Diabetes Complic 1998;12(4):228-37.
- Kono T, Hayami M, Kobayashi H, Ishii M, Taniguchi S. Acarbose-induced generalised erythema multiform (letter). Lancet 1999;354:396-7.
- Krahenbuhl S. Acarbose and acetaminophen a dangerous combination? Hepatology 1999;29:285-7.
- Kingman P, Menhere PP, Sels JP. Alpha glucosidase inhibition by miglitol in NIDDM patients. Diabetes Care 1992;15:478-83.
- Sakane N, Yoshida T, Kogure A, Kondo M. Different effect of acarbose and voglibose on serum 1,5-anhydroglucitol concentration (letter). Diabetes Care 1998;21:465-6.
- Yoshikana M, Murakami T, Yashiro K, Matsuda H. Kotalanol, a potent Alpha-glucosidase inhibitor with thio sugar sulfoniun. Sulfate structure, from antidiabetic ayurvedic medicine Salacia reticulata. Chem Pharm Bull Tokyo 1998;46:1339-40.
Recibido: 7 de noviembre del 2000. Aprobado: 23 de enero del 2001.
Dr. José A. Mesa Pérez. Centro de Atención al Diabético, 17 y D, El Vedado, Ciudad de La Habana, Cuba.
1 Especialista de II Grado en Endocrinología. Director del Centro de Atención al Diabético. Instituto Nacional de Endocrinología.
2 Especialista de II Grado en Endocrinología. Profesor Auxiliar. Investigador.
3 Especialista de II Grado en Endocrinología. Investigador Auxiliar.
4 Especialista de II Grado en Endocrinología. Profesor Asistente.