Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol v.13 n.1 Ciudad de la Habana ene.-abr. 2002
Conferencia
Laboratorio de Reproducción y Metabolismo
Centro de Estudios Farmacológicos y Botánicos (CEF y BO) del Consejo
Nacional de Investigaciones Científicas y Técnicas (CONICET), Buenos Aires, Argentina
Diabetes mellitus experimental: etiología de las malformaciones congénitas en descendientes de ratas diabéticas*
Dra. Élida González
DeCS: DIABETES MELLITUS/genética; DIABETES MELLITUS EXPERIMENTAL/genética; RATAS; ANIMALES DE LABORATORIO; EMBARAZO EN DIABETES; ANOMALIAS; PROSTAGLANDINAS; OXIDO NITRICO.
Subject headings: DIABETES MELLITUS/genetics; DIABETES MELLITUS, EXPERIMENTAL/genetics; RATS; ANIMALS, LABORATORY; PREGNANCY IN DIABETES; ABNORMALITIES/etiology; PROSTAGLANDINS; NITRIC OXIDE.
En el Centro de Estudios Farmacológicos y Botánicos (CEF y BO), del Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET) de Buenos Aires, se realizaron investigaciones básicas orientadas a la reproducción, habiendo llevado a cabo una trayectoria de muchos años en el estudio de la participación de las prostaglandinas en los procesos reproductivos, la influencia del óxido nítrico (NO) en estos procesos y su interrelación con el camino de síntesis y liberación de prostanoides. En ese marco el Laboratorio de Reproducción y Metabolismo, que dirijo, se ha abocado a efectuar estudios paralelos en diabetes mellitus y reproducción. Hemos establecido en numerosos trabajos que la diabetes altera la naturaleza de ovocitos inmaduros, ovulados, fecundados, procesos implantatorios, embrión en desarrollo, placentación, motilidad uterina y parto.
En una rápida introducción, me voy a referir a los agentes vasoactivos moduladores de nuestros procesos, que hemos analizado en detalle.
Prostaglandinas
Estos compuestos poliinsaturados son derivados del ácido araquidónico presente en los fosfolípidos de la membrana celular, donde se encuentra acilado en posición 2. Es liberado de dicha posición por, entre otras y principalmente, la fosfolipasa A2, enzima dependiente de calcio y regulada a su vez por numerosos factores. El ácido araquidónico es luego metabolizado a diferentes prostanoides (PGE2, PGF2a, PGI2, PGD2, PGA2) y leucotrienos (LTB4, LTC4, LTD4).1
La enzima ciclooxigenasa (cox), responsable de la síntesis de prostaglandinas a partir de un endoperóxido precursor, se presenta en 2 isoformas:
- COX1, regula la síntesis de prostaglandinas constitutivas, como la prostaciclina, cuya presencia se encuentra vinculada con el tono vascular, la hemodinamia y la integridad de la mucosa gástrica.
- COX2, inducida por numerosos agentes proinflamatorios y vasoactivos, controla la rápida y elevada síntesis de prostanoides en procesos activos como inflamación, destrucción celular, parto, apoptosis y necrosis pancreática en la diabetes autoinmune, etcétera.
La inhibición selectiva de estos procesos por antiinflamatorios no esteroideos apropiados es uno de los grandes desafíos de la farmacología, pues de esta forma se evitan los efectos colaterales propios de un bloqueo no selectivo de ambas isoformas.2
Las prostaglandinas han mostrado múltiples efectos en todos los procesos reproductivos: participan en la maduración del óvulo, en la ovulación, transporte oviductal, fertilización, implantación, crecimiento embrionario, placentación, flujo fetoplacentario, hemodinamia fetal y materna y trabajo de parto.3-8
Óxido nítrico
El óxido nítrico, molécula pequeña y de vida media corta, pero sumamente difusible y ubicua, es candidato a regular numerosas funciones en el desarrollo fetal y placentario.
Es sintetizado a partir de L-arginina por una reacción catalizada por la enzima óxido nítrico sintasa (NOS), que da por resultado el NO, radical libre, y L-citrulina.9
Numerosos estudios de diferentes laboratorios han implicado al NO en la modulación de una variedad de alteraciones inflamatorias agudas y crónicas, pero también existen evidencias sobre su capacidad de actuar como agente inflamatorio al regular la expresión de moléculas como ICAM-1 o VCAM-1.10,11 De igual modo, el NO tiene un papel importante en el mantenimiento del tono vascular, pero en condiciones patológicas puede inducir un cuadro de shock hipotensivo y mediar procesos apoptóticos y necróticos.12,13 Esta molécula es sumamente reactiva y de alta capacidad combinatoria, y se encuentra presente en numerosos sistemas y procesos fisiopatológicos.
En nuestro grupo de trabajo se ha profundizado en el estudio de las funciones del óxido nítrico entre las que se encuentra: el desarrollo ovocitario, el crecimiento embrionario y los procesos de implantación, así como múltiples interacciones en el desarrollo de la placenta y el trabajo de parto.14-19
La enzima sintetizadora NOS presenta también varias isoformas (iNOS, eNOS, nNOS), la primera de ellas es inducible e independiente de Ca2+ intracelular, y las 2 últimas, Ca2+- dependientes y constitutivas.20 La NOS inducible se hace presente y multiplica su actividad en procesos generalmente patológicos, genera un compartimento de NO que gobierna procesos de muerte celular, inflamación, shock séptico, destrucción pancreática autoinmune, etcétera.
El óxido nítrico ha sido descrito como activador de la enzima guanilato ciclasa, y dirige procesos de vasodilatación y relajación muscular mediante el incremento en la síntesis de GMPc.
Sin embargo, hace unos años, la Dra. Valeria Rettori, integrante de nuestro equipo, trabajando con el Dr. Samuel McCann, analizó el siguiente problema: la liberación de LHRH por hipotálamo medio basal era incrementada por NO; pero este proceso se inhibía en presencia de indometacina, un bloqueante de la enzima sintetizadora de prostaglandinas, y comprobó que la prostaglandina E2 era necesaria como intermediaria de este proceso.21 Esta observación originó una serie de estudios que culminaron con la certeza de que el NO podía activar a la enzima COX, en una vía alternativa independiente de GMPc.6,22,23 Esta vía implica un incremento en la síntesis de prostanoides, luego comprobado en numerosos tejidos y sistemas.
Diabetes Mellitus
La diabetes mellitus ha sido asociada a múltiples alteraciones reproductivas, afecta especialmente la gestación, desde estadios tan precoces como en el número y características de los ovocitos ovulados. Tanto en diabetes humana como en diabetes experimental se han demostrado efectos adversos en el crecimiento del óvulo ovulado y fecundado, número y características del embrión en desarrollo, proceso implantatorio, conducta contráctil uterina, desarrollo placentario, duración de la preñez, trabajo de parto y desarrollo perinatal.24-27
En la enfermedad diabética se ha encontrado una relación directa entre el mal control metabólico y la presencia de hiperglucemia con respecto al incremento de estrés oxidativo del organismo, con elevados niveles de especies reactivas de oxígeno (ROS) en todos los sistemas estudiados.28,29 Un desbalance REDOX provoca el envenenamiento y alteración de todos los compuestos y procesos enzimáticos expuestos.
Asimismo, se encuentra ampliamente descrito un incremento en los niveles de NO en tejidos reproductivos diabéticos, el cual, asociado con la presencia de ROS, provoca una alta concentración de peróxidos de nitrógeno, de efecto igualmente deletéreo.12,30
Por último, el funcionamiento de los vasos y la dinámica circulatoria se ven también alterados por un cambio en la relación entre especies vasodilatadoras y vasoconstrictoras, entre compuestos antiagregantes plaquetarios y aquellos trombogénicos: existen altos niveles de prostanoides, con un incremento en la relación entre tromboxano A2 y prostaciclina.31,32 La generación de prostaglandinas induce y media la formación de ROS en diferentes tejidos. Nuestro grupo de trabajo ha demostrado que los prostanoides, el óxido nítrico y las especies reactivas de oxígeno se regulan positivamente entre sí, lo cual perpetúa el daño pancreático en la diabetes experimental por estreptozotocina y origina la destrucción de las células b en los islotes.28,33,34
Se ha reportado también que el daño oxidativo sobre proteínas y DNA puede ser generado por una activación de la síntesis de prostaglandinas y esos mecanismos han sido propuestos como responsables de daños teratogénicos ocasionados por diferentes drogas sobre el embrión.35,36
En nuestro grupo de trabajo se han desarrollado 2 modelos de diabetes mellitus experimental por estreptozotocina en ratas:
- Diabetes tipo 1: se origina por administración de estreptozotocina (60 mg/kg) a hembras adultas. Entre el segundo y tercer día de la administración, el animal presenta glucemias que oscilan entre 300 y 400 mg/dL. Para los estudios de alteraciones en la gesta, los animales son apareados con machos sanos dentro de las 2 sem de inyección. Luego de este período, se altera irreversiblemente el ciclo estral.
- Diabetes tipo 2: se provoca por administración neonatal de estreptozotocina (100 mg/kg) a las 48 h de vida. El páncreas de estos neonatos sufre una destrucción y regeneración parcial, de lo cual resulta un animal adulto con hiperglucemias moderadas, que oscilan en 150-180 mg/dL en ayunas y ascienden hasta los 300 mg/dL en los 60 min posteriores a una sobrecarga de glucosa de 1,5 g/kg. Estas ratas son apareadas con machos sanos y sus ciclos son regulares durante períodos mayores. Son animales no insulinodependientes, pero presentan alteraciones significativas en sus procesos reproductivos, como veremos luego.
- ¿Qué sucede en nuestras ratas diabéticas con respecto al número y características de ovocitos y embriones?
Los ovocitos obtenidos de los animales descritos se han clasificado en 2 grupos principales:
- Los provenientes de animales en proestro: a) utilizados así como se obtienen a partir de punción de folículos antrales ("ovocitos inmaduros"); b) incubados en una gota de medio de cultivo durante 24 h en estufa gaseada ("madurados in vitro").
- Los provenientes de ratas en estro, obtenidos a partir del ámpula y utilizados directamente ("ovocitos ovulados").
Nuestros estudios se han centrado en el contenido de prostaglandina E por parte de ovocitos y embriones. La razón de este seguimiento reside en que el metabolismo anómalo de ácido araquidónico se encuentra estrechamente vinculado con la presencia de malformaciones. De hecho, la suplementación de ácido araquidónico y PGE2 protege contra las malformaciones diabéticas in vivo e in vitro.37 Muchos estudios han demostrado que la suplementación puede revertir los cambios morfológicos y bioquímicos asociados con malformaciones inducidas por la diabetes, en embriones y en saco de yolk. El agregado in vitro de PGE2, el metabolito mayoritario de ácido araquidónico, también revierte la teratogenicidad inducida por altas concentraciones de glucosa, como ha sido reiteradamente demostrado por Eriksson y otros.36
En estudios realizados sobre complejos ovocito-cumulus provenientes de ratas diabéticas tipo 1 por estreptozotocina observamos que dicho complejo contiene menor cantidad de PGE que las ratas sanas, tanto en ovocitos inmaduros como en madurados in vitro u ovulados, en tanto que la actividad de la enzima NOS es mayor.
Al analizar el efecto del óxido nítrico sobre la actividad de la enzima COX, utilizamos un dador de NO (SIN-1) agregado al medio de incubación. La producción de PGE se incrementa significativamente en ovocitos de animales sanos, y dicho incremento es bloqueado en presencia de inhibidores de la enzima NOS en el medio de incubación. Este efecto no se observa en animales diabéticos.
El agregado de especies capturadoras de ROS al medio de incubación de ovocitos provenientes de ratas diabéticas tipo 1 (enzima superóxido dismutasa, SOD), incrementa significativamente el contenido de PGE en el complejo ovocito-cumulus de animales control y diabéticos, equiparando los niveles de PGE del animal diabético con aquellos hallados en ratas sanas cuando el antioxidante actúa en combinación con un compuesto dador de NO.
Los resultados nos indican que en los complejos ovocito-cumulus de rata diabética tipo 1 existe menor producción de PGE y actividad incrementada de NO, de lo cual inferimos que los niveles disminuidos de PGE parecen correlacionarse con una deficiencia del complejo ovocito-cumulus para responder a la señal activadora de NO sobre COX, probablemente por anomalías en el estado de oxidación de los tejidos diabéticos, especialmente de los ovocitos ovulados por el animal.
Estudios realizados en embriones de ratas sanas y diabéticas
La obtención de embriones se ha realizado mediante 2 modalidades diferentes:
- Incubación de embriones: animales de 10 d de preñez; los embriones han sido separados de tejido uterino, decidua y membranas embrionarias. Posteriormente se ha procedido a incubarlos, durante 60 min en baño metabólico con el agregado de las sustancias en estudio.
- Cultivos embrionarios: animales de 9 d de preñez; los embriones han sido obtenidos y luego incubados in vitro durante 24 h en medio de cultivo con 75 % de suero de rata sana o diabética, según la técnica de New y otros.38 Este modelo ha permitido determinar los efectos del suero materno anómalo sobre el desarrollo embrionario en el período de organogénesis temprana. Destacamos que desde el día 9 al 10 de preñez en la rata, el embrión sufre cambios sorprendentes en su desarrollo, ya que se incrementa significativamente el número de somitas, se lleva a cabo la rotación axial, se visualiza el latido cardíaco y el cierre completo del tubo neural. Por lo expuesto, es de alto valor diagnóstico la visualización de dichos cambios en el período en estudio, así como cualquier variación bioquímica que pueda estudiarse durante esas 24 h.
En estos embriones provenientes de animales diabéticos tipo 1, el contenido de PGE es menor y la actividad de NOS es mayor que en los embriones control, al igual que lo observado para ovocitos.
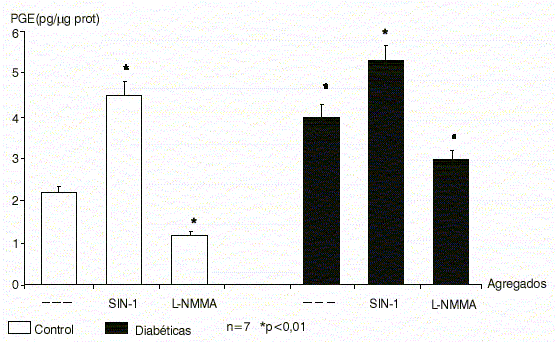
Ni el agregado de generadores de NO ni el bloqueo de la actividad de NOS por L-NMMA provoca un cambio en el contenido de PGE embrionaria en los animales diabéticos, a diferencia de lo que ocurre en embriones provenientes de ratas sanas (figura 1).
Fig.1. Contenido de prostaglandina E embrionaria en diabetes tipo 1: efecto del óxido nítrico.
Fuente: Reprod Fértil Deve-lop;12:141-7.
Procedimos luego a la incubación de embriones de rata sana en presencia de suero de rata diabética tipo 1 (que presenta una concentración de glucosa de aproximadamente 300 mg/dL) durante 24 h en estufa gaseada y con agitador rotatorio. El contenido de PGE es significativamente menor que en aquellos embriones provenientes de madres sanas incubados en presencia de suero de rata control euglucémica. La señal anómala del suero materno ha logrado alterar, en 24 h de exposición, los niveles de PGE dentro de estos embriones que, recordamos, provienen de animales sanos en su noveno día de preñez (figura 2).
Fig.2. Contenido de prostaglandina E en embriones de ratas control y diabéticas tipo 1 y de ratas sanas incubados en presencia de suero control y diabético.
Fuente: Reprod Fértil Develop 2000;12:141-7.
Embriones provenientes de ratas diabéticas tipo 2
Cuando los embriones provienen de ratas diabéticas tipo 2 (aquellas con administración neonatal de estreptozotocina y destrucción pancreática parcial), a pesar de que sus glucemias basales no superan generalmente los 200 mg/dL, existen numerosas anomalías en sus perfiles bioquímicos, así como también alteraciones en el desarrollo embrionario. Existe un número de somitas significativamente menor (9 ± 0,5 vs. 11 ± 0,3) (p < 0,05), y un contenido proteico más bajo (66 ± 4 vs. 35 ±3, p < 0,01), este último es un índice de retraso en su crecimiento y desarrollo. En nuestro modelo hemos detectado un 20 % de reabsorciones, aunque los embriones viables no presentan malformaciones, que sí ocurren en elevado porcentaje en los que provienen de animales diabéticos tipo 1.
El contenido de prostaglandina E en este modelo es, a diferencia de lo que ocurre en animales diabéticos insulinodependientes, significativamente mayor que los controles y la producción de óxido nítrico y la actividad de óxido nítrico sintasa se encuentran incrementadas en embriones diabéticos con respecto a los provenientes de animales control. En este aspecto, los resultados son iguales a los hallados en ratas diabéticas insulinodependientes.
El agregado de generadores nitridérgicos incrementa significativamente los niveles de PGE, tanto en embriones sanos como diabéticos tipo 2 mientras que el bloqueo de la enzima de síntesis de NO provoca una disminución en la producción del prostanoide en ambos casos (figura 3). De lo expuesto se deduce que en los embriones provenientes de ratas no insulinodependientes, el elevado contenido de PGE se correlaciona con un alto nivel de óxido nítrico, cuya producción parece ser regulada por este último. Especulamos sobre la posibilidad de que el alto contenido de prostaglandina E2 implique un mecanismo protector contra el entorno anómalo, con lo cual se evita el desarrollo de malformaciones congénitas que sí encontramos, en cambio, en los embriones de ratas diabéticas 1, en cuyo caso este mecanismo resulta inefectivo.
Fig. 3. Efecto del óxido nítrico sobre el contenido de prostaglandina E de embriones de ratas sanas y diabéticas tipo 2.
Fuente: Reprod Fértil Develop 2000;12:147-7.
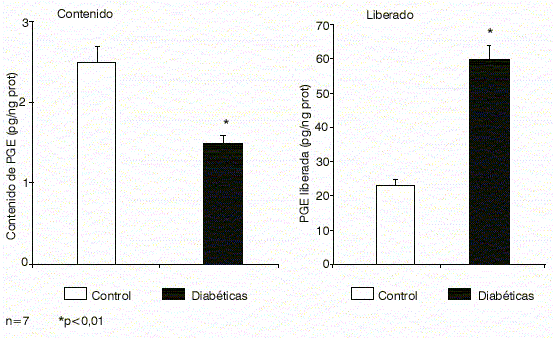
En este punto de nuestros estudios, nos preguntamos si existirían anomalías en cuanto a los mecanismos de síntesis y liberación de PGE por los embriones, o sobre el ritmo de captación y liberación de la prostaglandina por parte de los mismos. Como recordamos, el contenido de PGE es menor en los embriones de ratas diabéticas tipo 1. Cuando se estudian los niveles de PGE liberadas al medio de incubación, observamos en cambio que la liberación es mayor que en los embriones de rata sana; los niveles exteriorizados por los embriones diabéticos tipo 1 son realmente muy altos (figura 4), aún mayores que en las ratas diabéticas tipo 2, que partían de un contenido intraembrionario muy elevado.
Fig.4. Síntesis de prostaglandina E por embriones de ratas sanas y diabéticas tipo 1.
Fuente: Reprod Fértil Develop 2000; 12:141-7.
Concluimos que no existe impedimento en la síntesis del prostanoide por parte del embrión, sino una incapacidad de estos embriones para retener la prostaglandina en su interior. Tal vez sea por un defecto en la estructura de la membrana celular, o por un comportamiento anómalo de transportadores intracelulares. Son necesarios estudios más detallados a fin de dilucidar este aspecto tan interesante.
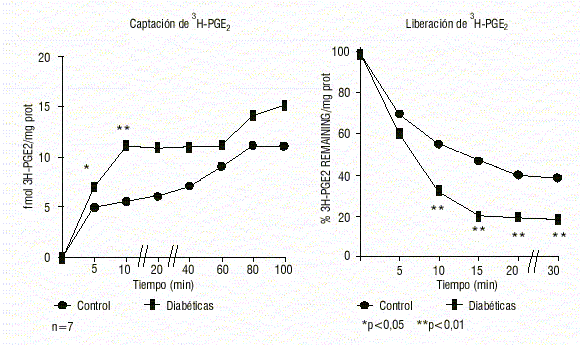
Hemos analizado posteriormente la cinética de captación y liberación de prostaglandina radiactiva por parte de embriones provenientes de animales diabéticos tipo 1 (figura 5). En este experimento se han incubado los embriones de animales de 10 d de preñez con 3H-PGE2 durante 100 min, hemos separado a diferentes tiempos, embriones lavados, para eliminar la pegada inespecífica del compuesto radiactivo, y disueltos en solvente hístico. La radiactividad ha sido evaluada en un contador de centelleo líquido y, luego, cuantificada la cantidad de PGE2 exógena captada por el embrión. En los primeros tiempos del experimento, a los 5 y 10 min, los embriones diabéticos incorporan significativamente mayor cantidad de prostaglandina que los controles sanos (Panel A).
Fig.5. Embriones de ratas sanas y diabéticas tipo 1.
Fuente : Reprod Fértil Develop 2000; 12:141-7.
En el siguiente experimento se han incubado los embriones durante 60 min con 3H-PGE. Al término de dicha incubación, se han cambiado los embriones a medio fresco sin radiactivo y se ha analizado la radiactividad remanente en el conceptus al separar embriones a diferentes tiempos, y proceder luego al conteo de radiactividad.
Los embriones diabéticos presentan un remanente significativamente menor desde los 10 y hasta los 30 min que ha durado el experimento. Es decir, que la pérdida de la prostaglandina exógena, rápidamente captada es también rápidamente llevada a cabo, como si el embrión se viera imposibilitado de retener dentro de sí la PGE necesaria para su desarrollo (Panel B).
En conclusión, los embriones provenientes de ratas diabéticas tipo 1 tienen un menor contenido de PGE, prostaglandina necesaria para modular el crecimiento y desarrollo embrionarios. Estos embriones, sin embargo, producen y liberan 40 veces su contenido en PGE en 1 h. Los experimentos cinéticos sugieren que podría existir una anomalía en la permeabilidad de membrana o una alteración en los transportadores de prostaglandinas.
Quiero finalizar recordando que nuestro interés se halla centrado en identificar los mecanismos modulatorios de estos importantes compuestos vasoactivos en el daño que produce la diabetes en la preñez en estadios realmente precoces, con el fin de contribuir al diseño de conductas terapéuticas diferentes y alternativas de prevención.
Agradecimientos
A las doctoras Alicia Sandra Jawerbaum, Verónica White, María Carolina Pustovrh, Débora Inés Sinner, Evangelina Capobianco y María Esther Castro por su colaboración en la realización de este trabajo.
Referencias bibliográficas
1. Behrman HR, Romero RJ, Prostaglandin and prostaglandin-like products in reproduction:eicosanoids, peroxydes and oxygen radicals. Reprod Endocrinol 1992:238-72.
2. Sirois J, Richards JS. Purifications and characterization of a novel, distinct isoform of prostaglandin endoperoxide synthase induced by human gonadotropin in granulosa cells of rat preovulatory follicles. J Biol Chem 1987;267:6382-8.
3. Gimeno AL, Franchi AM, González ET, Gimeno MF. Progesterone in vitro and the output of prostaglandin F from the uterus of ovariectomized rats. Priming or withdrawal? Prostaglandins Leukot Med 1984;14289-6.
4. Jawerbaum A, González ET, Faletti A, Novaro V, Vitullo A, Gimeno MA. Altered prostanoide reproduction by acumulus-oocyte complexes in a rat model of non-insulin-dependent diabetes mellitus. Prostaglandins 1996;52:209-219.
5. Faletti A, Pérez Martínez S, Perotti C, Gimeno MF. Activity of ovarian nitric oxide sinthase during ovulatory process in the rat: relationship with prostaglandin production. Nitric Oxide 1999; 4:430-7.
6. Herrero MB, Franchi AM, Gimeno MAF. Mouse spermatozoa can synthesize PGE 1 and 5 HETE in vitro: stimulatory action of nitric oxide. Prost Leuk & Essential Fatty Acids 1995;56:347-50.
7. Novaro V, Rettori V, González E, Jawerbaum A, Faletti A, Canteros G, et al. Interaction between uterine PGE and PGF2 alpha production and the nitridergic system during embryonic implantation in the rat. Prostaglandins 1996;51:363-76.
8. Novy MJ Linggins GC. Rol de las prostaglandinas en control fisiológico del parto. Sem Perinatol 1980;4:45-66.
9. Ignarro L, Buga GM, Wood KS, Byrns RE, Chaudhuri G. Endothelium-derived relaxing factor produced and released from artery and vein is nitric oxide. Proc Natl Acad Sci USA 1987;84:9265-9.
10. Peng HB, Libby P, Liao JK. Induction and stabilisation of I kappa B alpha by nitric oxide mediates inhibition of NF-kappa B. J Biol Chem 1995;270:14214-9.
11. Khan BV, Harrison DG, Olbrych MT, Alexander RW, Medford RM. Nitric oxide regulates vascular cell adhesion molecule 1 gene expression and redox-sensitive transcriptional events in human vascular endothelial cells. Proc Natl Acad Sci Usa 1996;93:9114-99.
12. Ding AH, Nathan CF, Stuerhr DJ. Release of reactive nitrogen intermediates and reactive oxygen intermediates from mouse peritoneal macrophages. J Reprod Fert 1988;107:249-54.
13. Wu K. Inducible ciclooxigenase and nitric oxide synthase En: Vascular Biology Research Center and Division of Haematology. Advances in Pharmacology. Vol. 33. The university of Texas Health Science Center of Houston, ed (Houston, Texas 77025: Department of internal medicine) 1996:179-206.
14. Novaro V, González E, Jawerbaum A, Rettori V, Canteros G, Gimeno MAF. Nitric oxide synthase during embryonic implantation. Reprod Fertil Develop 1997;9:557-64.
15. Jawerbaum A, González E, Faletti A Novaro V, Gimeno MAF. Nitric oxide mediates hCG induced prostaglandin E generation in rat oocyte-cumulus complexes. Reprod Fertil Develop 1997;(3):67.
16. Jaberbaum A, González E, Novaro V, Falrtti A, Gimeno MAF. Nitric oxides mediates increased prostaglandin E production by oocyte-cumulus complexes in the non-insulin-dependent diabetic rats. Reprod Fertil Develop 1998;10:185-90.
17. Jawerbaum A, González E, Pustovrh D, Sinner D, Perotti C, Gimeno MA. Diminished levels of prostaglandin E in type I diabetic oocyte-cumulus complexes. Influences of nitric oxide and superoxide dismutase. Reprod Fertil Develop 1999;105-10.
18. Jawerbaun A, Sinner D, White V, Postovrh C, Capobianco E, Gimeno M, et al. Modulation of pg E 2 generation in the diabetic embryo: effect of nitric oxide and superoxide dismutase. Prost Leuk & Ess Fatty Acids 2001;64(2):127-33.
19. González Elida, Jawerbaum A, Novaro V, Sinner D, Gimeno MAF. Nitric oxide modulates placental prostanoide production from late pregnant non-insulin-dependent diabetic rat. Prost Leuk & Ess Fatty Acids 1998;59 (5):299-304.
20. Moncada S, Palmer RM, Higgs EA. Nitric oxide: physiology, pathophysiology, and pharmacology. Pharmacol Rev 1991; 43:109-42.
21. Rettori V, Gimmeno NAF, Lyson D, McCann SM. Nitric oxide mediates norepinephrine induced prostaglandin E2 release from the hypothalamus. Proc Nathl Acad Sci USA 1994;89:22543-4.
22. Salvemini D. Regulation of cyclooxygenase enzymes by nitric oxide. Cell Mol Life Sci 1997;53(7):576-82.
23. Sautebin L, Iatenti A, Ianaro A, DiRosa M. Modulation by nitric oxide of prostaglandin biosynthesis in the rat. Br J Pharmacol 1995;114:323-8.
24. Fox H. Pathology of the placenta in maternal diabetes mellitus. Obsted Gynecol 1969;34:792-8.
25. Galbraith RM, Faulk WP. Immunologic considerations of the materno fetal relationship in diabetes mellitus. En: Merkartz IR, Adams PAI (eds). The diabetic pregnancy: a perinatal perspective. New York: Grune and Stratton; 1979;111-21.
26. Hu L, Lytras A, Bock ME, Yuen CK, Dodd JG, Cattini PA. Detection of placental growth hormone variant and chorionic somatomammotropin-LRNA expression in normal and diabetic pregnancy by reverse transcriptase-polymerase chain reaction. Mol Cell Endocrinol 1999;25:131-42.
27. Morris JM, Gopaul NK, Endresen MJ, Knight M, Linton EA, Dhir S et al. Circulating markers of oxidative stress are raised in normal pregnancy and pre-eclampsia. Br J Obstet Gynaecol 1998;105:1195-9.
28. González Elida, Jawerbaum Alicia, Sinner Debora, Pusttovrh Carolina, Vela Jorge, Xaus Carne et al. Pancreatic nitric oxide and oxygen free radicals in early stages of streptozotocin diabetes mellitus in the rat. Braz J Med Biol Res 2000;33:1335-42.
29. Domínguez C, Gussinye M, Ruiz E, Carrascosa A. Oxidative stress at onset and in early stages of type 1 diabetes in children and adolescents. Diabetes Care 1998;1736-42.
30. Maeda H, Okamoto T, Akaike T. Human matrix metalloprotease activation by insults of bacterial infection involving proteases and free radicals. Biol Chem 1998;379:193-200.
31. González E, Roselló-Catafaut J, Suburo A, Jawerbaum A, Novaro V, Gimeno M. Effect of HDE 140 and L-NAME in metabolic impairment due to strepto zotocin diabetes in rat. Med Sci Res 1996;25:133.
32. González Elida, Roselló-Catafau J, Xaus C, Jawerbaum A, Novaro V, Gómez G, et al. Influence of NOS and Kinin antagonists on metabolic parameters in chronic streptozotocin-induced diabetes mellitus. Prostaglandins 1997;53:321-36.
33. González Elida, Alicia Jawerbaum, Débora Sinner, Carolina Pustovrh, Carme Xaus, Gloria Gómez, et al. Evolution of streptozotocin-pancreatic damage in the rat:modulatory effect of endothelins on nitridergic and prostanoid pathway. Nitric Oxide 1999;3(6):459-66.
34. González Elida, Joan Roselló-Catafau, Alicia Jawerbaum, Jorge Vela, Débora Sinner, Carolina Pustovrh, et al. Involvement of inducible isoforms of COX and NOS in streptozotocin-pancreatic damage in the rat: interactions between nitridergic and prostanoid pathway. Prost, Leuk & Ess Fatty Acids 2001; 64(2):127-33.
35. Wentzel P, Welsh N, Eriksson UJ. Developmental damage, increased lipid peroxidation, disminished cyclooxygenase-2 gene expression and lowered prostaglandin E2 levels in rat embryos exposed to a diabetic environment. Diabetes 1999;48:813-20.
36. Eriksson UJ, Borg H, Fordberg H, Styrud J. Diabetic embryopathy. Studies with animal and in vitro models. Diabetes 1991;40:94-7.
37. Goldman A, Baker L, Piddington R, Marx B, Herold R, Egler J. Hyperglycemia-induced teratogenesis is mediated by a functional deficiency of arachidonic acid. Proc Natl Acad Sci USA 1985;82:8227-31.
38. New DAT. Whole embryo culture and the study of mammalian embryos during organogenesis. Biol Rew 1987;53:81-122.
Recibido: 4 de diciembre del 2001. Aprobado: 26 de diciembre del 2001.
Dra. Elida González. Laboratorio de Reproducción y Metabolismo del Centro de Estudios Farmacológicos y Botánicos (CEF y BO) del Consejo Nacional de Investigaciones Científicas y Técnicas (CONILET), Buenos Aires, Argentina. Correo electrónico: mailto:elidade@arnet.com.ar
* Conferencia impartida en el I Congreso Internacional de Salud Reproductiva en Diabetes Mellitus (SAREDIA 2000).