Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol v.13 n.3 Ciudad de la Habana sep.-dic. 2002
Trabajos originales
Instituto Nacional de Endocrinología
Glucemia, insulinemia y secreción de insulina en ratas hembras prepúberes hiperandrogenizadas e hiperestrogenizadas
Lic. Aimée Álvarez Álvarez,1 Lic. Eulises Díaz Díaz,2 Lic. Elisa M. Castells Martínez,3 Dra. Beatriz Huguez Hernandorena4 y Dr. Roberto M. González Suárez5
Resumen
En trabajos publicados previamente, realizados con distintos modelos experimentales de ratas, se halló una asociación entre la hiperandrogenización y la resistencia a la insulina caracterizada por hiperinsulinismo que, en ocasiones, se acompañaba de un deterioro de la tolerancia a la glucosa. Para obtener información adicional sobre el efecto de los esteroides sexuales sobre los mecanismos de regulación de la glucemia, se estudió el efecto de la administración de dosis altas de enantato de testosterona y de benzoato de estradiol en ratas hembras prepúberes, sobre el comportamiento de la glucemia y la insulinemia in vivo, durante una prueba de tolerancia a la glucosa. Adicionalmente se exploró in vitro, la capacidad de secreción de insulina estimulada por glucosa de los islotes de Langerhans de estas ratas hiperandrogenizadas e hiperestrogenizadas. Se encontró que la hiperandrogenización se acompañaba de un estado de resistencia a la insulina caracterizado por hiperinsulinemia, que se correspondía con un aumento de la capacidad de secreción de insulina de los islotes de Langerhans. Sin embargo, la hiperestrogenización de estas ratas prepúberes hembras no produjo cambios en los perfiles de la glucemia, de la insulinemia ni en la capacidad de secreción de insulina de los islotes de Langerhans estimulados con concentraciones de glucosa cercanos al rango fisiológico. Se concluyó que en este modelo experimental la hiperandrogenización produce un deterioro de la sensibilidad a la insulina.
DeCS: HIPERANDROGENISMO; RESISTENCIA A LA INSULINA; HIPERINSULINISMO; INTOLERANCIA A LA GLUCOSA; ISLOTES DE LANGERHANS; ESTEROIDES; SEXO.
En los últimos años se ha hecho evidente que los esteroides sexuales, además de su conocido papel en los procesos reproductivos, desempeñan una función importante en el metabolismo energético , particularmente sobre la secreción de insulina y sobre la acción de esta hormona. Se ha reportado la aparición del hiperinsulinismo y la disminución de la tolerancia a la glucosa asociados a cambios en las concentraciones de estradiol y progesterona durante el embarazo;1 la disminución de las concentraciones de glucosa e insulina en ayunas, así como la reducción de la incidencia de la diabetes por efecto de la terapia hormonal de reemplazo en mujeres posmenopáusicas.2,3 Al estradiol se le atribuye un importante papel en el mantenimiento de la sensibilidad a la insulina,4 se sabe que existe una variación de la sensibilidad a la insulina durante el ciclo menstrual en la mujer.5
Por otro lado, se plantea que los andrógenos están involucrados en la etiología de varias enfermedades en las que se verifican problemas de la homeostasis de la glucemia, como en el hirsutismo y el síndrome de ovarios poliquísticos (SOP);6,7 se ha demostrado la aparición de resistencia a la insulina en hombres y mujeres sanos tratados con un exceso de hormonas androgénicas.8,9 Adicionalmente, se ha descrito una disminución de la sensibilidad a la insulina por un defecto del metabolismo periférico de la glucosa, durante la pubertad normal.10 El dimorfismo sexual en la incidencia de la diabetes, encontrado en modelos experimentales en animales,11-13 es otro elemento que se suma a la serie de evidencias que sugieren la participación de las hormonas esteroides sexuales en el metabolismo hidrocarbonado.
No obstante, la importancia que los esteroides sexuales parecen tener en el control del metabolismo energético, los mecanismos moleculares involucrados en esta acción no han sido completamente dilucidados.
En trabajos previos de este grupo sobre el tema, se encontró una disminución de la sensibilidad a la insulina en ratas machos prepúberes hiperandrogenizadas14 y un deterioro de la tolerancia a la glucosa en ratas machos adultas hiperandrogenizadas,15 así como un aumento de la sensibilidad a la insulina en ratas machos adultas castradas.15
En este trabajo nos propusimos estudiar el efecto de una dosis alta de enantato de testosterona o de benzoato de estradiol en ratas hembras prepúberes in vivo, sobre las modificaciones de la glucemia y la insulinemia durante una PTG y, simultáneamente, in vitro, el efecto sobre la capacidad de secreción de insulina de los islotes de Langerhans de estas ratas hembras prepúberes hiperandrogenizadas o hiperestrogenizadas.
Este modelo permite examinar el efecto de la dosis de hormona administrada con un mínimo de interferencia por la secreción endógena de otras hormonas esteroides sexuales.
Métodos
Para el estudio utilizamos ratas Wistar hembras prepúberes de 1 mes que pesaban entre 70 y 80 g. Establecimos 3 grupos experimentales de al menos 6 ratas cada uno: I- ratas controles, II- ratas tratadas con testosterona y III- ratas tratadas con estradiol. Para los tratamientos con testosterona y estradiol se les suministró una dosis única de 5 mg/ rata de enantato de testosterona o 200 mg/rata de benzoato de estradiol, por inyección intramuscular utilizando como vehículo 1 mL de aceite vegetal. A las ratas controles sólo se les inyectó 1 mL de aceite vegetal por vía intramuscular. Los experimentos se realizaron 48 h después del tratamiento con testosterona y 24 h después del tratamiento con estradiol. Los experimentos para cada tratamiento se repitieron al menos 3 veces. Los valores de estradiol y de testosterona de cada grupo experimental se determinaron por radioinmunoensayo (RIA); se utilizaron los kits del WHO, Matched Reagent Programme, estandarizados en las condiciones de nuestro laboratorio,16 con sensibilidad de 0,2 nmol/L para el RIA de testosterona y de 6,1 pmol/L para el RIA de estradiol.
Prueba de tolerancia a la glucosa (PTG)
Para realizar la prueba administramos glucosa a razón de 3 g por kg de peso, por inyección intraperitoneal. La sangre para las determinaciones de insulina y glucemia la obtuvimos de la arteria retroorbital antes, 15, 30, 60 y 120 min después de la administración de glucosa y la recogimos sobre heparina.17 Determinamos la glucemia por el método de la glucosa oxidasa18 y cuantificamos la insulinemia por RIA.19
Obtención y estimulación de islotes de Langerhans
Aislamos los islotes según modificación del método de Lacy.20 Extrajimos el páncreas de rata e inmediatamente le eliminamos la grasa en una placa Petri con tampón Krebs-Ringer-Bicarbonato (KRB) (NaCl 118 mM; KCl 6,2 mM; MgSO4 1,5 mM; KH2PO4 mM; NaHCO3 32,2 mM; pH 7,4, suplementado con Hepes 10 mM, albúmina de suero bovino 0,2 % y glucosa 3,3 mM), sobre hielo.
Realizamos la digestión del páncreas en 5 mL de tampón KRB con 12 mg de colagenasa (sigma con actividad específica de 437 µ/mg), con agitación manual, a 37 °C durante 20 - 30 min. Una vez terminada la digestión hicimos 3 lavados con tampón KRB para eliminar la colagenasa y transferimos el tejido digerido a una placa Petri de fondo oscuro; aislamos manualmente los islotes libres de colágeno con una pipeta Pasteur bajo microscopio estereoscópico.
Para los experimentos de estimulación empleamos 20 islotes por tubo en 0,5 mL de tampón KRB con 3-isobutil-metilxantina (IBMX) 0,1 mM, que es un inhibidor de la fosfodiesterasa de AMPc y es capaz de potenciar la respuesta secretora de los islotes, más glucosa en concentración final de 1,65; 9,9; 18,9 y 34,9 mmol/L. Incubamos los islotes a 37 °C con agitación, durante 1h, con atmósfera de carbógeno (95 % O2- 5 % CO2 ) . Tomamos 500 µL del sobrenadante para determinar insulina por RIA.
Procesamiento estadístico de los datos
Procesamos los resultados mediante la prueba no paramétrica de suma de rangos para 2 grupos de Wilconxon, con un nivel de significación de p < 0,05. Se calculó el área bajo la curva por integración trapezoidal de los valores de todos los puntos.
Resultados
Los niveles plasmáticos de testosterona fueron de 0,2 ± 0,08 nmol/L para el grupo de ratas controles y de 25 ± 3,9 mmol/L para el grupo de ratas tratadas con testosterona (48 h después del tratamiento), por lo cual consideramos que, en el momento en que realizamos los experimentos, las ratas de este último grupo estaban hiperandrogenizadas, incluso con respecto a la ratas machos adultas para los que se han reportado valores basales de testosterona de 4 nmol/L.15
Los niveles plasmáticos de estradiol fueron no detectables en el grupo de ratas controles (la sensibilidad del RIA utilizado fue de 6,1 pmol/L ) y de 1 285 ± 48 pmol/L para el grupo de ratas tratadas con estradiol (24 h después del tratamiento ), por lo cual consideramos que en el momento en que se realizaron los experimentos, las ratas de este último grupo estaban hiperestrogenizadas.
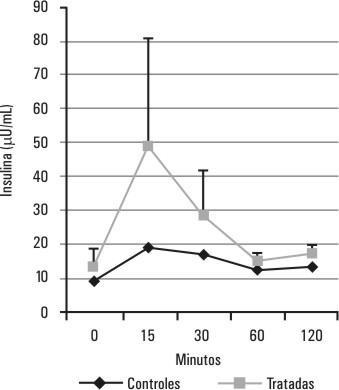
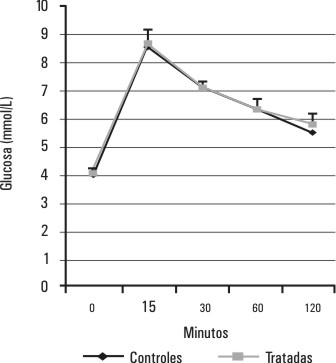
El comportamiento de la glucemia y la insulinemia durante la PTG en el grupo de ratas tratadas con testosterona se muestra en las figuras 1 y 2. Este grupo de ratas hiperandrogenizadas mantiene los niveles de glucemia semejantes a los del grupo control (p > 0,05 para la diferencia de áreas bajo la curva), a costa de un aumento significativo (p < 0,05 para la diferencia de áreas bajo la curva) de los valores de la insulinemia con respecto al grupo control, principalmente en los primeros 30 min de la PTG.
FIG. 1. Efectos del tratamiento con testosterona sobre la glucemia durante la PTG. Se muestra el comportamiento de la glucemia durante una PTG realizada 48 h después del tratamiento con testosterona, p > 0,05 (p=0,3) para la diferencia de áreas bajo las curvas correspondientes al grupo de ratas tratadas y al de ratas controles.
FIG. 2. Efectos del tratamiento con testosterona sobre la insulinemia durante la PTG. Se muestra el comportamiento de la insulinemia durante una PTG realizada 48 h después del tratamiento con testosterona, p < 0,05 (p=0,02) para la diferencia de áreas bajo las curvas correspondientes al grupo de ratas tratadas y al grupo de ratas controles.
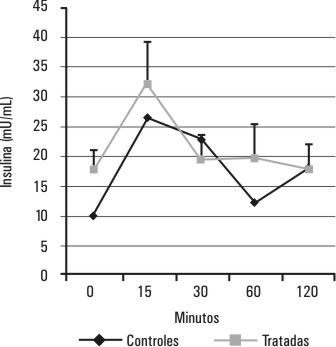
Los valores de la glucemia y la insulinemia del grupo de ratas tratadas con estradiol se muestran en las figuras 3 y 4 . En este grupo de ratas, la hiperestrogenización no induce cambios en los perfiles de glucemia (p > 0,05 para la diferencia de áreas bajo la curva) y de insulinemia (p > 0,05 para la diferencia de área bajo la curva ) durante la PTG.
FIG. 3. Efectos del tratamiento con estradiol sobre la glucemia durante la PTG. Se muestra el comportamiento de la glucemia durante una PTG realizada 24 h después del tratamiento con benzoato de estradiol, p > 0,05 (p=0,3) para la diferencia de áreas bajo las curvas correspondientes al grupo de ratas tratadas y al de ratas controles.
FIG. 4. Efectos del estradiol sobre la insulinemia durante la PTG. Se muestra el comportamiento de la insulinemia durante una PTG realizada 24 h después del tratamiento con estradiol, p > 0,05 (p=0,067) para la diferencia de áreas bajo las curvas correspondientes al grupo de ratas tratadas y al de ratas controles.
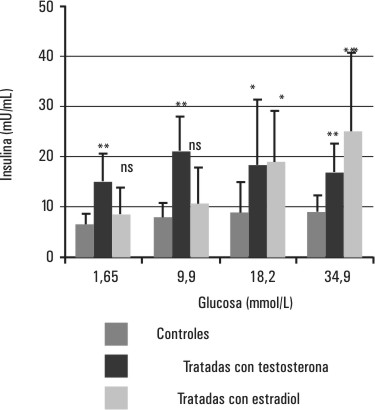
En la figura 5 se muestran los resultados del estudio in vitro de la capacidad de secreción de insulina de los islotes de Langerhans. Los islotes de las ratas tratadas con testosterona (hiperandrogenizadas) muestran un incremento significativo (p < 0,05 y p < 0,01) de la capacidad de secreción de insulina para todas las concentraciones estimulatorias de glucosa ensayadas con respecto a las ratas controles. Sin embargo, los islotes de las ratas tratadas con estradiol (hiperestrogenizadas) muestran un aumento significativo (p < 0,05 y p < 0,01) de la secreción de insulina solo en presencia de concentraciones estimulatorias de glucosa altas (18,2 y 34,9 mmol/L), las cuales son muy superiores al rango fisiológico.
FIG. 5. Efectos del tratamiento con testosterona y estradiol sobre la secreción de insulina de los islotes de Langerhans. Se muestra la secreción de insulina de los islotes de Langerhans de 3 grupos de ratas (tratadas con testosterona, tratadas con estradiol y controles) incubados en presencia de diferentes concentraciones de glucosa (1,6; 9,90; 18,20; 3,.9 mmol/L) durante 1 h a 37 ° C y con agitación.
ns- no significativa, * p < 0,05, ** p < 0,01.
Discusión
A los estrógenos se les atribuye un efecto positivo en el mantenimiento de la sensibilidad a la insulina,2-4 mientras que el exceso de andrógenos se asocia con estados en los que la sensibilidad a la insulina está disminuida.6,7,9 Posiblemente, la correlación entre estrógenos y andrógenos activos desempeñe un papel importante en la susceptibilidad al desarrollo de la diabetes,21 en la cual la disminución de la sensibilidad a la insulina constituye uno de los componentes fundamentales.
En ratas prepúberes, las concentraciones basales de testosterona (0,20 mmol/L) y de estradiol (no detectables por RIA) son muy bajos , por lo cual la utilización de estos modelos experimentales con ratas prepúberes nos permitió estudiar el efecto de la hiperandrogenización y de la hiperestrogenización prácticamente en ausencia de estrógenos y de andrógenos endógenos, respectivamente.
El comportamiento de las curvas de glucemia y de insulinemia durante la PTG de las ratas tratadas con testosterona (figs. 1 y 2) muestra un deterioro de la sensibilidad a la insulina caracterizado por un incremento estadísticamente significativo (p < 0,05) de los requerimientos de insulina (fig. 2) para mantener los niveles de la glucemia similares a los de los controles (fig. 1), de forma tal que en estas ratas prepúberes hiperandrogenizadas, la disminución de la sensibilidad a la insulina es compensada con un aumento de los niveles de insulina circulante de forma similar al reportado anteriormente para ratas machos prepúberes hiperandrogenizadas,14 no así para las ratas machos adultas en las cuales un esquema similar de androgenización origina no solo resistencia a la insulina con hiperinsulinismo sino también intolerancia a la glucosa con alteración de los valores de la glucemia durante la PTG.15 Por otra parte, la capacidad de secreción de insulina, in vitro, de los islotes de Langerhans de las ratas hembras prepúberes tratadas con testosterona está aumentada (fig. 5), lo cual podría ser parte del mecanismo compensatorio de la resistencia a la insulina que desarrollan estas ratas prepúberes como resultado de la hiperandrogenización. Un aumento similar de la capacidad secretora de insulina de los islotes de Langerhans fue encontrado en ratas machos adultas hiperandrogenizadas15 y en cultivos de islotes de ratas tratadas con 1 µg/mL de testosterona.22 Sin embargo, un esquema similar de hiperandrogenización en ratas machos prepúberes no produjo cambios en la capacidad secretora de insulina de los islotes pancreáticos, a pesar del aumento en los requerimientos de los niveles de insulina circulante para mantener los valores normales de la glucemia,14 lo cual hace pensar que este efecto se debe a mecanismos distintos al explorado en este estudio.
Si bien está descrito una disminución de la internalización y de la utilización de la glucosa en ratas hembras adultas ovariectomizadas, la hiperestrogenización de las ratas hembras prepúberes no provocó cambios en los requerimientos de insulina para mantener la glucemia en un nivel similar al de las ratas controles (figs. 3 y 4). En correspondencia con estos resultados, tampoco se encontraron cambios en la capacidad secretora de insulina de los islotes pancreáticos in vitro, a concentraciones de glucosa cercanos al rango fisiológico (1,65 y 9,9 mmol/L), por lo que parece ser que, al menos en las ratas hembras prepúberes, la hiperestrogenización sola no produce cambios en la sensibilidad a la insulina. El aumento significativo de la capacidad de secreción de insulina de los islotes de estas ratas hembras hiperestrogenizadas, que aparece a concentraciones estimulatorias de glucosa altas (18,2 y 34,9 mmol/L) podría estar dado por la expresión de un efecto sinérgico del estradiol y la glucosa (a concentraciones por encima del rango fisiológico). Nadal y otros, en un estudio de estimulación de islotes de Langerhans, han reportado un sinergismo entre el 17 b estradiol y la insulina que se hace evidente solamente a altas concentraciones de glucosa.23
La utilización de este modelo experimental de ratas hembras prepúberes hiperandrogenizadas e hiperestrogenizadas pudiera ser útil para examinar el poco conocido papel de la regulación hormonal de la secreción de insulina y, en particular, el de las hormonas esteroides sobre el metabolismo energético, lo que brindaría información útil para la comprensión de fenómenos de la práctica clínica asistencial como la terapia de reemplazo hormonal utilizada en la menopausia y en el hipogonadismo, la terapia contraceptiva, y también para el estudio del efecto de los xenoestrógenos o compuestos químicos ambientales con efecto estrogénico sobre el metabolismo hidrocarbonado.
Summary
In previously published studies conducted with different experimental models of rats, it was found an association between hyperandrogenization and insulin resistance characterized by hyperinsulinism that, on occasions, was accompanied by glucose tolerance deterioration. To obtain additional information on the effect of sexual steroids on the glycemia regulation mechanisms, it was studied the effect of the administration of high doses of testosterone enanthate and of estradiol benzoato in prepuberal rats on the behavior of glycemia and insulinemia in vivo during a glucose tolerance test. Besides, it was explored in vitro the capacity of the islets of Langerhans of these hyperandrogenized and hyperestrogenized rats for secreting insulin stimulated by glucose. It was found that hyperandrogenization was accompanied by a state of insulin resistance characterized by hyperinsulinemia that corresponded to an increase of the capacity of the islets of Langerhans to secrete insulin. However, the hyperestrogenization of these prepuberal rats did not produce changes either in the profiles of glycemia and insulinemia or in the capacity of the islets of Langerhans to secrete insulin stimulated by glucose concentrations near the physiological range. It was concluded that hyperandrogenization produces a deterioration of sensitivity to insulin in this experimental model.
Subject headings: HYPERANDROGENISM; INSULIN RESISTANCE; HYPERINSULINISM; GLUCOSE INTOLERANCE; ISLETS OF LANGERHANS; STEROIDS; SEX.
Referencias bibliográficas
- Kuhl C. Serum insulin and plasma glucagon in human pregnancy. On the pathogenesis of gestational diabetes. Acta Diabetol Lat 1997;14:1-8.
- Barret-Connor E, Laasco M. Ischemic heart disease risk in postmenopausal women. Effects of estrogen use on glucose and insulin levels. Arteriosclerosis 1990;10:531-4.
- Hammond CB, Jelousek FR, Lee KL, Creasman WT, Parker RT. Effects of long term estrogen replacement therapy. Metabolic effects. Am J Obstet Gynecol 1979;133:525-36.
- Kumagai S, Holmang A, Bjorntorp P. The effect of estrogen and progesterone on insulin sensitivity in female rats. Acta Endocrinol Scand 1993;149:91-7.
- Escalante PJM, Alpizar SM. Changes in insulin sensitivity, secretion and glucose effectiveness during menstrual cycle. Arch Med Res 1999;30:19-22.
- Poretsky L. On the paradox insulin-induced hyperandrogenism in insulin resistant states. Endocr Rev 1991;12:3-13.
- Buffington CK, Kitabchi A. Evidence for defect in insulin metabolism in hyperandrogenesis women with polycystic ovarian syndrome. Metabolism 1994; 43:1367-72.
- Bjorntorp P. Metabolic effect of body fat distribution. Diabetes Care 1991;14:1132-43.
- Podelrman KH. Insulin induction of insulin resistance by androgen and estrogen. J Clin Endocrinol Metab 1994;79:265-71.
- Amiel SA, Caprio S, Sherwin RS, Plewe G, Haymond MW, Tamborlane WV. Insulin resistance of puberty a defect restricted to peripheral glucose metabolism. J Clin Endocrinol Metab 1991;72:277-80.
- Shi K, Mizuno A, Sano T, Ishida K, Shima K. Sexual differences in the incidence of Diabetes Mellitus in Otsuka-Long-Evans-Tukushima-fatty rats: effects of castration and sex hormones replacement on its incidence. Metabolism 1994;43:1214-20.
- Efrat S. Sexual dimorphism of pancreatic beta cell degeneration in transgenic mice expressing an insulin-rats hybryd gene. Endocrinology 1994;128:897-901.
- Kawano K, Hirashima T, Mori S, Saitoh Y, Kurosumi M, Natori T. Spontaneous long term hyperglicemic rat with diabetic complications. Otsuka Long Evans Tokushima Fatty ( OLEFT) strain. Diabetes 1992;41:1422-8.
- Álvarez A, Díaz E, Castell E, González RM. Glucemia, insulinemia y secreción de insulina en ratas machos prepúberes hiperandrogenizadas e hiperestrogenizadas. Rev Cubana Endocrinol 2001;12:15-21.
- Álvarez A, Díaz E, Huguez B, González RM. Glucemia, insulinemia y secreción de insulina en ratas hipoandrogenizadas e hiperandrogénicas. Rev Cubana Endocrinol 1999;10:133-9.
- Sufi SB, Donaldson A, Jeffcoate SL. Who matched reagent programme steroid radioimmunoassay. Method manual. 21 ed. HRP. London: United Kingdom, 1999:25-35, 47-56.
- Deas M, Menéndez R, Álvarez A, González RM. Efecto hipoglicemiante de la Albahaca Morada sobre la glicemia y la insulinemia en modelos animales. Rev Cubana Invest Biomed 1988;7(1):53-9.
- Trinder P. Determination of glucose in blood using glucose oxidase with an alternative oxygen acceptor. Ann Clin Biochem 1969;6:24-7.
- Arranz MC, González RM. Utilización de un método rápido para la separación de la hormona libre y unida en el radioinmunoensayo de insulina. Rev Cubana Biomed 1989;17(3):150-6.
- Lacy PE, Kostianovsky M. Method for the isolation of intact islets of Langerhans from the rat pancreas. Diabetes 1967;16:15-23.
- Turevsky AA, Mozheiko LA. Morphological and morphometric characterization of the pancreatic endocrine system in different levels of ovarian hormones. Problems of Endocrinology 1990;36(6):1231-6. .
- Morimoto LS. Efecto de los esteroides sexuales sobre la síntesis y liberación de insulina en la rata: Estudios in vivo e in vitro. Tesis para obtener el grado de Doctor en Ciencias Fisiológicas, México: Universidad Nacional Autónoma de México. Colegio de Ciencias y Humanidades. Unidad Académica de los ciclos de profesional y de posgrado. Centro de Neurobiología, 1999.
- Nadal A, Rovira JM, Laribi O, León Quinto T, Andreu E, Ripoll C, Soria B. Rapid insulinotropic effect of 17 b-estradiol via plasma membrane receptor. FASEB J 1998;12:1341-8.
Recibido: 10 de mayo de 2002. Aprobado: 15 de julio de 2002.
Lic. Aimee Álvarez Álvarez. Instituto Nacional de Endocrinología, Zapata y D, El Vedado, Ciudad de La Habana, Cuba.
1 Licenciada en Bioquímica. Investigadora Agregada.
2 Licenciado en Bioquímica. Aspirante a Investigador.
3 Licenciada en Bioquímica.
4 Médico Veterinario. Responsable del Vivario.
5 Doctor en Ciencias Médicas. Investigador Titular. Profesor Titular.