Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol v.15 n.2 Ciudad de la Habana Mayo-ago. 2004
Presentación de casos
Hospital Pediátrico Docente "William Soler"
Síndrome de Prader-Labhart-Willi y apnea durante el sueño. A propósito de 3 pacientes
Dr. Pedro González Fernández,1 Dr. Gonzalo Pin Arboledas2 y Dra. Raquel Cabrera Panizo3
Resumen
El síndrome de Prader-Labhart-Willi (SPW) es una entidad que se asocia a trastornos respiratorios durante el sueño, lo que puede tener consecuencias fatales para la vida. Se presentan 3 pacientes con diagnóstico de SPW: 2 del sexo masculino y 1 del femenino. El diagnóstico en todos ellos fue confirmado después de los 2 años de edad. Los hallazgos clínicos más relevantes fueron: talla y peso corporal normal al nacimiento así como hipotonía muscular. En 2 pacientes la obesidad se inició después de los 2 años de edad y en el otro a los 18 meses de nacidos. La acromicria y retraso mental moderado estuvo presente en los 3 pacientes. Los resultados de los cariotipos por técnica de bandas fueron 46XY para los del sexo masculino y 46XX para la del femenino. Los 2 pacientes del sexo masculino presentaron episodios de apnea durante el sueño (Sleep Apnea Syndrome), lo que ocasionó el fallecimiento de ambos por paro respiratorio antes de los 12 años de edad. Se recomienda la vigilancia estrecha de estos pacientes, principalmente durante las infecciones respiratorias y las crisis de asma bronquial.
Palabras clave: Prader-Willi, apnea durante el sueño, obesidad, sueño.
El síndrome de Prader-Labhart-Willi (SPW) fue descrito por primera vez en 9 niños por A. Prader, A. Lebhart y H. Willi en 1965. Hasta el momento se han descrito aproximadamente 500 pacientes con este síndrome.1
Es conocido que los pacientes con SPW tienen una mayor predisposición a padecer de enfermedades respiratorias, entre otras afecciones,2 pero solo en los últimos años se ha señalado la existencia de una mayor probabilidad de sufrir de trastornos respiratorios durante el sueño, incluyendo la apnea (sleep apnea syndrome), lo que eleva el riesgo de sufrir paro respiratorio y muerte si se compara con la población normal.3-4
La obstrucción de la vía aérea superior en el niño puede manifestarse como una apnea obstructiva completa o como una obstrucción parcial con hipoventilación (hipoapnea), lo que resulta de la obstrucción parcial continua, la cual ocasiona una respiración paradójica, hipercapnea y a menudo hipoxemia. La fragmentación del sueño, el incremento del esfuerzo respiratorio y las anomalías intermitentes en los gases sanguíneos son las consecuencias fisiológicas inmediatas más frecuentes, así como un incremento de la resistencia de la vía aérea que ocurre con el inicio del sueño.5
La importancia que tiene conocer este aspecto del síndrome, su manejo y la escasez de publicaciones acerca de este tema es el motivo de la presentación de estos 3 pacientes, con el objetivo de alertar y tomar las precauciones necesarias para prevenir resultados fatales.
Observación clínica
Paciente 1
Paciente MAP. Edad 16 años. Antecedentes familiares sin interés clínico. Se realizó diagnóstico de SPW a los 6 años de edad. Ingresó en nuestro servicio en 1996 para perder peso, por lo que se inició dieta isocalórica. Se logró pérdida de peso de 1 kg durante los 15 días de ingreso. Se observó durante el sueño ronquido que ocupó más del 30 % del tiempo nocturno de sueño, así como episodios de apnea y somnolencia diurna, los que se determinaron por observación clínica durante los ingresos y en la casa. Ha tenido repetidos episodios de infecciones respiratorias altas. Se le realizaron análisis complementarios de rutina durante el ingreso que incluyeron: hemograma, velocidad de eritrosedimentación y electroencefalograma, entre otros, con resultados normales (fig. 1).
Paciente 2
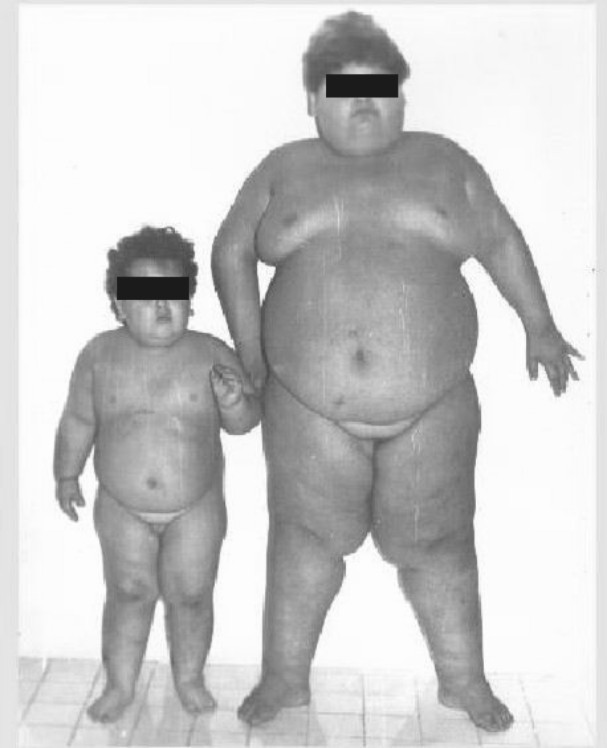
Paciente KMS. Edad 10 años. No se hallaron antecedentes familiares de interés. Se realizó diagnóstico de SPW a los 5 años de edad. Hubo ingresos repetidos en nuestro servicio por motivo de obesidad y tratamientos infructuosos para perder peso. Solo se logró mantener el peso inicial durante los ingresos. Somnolencia diurna marcada y trastornos respiratorios durante el sueño, los que se determinaron por observación clínica durante los ingresos y en la casa. En los últimos 2 ingresos, además de los ronquidos, presentó períodos prolongados de apnea durante el sueño que, en reiteradas ocasiones, requirió su traslado a la Unidad de Cuidados Intensivos (UTI). Falleció al mes del alta del último ingreso por paro respiratorio durante le sueño (fig. 2 izquierda).
Paciente 3
Paciente ALP. Edad 4 años. Diagnóstico de SPW a los 3 años de edad. Antecedentes maternos de asma bronquial. 2 ingresos en nuestro servicio por obesidad. Asma bronquial desde el primer año de edad, controlada con tratamiento por la especialidad de alergología con cromoglicato disódico entre las crisis de asma y con aminofilina via oral y salbutamol en jarabe durante las crisis. Ronquidos que ocupaban más del 30 % del tiempo de sueño nocturno, así como escasos episodios de apnea, los que se determinaron por observación clínica durante los ingresos y en la casa. No somnolencia diurna. Un ingreso por asma bronquial y 3 episodios de enfermedad respiratoria aguda infecciosa. Falleció a los 5 años de edad por paro respiratorio durante crisis de asma bronquial en centro hospitalario cercano a su domicilio (figura 2 derecha). En las tablas 1 y 2 se resume el resto de los datos de los pacientes.
Tabla 1. Antecedentes personales y resultados de datos complementarios
| Paciente | Sexo | Edad (años) | CI | Movimientos fetales | Parto normal | Cariotipo |
| KMS | M | 10 | 56 | escasos | Sí | 46XY |
| ALP | M | 4 | 60 | - | Sí | 46XY |
| MAP | F | 16 | 40 | - | Sí | 46XX |
CI: Coeficiente intelectual.
Tabla 2. Examen físico y trastornos del sueño
| Paciente | Obesidad después de 2 años de edad | Baja talla | Acromicria | Criptorquidia | Hipogenitalismo | Trastornos del sueño |
| KMS | Sí | Sí | Sí | No | Sí | Marcado |
| ALP | Sí | Sí | Sí | No | Sí | Marcado |
| MAP | Sí | Sí | Sí | - | - | Ligero |
Discusión
Generalmente los pacientes con SPW son remitidos al endocrinólogo pediatra por obesidad y nos enfrentamos a ellos con el diagnóstico ya realizado de SPW por el pediatra o el genetista, pero en otros casos son remitidos sin tener realizado el diagnóstico de SPW, de manera que el conocimiento de los criterios diagnósticos de esta entidad, así como las complicaciones que pueden presentarse en este tipo de paciente, son de un valor incuestionable para el endocrinólogo.
Criterios diagnósticos
1. Criterios diagnósticos mayores (1 punto cada uno).
- Hipotonía central en la infancia.
- Problemas de alimentación en la infancia/falta de medro.
- Ganancia ponderal rápida entre 1 y 6 años.
- Hallazgos faciales característicos.
- Hipogonadismo: hipoplasia genital, deficiencia puberal.
2. Criterios diagnósticos menores (½ punto cada uno).
- Movimientos fetales disminuidos y letargia en la infancia.
- Problemas de comportamiento típicos.
- Trastornos del sueño/apnea del sueño.
- Hipopigmentación.
- Manos y pies pequeños en relación con la altura/edad.
- Manos estrechas con borde cubital estrecho.
- Esotropia, miopía.
- Saliva viscosa y densa.
- Trastornos en la articulación del lenguaje.
- Piel suave.
3. Criterios que lo apoyan (sin puntuación)
- Umbral alto para el dolor.
- Problemas para controlar la temperatura.
- Escoliosis y/o cifosis.
- Adrenarquia prematura.
- Osteoporosis.
- Habilidad inusual para construir rompecabezas/puzzles.
- Estudios neuromusculares normales.
Debe sospecharse el diagnóstico en niños menores de 3 años que tienen 5 puntos (3 para criterios mayores), y 4 deben ser los criterios mayores en niños mayores de 3 años con 8 puntos.
El SPW se caracteriza clínicamente por obesidad (después de los 2 años de edad), hipotonía, retraso mental, baja talla, manos y pies pequeños (acromicria) e hipogonadismo. La mayoría de estos hallazgos están presentes en cualquier paciente con este síndrome, aunque existe variabilidad clínica. El SPW es causado por un defecto genético que involucra al cromosoma 15, lo cual no es hereditario en la mayoría de los casos y es el resultado de la pérdida de la contribución paterna de un área crítica de ese cromosoma (q11-13) que puede ocurrir como una microdeleción o una disomía unimaternal.6 La prevalencia se estima en 1 x 10 000 y 1 x 16 000 recién nacidos vivos, aunque su verdadera prevalencia sea probablemente sobreestimada, por el pobre conocimiento existente acerca del síndrome.7
En el recién nacido, el signo clínico cardinal para el diagnóstico del SPW es la hipotonía,8 a menudo sentida por la madre en el embarazo como una disminución de los movimientos fetales, lo que se relaciona durante el parto con presentaciones anómalas y se plantea que por esta razón la asfixia ocurre en estos pacientes con una frecuencia 8 veces mayor que en la población general.9 Otros autores han señalado alteraciones hipotalámicas y displasia broncopulmonar como un elemento más junto a la hipotonía para explicar esta elevada incidencia de trastornos respiratorios al nacimiento.10 Por otra parte, se ha postulado que la hipotonía es un factor contribuyente para el riesgo posterior de infecciones respiratorias.11
En el estudio realizado por Butler,11 en 64 pacientes adultos y niños con SPW se encontró que cerca del 50 % en ambos grupos de edad presentó antecedentes de infecciones respiratorias a repetición, así como trastornos del sueño en el 20,0 de ellos. Las alteraciones del sueño forman parte de los criterios diagnósticos menores del SPW.12 Estos criterios son muy útiles para valorar el diagnóstico clínico e indicar la necesidad del estudio citogenético - molecular ante la sospecha clínica.
Nuestros 3 pacientes presentaron los hallazgos clínicos propios de SPW (tablas 1 y 2), salvo los cariotipos que se realizaron por técnicas de bandas, y no fue posible encontrar las anomalías descritas. Todos tuvieron hipotonía al nacer y sólo en uno de ellos pudimos recoger el dato durante el embarazo, lo que coincidió con uno de los fallecidos. Los 3 pacientes presentaron retraso mental, hiperfagia, obesidad y acromicria, así como trastornos en la articulación del lenguaje, mientras el hipogenitalismo estuvo presente en los pacientes del sexo masculino. Este dato es más difícil de determinar en las pacientes del sexo femenino. La edad de los pacientes durante el período de estudio no permitió confirmar el diagnóstico de hipogonadismo.
Además de los hallazgos clínicos señalados, estos pacientes sufren de excesiva somnolencia diurna y tienen una anomalía primaria del ritmo circadiano del movimiento ocular rápido (REM) durante el sueño.13 También presentan una respuesta primaria ventilatoria anormal a la hipoxia y la hipercapnia que se exagera por la obesidad, así como trastornos respiratorios durante el sueño que comprenden desde ronquidos hasta la apnea.14-16 El ronquido se considera patológico si ocupa más del 30 % del tiempo de sueño.17 Esta hipersomnolencia, que puede o no estar asociada a la apnea durante el sueño, ocasiona una pobre saturación de oxígeno. Algunos autores han sugerido que las causas de la hipersomnolencia son los trastornos del hipotálamo posterior,18-19 mientras que otros sugieren que la apnea durante el sueño per se es la causa fundamental.15,20
La apnea durante el sueño (Sleep apnea syndrome) o apnea obstructiva se define en los niños como un desorden de la respiración durante el sueño caracterizada por la obstrucción parcial prolongada de la vía aérea superior y/o una obstrucción completa intermitente (apnea obstructiva) que altera la ventilación normal y los patrones normales de sueño. Se asocia a síntomas que incluyen ronquido habitual nocturno, dificultades con el sueño y/o problemas de conducta diurnos. Las complicaciones pueden incluir alteraciones del crecimiento, neurológicas y pulmonares, especialmente en los casos severos.21
Tamisier22 ha encontrado un aumento de la resistencia de las vías aéreas superiores durante la inspiración en los ciclos, que preceden al colapso en pacientes con trastornos respiratorios durante el sueño. Este concepto de incremento de la resistencia podría estar relacionado con la morbilidad cardiorrespiratoria. En consecuencia, estos pacientes tienen una alta mortalidad, así como un amplio rango de secuelas cardiorrespiratorias.23-24 La obesidad es el factor más fuertemente asociado en los pacientes con SPW, pero también pudiera ser el elemento que aporta una mayor confusión para el análisis, ya que se ha observado que las anomalías cardiorrespiratorias en pacientes obesos con SPW no implican necesariamente una asociación entre la apnea nocturna y la morbilidad cardiorrespiratoria. Existen otros elementos como la enfermedad pulmonar obstructiva crónica asociada a la obesidad, que en muchas ocasiones se subestima.
Laaban25 estudió en 60 pacientes con obesidad masiva las consecuencias cardiorrespiratorias del SPW y encontró que la apnea nocturna estaba asociada con hipoxemia diurna, así como con hipertensión de la arteria pulmonar e hipertrofia ventricular derecha moderadas, aunque no con complicaciones cardiorrespiratorias graves. Otros autores han encontrado resultados similares.26
Se ha encontrado una fuerte relación entre los niveles matutinos y vespertinos de leptina y el índice de apnea/hipoapnea durante el sueño, de manera que los niveles de leptina vespertinos son mayores que los nocturnos en los sujetos con apnea del sueño comparados con controles. El hecho de que en estos pacientes los niveles de leptina sean diferentes que en los controles es otro factor que puede estar contribuyendo al aumento de la obesidad en los pacientes con SPW.27 También se ha sugerido que la disfunción hipotalámica puede ser la causa principal de algunos trastornos como los asociados con el aparato reproductor, el apetito, la obesidad y la baja talla.18
Existen algunas evidencias que sugieren que el material genético contenido en el cromosoma 15 podría estar relacionado con la conducta compulsiva (intensa preocupación por la alimentación, ausencia de la saciedad e incesante búsqueda de alimentos) ante el alimento en estos pacientes a través de una alteración en la síntesis, liberación, metabolismo, transporte, actividad intrínseca o recaptación de neurotransmisores específicos, o a una alteración en el número o distribución de los receptores involucrados en la modulación de los mecanismos de retroalimentación. Entre los probables candidatos están los mecanismos GABA minérgicos, serotoninérgicos y neuropeptidérgicos, como el ghrelin.28-29
Hubo 2 pacientes fallecidos por paro respiratorio; uno de ellos tenía el síndrome de apnea durante el sueño y asma bronquial.
Se ha señalado por varios autores una incidencia elevada de muerte súbita asociada a problemas respiratorios en pacientes con SPW, tanto niños como adultos,11,30 lo que ha estado en relación con hallazgos propios del síndrome, como la obesidad, la hipotonía y la apnea durante el sueño, entre otros.31 Un dato interesante es que algunos investigadores han observado que el tratamiento con hormona de crecimiento aumenta el riesgo de muerte súbita por problemas respiratorios en estos pacientes,32 aunque otros autores lo niegan.23
Como es obvio, los pacientes con SPW presentan un riesgo elevado de sufrir trastornos de la ventilación durante la anestesia.33 La obesidad, el dismorfismo facial, los trastornos termorreguladores, la apnea durante el sueño, así como una respuesta prolongada y exagerada a los medicamentos sedantes en general en estos pacientes, son factores que elevan este riesgo, por lo que algunos autores recomiendan el uso de monofármacos anestésicos, como el sevoflurane.34
Se recomienda actuar tempranamente sobre aquellos factores que afecten la respiración normal, como son la adenoiditis y amigdalitis crónica, el asma bronquial y la posición del cuerpo al dormir, entre otros,34-37 pero la obesidad continúa siendo un hallazgo indefectible en los pacientes con SPW, así como el factor más difícil, pero no imposible, de mejorar38 y sobre el cual tenemos que enfatizar nuestras acciones terapéuticas para aliviar el riesgo de estos trastornos respiratorios.
Como conclusión, si bien los tratamientos habituales para la disminución del peso en estos pacientes tienen resultados desalentadores como consecuencia de la conducta compulsiva ya mencionada, la confección de un programa ad hoc que sea sencillo y fácil, junto a una mejoría en la interrelación y comunicación entre las personas que cuidan de ellos, han mostrado ser una opción terapéutica viable y efectiva para mejorar la obesidad.38-39 Se debe tener especial atención en buscar la presencia de estos síntomas respiratorios relacionados con el sueño que forman parte de los criterios diagnósticos menores,12 pero que no son mencionados en las tablas de seguimiento de los pacientes con SPW40 (tabla 3).
Tabla 3. Seguimiento de los pacientes con SPW
| Problema | Screening | Tratamiento recomendado |
| Primer año de vida | ||
| Hipotonía | Examen neurológico | Terapia física |
| Problemas alimentarios | Historia | S. nasogástrica/gastrostomía |
| Fallo de medro | Seguir peso/talla | Ingesta correcta/educación |
| Criptorquidia | Exploración | Terapia médica, cirugía |
| Hipoplasia genital | Exploración | ¿Tratar micropene? |
| Retraso motor | Valorar desarrollo | Intervención precoz |
| Infancia temprana | ||
| Retraso del lenguaje | Valoración | Terapia del lenguaje |
| Estrabismo | Exploración | Consulta oftalmológica |
| Hiperfagia/obesidad | Valorar peso/talla | Consulta nutricionista |
| Párvulo/escolar | ||
| Alteración del aprendizaje | Valorar educación | Programa educacional |
| Déficit del habla | Valoración del habla | Logopedia |
| Trastorno comportamiento | Historia, valoración | Terapia intervencionista |
| Hiperfagia/obesidad | Controlar peso | Consulta nutricionista, dieta ejercicio, cirugía |
| Lesiones de rascado | Historia, exploración | Uñas cortas, limpias |
| Miopía | Exploración | Consulta oftalmología |
| Adolescencia y adulto | ||
| Escoliosis | Exploración, radiología | Consulta ortopeda |
| Patología bucal | Exploración | Limpieza, pilocarpina |
| Diabetes mellitus | Valoración | Consulta endocrino |
| Trastornos emocionales | Educación psicólogo | Psicoterapia, medicación |
| Pubertad anormal | Exploración, LH, FSH | Consulta endocrino |
| Oligo/amenorrea | Historia | Consulta ginecología |
| Talla baja | GH neurosecretora | Tratamiento GH |
| Osteoporosis | Densimetría ósea | Suplementos Ca, ejercicio tratamiento hormonal |
| Trastorno comportamiento | Historia, valoración | Terapia |
| Hiperfagia/obesidad | Controlar peso | Consulta nutricionista, dieta |
Como apunta la evolución de nuestros 3 pacientes, en los niños afectados con SPW se debería realizar una evaluación completa de la función respiratoria en el tiempo de sueño e incluir en la decisión terapéutica la valoración y mejoría de su ventilación nocturna, sobre todo si se tiene en cuenta la cada vez más evidente relación entre las alteraciones del sueño y las cognitivas.
Summary
Prader-Labhart-Willi syndrome (PWS) is an entity associated with sleep disordered breathing, which may have fatal consequences for life. Three patients with diagnosis of PWS are presented: 2 males and 1 female. The diagnosis in all of them was confirmed after 2 years of age. The most significant clinical findings were: normal height and body weight at birth and muscular hypotonia. In two patients, obesity began at 2 years of age, and in one at 18 months of age. Acromicria and moderate mental retardation were observed in the three patients. The results of the karyotypes by band technique were 46XY for males and 46XX for females. The two male patients had episodes of sleep apnea (Sleep Apnea Syndrome), which caused their death due to respiratory arrest before being 12 years old. It is recommended the close surveillance of these patients, mainly during respiratory infections and bronchial asthma crises.
Key words: Prader-Willi, sleep apnea, obesity, sleep.
Referencias bibliográficas
1. Prader A, Labhart A, Willi H. Ein syndrom von adipositas, Kleinwuchs, kryptorchismus und oligophrenic nach myatonieartigen zuntand im neugeborenealter. Schweiz Med Wochenschr 1956;86:1260-1.
2. Butler JV, Whittington JE, Holland AJ, Boer H, Clarke D, Webb T. Prevalence of, and risk factors for, physical ill-health in people with Prader-Willi syndrome: a population-based study. Dev Med Child Neurol 2002;44:248-55.
3. Silvestri JM, Weese-Mayer DE. Respiratory control disorders in infancy and childhood. Curr Opin Pediatr 1996;8:216-20.
4. Richards A, Quaghebeur G, Clift S, Holland A, Dahlitz M, Parkes D. The upper airway and sleep apnea in the Prader-Willi syndrome. Clin Otolaryngol 1994; 19:193-7.
5. Beebe D, Gozal D. Obstructive sleep apnea and the prefrontal cortex: towards a comprehesive model linking nocturnal upper airway obstruction to daytime cognitive and behavioral deficits. J Sleep Res 2002;11:1-6.
6. Wharton RH, Loechner KJ. Genetic and clinical advances in Prader Willi syndrome. Curr Opin Pedatr 1996;8:618-24.
7. Nativio DG. The genetics, diagnosis, and management of Prader-Willi syndrome. J Pediatr Health Care 2002;16:298-303.
8. Aughton DJ, Cassidy SB. Physical features of Prader-Willi syndrome in neonates. Am J Dis Child 1990;144:1251-4.
9. Miller SP, Riley P, Shevrel MI. The neonatal presentation of Prader-Willi syndrome revisited. J Pediatr 1999;134:226-8.
10. Monnoreau S, Choulot JJ, Beze-Beyrie P, Barbier R, Doireau V, Mensire A et al. Présentation néonatale du syndrome de Prader-Willi. Acta Paediatr 2000;7[letter]: 573.
11. Butler JV, Whittington JE, Holland AJ, Boer H, Clarke D, Webb T. Prevalence of, and risk factors for, physical ill-health in people with Prader-Willi syndrome: a population-based study. Dev Med Child Neurol 2002;44:248-55.
12. Holm VA, Cassidy SB, Butler MG, Hanchett JM, Greenswagg LR, Whittman BY et al. Prader-Willi syndrome: consensus diagnosis criteria. Pediatrics 1993;91:398-402.
13. Richdale AL, Cotton S, Hibbit K. Sleep and behavior disturbance in Prader-Willi syndrome: a questionnaire study. J Intellect Disabil Res 1999;43:380-92.
14. Clift S, Dahlitz M, Parker JD. Sleep apnoea in the Prader-Willi syndrome. J Sleep Res 1994;3:121-6.
15. Hiroe Y, Inoue Y, Higami S, Suto Y, Kawahara R. Relationship between hypersomnia and respiratory disorder during sleep in Prader-Willi syndrome. Psychiatry Clín Neurosci 2000;54:323-5.
16. Nixon GM, Brouillette RT. Sleep and breathing in Prader-Willi syndrome. Pediatr Pulmonol 2002;34:209-17.
17. Castronovo V, Zucconi M, Nosetti L, Marazzini C, Hensley M, Veglia F et al. Prevalence of habitual snoring and sleep-disordered breathing in preschool aged children in an Italian community. J Pediatr 2003;142:377-82.
18. Swaab DF. Prader-Willi syndrome and the hypothalamus. Acta Paediatr Suppl 1997;423:50-4.
19. Swaab DF, Purba JS, Hofman MA. Alterations in the hypothalamic paraventricular nucleus and its oxytocin neurons (putative satiety cells) in Prader-Willi syndrome: A study of five cases. J Clin Endocrinol Metab 1995;80:573-9.
20. Doshi A, Udwadia Z. Prader-Willi syndrome with sleep disordered breathing: effect of two years nocturnal CPAP. Indian J Chest Dis Allied Sci 200;43:51-3.
21. American Thoracic Society. American Thoracic Society: Standard and indications for cardiopulmonary sleep studies in children. Am J Resp Crit Care Med 1996; 154:866-78.
22. Tamisier R, Pepin JL, Wuyam B, Deschaux C, Levy P. Expiratory Changes in Pressure: Flow Ratio During Sleep in Patients with sleep disordered breathing. Sleep 2004;27:240-8
23. Schrander-Stumpel CT, Curfs LM, Sastrowijoto P, Cassidy SB, Schrander JJ, Fryns JP. Prader-Willi syndrome: causes of death in an international series of 27 cases. Am J Med Genet 2004;124 A:333-8.
24. Vogels A, Van Den Ende J, Keymolen K, Mortier G, Devriendt K, Legius E et al. Minimum prevalence, birth incidence and cause of death for Prader-Willi syndrome in Flanders. Eur J Hum Genet 2004;12:238-40.
25. Laaban JP, Cassuto D, Orvoën-Frija E, Iiou MC. Cardiorrespiratory consequences of sleep apnoea syndrome in patients with massive obesity. Eur Respir J. 1998;11:20-7.
26. Fung KP, Lau SP, Chow OK, Lee J, Wong TW. Effects of overweight on lung function. Arch Dis Child 1990;65:512-5.
27. Patel S, Palmer L, Larkin E, Jenny N, White D, Redline S. Relationship between obstructive sleep apnea and diurnal leptin rhythms. Sleep Sleep 2004;27:235-9
28. Haqq AM, Farooqi IS, O'Rahilly S, Stadler DD, Rosenfeld RG, Pratt K et al. Serum ghrelin levels are inversely correlated with body mass index, age and insulin concentrations in normal children and are markedly increased in Prader-Willi syndrome. J Clín Endocr Metab 2003;88:174-8.
29. Dimitritropoulos A, Feurer ID, Roof E, Stone W, Butler MG, Sutcliffe J et al. Appetitive behavior, compulsivity, and neurochemistry in Prader-Willi syndrome. MRDD Research Reviews 2000; 6:125-30.
30. Nordmann Y, Eiholzer U, L'Allemand D, Mirjanic S, Markwalder C. Sudden death of an infant with Prader Willi syndrome. Not a unique case? Biol Neonate 2002; 82:139-41.
31. Oiglane E, Ounap K, Bartsch O, Rein R, Talvik T. Sudden death of a girl with Prader-Willi syndrome. Genet Couns. 2002;13:459-64.
32. Vliet GV, Deal CL, Crock PA, Robitaille Y, Oligny LL. Sudden death in growth hormone-treated children with Prader-Willi syndrome. J Pediatr 2004;144:129-31.
33. Tseng CH, Chen C, Wong CH, Wong SY, Wong KM. Anesthesia for pediatric patients with Prader-Willi syndrome: report of two cases. Chang Gung Med J 2003; 26:453-7.
34. Rinaldi S, Rizzo L, Di Filippo A, Secchi S, Paternoster G, La Torre MS et al. Monopharmacologic general anaesthesia with sevoflurane in paediatric patient with Prader-Willi syndrome. Minerva Anestesiol 2002;68:783-90.
35. Fernández do Prado L, Li X, Thompson R. Body Position and Obstructive Sleep Apnea in Children. Sleep 2002;25:66-71.
36. Cohen AN, Cohen A, Tirosh E. The relationship between gastroesophageal reflux and apnea in infants. J Pediatr 2000;137:321-6
37. Friedman BC, Hendeles-Amitai A, Kozminsky E, Leiberman A, Friger M, Tarasiuk A et al. Adenotonsillectomy improves neurocognitive function in children with Obstructive Sleep Apnea Syndrome. Sleep 2003;26:999-1005.
38. Hooren RH, Widdershoven GA, Borne HW, Curfs LM. Autonomy and intellectual disability: the case of prevention of obesity in Prader-Willi syndrome. J Intellect Disabil Res 2002:46:560-8.
39. Eiholzer U, Nordmann Y, L'Allemand D, Schlumpf M, Schmid S, Kromeyer-Hauschild K. Improving body composition and physical activity in Prader-Willi Syndrome. J Pediatr 2003;142:73-8.
40. Galán E, Baca M. Síndrome de Prader-Willi. Pediatr Clín 2003;12:127-36.
Recibido: 4 de agosto de 2004. Aprobado: 10 de septiembre de 2004
Dr. Pedro González Fernández. Hospital Pediátrico Docente "William Soler", Ciudad de La Habana, Cuba. Email: gonzalez@infomed.sld.cu
1 Especialista de II Grado en Endocrinología. Profesor Auxiliar.
2 Especialista en Pediatría. Especialista Universitario en Medicina de los Trastornos del Sueño. Hospital Quirón, Valencia, España.
3 Especialista de I Grado en Pediatría. Servicio de Endocrinología.