Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol v.15 n.2 Ciudad de la Habana Mayo-ago. 2004
Enfoque actual
Facultad de Medicina de la Universidad de Barcelona
Células madre: un nuevo concepto de medicina regenerativa
Dra. M. Eugenia Mato Matute1 Resumen
Célula madre o stem cell es una célula totipotente/pluripotente o multipotente, capaz de generar uno o más tipos de células diferenciadas y que además posee la capacidad de autorrenovación. En los animales superiores, cuando nos referimos a células madre, pensamos en las células totipotentes embriónicas, que a su vez se clasifican en los siguientes grupos: células madre embriónicas (ES), células madre germinales (EG) y células madre de los teratomas y teratocarcinomas. Sin embargo, la mayoría de los tejidos adultos que forman parte del organismo de estos animales superiores, poseen la capacidad intrínseca de auto renovarse, a partir de poblaciones celulares que permanecen remanentes en quiescencia durante la vida del animal, pero que mantienen la capacidad de diferenciación. Este proceso ha abierto una nueva era en la llamada medicina regenerativa, que no es más que aprovechar los mecanismos naturales de renovación celular para reparar los tejidos dañados. Sin embargo, este nuevo concepto en la medicina no solo ha planteado nuevas posibles vías terapéuticas de estudio, tales como las llamadas terapias celulares, sino que también ha abierto sin duda la "caja de pandora", que exige no solo un debate científico sino ético por parte de la sociedad en general.
Palabras clave: Medicina regenerativa, células madre, diabetes mellitus.
A lo largo de la vida de un organismo, las células que forman los tejidos, ya sea de manera natural o por una enfermedad aguda o crónica, sufren un desgaste y se degeneran. Los avances en la medicina basada en técnicas sustitutivas del tejido dañado han supuesto una revolución no exenta de problemas; entre ellos cabe destacar la limitación en el número de donación de órganos, además de las complicaciones inmunológicas (rechazo del injerto), complicaciones paliadas en parte de manera farmacológica.
Se sabe que de manera natural los tejidos que forman parte de nuestro organismo tienen la capacidad intrínseca de auto renovarse, proceso que se produce gracias a las células que permanecen remanentes y con capacidad de diferenciación. Este fenómeno ha abierto una nueva era en la llamada medicina regenerativa, que no es más que aprovechar los mecanismos naturales de renovación celular para reparar los tejidos dañados. No cabe duda de que este nuevo concepto en la medicina no solo ha abierto nuevas posibles vías terapéuticas de estudio en terapias celulares, sino también la "caja de pandora", por lo que no solo es motivo de debate científico sino que exige un debate ético por parte de la sociedad en general.
Definición y tipos de células madre
Célula madre o stem cell se define como una célula totipotente/pluripotente o multipotente, capaz de generar uno o más tipos de células diferenciadas, y que además posee la capacidad de auto renovación, es decir, de producir más células madre. En los animales superiores, las células madre se clasifican en los siguientes grupos:
1. Células madre embriónicas
1.1. Células madre embriónicas (ES).
1.2. Células madre germinales (EG).
1.3. Células madre de los teratomas y teratocarcinomas.
Células madre embriónicas. Derivan de la masa celular interna del embrión en el estadio de blastocito (7-14 días) y son totipotentes/pluripotentes. A partir de ellas, y tras muchas divisiones celulares, surgirán con las que forman parte del tejido especializo. Sin embargo, aunque las células de la masa celular interna del blastocito son pluripotentes, no son en sí mismas células madre dentro del embrión, porque estas no se mantienen indefinidamente como tales en condiciones in vivo, sino que se diferencian sucesivamente en los diversos tipos celulares durante la fase intrauterina. Lo que ocurre es que cuando se extraen del embrión y se cultivan bajo ciertas condiciones in vitro, estas se convierten en células "inmortales" dotadas de esas 2 propiedades mencionadas: auto renovación y pluripotencia, características importantes para poder ser utilizadas en terapia celular.
Células madre germinales (EG). Se localizan en la cresta germinal de los fetos, lugar donde se produce la diferenciación de la línea germinal.
Células madre de los teratomas y teratocarcinomas: Se localizan en las gónadas en forma de tumoración. Las células diferenciadas del tumor se forman a partir de células madre pluripotentes de carcinoma embrionario que derivan, a su vez, de células primordiales germinales del embrión (posimplantación). Son tumores que contienen una gran variedad de tipos celulares que incluyen desde células musculares, cartílago, hueso, epitelio, neuroectodermo primitivo, estructuras ganglionares y epitelio glandular, es decir, derivan de las 3 capas embrionarias que tiene un embrión (endodermo, mesodermo y ectodermo).
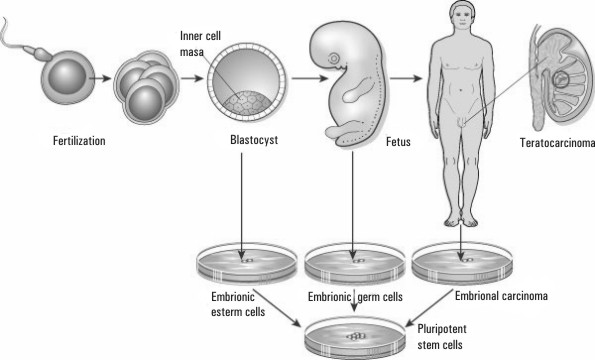
Las células diferenciadas del tumor se han cultivado y se ha comprobado que mantienen la capacidad pluripotencial. Uno de los experimentos más espectaculares fue que tras el tratamiento de una línea celular de un tumor testicular con ácido retinoico, las células se diferenciaron a células nerviosas1-6 (fig.1).
Fig. 1. Células madre de origen embriónico. Esquema reproducido de la publicación Peter JD, John G. The end of the beginning for pluripotent stem cells. Nature 2001;414:92-7.
2. Células madre órgano-específicas (adulto)
Derivadas de las células embriónicas, poseen a lo largo de la vida del tejido capacidad multipotencial, es decir, son capaces de originar células especializadas de un órgano concreto en el embrión y también en el adulto. El ejemplo más claro de este tipo celular es el de las células de la médula ósea, que son capaces de generar todos los tipos celulares de la sangre y del sistema inmune.7 Aunque se conoce desde hace tiempo la existencia de dichas células en los diferentes tejidos, en los últimos años diferentes autores han identificado estas células que provienen de la médula ósea que, como la sangre o la epidermis, presentan gran tasa de proliferación, y aún más sugerente es que algunas de ellas presentan la suficiente flexibilidad o plasticidad como para generar células especializadas de otros linajes (fenómeno de transdiferenciación).8-9 Esto ha supuesto una sorpresa alentadora, ya que aumenta la perspectiva de obtener a largo y medio plazos terapias celulares sin los problemas éticos que conducen a la destrucción de embriones congelados.
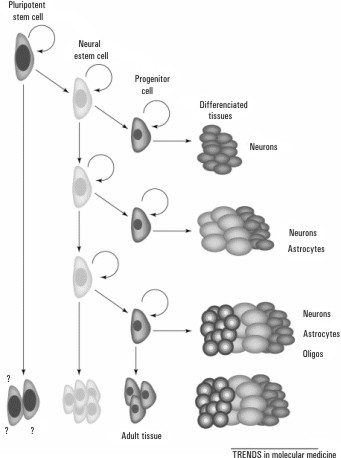
La pregunta clave es cómo, cuándo y por qué una célula stem en un tejido adulto empieza a diferenciarse. Existen múltiples mecanismos dentro del "nicho" o habitat celular que producen tanto señales internas como externas, que permiten que se produzcan divisiones simétricas y asimétricas y que darán juego al mantenimiento de las propias células madre, como el inicio de la diferenciación celular. Esto se produce a partir de factores de transcripción que actúan en genes específicos (fig.2).
Fig. 2. Posibles orígenes de las células madre adultas. Reproducción extraída de la publicación Peter JD, John G. The end of the beginning for pluripotent stem cells. Nature 2001;414:92-7.
Señales internas y externas
Numerosos estudios básicos realizados en Drosophila melanogaster (mosca del vinagre) y ratón han demostrado la existencia de una serie de controles internos que a modo de relojes marcan a las células el número de divisiones simétricas antes de empezar el proceso de diferenciación que dará lugar a una estirpe celular concreta. A pesar de los pocos conocimientos que se tiene de dichos procesos, los estudios básicos indican la existencia de proteínas específicas (activadoras/inhibidoras) implicadas en el ciclo celular y el papel importante de la longitud del telómero (del griego Telos: final y meros: parte), como los extremos de los cromosomas formados por regiones repetidas de ADN no codificantes, con funciones muy concretas en la estabilidad molecular. El número de repeticiones que encontramos en el telómero es variable incluso en diferentes células de un mismo individuo; no obstante, el promedio tiende a ser constante para cada especie. Por otro lado, la telomerasa (formada por un complejo proteína-ácido-ácido) es una polimerasa producida por las células germinales embriónicas que permite la elongación de los telómeros. Se sabe que la telomerasa es reprimida en las células somáticas maduras, lo que comporta un acortamiento del telómero al final de cada división celular. Cuando la longitud del telómero alcanza cierto límite, se interrumpen las mitosis y quedan las células en estadio Go de su ciclo.10 También se puede hablar de controles externos: un conjunto de señales paracrinas y autocrinas entre las células madre/hijas y las vecinas; entre ellas se destacan:
- Factores secretados, que son los más conocidos, y los factores de la médula ósea, entre los que se incluyen numerosas citoquinas.
- Interacción célula-célula a través de proteínas de membrana.
- Integraciones de las células con la matriz extracelular por medio de receptores de membranas integrinas.
En muchos de estos casos, la señal externa interacciona con el receptor de membrana, lo que se traduce en el interior de la célula como una cascada de señalizaciones, es decir, un conjunto de reacciones bioquímicas (fosforilaciones y desfosforilaciones de proteínas), que finalmente acaba en la activación y desactivación de un grupo de genes. Esto implica que la célula puede cambiar su patrón de expresión, lo que en determinados casos significa un paso más en su ruta de diferenciación, su proliferación, o incluso puede significar la muerte celular programada (apoptosis), mientras existe un equilibrio fino entre estos procesos celulares.
Plasticidad de las células madre. Concepto de transdiferenciación celular
Investigaciones actuales dan una mayor evidencia de que las células madre adultas tienen la capacidad pluripotencial en respuesta a un estrés tisular. Existen numerosos trabajos científicos que demuestran que la colonización por parte de células stem circulantes en la sangre periférica de órganos sometidos a daño tisular tiene la capacidad de regenerar/reparar el tejido dañado. Sin embargo, los resultados deben ser cuidadosamente analizados a pesar de que existen evidencias claras de dichos procesos.11-13 El proceso de transdiferenciación requiere que una célula ponga en marcha mecanismos de desdiferenciación y rediferenciación que darán como punto final otro tipo celular. En los últimos años, un nuevo concepto ha surgido y es el de la fusión celular. Este fenómeno ha sido recientemente demostrado en experimentos realizados con cocultivo de células procedentes de la médula ósea con células del corazón, del hígado o neuronales. La fusión entre estas células provoca un aporte de material genético nuevo que podría permitir la sustitución de las células que se están degenerando por otras nuevas. Sin embargo, estas desdiferenciaciones aparentes resultaron con el producto de células híbridas (tetraploides).14 Dichas aberraciones cromosómicas impiden su utilización en algún tipo de terapia celular. Por otra parte, existen trabajos que demuestran que los cultivos de células madre podrían producir cambios en la cinética del ciclo celular o adhesión celular, alteraciones adquiridas como consecuencia del cultivo.15,16 El sistema inmune frente al trasplante de células madre
Uno de los problemas que plantean las terapias del transplante son los inmunológicos, que acaban con el rechazo del injerto. Sin embargo, la terapia alternativa de obtención, expansión y diferenciación de las células madre requiere el transplante de estas, con el riesgo obvio de un rechazo de este injerto celular. A pesar de tener abundante experiencia clínica, no se pueden extrapolar los resultados de ambas técnicas, ya que las células no poseen vascularización.
Está demostrado que un injerto es rechazado porque existe un reconocimiento por parte de los linfocitos T citotóxicos a moléculas del complejo de histocompatibilidad mayor (MHC) de clases I y II, expresadas en la superficie celular.
Recientemente se han encontrado niveles bajos de expresión de estas moléculas en células madre embrionarias humanas,17,18 y aunque aumentan al diferenciarlas in vitro, no llegan nunca a los niveles de los observados en órganos enteros. Por la poca o nula experiencia in vivo, poco se conoce del poder antigénico de dichas células, si bien estudios ponen de manifiesto que los niveles bajos son suficientes para inducir una respuesta inmunológica. Sin olvidarnos de las células Natural Killer que intervienen de forma activa en la cascada de reacción que conduce al rechazo, no se ha observado la expresión del MHC de clase II en las células madre.18 Existen, sin embargo, proyectos de que, al igual que con los órganos, se creen bancos de células madre que estén isotipadas para el HLA, y de este modo elegir el isotipo más adecuado para el paciente.
Diabetes mellitus y células madre
La diabetes mellitus puede subdividirse en 2 grandes enfermedades: la diabetes mellitus tipo 1 (insulino-dependiente) o DM1, caracterizada por un proceso autoimmune de destrucción de las células productoras de insulina que provoca la falta de esta hormona, y la diabetes mellitus tipo 2 (no insulino-dependiente), que representa un 90 % de los casos diagnosticados. Su aparición se debe a la combinación entre la resistencia a la acción de la insulina por parte de los tejidos periféricos y una alteración de la función de la célula pancreática. Esta disfunción parece ser el resultado de la incapacidad de la células ß para producir y secretar insulina cuando aumenta la demanda de esta. La diabetes afecta a un 4-5 % de la población mundial, aunque el número de individuos que la padecen aumenta muy rápido, especialmente en los países desarrollados. Es la alteración metabólica más frecuente entre los humanos y conduce también a la aparición de complicaciones secundarias, tales como retinopatía, neuropatía y alteraciones cardiovasculares. En un estudio poblacional realizado por el Consejo Asesor sobre la Diabetes, en Cataluya (1997), se observó que la prevalencia de la enfermedad conocida es del 6,7 % y que aumenta en relación con la edad, de manera que la prevalencia de DM tipo 2 global (conocida y no conocida) es del 10,3 en la población de 30 a 89 años.19
En la actualidad existen terapias para los 2 tipos de diabetes que resultan insatisfactorias porque no ofrecen una cura de la enfermedad, y en la mayoría de los casos no podrán evitar la aparición de las complicaciones secundarias asociadas a ella. El transplante de islotes pancreáticos ha sido sin duda una esperanzadora estrategia para restaurar la masa de célula funcional en los pacientes diabéticos y poder así conseguir la normoglicemia; no obstante, presentan limitaciones, como ya se ha expuesto, el rechazo del injerto y el número de páncreas necesarios para la obtención de una cantidad óptima de islotes (al menos 2 donantes/pacientes).20 Esto comporta la necesidad de identificar nuevas terapias genéticas como, por ejemplo, la obtención de células productoras de insulina a partir de células pluripotentes. Sin embargo, es necesario profundizar en los mecanismos moleculares de la propia célula beta que se intenta reestablecer. La viabilidad de esta nueva estrategia celular depende principalmente de 3 importantes pre requisitos:
- Identificación de células pluripotenciales o unas células progenitoras pancreáticas que tengan la capacidad de auto replicarse y de generar células diferenciadas.
- Identificación de las señales proliferativas que permiten expandir, de una manera específica, estos progenitores pancreáticos.
- Identificación de señales instructivas que induzcan la diferenciación de estas células pluripotenciales o progenitoras en células funcionales que secreten la insulina correctamente procesada, de una manera pulsátil, en respuesta a concentraciones fisiológicas de glucosa.
A diferencia de células que provienen del mesodermo (cardiomiocitos) o las que provienen del ectodermo (células neuronales), pueden ser diferenciadas espontáneamente in vitro las células derivadas del endodermo, entre las que se incluyen las células del páncreas, las cuales requieren la presencia de factores en general desconocidos que son los que dirigen la diferenciación celular. Básicamente han sido utilizadas 2 estrategias de selección para células con capacidad de diferenciación beta celular, que son las siguientes:
1. Estrategia de Trapping (utilizada por el equipo del Dr. Soria). Las stem cells son transfectadas con una construcción que lleva un gen de resistencia a un antibiótico (neomicina) el cual está bajo el control del gen de la insulina. De esta manera, se seleccionan las células que al diferenciarse activarán únicamente dicho promotor; posteriormente, se añade a la construcción un marcador no tóxico, pero fácilmente perceptible: la proteína fluorescente del verde (GFP), de manera que las células expresan insulina y proteína verde, lo que permite una selección más fina de estas. De ese modo, se estableció la línea celular IB/3x-99 derivada directamente de un cultivo de células ES de ratón, las cuales tienen la capacidad de formar los agregados de las células que secretaron la insulina de una manera dependiente de la glucosa.21 Para probar la capacidad funcional de estas células in vivo, los agregados celulares fueron implantados en el bazo de ratones. La mayoría de los animales presentaron un control de la glucosa de la sangre. Sin embargo, el 40 % de los trasplantados desarrollaron a las 12 semanas una hiperglicemia.22 El estudio también establece claras dificultades. Varias razones pueden explicar la pérdida de las células trasplantadas: pérdida de características genotípicas en ausencia de la presión selectiva, muerte inducida de la célula quizás por motivo del nuevo nicho celular, rechazo por parte del huésped al injerto celular y producción de tumores.
2. Marcadores selectivos de células madre pancreáticas. La nestina es una proteína del filamento que se ha identificado por ser un marcador de células stem del sistema nervioso central. Por existir muchas similitudes entre ellas y las del páncreas, Lumelsky propuso a la nestina como un marcador específico de célula stem endocrina.23 El protocolo utilizado por estos investigadores demostró que tras la privación en el medio de cultivo del Leukimia factor inhibitor (LIF) o al suplementar este con bFGF, era posible la formación de agregados celulares que expresaran no solamente insulina sino también glucagon, somatostatina y polipéptido pancreático, hormonas que se encuentran en los islotes de Langerhans. No se identificó ningún marcador exocrino (amilasa, carboxipeptidasa A). Análisis histológicos demostraron que los clusters celulares tenían características comunes con la estructura normal del islote; sin embargo, únicamente un 50 % de las células expresaban insulina. Estudios funcionales de secreción dieron muestras de respuesta en forma de dosis dependiente. La estrategia de seleccionar células que expresaran la proteína Nestina ha sido criticada, aunque numerosas evidencias podrían confirmar que puede ser un buen marcador, a pesar de que existe un solapamiento en los factores de transcripción de la neurogénesis y la endocrinogénesis, factores claves neuronales del bHLH, tales como neurogenina 1-2, neuro D, y neuro D2 pueden ayudar a activar el gen de la insulina en una célula neuronal, y son factores idénticos (Neuro D), o muy similar (Ngn1 o 2) a esos componentes del bHLH, necesarios para la función y el desarrollo pancreáticos de la célula de la endocrina (Neuro D y Ngn3).24-25
No obstante, el marcador específico endodermal HNF3b se expresa en células derivadas de las embriónicas, además de otros marcadores que deben ser explorados para poder comprender el proceso íntimo de cómo una célula indiferenciada se transforma en célula con fenotipo beta.
En el caso del páncreas adulto, no hay consenso sobre el tipo celular que podría ser la verdadera stem cell pancreática.26 Se ha descrito que en el páncreas existe un proceso de neogénesis, es decir, de formación exnovo de islotes pancreáticos, que aumenta en diferentes situaciones, tanto en humanos27 como en modelos animales.28-30 Algunos autores postulan que después de una pancreatectomía parcial, algunas células ductales maduras podrían empezar a proliferar y diferenciarse hasta dar origen a una célula con capacidad multipotencial. La dirección de diferenciación de estas células dependería de señales externas o morfógenas.31 En este caso, hablaríamos de stem cells funcionales de manera parecida a las que se han descrito en el hígado y en otros tejidos.32-34 Otros autores han descrito la existencia de posibles stem cells en los mismos islotes pancreáticos35,36 y han sugerido que estas son una fuente de nuevas células del islote. Por lo tanto, aunque los experimentos han demostrado que en el páncreas existe un proceso regenerativo tanto intra como extra islote, la detección y caracterización de las stem cells pancreáticas está resultando un trabajo difícil. La falta de unos marcadores claros,37-39 así como de ensayos fiables, ha obstaculizado esta difícil tarea. No obstante, sabemos que nuevas células se generan durante la vida adulta y que, en parte, provienen de células que se encuentran en el ducto pancreático. Una rigurosa caracterización del proceso del desarrollo embrionario del páncreas, de los mecanismos moleculares de proliferación y apoptosis de los islotes pancreáticos, así como de los posibles candidatos a stem cells descritos, nos tendría que permitir aislar a las stem cells adultas pancreáticas.
La posibilidad de una expansión y diferenciación de estas células permite abrir la esperanza de obtener un número suficiente de células que ayuden al desarrollo de la terapia celular. Aún más apasionante es la posibilidad de que a partir de una pequeña muestra de tejido del paciente se pueda aislar y obtener in vitro nuevos islotes que podrían ser transplantados al propio paciente y evitar, de esta manera, problemas de rechazo.
Summary
The stem cell is a totipotent/pluripotent, or multipotent cell, capable of generating one or more types of differentiated cells and it also has the capacity of self-renovation. In the higher animals, when we refer to stem cells, we think about totipotent embrionic cells, which are at the same time classified into embrionic stem cells (ES), germinal stem cells (GS) and stem cells from teratomas and teratocarcinomas. However, most of the adult tissues that are part of the organism of these higher animals have the intrinsic capacity for self-renovation. In the higher animals, when we refer to stem cells, we think about totipotent embrionic cells that at the same time are classified into the following groups: embrionic stem cells (ES), germinal stem cells (GS) and stem cells from the teratomas and teratocarcinomas. However, most of the adult tissues that are part of the organism of these higher animals have the intirinsic capacity of selfrenovation, starting from cellular populations that remain in quiescence during animal life, but have the capacity of differantion. This process has opened a new era in the so-called regenerative medicine, which takes advantage of the natural mechanisms of cellular renovation to repair the damaged tissues. However, this new concept in medicine has not only stated new possible therapeutic ways of study, such as the so called cellular therapies, but it has undoubtedly opened "Pandora's box" , demanding not only a scientific debate, but also an ethical debate on the part of society in general
Key words: Regenerative medicine, stem cells, diabetes mellitus.
Referencias bibliográficas
1. Donovan PJ, Gearhart J. The end of the beginning for pluripotent stem cells. Nature 2001;414:92-7.
2. Martin G. Isolation of a pluripotent cell line from early mouse embrios cultured in medium conditioned by teratocarcinoma cells. Proc Natl Acad Sci 1981;78:7634-8.
3. Evans MJ, Kaufman MH. Establishment in culture of pluripotential stem cells from mouse embrios. Nature 1981;291:154-6.
4. Thomson JA, Itskovitz-Eldor J, Shapiro SS. Embrionic stem cell lines derived from human blastocits. Sci 1998;282:1145-7.
5. Reubinoff BE, Pera MF, Fong CI, Trouson A, Bongso A. Embrionic stem cells lines from human blastocists: somatic differentation in vitro. Nature Biotechol 2000;18:399-404.
6. Bishop AE, Butteri LDK, Polak JM. Embrionic stem cells. J Pathol 2002;197:424-9.
7. Mezey E, Chandross KJ. Bone marrow: a possible alternative source of cells in the adult nervous system. Eur J Pharmacol 2000;405(1-3):297-302.
8. Poulsom R, Alison MR, Forbes SJ, Wright NA. Adult stem cell plasticity. J Pathol 2002;197:441-56.
9. Björklund A, Svendsen CN. Chimeric stem cells. Trends in molecular medicine 2001;7:144-6.
10. Blackburn EH, Szostak JW. Molecular structure of centromeres and telomereses. Ann Rev Biochem 1984;53:163-94.
11. Petersen BE. Bone marrow as a potential source of hepatic oval cells. Science 1999;284:1168-70.
12. Alison MR. Hepatocyte from non-hepatic adult stem cells. Nature 2000;406:257-60.
13. Ferrari G. Muscle regeneration by bone marrow-derived myogenic progenitors. Science 1998;279:1528-30.
14. Ying QL, Nichols J, Evans EP, Smith AG. Changing potency by spontaneous fusion. Nature 2002;4:416(6880).
15. Vescovi AL, Rietze R, Magli MC, Bjornson C. Hematopoietic potential of neural stem cells. Nat Med. 2002;8(6):535; author reply 536-7.
16. Wagers AJ, Sherwood RI, Christensen JL, Weissman IL. Little evidence for developmental plasticity of adult hematopoietic stem cells. Science 2002;27: 297(5590):2256-9.
17. Hori J, Tat Fong NG, Shatos M, Klassen H, Streilein JW, Young MJ. Neural progenitor cells lack immunogenicity and resist destruction as allografts. Stem Cells 2003;21:05-416.
18. Liechty KW, MacKenzie TC, Shaaban AF, Radu A, Moseley AM, Deans R et al. Human mesenchymal stem cells engraft and demonstrate site-specific differentiation after in utero transplantation in sheep. Nat Med 2000;6(11):1282-6.
19. Generalitat de Catalunya, departament de Sanitat i Seguretat Social. Prevalença de diabetis mellitus no insulinodependent a catalunya. Bulletí Epidemiològic de catalunya 1997;3:41-3.
20. Shapiro AM, Lakei JR, Rian EA. Islet transplantation in seven patients with type I diabetes mellitus using a glucocorticoid-free immunosuppressive regimen. N Engl J Med . 2000;27:230-8.
21. Soria B, Skoudy A, Martin F. From stem cells to beta cells: new strategies in cell therapy of diabetes mellitus. Diabetología 2001;44(4):407-15.
22. Soria B, Roche E, Berna G, Leon-Quinto T, Reig JA, Martin F. Insulin-secreting cells derived from embryonic stem cells normalize glycemia in streptozotocin-induced diabetic mice. Diabetes 2000;49(2):157-62.
23. Lumelsky N, Blondel O, Laeng P, Velasco I, Ravin R, McKay R. Differentiation of embryonic stem cells to insulin-secreting structures similar to pancreatic islets. Science 2001; 92(5520):1389-94.
24. Jenny M, Uhl C, Roche C, Duluc I, Guillermin V, Guillemot F, et al. Neurogenin3 is differentially required for endocrine cell fate specification in the intestinal and gastric epithelium. G EMBO J 2002. 2;21(23):6338-47.
25. Gallo R, Zazzeroni F, Alesse E. REN: a novel, developmentally regulated gene that promotes neural cell differentiation. J Cell Biol 2002.19;158(4):731-40.
26. Bonner-Weir S, Sharma A. Pancreatic stem cells. J Pathol 2002;197:519-26.
27. Gepts W. Pathological Anatomy of the Pancreas in Juvenile Diabetes. Diabetes 1965;14:619-33.
28. Weaver CV, Sorenson RL, Kaung HC. Immunocitochemical localization of insulin-immunoreactive cells in the ducts of rats treated with tripsin inhibitor. Diabetología 1985;28:781-5.
29. Bonner-Weir S, Baxter LA, Schuppin GT, Smith FE. A second pathway for regeneration of the adult exocrine and endocrine pancreas: a possible recapitulation of embrionic development. Diabetes 1993;42:1715-20.
30. Xu G, Stoffers DA, Habener JF, Bonner-Weir S. Exendin-4 stimulates both ß-Cell replication and neogenesis, resulting in increased ß-Cell mass and improved glucose tolerance in diabetic rats. Diabetes 1999;48:4909-18.
31. Sharma A, Zangen DH, Reitz P. The homeodomain protein IDX-1 increases after an early burst of proliferation during pancreas regeneration. Diabetes 1999;48:507-13.
32. Potten C. Stem cells in gastrointestinal epithelium: numbers, characteristics and death. Phil Trans R Soc Lond B 1998;353:821-30.
33. Alison M, Sarraf C. Hepatic stem cells. J.Hepatol. 1998;29:678-83.
34. Block GD, Locker J, Bowen WC. Population expansion, clonal growth and specific differentiation patterns in primary culture of hepatocites induced by HGF/SF, EGF and TGFß in a chemically defined (HGM) medium. J Cell Biol 1996;132:1133-49.
35. Guz I, Nasir I, Teitelman G.2001 Regeneration of pancreatic ß cells from intra-islet precursor cells in an experimental model of diabetes. Endocrionology 1996;142:4956-68.
36. Zulewski H, Abraham EJ, Gerlach MJU. Multipotential nestin-positive stem cells isolated from adult pancreatic islets differentiate ex vivo into pancreatic endocrine, exocrine and hepatic phenotypes. Diabetes 2001;50:521-33.
37. Bouwens L, Wang RN, De Bali E, Pipeleers DG, Kloppel G. Citokeratins as markers of ductal cell differentiation and isle neogenesis in the neonatal rat Pancreas. Diabetes 1994;43:1279-83.
38. Offield MF, Jetton TL, Laboski P. PDX-1 is required for pancreatic outgrowth and differentiation of the rostral duodenum. Development 1996;122:983-5.
39. Teitelman G, Alpert S, Polak JM, Martínez A, Hanahan D. Precursor cells of mouse endocrine pancreas copexpress insulin, glucagon and the neuronal proteins tirosine hidroxilase and neuropeptide I but not pancreatic polipeptide. Development 1993;118:1031-9.
Recibido: 4 de agosto de 2004. Aprobado: 10 de septiembre de 2004.
Dra. M. Eugenia Mato Matute. Fundación Sardá Farriol, Departamento de Biología Celular y Anatomía Patológica. Facultad de Medicina de la Universidad de Barcelona (UB). E-mail: eugenia_mato_matute@yahoo.es
1 Doctora en Ciencias Biológicas. Profesora Asociada.