Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol v.15 n.3 Ciudad de la Habana Sep.-dic. 2004
Trabajos originales
Instituto Nacional de Endocrinología (INEN)
Anticuerpos monoclonales contra la gonadotropina coriónica humana (hCG) para su uso en la detección de embarazo
Lic. Bertha V. Rodríguez Pendás,1 Lic. Rosa de Dios D'Espaux,2 Lic. Julio César Rodríguez García,2 Lic. Celeste Arranz Calzado1 y Dr. Roberto M. González Suárez3
Resumen
Se reporta la generación de 2 anticuerpos monoclonales (AcM) de ratón dirigidos contra la hormona gonadotropina coriónica humana (hCG), a partir de la inmunización de ratones BALB/c con hCG humana, purificada en el Instituto Nacional de Endocrinología (INEN). Los AcM obtenidos son de la clase IgG y fueron purificados a partir de líquido ascítico, mediante cromatografía de afinidad en proteína G Sepharosa. El estudio de afinidad y especificidad demostró que estos anticuerpos podían ser útiles en ensayos inmunoenzimáticos, con el uso de uno de ellos en el sistema microELISA, de nuestra institución, para la detección cualitativa de embarazo en orina.
Palabras clave: Hibridoma, hormonas glicoproteicas, ensayo inmunoenzimático.
La gonadotropina coriónica humana (hCG) es una hormona glicoproteica que se produce en condiciones normales en la placenta y aparece en el plasma y en la orina durante el embarazo.1 La hCG, junto a la hormona folículo estimulante (FSH), la hormona luteinizante (LH) y la hormona estimulante del tiroides (TSH), está constituida por una cadena alfa, estructuralmente similar entre ellas, y una cadena beta específica que determina su actividad biológica.2 Esta hormona estimula la producción de hormonas esteroides por el cuerpo lúteo, lo que propicia el ambiente uterino adecuado para el desarrollo del embrión.3 El principal uso de la determinación de la hCG es el diagnóstico precoz del embarazo; sin embargo, es posible observar niveles elevados en pacientes con carcinomas urogenitales,4 embarazos ectópicos5 y ováricos.6
La determinación de hCG se realizaba tradicionalmente por ensayo inmunoisotópico (RIA) con el uso de anticuerpos policlonales, método altamente sensible pero que presenta un marcado efecto de reacciones cruzadas en relación con las demás hormonas glicoproteicas, lo cual hace poco precisos los resultados. De ahí que recurrir a la tecnología de producción de hibridomas es una ventaja en este sentido, ya que permite disponer de poblaciones homogéneas de anticuerpos que por su especificidad y suministro ilimitado permiten desarrollar metodologías alternativas.
En nuestra institución se desarrolló un método cualitativo para la determinación de ß hCG, con el empleo de un AcM altamente específico (IG1) en la detección de embarazo y patologías productoras de hCG,7 pero la posibilidad de desarrollar nuevas tecnologías analíticas donde estuvieran involucrados AcM anti-hCG se veía limitada por disponer de ese solo AcM que, además, demostró no ser óptimo para unirse a fase sólida. Esto constituyó la motivación principal para realizar este trabajo, donde se reporta el proceso de generación y caracterización de 2 hibridomas secretores de AcM anti-hCG, no con el fin de sustituir al ya existente, sino de disponer de nuevos clones productores de AcM anti-hCG y de la utilización del más adecuado de acuerdo con los resultados de la caracterización, como alternativa en el sistema inmunoenzimático de detección temprana de embarazo, establecido en nuestra institución.
Métodos
Inmunización
Se empleó hCG humana, aislada y purificada en el Instituto Nacional de Endocrinología (INEN).8 Se inmunizaron 5 ratones BALB/c por vía subcutánea, en los días 0, 15 y 21, con dosis de 20 µg de hCG. Para la primera dosis, el antígeno fue emulsionado con adyuvante completo de Freund; para las dosis restantes se empleó adyuvante incompleto. El animal que tenía mayor título de anticuerpos (1/10 000) evaluado por RIA recibió, 3 días antes de la fusión, una última dosis intravenosa de 20 µg de hCG en solución salina, tamponada con fosfato de sodio pH 2.
Fusión, cultivo y clonaje de hibridomas
La hibridización se realizó siguiendo los principios básicos descritos por Kolher en 198,9 con el uso de plasmacitoma de ratón P3X63, Ag8653; se utilizó polietilenglicol 1 500 (BDH) como agente promotor de la fusión y una relación mieloma-linfocito de 1 a 10. Como cultivo de células alimentadoras se utilizaron linfocitos provenientes del bazo de un ratón no inmunizado. Las células fundidas se sembraron en placas Costar de 96 pozos a una concentración de 100 000 células/mL de medio.
El medio de cultivo utilizado fue RPMI 1640 (Gibco) suplementado con 17 MM de bicarbonato de sodio, 18 de hepes, 2 de glutamina, 1 de piruvato de sodio, 0,05 de 2 mercaptoetanol, 20 % de suero de ternero fetal y 40 µg/mL de gentamicina. Durante los primeros 14 días después de la fusión se utilizó el medio de cultivo selectivo hipoxantina 10 MM, aminopterina 4 x 10-7 M y timidina 1,6 x 10-5 M. A partir de la segunda semana de cultivo se realizó el tamizaje primario de los sobrenadantes para determinar la presencia de anticuerpos específicos anti-hCG, con el empleo de un RIA en fase líquida.
Los cultivos de hibridomas seleccionados para la producción se clonaron y reclonaron por el método de dilución limitante10 y se expandieron en frascos de cultivo, los cuales fueron utilizados para la recuperacion del AcM a partir de los sobrenadantes, así como para la crioconservación de las células y su inoculación a ratones.
Sistema de detección de anticuerpos
Para la presencia de anticuerpos anti-hCG en los sobrenadantes de los cultivos de hibridomas y sus ascitis se utilizó un método isotópico en fase líquida a partir del cual se incubaron 50 µL de las muestras con 100 µL de la hormona marcada con 125I (hCG-125I) y 250 µL de tampón fosfato, pH 7,4 por 16 h a 4 ºC. El complejo antígeno-anticuerpo fue precipitado por adición de 100 µL de suero normal de ratón, 100 de suero antitotal de ratón y 300 de PEG (6 000) al 15 % en EDTA, e incubado por 1 h a temperatura ambiente. Una vez centrifugado 30 min a 2 000 g, la radiactividad del precipitado fue medida en un contador gamma LKB. Se establecieron controles de radiactividad total y de unión inespecífica, así como controles negativos (sobrenadante de cultivo de un hibridoma no relacionado) y positivos (suero del ratón utilizado en la fusión).
Determinación del isotipo de los anticuerpos monoclonales
Se empleó un juego de reactivos con antisueros clasificadores para las diferentes clases y subclases de inmnoglobulinas de ratón (Amersham). Los sobrenadantes de cultivo de los hibridomas seleccionados se enfrentaron a los antisueros clasificadores específicos, en un ensayo de inmunodifusión doble en gel de agarosa.11
Obtención de ascitis
Para la producción de líquido ascítico tumoral rico en AcM se inocularon 3 millones de células híbridas en la cavidad peritoneal de ratones BALB/c, previamente tratados con 0,5 mL de pristane TM (Aldrich) por la misma vía. El líquido ascítico, colectado por punción abdominal aproximadamente entre 7 a 10 días después de la inoculación, se centrifugó para eliminar los residuos de fibrina, se le añadió timerosal al 0,1 % y se conservó en alícuotas a -20 ºC, hasta su purificación.
Purificación de los anticuerpos monoclonales
La purificación de los AcM anti hCG a partir de los fluidos ascíticos se realizó por cromatografía de afinidad en una columna con proteína G, utilizando tampón fosfato 0,02 M pH 7 para diluir las muestras a partes iguales. La elusión se realizó con tampón glicina 0,1 M pH 2,7. La determinación de la actividad de los eluatos y de las ascitis antes de purificar se realizó mediante un RIA en fase líquida con iguales condiciones a las ya descritas. Todas las determinaciones de proteínas se realizaron por el método de Lowry12 y se determinó la concentración de IgG de ratón específica por ELISA;13 su pureza se analizó en gel de poliacrilamida (10 %) con dodecil sulfato de sodio (SDS-PAGE).
Desplazamiento y especificidad de los AcM en RIA en fase líquida
Para evaluar el comportamiento de los anticuerpos obtenidos en un sistema de radioinmunoensayo se estudió la curva de desplazamiento del trazador por la hCG. Para esto se utilizaron diluciones de cada AcM con un 20 % de unión a la hCG-125I en RIA en fase líquida, y 100 µL de estándar de hCG a diferentes concentraciones de dicha hormona desde 100 hasta 6 ng/mL.
Para determinar la posible reacción cruzada de nuestros anticuerpos con las hormonas glicoproteicas estructuralmente relacionadas, se realizó un RIA en fase líquida con las mismas condiciones experimentales al descrito previamente para la detección de anticuerpos, así como 100 µL de FSH, LH y TSH a concentraciones desde 1 000 a 1 ng/mL, frente a diluciones limitantes de los anticuerpos anti hCG.
Determinación de la constante de afinidad (Ka)
A partir de las curvas de desplazamiento del RIA en fase líquida de los diferentes AcM con altas concentraciones de estándar, se calcularon los parámetros requeridos para determinar la Ka de cada anticuerpo por análisis de Scatchard:14
U: concentración de antígeno unido al anticuerpo.
L: concentración de antígeno libre.
Aplicación de los AcM anti-hCG en un ensayo inmunoenzimático cualitativo
Los AcM obtenidos (GB3 y GB8) fueron comparados con el AcM IG1, utilizado en el ensayo de detección de embarazo desarrollado en el INEN7 y por los resultados de afinidad y especificidad de estos decidimos utilizar el AcM GB8 en el ensayo por cumplir con las características deseadas para esta aplicación.
En placas de cloruro de polivinilo de 96 pozos, recubiertas con un anticuerpo policlonal anti hCG en conejo (obtenido en el INEN) a una concentración de 5 µg/mL, se añadieron 50 µL de muestra de orina de las pacientes o de controles, conjuntamente con 50 µL del AcM anti hCG (IG1 o GB8) a una concentración de 10 µg/mL, y se incubaron 15 min a temperatura ambiente en la oscuridad. Pasado este tiempo, se lavó la placa 3 veces con tampón Tris-Tween 20, 0,01 M pH 7,8; se añadieron 100 µL de conjugado anti ratón peroxidasa (Amersham) y se incubó 15 min a temperatura ambiente en la oscuridad; luego se repitió el proceso de lavado. La reacción de color se produjo al añadir 100 µL de sustrato ortofenilendiamina 0,01 M a cada pozo durante 15 min y se detuvo la reacción con 20 µL de ácido sulfúrico 2,5 N. La densidad óptica (DO) a 492 nM se midió en el espectrofotómetro del equipo SUMA. En el diagnóstico de rutina los resultados obtenidos se compararon con los colores desarrollados por los controles, tanto positivo (100 UI/mL) como negativo (6 UI/mL). El diagnóstico de embarazo se estableció cuando el color desarrollado fue superior al control negativo y similar o superior al control positivo, con valores de DO similar al control positivo (= 0,950) o más de 3 veces superior a la concentración del control negativo (= 0,230). Los casos donde no se pudo establecer claramente este criterio se reportaron como dudosos.
Se utilizaron 50 muestras positivas y negativas de mujeres provenientes de la consulta de ginecología del hospital ginecoobstétrico "Ramón González Coro", para ser evaluadas con AcM y comparar sus resultados.
Resultados
A partir de la técnica de fusión se obtuvieron híbridos en el 87 % de los pozos, los cuales se clonaron y reclonaron, lo que dio lugar a 2 clones estables productores de AcM anti-hCG que se denominaron GB3 y GB8 respectivamente. En este trabajo se describen las características de estos hibridomas y la utilización de uno de ellos en un ELISA cualitativo, para la determinación de embarazo.
El sistema de detección de los anticuerpos por RIA en fase líquida resultó eficiente en todos los casos, al poder detectar porcentajes de unión adecuados para esta determinación en el orden de 20 a 30 % de cada una de las muestras frente a la hCG-125I, tanto en los sobrenadantes de cultivo como en las ascitis obtenidas.
El estudio de isotipo con anticuerpos específicos demostró que las 2 líneas de hibridomas secretaban AcM del tipo IgG1 y su cadena ligera es kappa, lo que se correspondió con las fracciones eluidas a los pH utilizados en la purificación.
La cromatografia de afinidad en proteína G utilizada para la purificación de los AcM anti-hCG fue rápida y eficiente, y se obtuvieron preparaciones con un elevado grado de pureza, lo cual se refleja en la figura 1, tomando como ejemplo representativo la purificación del AcM GB8.
FIG. 1. Purificación del AcM anti-hCG (AcM GB8) por columna de afinidad con proteína G.
En la tabla 1 podemos observar que los porcentajes de unión específica fueron de 27 % para el GB3 y 25 para el GB8. El control analítico de ambos anticuerpos purificados en cuanto a su concentración de proteínas por Lowry fue muy similar, con la obtención de valores de 0,75 mg/mL en ambos casos. La concentración de IgG de ratón (anti-hCG) también reflejó concentraciones similares de 0,6 mg/mL y 0,7 mg/mL para el GB8 y GB3, respectivamente, lo que nos indica también el grado de pureza, pues la cantidad total de proteínas obtenidas en la purificación se corresponde con las IgG de ratón específicas.
Tabla 1. Características analíticas de los anticuerpos GB3 y GB8
| AcM | Porcentaje de unión específica RIA | Proteínas Lowry mg/mL | IgG ELISA mg/mL | Ka* 108 M-1 | Isotipo |
| GB3 | 27 | 0,75 | 0,6 | 0,514 | IgG1 k |
| GB8 | 25 | 0,75 | 0,7 | 3,738 | IgG1 k |
* Constante de afinidad.
Las características cinéticas de los anticuerpos monoclonales anti-hCG evaluados por RIA mostraron un desplazamiento de los hibridomas GB3 y GB8 con porcentajes de unión a la hCG-125I entre 80 y 20 % para concentraciones de hCG, que oscilaron en un rango de 12,5 a 800 mU/mL.
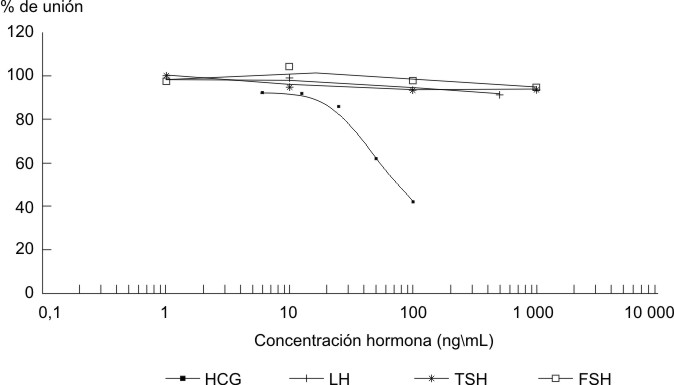
Los resultados de la especificidad de los anticuerpos monoclonales obtenidos, en relación con el resto de las hormonas glicoproteicas, pueden apreciarse en las figuras 2 y 3 correspondientes al GB3 y GB8, respectivamente. El estudio realizado utilizó concentraciones de las hormonas glicoproteicas (FSH, LH y TSH) 10 veces superiores al rango de trabajo de las curvas de calibración de hCG utilizadas; sin embargo, no desplazaron la unión de los AcM a la hCG-125I, lo que demuestra que estos anticuerpos no presentan reacción cruzada con las otras gonadotropinas utilizadas en el ensayo y son específicos para la cadena beta de la hCG. La alta especificidad de estos anticuerpos pudiera resolver los problemas generados como consecuencia de la gran heterogeneidad de las formas circulantes de la hormona hCG para su análisis y purificación.15
FIG. 2. Estudio de especificidad del anticuerpo monoclonal GB3 ante concentraciones crecientes de las hormonas LH, FSH y TSH (1 000-1 ng/mL).
FIG. 3. Estudio de especificidad del anticuerpo monoclonal GB8 ante concentraciones crecientes de las hormonas LH, FSH y TSH (1 000-1 g/mL).
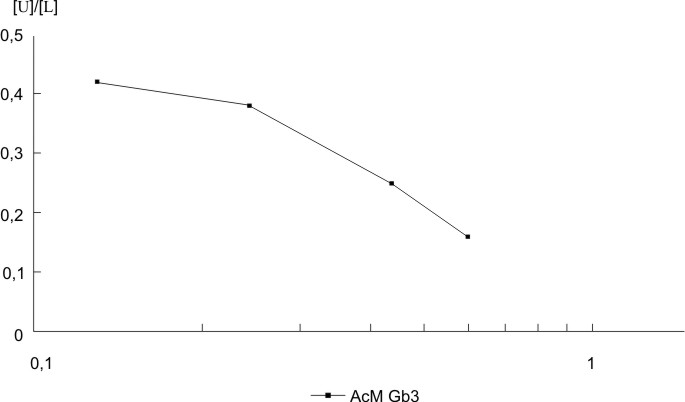
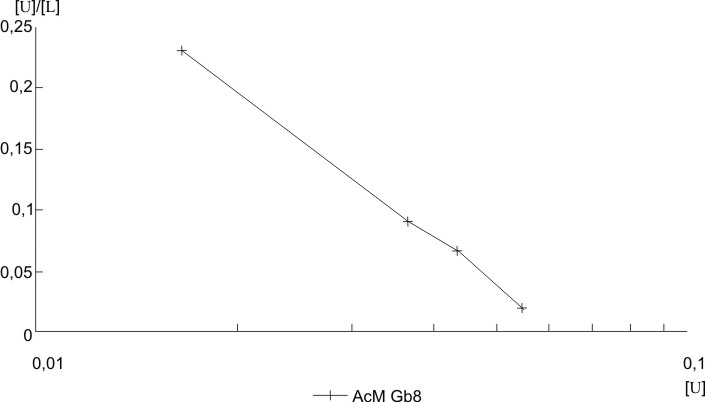
Los anticuerpos monoclonales anti-hCG (GB3 y GB8) resultaron tener valores de constante de afinidad de 0,514 x 108 y 3,738 x 108 M-1, respectivamente, y se observa en las figuras 4 y 5 que la gráfica de Scatchard fue lineal, lo que constituye otro argumento a favor de la monoclonalidad de estos anticuerpos. El GB8 tiene una Ka mayor; por tanto, posee una capacidad mayor de unirse al antígeno, por lo que cumple con los parámetros de afinidad y especificidad necesarios para ser introducido en un método analítico.
FIG. 4. Determinación de la constante de afinidad del AcM anti- hCG (GB3). Gráfica de Scatchard.
FIG. 5. Determinación de la constante de afinidad del AcM anti- hCG (GB8). Gráfica de Scatchard.
Con este fin se realizaron determinaciones de hCG con el AcM-GB8 a muestras positivas y negativas, y no se encontraron diferencias entre los resultados de estas al utilizar el AcM IG1 del ensayo cualitativo para diagnóstico de embarazo y nuestro AcM GB8 (tabla 2), lo que demuestra que este nuevo anticuerpo cumple con los requisitos para los cuales fue creado y permite su incorporación al método, al no encontrarse diferencias entre los resultados para cada anticuerpo.
Tabla 2. Comparación de los resultados de las muestras en el ELISA cualitativo con los diferentes anticuerpos monoclonales
| Muestras (N = 50) | AcM IGI (control) | AcM GB8 |
| Casos + | 42 | 42 |
| Casos - | 8 | 8 |
Discusión
Del tamizaje inicial se seleccionaron 2 cultivos de hibridomas secretores de anticuerpos monoclonales específicos para la hCG, con porcentajes de unión en un rango entre 20 y 30 %.
La utilización de la cromatografía de afinidad en matriz de proteína G, fue eficiente según se observó en la figura 1, correspondiente a la purificación del AcM GB8, como ejemplo del proceso de purificación desarrollado.
Aunque se han informado técnicas alternativas para la purificación de AcM a partir de sobrenadantes de cultivo, precisamente para eliminar de las preparaciones los posibles contaminantes,16 en nuestro caso con la utilización del método tradicional de producción de ascitis17 y las purificaciones por cromatografía de afinidad obtuvimos cantidades suficientes de AcM, con un alto grado de pureza, suficiente para ser utilizado en sistemas de diagnóstico in vitro.
En todos los casos, las muestras de anticuerpos procesadas eran capaces de atrapar entre 20 y 30 % de la cantidad del trazador añadido, es decir, aproximadamente 10 000 cpm (conteos por min).
Las curvas de desplazamiento de los AcM obtenidos y evaluados por RIA mostraron porcentajes de unión a la hormona hCG-125I, entre un 20 y 80 %, para concentraciones que oscilaron en un rango de 100-6 ng/mL. Con el estudio de especificidad demostramos que los anticuerpos obtenidos son específicos para la cadena ß de la hCG (figs. 2 y 3 ). Esto demuestra, además, que la estrategia de pesquizaje y los correspondientes clonajes de los híbridos productores fue válida, pues no se encontró reacción cruzada con ninguna de las hormonas hipofisarias.
La posibilidad de poder caracterizar en términos cinéticos la afinidad de los AcM permite la selección óptima de parejas de AcM sobre la base de su afinidad. Según se observó en las figuras 4 y 5, el estudio de afinidad por análisis de Scatchard de los AcM obtenidos demostró que los valores de Ka son aceptables para este tipo de anticuerpos, los cuales son similares a los encontrados con otros AcM específicos a la hCG.18-19
Los resultados obtenidos al utilizar el AcM GB8 en el sistema microELISA cualitativo para la detección de embarazo muestran que el GB8 cumple con los requisitos de especificidad y afinidad necesarios para su incorporación al método, como una posible alternativa de trabajo para este ensayo cualitativo de alta sensibilidad y especificidad.
Disponer de una batería de AcM específicos a la hCG, además de garantizar el mantenimiento estable del ensayo de determinación cualitativa de hCG en orina, desarrollado previamente en nuestra institución, posibilitaría el desarrollo de un sistema cuantitativo de alta especificidad con la combinación de estos, que no reconozca ninguna molécula que no sea la hCG, sobre todo la LH, con la cual tiene tantas semejanzas estructurales, tanto en la cadena alfa como en la beta.20
Otros usos de gran importancia en cuanto a los 2 AcM obtenidos pudieran estudiarse en nuevos ensayos no instrumentales,21 así como la sustitución del anticuerpo policlonal anti-hCG que se utiliza en la fase sólida de este método cualitativo, por uno de estos AcM, como se recomienda en los diseños que emplean parejas de AcM en formatos de doble captura.22
Los anticuerpos monoclonales anti-hCG obtenidos mostraron cumplir con los requisitos de afinidad y especificidad deseada, para su potencial utilidad junto a un anticuerpo policlonal en el desarrollo de sistemas inmunoenzimáticos para determinar hCG en orina.
Summary
The generation of 2 mouse monoclonal antibodies directed against the human chorionic gonadotropin hormone (CGh), starting from the immunization of BALB/c mice with human CGh purified at the National Institute of Endocrinology (NIEN) is reported. IgG monoclonal antibodies were obtained. They were purified starting from the ascitic fluid by affinity chromatography in protein G Sepharose. The affinity and specificity study showed that these antibodies could be useful in immunoenzimatic assays, using one of them in the microELISA system of our institution for the qualitative detection of pregnancy in urine.Key words: Hybridoma, glycoprotein hormones, immunoenzymatic assay.
Referencias bibliográficas
1. Birken S, Maydelman Y, Gawinowicz MA, Pound A, Liu Y, Hartree A. Isolation and characterization of human pituitary chorionic gonadotropin. Endocrinol 1996;137.p.1402-11.
2. Melmed S, Kleinberg D. Anterior pituitary gonadotropins. Section two. En: Larsen PR, Kronenberg HM, Melmed S, Pllonsky KS, eds. William Texbook of Endocrinology. Tenth Ed: Philadelphia; Elsevier Science 2003.p.212-9.
3. Ornoy A. The role of the placenta in the maintance of normal pregnancy. Isr Med Assoc J 2000;2.p.838-40.
4. Berger P, Sturgeon C, Bidart JM, Paus E, Gerth R, Niang M et al. Toward user-oriented standarization of pregnancy an tumor diagnosis: assigment of epitopes to the three dimensional structure of diagnostically and comercially relevant monoclonal antibodies directed against human chorionic gonadotropin and derivaties. Tumour Biol 2002;23:1-38.
5. Borreli PT, Butler SA, Docherty SM, Staite EM, Borrelli AL, Iles RK. Human chorionic gonadotropin isoforms in the diagnosis of ectopic pregnancy. Clin Chem 2003;49:2045-9.
6. Tabas JA, Strehlow M, Isaacs E. A false negative pregnancy test in a patient with a hydatiform molar pregnancy. N Engl J Med 2003;349.p.2172-3.
7. García G, Arranz C, Rodríguez B, Almeida I. González R. Validación de un juego de reactivos (cualinen-hCG) para la detección cualitativa de gonadotropina coriónica humana en el embarazo. Rev Cubana Endocrinol 2002;13:221-30.
8. Birken S, Canfield RE. Chemistry and inmunochemistry of human chorionic gonadotropin. En: Segal SJ (ed). Chorionic Gonadotropin. New Yok: Plenum Press 1998:65-88.
9. Kohler G. The technique of hybridoma production. In Immunological methods. New York: Academic Press 1981;12:285-98.
10. Campbell, AM. Selection and cloning. En: Campbell AM (ed). Monoclonal antibody and immunosensor technology. Elsevier Science Publishers, Amsterdam, The Netherlands 1991:225-37.
11. Ouchterlony O, Nielsson LA. Immunodiffusion and immunoelectrophoresis. En: Weir DM (ed). Handbook of experimental immunology. Editorial Blakwell Scientific Publications; 1978:196.
12. Lowry OH, Rosebrough NJ, Farr Al, Randall RJ. Protein measurement with the folin phenol reagent. J Biol Chem 1951;193.p.265-9.
13. Díaz E, Arranz C, Deas R, González R. Metodología preparativa y analítica para estandarizar y validar un sistema ELISA para cuantificar IgG de ratón. Rev Cubana Endocrinol 1998;9:53-62.
14. Scatchard G. The attraction of proteins for small molecules and ions. New York. Ann Acad Sci 1954;51.p.660672.
15. Tayapiwatana C, Poonpipat P. Characterization of monoclonal antibodies recognizing alpha and beta subunits of human chorionic gonadotropin hormone. Asian Pac J Allergy Immunol 1998;16:127-35.
16. Valdés VR. Alternative techniques to obtain monoclonal antibodies at a small scale: Current State and Future Goals. Biotecnología Aplicada 2002;19:119-31.
17. Jackson LR, Trudel LJ, Fox JG, Lipman NS. Monoclonal antibody production in murine ascitis I. Clinical and Pathologic features. Laboratory Animal Science 1999;49:70-19.
18. Baluja I, Brito A, Acosta C, Hernández M, Zalueta O, Melchor A. Monoclonal antibody against free beta subunit of human chorionic gonadotropin. Hybrid Hybridomics 2002;21:381-4.
19. Novo C, Domingos A, Karmali A. Purification and characterization of monoclonal antibodies against the free alpha subunit of human chorionic gonadotrophin. Mol Biotechnol 2001;17:119-28.
20. Van Amerogen A. Human chorionic gonadotropin determination in LH presence using monoclonal antibody. Pept Res 1994;7:83-90.
21. Madersbacher S, Berger P. Antibodies and immunoassays. Methods 2000;21:41-50.
22. Cole LA. Immunoassay of human chorionic gonadotropin, its free subunits and metabolites. Clin Chem 1997;43:2233-43.
Recibido: 8 de mayo de 2004. Aprobado: 5 de septiembre de 2004.
Lic. Bertha Rodríguez Pendás. Instituto Nacional de Endocrinología. Zapata y D, Vedado, Ciudad de La Habana, Cuba. Email:berthapendas@infomed.sld.cu
1 Investigadora Auxiliar.
2 Investigador Agregado.
3 Investigador Titular.