Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol v.15 n.3 Ciudad de la Habana Sep.-dic. 2004
Instituto Nacional de Endocrinología (INEN)
Tratamiento del bocio tóxico difuso con 131I en dosis de 80 µCi/g de tejido tiroideo
Dr. Francisco Ochoa Torres,1 Dr. Hugh Gregorio Knight Bermúdez2 y DrC. Ernesto Alavez Martín3
Resumen
El 131I ha demostrado ser la terapéutica más eficaz en el tratamiento del bocio tóxico difuso (BTD). Sin embargo, no existe consenso sobre la dosis a administrar: fija o de acuerdo con la actividad funcional del tiroides y su tamaño. Con el fin de evaluar los resultados terapéuticos con una dosis de 80 µCi/g de tejido tiroideo, estimado por palpación y sin tener en cuenta la actividad funcional del tiroides, se estudiaron 61 pacientes diagnosticados por la clínica, así como las determinaciones de TSH y T4 total en edades entre 20 y 80 años, de uno y otro sexos, con tamaño de la glándula de más de 30 g y si habían recibido o no propiltiouracilo (PTU) previamente. El seguimiento postratamiento se realizó cada 2 meses durante 3 años por el mismo especialista y con iguales procederes. La eficacia del tratamiento con la primera dosis fue de 85,2 %. La frecuencia de hipotiroidismo a los 3 años de evolución fue de 29,5. La edad del paciente, el sexo, el tamaño del bocio y el tratamiento con PTU no influyeron en la respuesta a este. Las ventajas mostradas por el método fueron: una eficacia alta, la dosis de 131I se calcula con facilidad, es fácil de aplicar, disminuye el costo al no tener que realizar valoración del estado funcional de la glándula y reduce las consultas.
Palabras clave: Bocio tóxico difuso, tratamiento.
El empleo del 131I como tratamiento del bocio tóxico difuso (BTD) comenzó en el año 1942 y ha ido ganando adeptos en el decursar de los años. Actualmente puede considerarse como el tratamiento de elección para el control del hipertiroidismo del BTD, pues aunque no actúa sobre la etiología de la enfermedad, al eliminar las células productoras de tiroxina (T4) y triyodotiroxina (T3) suprime las manifestaciones clínicas de esta y el paciente se siente curado.
Las razones que han motivado su aplicación son las siguientes: es un proceder terapéutico de aplicación sencilla, muy eficaz, de costo comparativamente bajo y los efectos secundarios señalados al principio de su empleo se han ido descartando; en el presente sólo está contraindicado en gestantes y durante la lactancia.1,2 La complicación que con mayor frecuencia se presenta es el hipotiroidismo, lo cual constituye la principal objeción que ha sido señalada por la mayoría de los investigadores y que aumenta con los años de evolución postratamiento,3-7 pues el hipoparatiroidismo se presenta raramente,8,9 pero su forma latente se observa con mayor frecuencia.10 El diagnóstico del cáncer tiroideo y de la leucemia posteriores al tratamiento es muy poco frecuente y en estos momentos no se acepta que pudieran tener una relación de causa y efecto.11-13
La mayor discrepancia en el empleo del 131I como tratamiento del BTD está relacionada con la dosis que debe aplicarse a estos pacientes y la forma de calcularla, pues no existe consenso al respecto,14 ya que el objetivo básico del tratamiento (erradicar el hipertiroidismo y evitar el hipotiroidismo) no se ha logrado. Para calcular la dosis de 131I a administrar se han empleado varios procederes: a) dosis fijas, calculada o no, de acuerdo con el tamaño o con la actividad de la glándula;15,16 b) dosis de acuerdo con el tamaño de la glándula y administrar 5 mCi si esta es pequeña, 10 si es mediana y 15 cuando es grande;7,17 c) dosis fijas de 10 mCi;18,19 d) dosis de 80 a 160 (micro) µCi/g de tejido tiroideo y de acuerdo con la captación de yodo en 24 h;20,21 e) dosis de 10 a 30 mCi, según el tamaño del bocio y la concentración de triyodotironina (T3)22 y f) dosis calculada sobre la base de 8 mCi x 100 % de captación de 123I el día antes del tratamiento y si osciló entre 10 y 30 mCi.23
El Instituto Nacional de Endocrinología ha utilizado históricamente dosificaciones diferentes de 131I con el propósito de acercarse a la dosis ideal, que sería aquella que produjera la mayor eficacia terapéutica, es decir, la erradicación del hipertirodismo con la dosis inicial y con el menor número posible de hipotiroidismo postratamiento. Las dosis se han calculado basándose en una fórmula matemática en la cual se tenía en cuenta la intensidad radiactiva, que se deseaba absorbiera el tiroides (3 000, 6 000 y 9 000 rads [30-90Gy]), el tamaño de la glándula -estimado por palpación digital- y su actividad funcional, lo cual permitió administrar entre 1 y 7 mCi.24 La dosis, calculada en igual forma, se repetía cada 6 meses, de ser necesario, hasta lograr el control definitivo del hipertiroidismo. En el momento actual se cuestiona este método, ya que presenta dificultades como son: tener que realizar previamente una captación de 131I en 72 h para obtener la captación a las 24 h y la vida media efectiva (VME), así como -al menos- una interconsulta con el radioterapeuta (Ochoa F, Alavez E. Aportes al estudio del hipertiroidismo en Cuba. Trabajo de terminación de la Residencia. INEN. 1971; Llerena V, Alavez E. Valoración del tratamiento quirúrgico y con 131I en el BTD. Trabajo de terminación de la Residencia. INEN. 1978; Lores E, Ochoa F. Resultados del tratamiento del hipertiroidismo con 131I a la dosis de 60 grays. Trabajo de terminación de la Residencia. INEN. 1993).
Por tal motivo, nos propusimos calcular la dosis sin tener en cuenta la actividad funcional de la glándula y sólo valorar su tamaño, y de acuerdo con nuestra experiencia, conjuntamente con el departamento de radiobiología del Instituto Nacional de Oncología (INOR), se decidió emplear una dosis calculada de 80 µCi/g de tejido tiroideo y evaluar sus resultados terapéuticos.3
Métodos
Se estudiaron 61 pacientes hipertiroideos por BTD tratados con 131I a una dosis de 80 µCi/g de tejido tiroideo, atendidos en consulta externa del Instituto Nacional de Endocrinología (INEN), en el período comprendido entre 1985-2000.
Los pacientes debieron reunir los siguientes criterios: edad entre 20 y 80 años, de uno y otro sexos, con un índice de tirotoxicosis >19,25 concentración sérica de T4t >150 nmol/L y de TSH (hormona hipofisaria estimuladora del tiroides) < 0,3 mUI/L, que tuvieran 3 años de seguimiento después de la primera dosis de 131I y atendidos siempre por el mismo especialista. El hecho de haber ingerido previamente antitiroideos de síntesis (propiltiouracilo: PTU) no fue excluyente.
El tratamiento se realizó en el departamento de radiobiología del INOR y la dosis se calculó multiplicando 80 µCi/g de tejido tiroideo estimado por palpación digital sin tener en cuenta la actividad funcional del tiroides (captación de 131I a las 24 h y la vida media efectiva VME). La dosis calculada se administró por vía oral en ayuna. Los pacientes fueron mantenidos en observación durante 2 h después de la ingestión del radiofármaco, con el objetivo de asegurar la total asimilación del 131I y detectar la aparición de reacciones adversas.
El seguimiento posterior a la ingestión del 131I se realizó cada 2 meses teniendo en cuenta la clínica y las pruebas funcionales tiroideas mencionadas. La dosis de 131I se repitió cada 6 meses si persistía el hipertiroidismo.
En la investigación se evaluaron los siguientes aspectos:
- Eficacia de la dosis de 131I según el porcentaje de pacientes que eliminaron el hipertiroidismo después de la aplicación de la primera dosis del radiofármaco.
- Persistencia del hipertirodismo (se considera cuando a los 6 meses del primer tratamiento con 131I este se mantiene).
- Frecuencia del hipotiroidismo: porcentaje de pacientes que presentaron hipotiroidismo en los primeros 3 años postratamiento.
Variables analizadas y su posible relación con la eficacia de la dosis. Distribución de los pacientes
- Grupos de edades:
20 a 29: 8 (13,1).
30 a 39: 32 (52,4).
40 a 49: 12 (19,7).
50 a 59: 5 (8,2).
60 a 80: 4 (6,6). - Tamaño del tiroides:
Bocio pequeño: > 30 y < 50 g: 8 (13,1).
Bocio mediano: = 50 y < 80 g: 46 (75,4).
Bocio grande: = 80 g: 7 (11,5). - Sexo:
Femenino: 53 (86,9).
Masculino: 8 (8,13). - Tratamiento previo con propiltiouracilo (PTU):
Sí: 8 (13,1).
No: 53 (86,9).
El medicamento se suspendió a los 6 meses al persistir el hipertiroidismo.
Procesamiento y análisis estadístico
Se determinaron las distribuciones de frecuencias de las variables cualitativas, así como la media y desviación estándar de las cuantitativas.
Los valores promedio de las variables cuantitativas antes y después del tratamiento se compararon mediante la prueba de t de Student para muestras pareadas; la distribución de las variables cualitativas antes y después del tratamiento se comparó mediante la prueba de McNeuman.
Se evaluó la posible asociación de la eficacia del tratamiento con las variables señaladas, mediante la prueba de Chi cuadrado. Se estimó como nivel de significación p < 0,05.
Resultados
Con la primera dosis de 131I de 80 µCi/g de tejido se logró la desaparición del hipertiroidismo en 52 pacientes (85,2 %) en los primeros 6 meses, mientras persistió en 9 (14,8); de ellos, 7 (11,5) requirieron una segunda dosis para eliminarlo antes de los 12 meses, y los otros 2 (3,3) una tercera dosis para eliminarlo a los 18 meses (tabla 1).
Tabla 1. Eficacia de la dosis de 131I en el tratamiento de los pacientes con BTD
| Dosis* | Eliminación del hipertiroidismo | |
| No. | % | |
| 1ra. | 52 | 85,2 |
| 2da. | 7 | 11,5 |
| 3ra. | 2 | 3,3 |
| Total | 61 | 100,0 |
* El intervalo entre las dosis fue de 6 meses.
Respuesta al tratamiento según las variables estudiadas
a) De acuerdo con las edades:De los 8 pacientes comprendidos entre 20 y 29 años (tabla 2), 7 se controlaron con una dosis (87,5 %) y persistió en 1 (12,5); de los 32 del grupo entre 30 y 39 años, 27 (84,4) resolvieron con la primera dosis y no así 5 de ellos (15,6); de los 12 del grupo de 40 a 49 años, 10 (83,3) resolvieron con la primera dosis y en 2 (16,7) persistió; de los 5 del grupo de 50 a 59 años, 4 (80,0) resolvieron con la primera dosis y en 1 (20,0) persistió y de los 4 del grupo de 60 a 80 años, 4 (100,0) resolvieron con la primera dosis. No hubo diferencia significativa entre los grupos (tabla 2).
Tabla 2. Relación entre eficacia de la dosis de 131I y los grupos de edades
| Grupos de edades (años) | Eliminación del hipertiroidismo | Persistencia del hipertiroidismo | Total de pacientes | |||
| No. | % | No. | % | No. | % | |
| 20-29 | 7 | 87,5 | 1 | 12,5 | 8 | 13,1 |
| 30-39 | 27 | 84,4 | 5 | 15,6 | 32 | 52,4 |
| 40-49 | 10 | 83,3 | 2 | 16,7 | 12 | 19,7 |
| 50-59 | 4 | 80,0 | 1 | 20,0 | 5 | 8,2 |
| 60-80 | 4 | 100 | 0 | 0 | 4 | 6,6 |
| Total | 52 | 85,2 | 9 | 14,8 | 61 | 100,0 |
X2 = 0,888; p = 0,92.
b) De acuerdo con el tamaño del bocio:
De los 8 pacientes con bocio pequeño, 7 resolvieron con la primera dosis (87,5 %) y en 1 (12,5) persistió el hipertiroidismo; de los 46 que presentaban bocio mediano, 38 resolvieron con la primera dosis (82,6) y en 8 (17,4) se mantuvo, mientras los 7 pacientes con bocios grandes resolvieron con la primera dosis. No hubo diferencia significativa entre los grupos (tabla 3).
Tabla 3. Relación entre la eficacia de la dosis de 131I y el tamaño del bocio
| Tamaño del bocio (g) | Eliminación del hipertiroidismo | Persistencia del hipertiroidismo | Total de pacientes | |||
| No. | % | No. | % | No. | % | |
| > 30 y < 50 | 7 | 87,5 | 1 | 12,5 | 8 | 13,1 |
| = 50 y < 80 | 38 | 82,6 | 8 | 17,4 | 46 | 75,4 |
| = 80 | 7 | 100 | - | - | 7 | 11,5 |
| Total | 52 | 85,2 | 9 | 14,8 | 61 | 100 |
X2 = 1,498; p = 0,47.
c) De acuerdo con el sexo:De los 53 pacientes del sexo femenino, 45 (84,9 %) resolvieron con una sola dosis, mientras que en 8 (15,1) el hipertiroidismo persistió, y de los 8 pacientes del sexo masculino, 7 (87,5) resolvieron con una dosis, mientras que persistió en 1 (12,5). No hubo diferencia significativa entre uno y otro sexos.
d) De acuerdo con el tratamiento con PTU:
De los 8 pacientes tratados, 7 (87,5 %) resolvieron con la primera dosis, mientras que el hipertiroidismo persistió en 1 (12,5), y de los 53 no tratados, resolvieron con la dosis inicial 45 (84,9), mientras que 8 (15,1) se mantuvieron hipertiroideos. No hubo diferencia significativa entre ambos grupos (tabla 4).Tabla 4. Relación entre la eficacia de la dosis de 131I y el tratamiento previo con propiltiouracilo
| Pacientes | Eliminación del hipertiroidismo | Persistencia del hipertiroidismo | Total de pacientes | |||
| No. | % | No. | % | No. | % | |
| No tratados con propiltiouracilo | 45 | 84,9 | 8 | 15,1 | 53 | 86,9 |
| Tratados con propiltiouracilo | 7 | 87,5 | 1 | 12,5 | 8 | 13,1 |
| Total | 52 | 85,2 | 9 | 14,8 | 61 | 100,0 |
X2 = 0,117; p = 0,73.
Frecuencia del hipotiroidismo
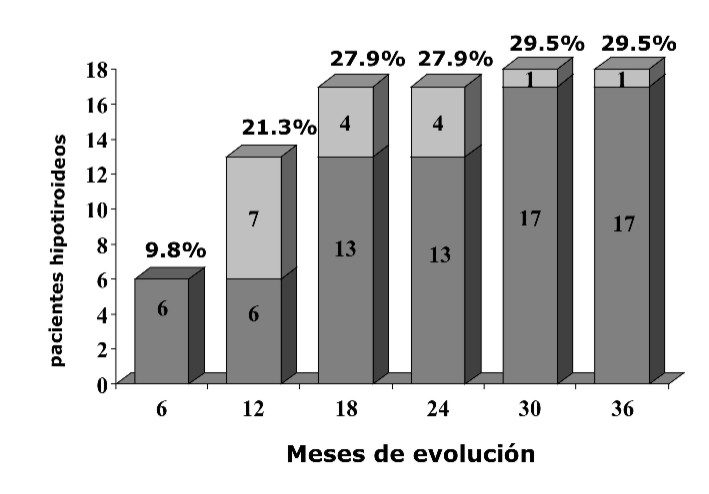
En los primeros 6 meses presentaron hipotiroidismo 6 pacientes (9,8 %) y 7 (11,5) en los 6 meses siguientes, para un total de 13 (21,3) en el primer año de tratamiento; en los 6 meses posteriores se incrementaron a 17 (27,95) y en los 18 meses siguientes no se observaron nuevos casos con hipotiroidismo. A los 30 meses se presentó otro paciente, quien elevó la cifra de hipotiroidismo a 18 (29,5), la cual no varió durante los últimos 6 meses del estudio (fig. 1).
FIG. Frecuencia de hipotiroidismo postratamiento en 3 años de evolución (n = 61).
Discusión
En el Instituto de Endocrinología se han aplicado diversas dosis tratando de evitar el hipotiroidismo pos 131I, y en la primera dosis se alcanzó una eficacia del 34 al 77,5 %.24 Es necesario señalar que para calcular la dosis de mCi a administrar, en estos estudios se empleó la fórmula en la cual se tiene en cuenta el tamaño de la glándula y su actividad funcional.
En el extranjero se han aplicado también diferentes procederes: en la década del 80, Torres18 aplicaba dosis fija de 10 mCi para todos los pacientes y obtuvo una eficacia para la primera dosis del 81 %. No se tuvo en cuenta el tamaño de la glándula ni su actividad funcional.
Más recientemente otros autores25 trataron a los pacientes con dosis fija de 5 mCi sin tener en cuenta la actividad funcional de la glándula ni su tamaño y se obtuvo una eficacia con la dosis inicial del 72,4 %, y al inicio del presente siglo14 se presentó un trabajo en el cual se administraron dosis fijas de 6,3 mCi a los pacientes cuya captación a las 4 h era inferior al 50 %, y de 9,4 mCi si era superior al 50,0 y con este esquema obtuvieron una eficacia de la primera dosis del 71,0; no se tuvo en cuenta el tamaño de la glándula. En este trabajo se presentaron además los resultados de la administración de 80 a 120 µCi/g de tejido tiroideo de acuerdo con la captación de 131I a las 24 h, en los que se obtuvo una eficacia con la primera dosis del 58 %. Si tenemos en cuenta la eficacia del 85,2 % de la primera dosis de 131I, vemos que el único resultado que se señala superior al 80 % fue el Torres.18
Al existir un número de pacientes donde la dosis fue eficaz y otro pequeño grupo donde se mantuvo el hipertiroidismo, nos preguntamos si existió algún factor que influyó en estos resultados. Son múltiples las causas señaladas que pueden influir en la respuesta de los pacientes al tratamiento con 131I: actividad funcional del tiroides, características sociales, edad, sexo, tamaño del tiroides, antecedentes de enfermedades del tiroides, tratamiento con antitiroideos de síntesis (ATS) y niveles del anticuerpo antirreceptor. Con el propósito de precisar si en este estudio influyeron algunos de estos factores, se investigó la asociación de la eficacia del tratamiento recibido con la edad, el sexo, el tamaño del tiroides y el tratamiento con ATS. La edad y el sexo no influyeron en nuestros resultados, lo cual ha sido señalado también por diferentes autores.7,14,23-25,26-28
Al analizar la respuesta al tratamiento de acuerdo con el tamaño del tiroides, los pacientes que obtuvieron el mayor porcentaje de eliminación del hipertiroidismo con la dosis inicial fueron los de bocio de gran tamaño, aunque no existió diferencia significativa entre los grupos, lo cual no coincide con lo observado por otros autores,7,16,21,29 quienes plantean una mayor persistencia del hipertiroidismo en ellos independientemente del método que se utilice para el cálculo de la dosis. Es de señalar que existen estudios en los cuales se señala que el tamaño del bocio no parece influir en la eficacia del tratamiento.15,18,22
En cuanto a la administración o no de propiltiouracilo (PTU) previo al tratamiento con 131I, no se constató diferencia estadísticamente significativa entre ambos grupos. No se presentó exacerbación de las manifestaciones clínicas en quienes no tomaron previamente el medicamento, así como tampoco radiorresistencia en quienes lo tomaron. Es de señalar que algunos autores plantean que la administración de PTU no permite una buena respuesta al 131I,30-33 no así la ingestión de metimazol y carbimazol.33-36 Por lo tanto, podemos concluir que las variables analizadas en este estudio no influyeron en los resultados obtenidos. Consideramos que es necesario continuar investigando qué factores pueden influir en una buena respuesta además de los analizados, tales como situaciones de estrés mantenido y características de los trastornos inmunológicos, presentes en esta enfermedad.
La principal objeción que ha sido señalada por los investigadores al tratamiento del BTD con 131I es la frecuencia de hipotiroidismo postratamiento, el cual aumenta con los años de evolución.4,7,14,20-22,34
En los estudios realizados en el INEN, ya mencionados, la presencia de hipotiroidismo a los 3 años postratamiento fluctuó entre 6,9 y 20 % y estuvo relacionado con la dosis de 131I administrada y en proporción inversa con la eficacia del tratamiento. En el presente trabajo alcanzó en ese período el 29,5 %.
Farrar20 opina que el hipotiroidismo es una consecuencia inevitable de todo paciente tratado a corto o largo plazos, y tan es así que algunos autores plantean que la dosis ideal que elimine rápidamente el hipertiroidismo sin riesgo de hipotiroidismo no existe,7,22,23 y en el presente, teniendo en cuenta lo señalado, hay autores que tienen la filosofía de aceptar el hipotiroidismo más que el hipertiroidismo.7,23,37 No obstante, pensamos que sería interesante investigar qué otros factores favorecerían la presencia de esta complicación.
En conclusión, consideramos que el tratamiento empleado en este trabajo, el cual consiste en la aplicación de 80 µCi/g de tejido tiroideo sin tener en cuenta la actividad funcional de la glándula, tiene una eficacia elevada, pues elimina el hipertiroidismo con la primera dosis en un elevado número de pacientes y además suprime el hipertiroidismo antes de los 18 meses en aquellos en quienes persistió. Por otra parte, es fácil de aplicar y menos costoso para el paciente y para el país. Como desventaja tiene la aparición del hipotiroidismo, lo cual debemos sopesar teniendo en cuenta las ventajas.
Summary
131I has proved to be the most efficient therapeutics in the treatment of diffuse toxic goiter (DTG). However, there is no consensus on the dose to be administered: fixed dose or according to the functional activity of the thyroid and its size. In order to evaluate the therapeutical results at a dose of 80 Ci/g of thyroid tissue, estimated by palpation and without having into account the functional activity of thyroid and wether they had received propylthiouracil (PTU) previously , 61 patients diagnosed by the clinic, as well as determinations of TSH and total T4, were studied in individuals aged 20-80 of both sexes, with a thyroid size over 30 g. The posoperative follow-up was performed every 2 months for 3 years by the same specialist and with identical procedures. The efficiency of the treatment with the first dose was 85.2 %. The frequency of hypothyroidism at 3 years of evolution was 29.5. The age of the patient, the sex, the goiter size and the treatment with PTU did not influence on the response to it. The advantages showed by the method were: high efficiency, the dose of 131I may be easily calculated, simple application, decrease of the cost, since it is not necessary to assess the functional state of the gland, and reduction of visits.
Key words: Diffuse toxic goiter, treatment.
Referencias bibliográficas
1. Evans PM, Webster J, Evans WD. Radioiodine treatment in unsuspected pregnancy. Clin. Endocrinol 1998;48:281-3.
2. Berg GE, Nystrom GH, Jacobson L. Radioiodine treatment of hyperthyroidism in a pregnant woman. J Nucl Med 1998;39:357-8.
3. Cárdenas RV. Sobre 226 casos de hipertiroidismo tratados con Yodo radiactivo (131I). Departamento de Medicina Nuclear. Hospital Oncológico. Rev Cubana Cir 1965;4:280-8.
4. Goolden AWG, Steward JS. Long-term results form graded low dose radiactive Iodine. Therapy for thyrotoxicosis. Clin Endocrinol 1986;48:217-22.
5. Bell RL. The treatment of hyperthyroidism with radioactive iodine. Endocrinol Med Assoc 1974;7:568-70.
6. Shafer RB, Nuttal FQ, Takaichi Y. Acute changes in thyroid function in patients treated with radioiodine. Lancet 1975;2:635-40.
7. Nordyke RA, Gilbert FI Jr. Optimal Iodine-131 doses for eliminating hyperthyroidism in Graves' disease. J Nucl Med 1991;32:411-6.
8. Bustillo E, Alavez E. Hipoparatiroidismo después de la terapia con 131I: presentación de un caso. Rev Cubana Med 1986;25:587-91.
9. Adams PH, Chalmers TM. Parathyroid function after 131I therapy for hyperthyroidism. Clin Sci 1965;29:391-5.
10. Bustillo E, Alavez E. Estudio de la función de las paratiroides mediante la prueba del EDTA después de la terapéutica con 131I. Rev Cubana Med 1986;25:80-5.
11. Franklyn JA, Maisonneuve P, Sheppard M, Betteridge J. Cancer incidence and mortality after treatment for hyperthyroidism with radioiodine (abstract): a population based cohort study. Lancet 1999;353:2111-5.
12. Saenger EL, Thomas GE, Tompkins EA. Incidence of leukemia following treatment of hyperthyroidism. Preliminary report of the cooperative thyrotoxicosis therapy: follow up study. JAMA 1968;205:147-51.
13. Halnan HE. Radioiodine treatment of hyperthyroidism a more liberal policy? Clin Endocrinol Metab 1985;14:467-89.
14. Kalinyak JE, McDougall R. How should the dose of iodine-131 be determined in the treatment of Graves' hyperthyroidism? J Clin Endocrinol Metab 2003; 88: 975-7.
15. Wartofsky DG, Solomon B. Differences and similarities in the diagnosis and treatment of Graves' disease in Europe, Japan and the Unites States.. Thyroid 1991;1:129-41.
16. William LD, Ward L, Salamon EA, Ludwig S, Rowe CR, Cowden EA. A randomized comparison of radioiodine doses in Graves' hyperthyroidism. J Clin Endocrinol Metab 2003;88:978-83.
17. Radioiodine therapy of Graves' hyperthyroidism. Standard V/S calculated 131 iodine activity. Results from a prospective randomized multicentre study. Eu J Clin Invest 1991;35:207-12.
18. Torres AP, Normandía AM, Ayala ZM, Gómez CG, Serrano GI, González BD. Tratamiento del hipertiroidismo con una dosis de 10 milicuries de 131I en la enfermedad de Graves-Basedow. Rev Endocrinol Nutr 1997;5:63-6.
19. Allahadadia A, Daykin J, Sheppard MC, Gough SC, Franklin JA. Radioiodine treatment of hyperthyroidism. Prognostic factors for outcome. J Clin Endocrinol Metab 2001;86:3611-7.
20. Farrar JJ, Toft AD. Iodine 131 treatment of hyperthyroidism: current tissues. Clin. Endocrinol (Oxf) 1991;35:207-12.
21. Jarliv E, Hegedys L, Kristensen L. Is calculation of the dose in radioiodine therapy of hyperthyroidism worthwhile?. Clin.Endocrinol (Oxf) 1995;43:325-40.
22. Hernández SE, Torres AP, Normandía AMA, Galindo RME, Amador LN, Gonzáles BD. Tratamiento del bocio tóxico difuso con dosis única de yodo radiactivo 131I calculada por el tamaño del bocio y la concentración de triyodotironina (T3). Rev Endocrinol Nutr 2003;11:157-61.
23. Alexander EK, Larsen PR. High dose 131I therapy for the treatment of hyperthyroidism caused by Graves´ disease. J Clin Endocrinol Metab 2002;87:1073-7.
24. Crooks J, Murray IPC, Wayne EJ. Statistical methods applied to the clinical diagnosis of thyrotoxicosis. Quart J Med 1959;28:211-34.
25. Watson AB. Outcome following standardized 185 MBq dose of 131I. Therapy for Graves´ disease. Clin Endocrinol (Oxf) 1998;2:487-96.
26. Nagayama Y. Radiodine-131 therapy of Graves´ disease: use of the new high resolution ultrasonic scanner for the accurate weight of the thyroid gland. Endocrinol JPN 1989;36:359-65.
27. Tsurata N, Nagayama Y, Yokoyama N, Izumi M, Nagataki S. Long-term follow up studies on iodine-131 treatment of hyperthyroidism Graves´ disease based on the measurement of the thyroid volume by ultrasonography. Ann.Intern Med 1993;7:193-7.
28. Flower M, Al-Saadi A, Harmer C, McCready R, Ottr RJ. Dose-response study on thyrotoxic patients undergoing position emission tomography and radioiodine therapy. J Nucl Med 1994;21:531-6.
29. Bruin TWA, Croon CDI, De Klerk JMH, Isselt JWV. Standardized radioiodine therapy in Graves´ disease: the persistent effect of thyroid weight and radioiodine uptake on outcome. J Int Med 1994;236:507-13.
30. Tutle RM, Patience T, Buld S. Treatment with propylthiouracil before radioiodine therapy is associated with higher treatment failure rate than therapy with radioiodine alone in Graves´ disease. Clin Endocrinol 1995;45:243-9.
31. Imseis RE, Vanmiddlesworth L, Massie JD, Bush AJ, Vanmiddlesworth NR. Pretreatment with propylthiouracil but not methimazole reduces the therapeutic efficacy of iodine-131 in hyperthyroidism. J Clin Endocrinol Metab 1998;83:685-7.
32. Hancock LD, Tuttle RM, LeMar H, Bauman J, Patience T. The effects of propylthiouracil on subsequent radioactive iodine therapy in Graves´ disease. Clin. Endocrinol 1997;47:425-33.
33. Goolden AWG, Fraser TR. Effect of pretreatment with carbimazole in patients with thyrotoxicosis subsequentely treated with radioactive iodine. Br Med J 1969;3:443-4.
34. Andrade VA, Gross JL, Maia AL. The effect of methimazole pretreatment on the efficacy of radioactive iodine therapy in Graves´ hyperthyroidism: one year follow-up of a prospective randomized study. J Clin Endocrinol Metab 2001;86:3488-93.
35. Maracocci C, Gianchecchi D, Masini I. A reappraisal of the role of methimazole and others factors on the efficacy and outcome of radioiodine therapy of Graves´ hyperthyroidism. J Endocrinol Invest 1990;13:513-20.
36. Zúñiga-González S, Pérez-Rodríguez P. Tratamiento de la enfermedad de Graves con radioyodo. Influencia del pretratamiento con metimazol. Rev Endocrinol Nutr 2003;11:171-4.
37. Taylor PK, Keir MJ, Ross WM. Ablative radioiodine therapy for hyperthyroidism: long-term follow up study. Br Med J 1984;289:361-3.
Recibido: 4 de octubre de 2004. Aprobado: 20 de noviembre de 2004.
Dr. Francisco Ochoa Torres. Instituto Nacional de Endocrinología, Zapata y D, Vedado, Ciudad de La Habana, Cuba.
1 Especialista de II Grado en Endocrinología.
2 Especialista de I Grado en Endocrinología.
3 Profesor Consultante. Especialista de II Grado en Endocrinología. Investigador Titular.