Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol vol.22 no.2 Ciudad de la Habana Mayo.-ago. 2011
ARTÍCULOS ORIGINALES
Mineralización ósea en niños y adolescentes con hipotiroidismo congénito
Bone mineralization in children and adolescents presenting with a congenital hypothyroidism
Kesia Granela Cortiñas,I Cecilia Pérez Gesen,II Francisco Carvajal Martínez,III Daysi Navarro Despaigne,IV Emma Domínguez Alonso,V Oscar Díaz Horta,VI Gilda Monteagudo PeñaVII
IEspecialista de I Grado en Endocrinología. Instituto Nacional de Endocrinología. La Habana, Cuba.
IIEspecialista de II Grado en Endocrinología. Investigadora Agregada y Profesora Asistente. Departamento de Endocrinología Pediátrica. Instituto Nacional de Endocrinología. La Habana, Cuba.
IIIEspecialista de II Grado en Endocrinología. Profesor Titular e Investigador Titular y de Mérito. Jefe del Departamento de Endocrinología Pediátrica. Instituto Nacional de Endocrinología. La Habana, Cuba.
IVEspecialista II Grado en Endocrinología. Profesora e Investigadora Titular. Instituto Nacional de Endocrinología. La Habana, Cuba.
VEspecialista de II Grado en Bioestadística. Investigadora Agregada. Instructora. Instituto Nacional de Endocrinología. La Habana, Cuba.
VIDoctor en Ciencias Biológicas. Investigador Auxiliar. Instructor. Instituto Nacional de Endocrinología. La Habana, Cuba.
VIIEspecialista de II Grado en Endocrinología. Máster en Salud Reproductiva. Profesora Auxiliar. Investigadora Agregada. Instituto Nacional de Endocrinología. La Habana, Cuba.
RESUMEN
Introducción: en el hipotiroidismo congénito la mineralización ósea puede afectarse por la enfermedad o por los efectos del tratamiento con hormonas tiroideas.
Objetivo: determinar en pacientes con hipotiroidismo congénito la mineralización ósea.
Métodos: se realizó estudio descriptivo transversal pareado, en niños cubanos con hipotiroidismo congénito (n=67) y un grupo control (n=67). Se analizó la mineralización ósea por densitometría, y se tuvo en cuenta la edad, el sexo, la maduración ósea y sexual, el diagnóstico hormonal y el tratamiento. Se aplicaron intervalos de confianza (95 %), análisis de varianza y correlación con significación.
Resultados: la densidad, el contenido mineral óseo y el z-score en niños cubanos con hipotiroidismo congénito, y el grupo control no fue diferente significativamente (p=0,466; 0,155; 0,416 respectivamente). Estimaciones de asociación de mineralización ósea por edad mostró diferencia significativa en la densidad mineral ósea y contenido mineral óseo (p=0,000) para ambos grupos, y el z-score solo para los enfermos. La mineralización ósea fue significativa en la dosis promedio con levotiroxina en la segunda y tercera fase ósea, y en el tiempo de tratamiento. En el hipotiroidismo congénito permanente hubo correlación con el diagnóstico hormonal y el tiempo de tratamiento (p=0,000).
Conclusiones: la mineralización ósea es homogénea en ambos grupos. La densidad y el contenido mineral óseo en niños cubanos con hipotiroidismo congénito y el grupo control se asocian con la edad, y son independientes del sexo. El z-score en pacientes con hipotiroidismo congénito sufre variación con la edad, y es independiente al sexo en ambos grupos. La densidad y el contenido mineral óseo varían en niños con hipotiroidismo congénito.
Palabras clave: Hipotiroidismo congénito, mineralización ósea, densitometría.
ABSTRACT
Introduction: in the case of the congenital hypothyroidism the bone mineralization may be affected by disease or by the effects of the thyroid hormones treatment.
Objective: to determine the bone mineralization in patients presenting with congenital hypothyroidism.
Methods: a cross-sectional, matched and descriptive study was conducted in Cuban children with congenital hypothyroidism (n= 67) and a control group (n= 67). The bone mineralization was analyzed by densitometry taking into account age, sex, bone and sexual maturation, hormonal diagnosis and treatment. The 95 % CI were applied, variance analysis and correlation with significance.
Results: density, bone mineral content and z-score in Cuban children with congenital hypothyroidism and the control group there was significantly different (p= 0,466; 0,155; 0,416), respectively. The estimations of bone mineralization association according to age showed a significant difference in bone mineralization density and the bone mineral content (p= 0,000) for both groups, and the z-score only for the sick persons. The bone mineralization was marked in mean dose with levothyroxine during the second and third bone phase and the treatment time. In the case of permanent congenital hypothyroidism there was a correlation with hormonal diagnosis and the treatment time (p= 0,000).
Conclusions: the bone mineralization is homogeneous in both groups. Density and bone mineral content in Cuban children with congenital hypothyroidism and the control group are associated with age independently of sex in both groups. Density and bone mineral content are different in the children with congenital hypothyroidism.
Key words: Congenital hypothyroidism, bone mineralization, densitometry.
INTRODUCCIÓN
El hipotiroidismo congénito (HC) es uno de los disturbios endocrinos más frecuentes, ocurre en aproximadamente 1:3 000 a 1:4 000 nacimientos, y es una de las causas prevenibles de retraso mental.1-4 La carencia de las hormonas tiroideas (HT) en la primera etapa de la vida deja como secuelas retraso mental permanente, diversas alteraciones neurológicas, trastorno del crecimiento longitudinal, en la mineralización, así como el desarrollo óseo (indicador de maduración biológica) y sexual.
La repercusión negativa del HC sobre el desarrollo somático e intelectual del niño justificó la introducción, a partir de la década del 70 del pasado siglo,5 de un programa internacional operativo de tamizaje neonatal, que permitió solucionar el diagnóstico precoz y la prevención de las secuelas.6-16
En Cuba, en el mes de octubre de 1986, se inició el Programa Nacional de Diagnóstico Precoz del HC (PNDPHC),4,7 que, tras 20 años de experiencia, ha atendido a 735 niños hipotiroideos.17 La evaluación de la efectividad del diagnóstico precoz y el tratamiento oportuno del HC ha pasado por diferentes etapas, y uno de los primeros indicadores empleados fue la evaluación neurocognitiva.12 En 2001, luego de 12 años de experiencias del PNDPHC, se realizó una investigación con el objetivo de identificar el efecto de la severidad del HC y el tratamiento sustitutivo con levotiroxina sódica (LT4) sobre el crecimiento. Dos años después se desarrolló un estudio con el objetivo de identificar malformaciones congénitas extratiroideas y su posible asociación con el HC y otros factores.18,19
Motivó el presente estudio continuar precisando las peculiaridades del HC, partiendo del decisivo papel de las HT sobre la mineralización ósea, la posible afectación de la masa ósea en pacientes con esta enfermedad, y las discrepancias encontradas en las diferentes investigaciones realizadas en otras latitudes en relación con este tema. Nos propusimos, adquirir experiencia y criterios propios en relación con la mineralización del hueso en niños con HC.
La formación de la masa ósea depende de 2 procesos: el modelado óseo, y el remodelamiento óseo. El primero es responsable del crecimiento longitudinal y las modificaciones del diámetro transversal, se produce desde el nacimiento y se detiene después de la pubertad. El segundo, permite el constante recambio de hueso viejo por hueso nuevo, y dura desde la pubertad hasta la muerte. En el transcurso de la vida la masa ósea cursa por 3 fases: la primera comienza en la etapa fetal hasta los 30 años, mientras que la segunda y tercera fases se inician en la tercera y cuarta década de la vida respectivamente. La primera fase, a su vez, se divide en 3 etapas: la niñez (desde la séptima semana embrionaria hasta aproximadamente los 10 años de vida), y es un período crucial para el desarrollo óseo, porque es cuando el esqueleto crece más y logra su casi total osificación (en esta etapa las hormonas que tienen mayor actividad son las HT); la segunda etapa es la puberal (desde los 11 años hasta aproximadamente los 16, según el sexo), que es cuando ocurre el llamado estallido puberal, que no es más que el tercer ciclo de crecimiento óseo importante que se produce en el ser humano; y por último, está la consolidación ósea o pospuberal, que es en la que se culmina la osificación y se adquiere la talla definitiva. Las HT son necesarias para el reclutamiento, la maduración y la actividad de osteoblastos y osteoclastos, modulan el proceso de remodelado e inducen cambios secundarios en las concentraciones de calcio, hormona paratiroidea (PTH) y vitamina D; regulan, además, la osificación y maduración del cartílago de crecimiento, por lo que resultan de gran importancia para el desarrollo óseo. En cuanto al crecimiento y maduración del esqueleto favorecen la trascripción del gen que codifica el factor de crecimiento (IGF-1), además de tener efectos indirectos sobre la síntesis y/o secreción de otras hormonas como la hormona de crecimiento (GH), insulina y gonadotropinas.20
Partiendo de que el desarrollo óseo normal en la niñez y hasta la adultez temprana es lo que garantiza la reserva ósea y que a partir de los 30 años el recambio óseo se ve sometido a múltiples eventos que modifican su estado y que contribuyen a un mayor riesgo de osteoporosis, resulta de suma importancia determinar cómo se encuentra la densidad mineral ósea (DMO) en pacientes afectos con HC en etapas en que aún pudiera detectarse un estadio temprano de la enfermedad y realizar prevención primaria de la osteoporosis.
Hasta el momento, en la experiencia cubana, se ha demostrado que el diagnóstico temprano del HC puede lograr una adecuada maduración del sistema nervioso central, neurocognitivo y crecimiento lineal; sin embargo, se desconocen las características de la mineralización del hueso en estos pacientes, por lo que nos propusimos identificar las características de la mineralización ósea en pacientes con HC y su relación con el tratamiento.
MÉTODOS
Se realizó un estudio descriptivo transversal con el objetivo de caracterizar la mineralización ósea en pacientes con HC en el período de enero a mayo de 2008, que incluyó 2 grupos de niños y adoles centes: uno constituido por la totalidad de los pacientes con HC mayores de 8 años seguidos por el PNDPHC, residentes en Ciudad de La Habana y La Habana; y otro, formado por niños sanos pareados por edad y sexo 1:1. Para el cálculo del tamaño muestral se consideraron los supuestos siguientes:1
- Valor promedio de densidad mineral ósea (DMO) (g/cm2) en pacientes con HC: 0,975.21
- Valor promedio de DMO (g/cm2) en población sana: 0,832.21
- Desviación estándar (DS) de DMO en población sana: 0,092.21
A partir de estos se calculó el valor de d mediante la fórmula siguiente: d=promedio de DMO en sanos-promedio de DMO en enfermos/DS de DMO en población sana. Se obtuvo d=0,4 y para dicho valor tabulado, conjuntamente con potencia (1-b)=0,90 y confiabilidad (a)=0,05, resultó un tamaño de muestra mínimo de 67 sujetos en cada grupo.
Como criterios de inclusión se tuvo en cuenta que el grupo de estudio (hipotiroideos, n=67) estuviera constituido por pacientes, pesquisados y seguidos por el PNDPHC, con residencia permanente en Ciudad de La Habana y La Habana, atendidos en el Departamento de Endocrinología Pediátrica del INEN, y nacidos en el período comprendido entre mayo de 1986 y diciembre de 2000. El grupo control (no hipotiroideos, n=67) fueron niños y adolescentes, supuestamente sanos, procedentes del consultorio No. 19 del área de salud "Rampa", del municipio Plaza de la Revolución.
Como criterios de exclusión, se tuvo en cuenta que el grupo de estudio fuera de pacientes que causaron baja del PNDHC o pacientes con hipotiroidismo que no realicen el tratamiento con HT, y en ambos grupos, que hubiera ausencia de condiciones que provoquen osteoporosis por desuso, como el encamamiento o inmovilización por 15 días o más, independientemente de la causa, con un período anterior de 1 ó 2 meses, osteoporosis permanente, osteocondrodistrofias, osteocondrodisplasias, DM, hiperplasia suprarrenal congénita, hipogonadismo, hiperprolactinemia o síndrome de Cushing, paresia cerebral, enfermedades neurometabólicas, síndromes de Turner, síndrome de Klinelfelter, síndrome de Edward, síndrome de Patau, glucogenosis, mucopolisacaridosis, seudohipoparatiroidismo, homocistinuria, hipofosfaturia, fenilcetonuria, hepatitis neonatal, déficit de la enzima alfa 1 antitripsina, fibrosis quística, desnutrición, enfermedad celiaca, síndrome de mala absorción, escorbuto, raquitismo, síndromes linfoproliferativos, anorexia nerviosa, inactividad generalizada y drogas como anticoagulantes, glucocorticoides, hormona adrenocorticotropa (ACTH), agonistas de hormona liberadora de gonadotropina, somatotropina recombinante, citostáticos, anticonvulsivantes, diuréticos, suplemento vitamínico o de calcio, además de la voluntariedad.
Los pacientes seleccionados por cumplir los criterios de inclusión fueron citados en unión de sus padres o tutores a una consulta creada al efecto. En la primera consulta se les explicó el motivo de la cita, y se les pidió su consentimiento para participar en la investigación. A los que aceptaron participar se les realizó interrogatorio, examen físico y se indicó la densitometría ósea. Además de las historias clínicas correspondientes, se obtuvieron los datos necesarios para darle respuesta a los objetivos de la investigación. Al final, los participantes se citaron nuevamente a la consulta para darles las conclusiones del estudio. Para la selección de los controles se empleó un método aleatorio polietápico; o sea, inicialmente se seleccionó un consultorio del área de salud, y luego, de la lista de pacientes, se obtuvieron los sujetos, que se parearon progresivamente con los del grupo de estudio por un método aleatorio simple. Se les visitó en su domicilio, se les invitó, y después de obtener el consentimiento informado, se realizó igual procedimiento que a los niños y adolescentes del grupo de estudio, realizando la consulta en el consultorio médico correspondiente.
Los indicadores de la mineralización ósea se obtuvieron por densitometría ósea, realizada en la región lumbar de la columna vertebral con el sujeto en decúbito supino, usando un densitómetro LEXXOS de la marca MSD, de los servicios de ortopedia de los hospitales "Fructuoso Rodríguez" y "Frank País", operado por personal especializado. Se determinó la DMO expresada en g/cm2, el contenido mineral óseo (CMO) expresado en g, y el puntaje z-score. La DMO se expresa en g/cm2, y es la diferencia entre el pico de energía total (enviado por el equipo DXA a través de los huesos) menos el absorbido por los tejidos blandos.21,22 El CMO se expresa en g, y representa la masa mineral seca del hueso.21,22 z-score es un valor calculado automáticamente por el programa del equipo de densitometría, expresa la deficiencia existente en la DMO y el CMO del paciente y un estándar poblacional similar en edad, sexo y etnia. Un número negativo significa que se tiene afectación ósea con respecto a los estándares, por lo tanto, es un predictor del grado de déficit la mineralización ósea.21,22 Se consideraron los criterios de interpretación siguientes (estimación creada por los autores):
Normal: > -1.
Disminuido: ³ -1 y < -2.
Marcadamente disminuido: £ -2.
Las variables independientes para ambos grupos fueron: edad cronológica y sexo. En las particularidades del tratamiento se dividió el grupo de hipotiroideos, en transitorio y permanente (según la revaluación diagnóstica del PNDPHC), y se tuvo en cuenta como dosis inicial de LT4: cantidad de LT4 calculada en microgramos/kilogramos/día (µg/kg/día) que se administró al recién nacido al diagnóstico. Dosis promedio (DP) de LT4: cálculo de forma diferencial de acuerdo con las etapas del desarrollo óseo. En todos los casos se obtuvo mediante la sumatoria de las dosis promedio diarias de LT4 reportadas en cada consulta de seguimiento dividida entre el número de consultas, y se expresó en µg/kg/día y tiempo de tratamiento trascurrido (medido en años) desde que inició la terapia con LT4 hasta el momento observacional:
- DP LT4-1: dosis promedio de LT4 entre la 7ma. semana de vida extrauterina hasta 10 años de edad.
- DP LT4-2: dosis promedio de LT4 entre los 11 y 17 años de edad.
- DP LT4-3: dosis promedio de LT4 después de los 17 años de edad.
Se aplicó una prueba t Student para determinar n diferencias entre los grupos de niños con hipotiroidismo y los niños del grupo control respecto a las variables de la mineralización ósea (DMO, CMO y z-score). En el caso que no existió homogeneidad de las varianzas de acuerdo con la prueba de Levene, la prueba t Student fue corregida por la prueba Welch. Para evaluar si la muestra se ajustaba a una distribución normal, se aplicó la prueba de Kolmogorov-Smirnov. Se aplicó la prueba de hipótesis ANOVA para muestras pareadas, asumiendo varianzas desiguales (T2 de Tamhane) para las diferencias entre grupos de DMO, CMO y z-score, y se consideró la variable grupos como factor, mientras que DMO, CMO y z-score como variables dependientes.
Se aplicó el consentimiento informado a niños y/o familiares, en dependencia de la edad, y se brindó la información necesaria sobre la investigación, además de la estricta confidencialidad de la información correspondiente a este estudio. Existió la disposición de asegurar la asistencia médica en caso de que los estudios realizados tuvieran resultados que requirieran algún proceder terapéutico, pero no fue necesario.
RESULTADOS
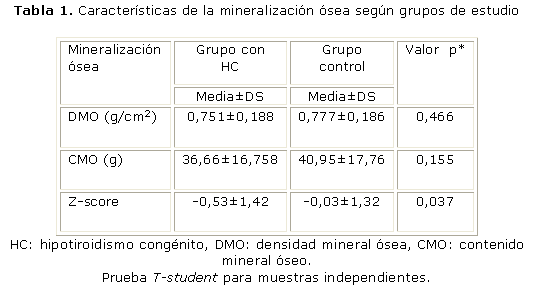
De los 67 pacientes de cada grupo 50 eran varones y 84 hembras, las edades estuvieron en un rango de 8 a 21 años, 18 de cada grupo tenían 11 años o menos, 35 eran mayores de 11 y menores de 17 años, mientras que los 14 restantes tenían más de 17 años. No hubo diferencias en los valores medios de la DMO (0,751 g/cm2 y 0,777 g/cm2), y del CMO (40,95 g/cm2 y 36,66 g/cm2) entre los niños del grupo control y los del grupo de estudio. Al contrastar los valores estimados del z-score, en ambos grupos se probó que los niños del grupo de estudio tenían valores significativamente inferiores a los sujetos aparentemente sanos (p= 0,037) (tabla 1).
Con respecto a la distribución de los sujetos según grados de mineralización ósea a partir del resultado del puntaje z-score según grupos de estudio, se observa que la frecuencia de niños con mineralización retardada es mayor en el grupo de estudio (p=0,117) (tabla 2).
Los 3 indicadores de mineralización ósea, en ambos grupos de estudio, tuvieron valores medios progresivamente crecientes en relación con la edad. En los niños de edades inferiores a los 11 años pertenecientes al grupo de los hipotiroideos, la media y dispersión para la DMO fue de 0,59±0,07, CMO 22,11±5,09 y z-score 0,78±0,79, mientras que el grupo control las medias fueron de 0,56±0,08, 22,76±6,36, 0,27±0,89 respectivamente. Los de 11 a 17 años tuvieron media y dispersión de DMO de 0,74±0,13, CMO 35,93±12,98 y z-score de -0,38±0,89, mientras que para el grupo control la DMO fue en promedio 0,79±0,18, CMO 42,80±42,80 y z-score 0,22±1,31. En ambos grupos en los mayores de 17 años se observaron valores mayores de la DMO 0,98±0,19, 1,01±0,12 y CMO 57,30±22,47, 59,73±11,84, mientras que en el z-score se observó menor valor medio (-0,06±0,98 en hipotiroideos y -0,19±0,61 en los controles) al compararlo con los grupos de menor edad. Las diferencias de medias en ninguna de las comparaciones resultó estadísticamente significativa a un nivel de a= 0,05.
Los valores medios de al DMO fueron similares en varones y hembras tanto hipotiroideos como sanos, el CMO fue ligeramente menor en las hembras; mientras el z-score fue menor en los varones. Tanto para el CMO como para el z-score los hipotiroideos tuvieron valores menores con respecto a sus controles del mismo sexo, sin embargo, estas diferencias no resultaron estadísticamente significativas (p>0,005) (tabla 3).
Tabla 3. Características de la mineralización ósea según edad y sexo por grupos de estudio
| Grupos etarios | ||||||||
| ≤ de 11 años | 11 a 17 años | > 17 años | ||||||
| Hipotiroideos | Controles | Hipotiroideos | Controles | Hipotiroideos | Controles | |||
| Media ± DS | Media ± DS | Media ± DS | ||||||
| DMO (g/cm2) | 0,59±0,07 | 0,56±0,08 | 0,74±0,13 | 0,79±0,18 | 0,98±0,19 | 1,01±0,12 | ||
| CMO (g) | 22,11±5,09 | 22,76±6,36 | 35,93±12,98 | 42,80±42,80 | 57,30±22,47 | 59,73±11,84 | ||
| Z-score | 0,78±0,79 | 0,27±0,89 | -0,38±0,89 | 0,22±1,31 | -0,06±0,98 | -0,19±0,61 | ||
| Sexo | ||||||||
| Masculino | Femenino | |||||||
| Hipotiroideos | Controles | Hipotiroideos | Controles | |||||
| Media ± DS | Media ± DS | |||||||
| DMO (g/cm2) | 0,77±0,239 | 0,79±0,221 | 0,74±0,153 | 0,77±0,219 | ||||
| CMO (g) | 40,46±22,47 | 43,12±18,66 | 34,44±11,95 | 39,67±17,31 | ||||
| Z-score | -0,14±1,07 | -0,07±1,04 | 0,08±0,96 | 0,28±1,11 | ||||
DMO: densidad mineral ósea, CMO: contenido mineral óseo.
Se demostró correlación positiva entre la edad y todos los indicadores de mineralización ósea. Con las variables DMO y CMO fue de moderada a fuerte (por encima de 50 %) tanto en los niños hipotiroideos como en los no hipotiroideos, la que resultó significativa para a< 0,001. En el caso particular del z-score se probó que existe correlación débil (32,7 %) que resultó significativa (p= 0,007) en hipotiroideos; sin embargo, en los no hipotiroideos no hubo correlación significativa (p= 0,256).
Cuando lo analizamos por las categorías de edades en ambos grupos en relación con cada indicador de la mineralización ósea, mediante una prueba de comparaciones múltiples, obtuvimos que:
En hipotiroideos:
a La DMO, CMO, z-score de los niños £ 11 años es diferente (p< 0,05) a la del grupo de 11 a 17 años.
b La DMO, CMO, z-score de los que tenían de 11 a 17 años es diferente (p< 0,05) a la del grupo ³ de 17 años.
c La DMO, CMO, z-score en los pacientes con edad £ 17 años es diferente (p< 0,05) al grupo de los £ 11 años.
En los controles:
d El CMO de los sujetos £ 11 años es diferente (p< 0,05) al grupo de niños que tenían entre 11 y 17 años.
e El CMO de los que tenían entre 11 y 17 años es diferente (p< 0,05) al del grupo de £ de 17 años.
f El CMO de los ³ de 17 años es diferente (p< 0,05) al grupo de £ 11 años (tabla 4).
Tabla 4. Estimaciones de asociación entre la mineralización ósea y la edad de los sujetos de ambos grupos
| Variables | Hipotiroideos | Controles | ||||
| DMO (g/cm2) | Edad* | |||||
| R (% correlación) | Valor p | R (% correlación) | Valor p | |||
| 0,694 (69,4 %) | 0,000 | 0,742 (74,2 %) | 0,000 | |||
| CMO (g) | 0,718 (71,8 %) | 0,000 | 0,726 (72,6 %) | 0,000 | ||
| Z-score | 0,327 (32,7 %) | 0,007 | 0,141 (14,1 %) | 0,256 | ||
| Edad (valor p)** | ||||||
| ≤ 11 | 11 a 17 | ≥ 17 | ≤ 11 | 11 a 17 | ≥ 17 | |
| DMO (g/cm2) | 0,59 ac | 0,74 ab | 0,95 bc | 0,55 | 0,79 | 1,01 |
| CMO (g) | 22,11 ac | 31,94 ab | 56,67 bc | 22,76 df | 40,57 de | 57,88 ef |
| Z-score | 0,57 ac | -1,08 ab | -0,74 bc | 0,11 | 0,23 | -0,56 |
CMO: contenido mineral óseo, DMO: densidad mineral ósea.
Coeficiente de correlación lineal de Pearson.
** Post Hoc (Bonferroni) test.
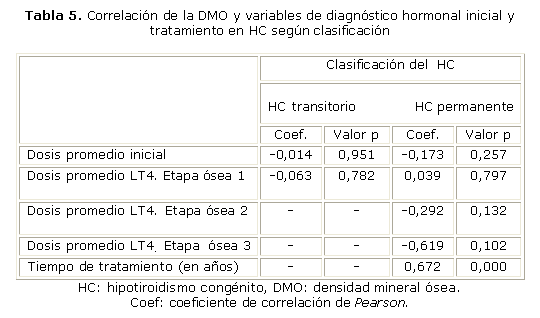
El tiempo de tratamiento tuvo una correlación positiva de moderada a fuerte con la DMO (coef= 0,672), que resultó altamente significativa (p< 0,0001). En cambio, no existió correlación significativa entre la DMO y la dosis de LT4 promedio inicial, ni en las diferentes etapas del desarrollo óseo (p> 0,05) (tabla 5).
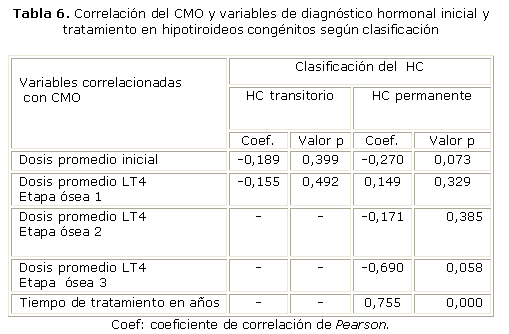
En cuanto al CMO se evidenció correlación positiva fuerte en los hipotiroideos permanentes con el tiempo de tratamiento, el valor p< 0,0001. En cambio, no se detectó correlación significativa del CMO con la dosis de LT4 promedio inicial y en las etapas 1, 2 y 3 de desarrollo óseo en los hipotiroideos permanentes, y con ninguna de las variables analizadas en los transitorios (p> 0,05) (tabla 6).
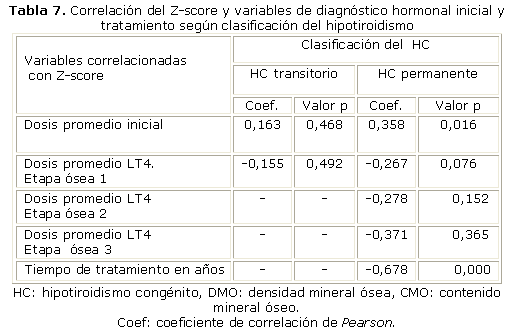
Finalmente se prueba que en los hipotiroideos permanentes existe correlación positiva fuerte con el tiempo de tratamiento (p< 0,0001), sin que se demostrara correlación en el resto de las variables. Sin embargo, en el caso de los hipotiroideos transitorios no fueron significativas ninguna de las correlaciones del z-score con las variables de diagnóstico y tratamiento (p> 0,05) (tabla 7).
DISCUSIÓN
De las disfunciones tiroideas, fue la hiperfunción la que primero se reportó como factor de riesgo para la osteoporosis, y tradicionalmente se le atribuyó este efecto a los niveles elevados de HT.23 Recientemente, Abe y otros24 propusieron un papel directo de la hormona estimuladora del tiroides (TSH) sobre la masa ósea, y demostraron que las ratas que tenían delección del gen del receptor de TSH (TSHR) presentaban DMO reducida que no aumentaba con suplemento de HT, por lo que sugirieron que la pérdida ósea era independiente de los niveles de las hormonas tiroideas T3 y T4. Esto hace pensar que la TSH regula negativamente el remodelado óseo al inhibir la proliferación y diferenciación, de osteoclastos y de osteoblastos, por mecanismos distintos. Más tarde, el mismo grupo,25 demostró que la TSH disminuye la producción del factor de necrosis tumoral (TNFa) y citoquinas involucrados en la patogenia de varias formas de osteoporosis, al regular negativamente la osteoclastogénesis. En fin, hasta este momento no se ha definido si la pérdida ósea en la tirotoxicosis resulta de exceso de HT, de deficiencia de TSH, o de la combinación de ambos.
Conociendo las acciones y efectos de la HT sobre la masa ósea, la imperiosa necesidad de un tratamiento sustitutivo hormonal de reemplazo (generalmente mantenido de por vida), y las características del remodelado óseo durante la infancia y adolescencia, surgió el propósito de identificar diferencias de la mineralización ósea mediante sus respectivos indicadores (DMO, CMO y el z-score) en nuestros niños y adolescentes.
Si bien no hubo diferencias significativas en los valores promedio de la DMO y del CMO entre el grupo control y el de niños bajo tratamiento por hipotiroidismo, es importante tener presente que, según valores del z-score, este último grupo tiene mayor cantidad de niños con mineralización deficiente (16 vs. 5,9 %), lo que consideramos el resultado más interesante e importante de esta investigación, y que pudiera ser expresión de una serie de factores, entre los que podemos señalar, los genéticos, o quizás resultado del tratamiento para el control del hipotiroidismo. Existen otros factores que intervienen en la DMO, dígase estado nutricional, características de la alimentación, consumo de calcio (lácteos y sus derivados), actividad física, antecedentes familiares que pudieran ser tomados en cuenta en otra investigación, así como la inclusión de la homeostasis cálcica y marcadores de recambio óseo, entre otros, para evaluar un estado completo de la calidad ósea.
Las variables de mineralización siempre fueron menores en hipotiroideos, a pesar de que solo el z-score fue significativo, lo que, en cierta medida, es un resultado esperado por todos los argumentos que se mencionan en la introducción de este trabajo, tanto por los efectos del HC como por el tratamiento. La razón para explicar que las diferencias en DMO y CMO no sean significativas pudiera ser porque son pacientes diagnosticados tempranamente, en los que el seguimiento y tratamiento garantizan el estado eutiroideo, y esto hace que las alteraciones de la mineralización a estas edades sean mínimas, pero no podemos asegurar que esta brecha no se amplíe en la medida que avance la edad, por lo que estudios posteriores pudieran dar más luz en ese sentido. Es preocupante que los valores medios del z-score en ambos grupos sean negativos, y cabría preguntarse si esto se debe a que se calcula sobre la base de un estándar no cubano. Determinaciones posteriores, cuando exista un estándar de nuestro país para recalcularlo, permitirán dar respuesta a esta interrogante.
En Francia evaluaron DMO y marcadores de recambio óseo en una muestra de 44 niños diagnosticados por tamizaje neonatal con terapia de reemplazo con LT4 con una edad promedio de 8,5±3,5 años (coincidiendo con el tiempo de tratamiento), y no describen diferencias de la DMO en relación con los controles, aunque sí refieren diferencias significativas de la DMO en columna lumbar en 8 niños con aporte de calcio disminuido en la dieta (p< 0,06) y un peso inferior al resto (p< 0,05). Respecto a los marcadores de recambio óseo (específicamente la osteocalcina) se detectaron cifras muy bajas en los hipotiroideos y una correlación positiva (r= 0,42; p= 0,02) con la T4 libre en el seguimiento.26
En Italia se realizó estudio longitudinal de la DMO, CMO y marcadores séricos de recambio óseo en 116 niños caucásicos (no describen rangos de edades) con HC. No encontraron diferencias significativas en relación con el grupo control, pero refieren concentraciones altas de fosfatasa alcalina, paratohormona y osteocalcina en los períodos de mayor dosis de LT4 (p< 0,05).27 Brasil reportó una diferencia significativa de la DMO en 60 niños y adolescentes afectados de HC respecto a un grupo control (0,795 vs. 0,832 g/cm2; p= 0,04) y en relación con el CMO (959,53 vs. 1 080,68 g; p= 0,14).1
Aunque son similares a lo reportado por otra universidad italiana, también realizaron un estudio de la DMO partiendo del z-score Salerno y otros, para evaluar los efectos del tratamiento prolongado con levotiroxina en 37 adultos jóvenes portadores de HC detectado desde la etapa neonatal. Describen valores medios del z-score en -0,3±0,7;28 y en Canadá, a 20 infantes con HC tratados desde el nacimiento, se le estudió la masa ósea por absorsiometría dual de rayos x, y los valores de la DMO se encontraron dentro de los rangos normales, así como similares al grupo control.29
Los 3 indicadores de mineralización ósea en ambos grupos de estudio tuvieron valores medio progresivamente crecientes en relación con la edad. Estos son resultados esperados, puesto que la categorización de la edad se realizó en correspondencia con las etapas del desarrollo óseo, y por tanto, los valores de la DMO y el CMO tienen un incremento lineal con la edad y acentuado en la etapas del desarrollo puberal.
Fueron evidentes correlaciones significativas entre la edad y las variables DMO y CMO en los pacientes hipotiroideos y en el grupo control (p< 0,05), y además, dichas correlaciones se identificaron como buenas (por encima de 50 %). En el caso particular del z-score se probó que existe correlación significativa con la edad en hipotiroideos (p= 0,007), aunque esta fue débil (32,7 %); sin embrago, en el grupo control no hubo correlación significativa.
La edad de los sujetos en los estudios publicados en la bibliografía internacional no es similar a la de nuestros participantes, por lo que no nos es posible comparar las diferencias encontradas al respecto, toda vez que en general los sujetos eran más jóvenes que el grupo nuestro. En Francia y en uno de los reportes de Italia, en Canadá y en Brasil el promedio de edad estuvo entre los 8 y los 9 años, mientras la serie de Salerno y otros, en Nápoles, tenía un promedio de edad de 17,8 años.1,26,28,29
En cuanto al sexo no hubo diferencias, y en relación con su comportamiento en ambos grupos tampoco existieron diferencias significativas en los hipotiroideos y en los controles. No se identificó asociación de ninguna variable de la mineralización ósea en cuanto al sexo. Si bien es cierto que el pico de masa ósea es mayor en el hombre que en la mujer, y que esta alcanza su desarrollo gonadal antes que el varón, a nivel de la mineralización no se reporta que existan diferencias entre los sexos; nuestros resultados, al igual que lo reportado por otros autores, confirman esta hipótesis.1,26,29
En la Universidad de Amsterdam29 realizaron un estudio en 14 mujeres jóvenes con HC y 9 controles, y no describen diferencias significativas entre los 2 grupos en los estudios realizados en región femoral: CMO (38,6 vs. 37,6 g), DMO (0,98 vs. 1,01 g/cm2, y z-score 0,1 vs. 0,3 SD), sin embargo sí encontraron diferencias significativas en la región de la columna (DMO 0,97 vs. 1,09 g/cm2, y z-score -0,5 vs. 0,6 SD). A pesar de ser una pequeña muestra, vale la pena resaltar la importancia de cómo ya comienza a variar la mineralización ósea en las diferentes áreas corporales.
En resumen, si bien nuestros resultados confirman los beneficios del PNDPHC, las diferencias encontradas en el grado de mineralización requerirán del desarrollo de nuevas investigaciones que permitan definir no solo la magnitud de la diferencia, sino también sus probables etiológicos, y sobre todo, si esta se mantiene o intensifica con el decursar de los años.
Se concluye que de los indicadores de mineralización ósea el z-score fue el único que mostró diferencias (disminución) en los pacientes con HC en relación con los sujetos de igual edad y sexo, aparentemente sanos. La mineralización ósea, específicamente la DMO y el CMO, se incrementa con la edad y el grado de desarrollo puberal, pero no está influida por el sexo. En las particularidades del tratamiento un incremento en el tiempo de tratamiento se asoció con los 3 indicadores de la mineralización ósea (DMO, CMO y el z-score) en los pacientes con hipotiroidismo permanente.
REFERENCIAS BIBLIOGRÁFICAS
1. Demartini AC, Kulak Carolina AM, Borba VC. Bone mineral density of children and adolescents with congenital hypothyroidism. J Pediatr Endocrinol Metab. 2007;51(7):1-14.
2. Kopp P. Perspective: genetic defects in the etiology of congenital hypothyroidism. Endocrinology. 2002;143:2019-24.
3. Brown RS, Demmer LA. Editorial: the etiology of thyroid dysgenesis-still an enigma after all these years. J Clin Endocrinol Metab. 2002;87:4069-71.
4. Güell R. Enfermedades del tiroides en el niño y el adolescente. Barcelona: Permanyer Publications Mallorca; 1998. p. 21-47.
5. Dussault JH. The anecdotal history of screening for congenital hypothyroidsm. J Clin Endocrinol Metabol. 1999;84:4332-4.
6. Vogiatzi MG, Kirkland JL. Frequency and necessity of thyroid function test in neonates and infants with congenital hypothyroidism. Pediatrics. 1997;100:1-4.
7. Güell R. Cuban national program for detection of congenital hypothyroidism: results after five years of screening. In: Wilcken B, Webster D. eds. Neonatal Screening in the nineties. Australia: Kelvin Press; 1995. p. 345-51.
8. Mayayo E, Santisteban P, Vinces Calvet E. Patología tiroidea fetal y neonatal. En: Argente Oliver J, Carrascosa Lezcano A, Gracia Bouthelier R, Rodríguez Hierro eds. Tratado de Endocrinología Pediátrica y de la Adolescencia. Madrid: Doyma. 2000. p. 64-70.
9. Mayayo E, Santisteban P, Labarta JI, Fernández A. Hipotiroidismo congénito. En: Pombo M. ed. Tratado de Endocrinología Pediátrica. 3ra. ed. Madrid: McGraw-Hill Interamericana; 2002. p. 532-56.
10. Nuñez Almache O. Hipotiroidismo congénito. Pediátrica. 2003;5(2):93-100.
11. Álvarez P, Cordido F. Hipotiroidismo. Guías Clínicas. 2002;2(22).
12. Carvajal Martínez F. Hipotiroidismo. En: De La Torre ME, González VJ, Gutiérrez MJA, Rodríguez JJ, eds. Pediatría. La Habana: Editorial Ciencias Médicas; 2004. p. 64-6.
13. Gruters A, Finkc R, Krude H, Meinbold H. Etiogenical grouping of permanent congenital hythyroidism with thyroid gland in situ. Horm Res. 1994;41:3-9.
14. Sánchez-Ventura J. Cribado neonatal de metabolopatias congénitas. Folleto sobre hipotiroidismo. 2004. p. 2-4.
15. Dallas J, Foley T. Hypothyroidism. Pediatric endocrinology. 1996;8:391-9.
16. Kopp P. Perspective: genetics defects in the etiologic of congenital hypothyroidism. Endocrinology. 2002;143:2019-24.
17. Subregistro del Departamento de Estadística. Instituto Nacional de Endocrinología. 2007.
18. Renón EA. Efecto de la severidad del hipotiroidismo congénito y su tratamiento sobre el crecimiento [trabajo de terminación de residencia]. Instituto Nacional de Endocrinología; 2001.
19. Velásquez PA. Malformaciones congénitas extratiroideas y posibles factores asociados a su aparición en pacientes del programa nacional de diagnóstico precoz de hipotiroidismo congénito en Ciudad de la Habana y La Habana [trabajo de terminación de residencia]. Instituto Nacional de Endocrinología; 2004.
20. Sánchez Cruz JC, Navarro Despaigne D, Hernández Ortega A. Acción fisiopatológica integrada de las hormonas sobre el tejido óseo. Rev Cubana Endocrinol. 2006;17(2):1-3.
21. Diagnostic Medical Systems. Bone Densitometer. Dual Emission X-Ray Absorptiometry. Manual. Francia. 2005.
22. Lakatos P. Thyroid hormones: beneficial or deleterious for bone? Calcif Tissue Int. 2003;73:205-9.
23. Abe E, Marians RC, Yu W, Xue-Bin W, Ando T, Li Y, et al. TSH is a negative regulator of skeletal remodeling. Cell. 2003;115:151-62.
24. Hase H, Ando T, Eldeiry L, Brebene A, Yuanzhen P, Liu L, et al. TNFa mediates the skeletal effects of thyroid-stimulating hormone. Proc Natl Acad Sci USA. 2006;103:12849-54.
25. Léger J, Ruiz JC, Guibourdenche J, Kindermans C, Garabedian M, Czernichow P. Bone mineral density and metabolism in children with congenital hypothyroidism after prolonged L-thyroxine therapy. 1997;86:704-10.
26. Weber G, Mora S, Bellini A, Bosco M, Prinster C, Siragusa V, di Natale B, Chiumello G. Bone mineral metabolism and thyroid replacement therapy in congenital hypothyroid infants and young children. J Endocrinol Invest. 1995 Apr;18(4):277-82.
27. Salerno S, Lettiero T, Esposito del Puente A, Esposito V, Capalbo D, Carpinelli A, et al. Effect of long-term L-thyroxine treatment on bone mineral density in young adults with congenital hypothyroidism. Eur J Endocrinol. 2004;151:689-94.
28. Kooh SW, Brnjac L, Ehrlich RM, Qureshi R, Krishnan S. Bone mass in children with congenital hypothyroidism treated with thyroxine since birth. J Pediatr Endocrinol Metab. 1996;9:59-62.
29. Kempers MJ, Vulsma T, Wiedijk BM, de Vijlder JJ, van Eck-Smit BL, Verberne HJ The effect of life-long thyroxine treatment and physical activity on bone mineral density in young adult women with congenital hypothyroidism. J Pediatr Endocrinol Metab. 2006 Dec;19:1405-12.
Recibido: 30 de diciembre de 2010.
Aprobado: 24 de abril de 2011.
Kesia Granela Cortiñas. Instituto Nacional de Endocrinología. Calzada de Zapata esquina D, El Vedado, municipio Plaza. La Habana, Cuba. Correo electrónico: kgc@hpc.cmw.sld.cu