Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol vol.22 no.3 Ciudad de la Habana sep.-dic. 2011
ARTÍCULOS ORIGINALES
Índice cintura-cadera contra perímetro cintura para el diagnóstico del síndrome metabólico en niños y adolescentes con familiares de primer grado diabéticos tipo 1
Waist-hip index versus waist circumference for diagnosis of metabolic syndrome in first degree-children and adolescents relatives of persons with type 1 diabetes
Eduardo Cabrera-Rode,I Yadenys Bioti Torres,II Sigrid Marichal Madrazo,III Judith Parlá Sardiñas,IV Celeste Arranz Calzado,V Raysa Olano Justiniani,VI Pedro González Fernández,VII Manuel Vera GonzálezVIII
IDoctor en Ciencias Biológicas. Investigador Titular. Jefe Departamento Inmunología. Instituto Nacional de Endocrinología. La Habana, Cuba.
IIEspecialista de I Grado en Medicina General Integral. Residente de 3er. año de Endocrinología. Instituto Nacional de Endocrinología. La Habana, Cuba.
IIIEspecialista de I Grado en Endocrinología. Hospital Pediátrico de Centro Habana. La Habana, Cuba.
IVEspecialista de I Grado en Endocrinología. Instituto Nacional de Endocrinología. La Habana, Cuba.
VLicenciada en Bioquímica. Máster en Bioquímica Clínica e Inmunología. Asistente. Investigadora Auxiliar. Instituto Nacional de Endocrinología. La Habana, Cuba.
VIEspecialista de I Grado en Medicina General Integral y Laboratorio Clínico. Instituto Nacional de Endocrinología. La Habana, Cuba.
VIIEspecialista de II Grado en Endocrinología. Máster en Atención Integral al Niño. Investigador y Profesor Auxiliar. Hospital Pediátrico Docente "William Soler". La Habana, Cuba.
VIIIEspecialista de II Grado en Endocrinología. Profesor e Investigador Auxiliar. Instituto Nacional de Endocrinología. La Habana, Cuba.
RESUMEN
Objetivo: comparar las mediciones de perímetro cintura e índice cintura-cadera para determinar la frecuencia del síndrome metabólico en familiares de primer grado de personas con diabetes tipo 1, utilizando diferentes definiciones pediátricas.
Métodos: se estudiaron 224 familiares de primer grado de personas con diabetes tipo 1, en edades comprendidas entre los 4 y los 19 años. Se les determinó peso, talla, perímetro cintura y perímetro cadera, tensión arterial, glucemia, triglicéridos y HDL-colesterol. Se aplicaron las definiciones de síndrome metabólico según los criterios de Cook, Ford, la Federación Internacional de Diabetes y del consenso cubano. Se realizó una variante del consenso cubano utilizando: índice de masa corporal e índice cintura-cadera, según tablas cubanas, valores de glucosa ³ 5,6 mmol/L y tensión arterial ³ 90 percentil (tablas cubanas). Se tomaron, de forma independiente, los criterios de HDL-colesterol y triglicéridos. Empleamos el índice cintura-cadera de las tablas cubanas, el perímetro cintura sugerido por la Asociación Latinoamericana de Diabetes y el europeo para las definiciones estudiadas. Para la comparación de las frecuencias del síndrome metabólico, se usó la prueba exacta de Fisher.
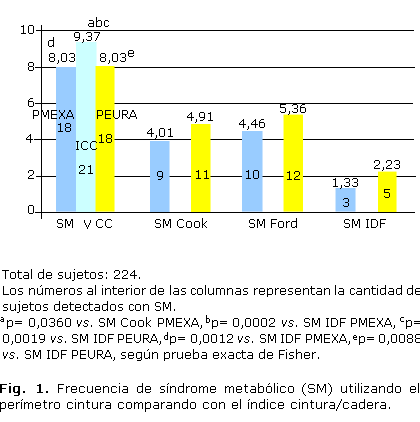
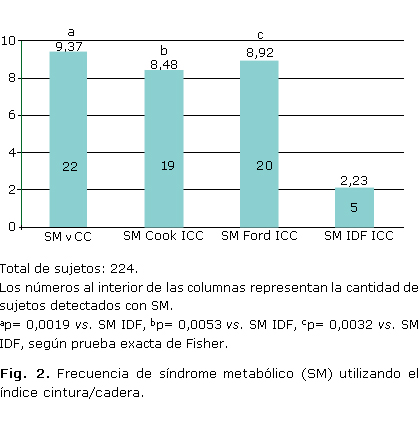
Resultados: la frecuencia del síndrome metabólico al aplicar la variante del consenso cubano fue de 9,37 % (21/224). Al comparar la variante del consenso cubano con las definiciones de Cook, Ford y la Federación Internacional de Diabetes (que utiliza el perímetro cintura de la Asociación Latinoamericana de Diabetes), se observó diferencia significativa con Cook y la Federación Internacional de Diabetes (4,01 %, p= 0,0360; 1,33 %, p= 0,0002 respectivamente). Al confrontar la presencia del síndrome metabólico de la variante del consenso cubano con Cook (8,48 %; 19/224) y Ford (8,93 %; 20/224), teniendo en cuenta el índice cintura-cadera de las tablas cubanas, podemos detectar frecuencias similares de familiares de primer grado de personas con diabetes tipo 1 con síndrome metabólico. En cambio, encontramos diferencias significativas cuando comparamos las frecuencias del síndrome metabólico de la variante del consenso cubano (p= 0,0019), de Cook (p= 0,0053) y de Ford (p= 0,0032), con la definición sugerida por la Federación Internacional de Diabetes (2,23 %; 5/224) empleando el índice cintura-cadera.
Conclusiones: nuestros datos indican que para el diagnóstico del síndrome metabólico debemos utilizar el índice cintura-cadera y no el perímetro cintura sugerido por la Asociación Latinoamericana de Diabetes, aún sin presentar datos propios del perímetro cintura de la población cubana.
Palabras clave: síndrome metabólico, niños y adolescentes, familiares de primer grado de diabéticos tipo 1, índice cintura-cadera, perímetro cintura.
ABSTRACT
Objective: to compare the measurements of waist circumference and waist-hip circumference to determine the frequency of metabolic syndrome in first degree relatives of persons with type 1diabetes, using different pediatric definitions.
Methods: two hundred twenty four first degree relatives of persons with type 1 diabetes were studied in ages from 4 to 10 years. Weight, height, waist-hip circumference, blood pressure, glycemia, triglycerides and HDL-cholesterol were determined. The definitions of metabolic syndrome according to Cook, Ford, International Federation of Diabetes and the Cuban consensus were applied. A variant of Cuban consensus was performed using: body mass index and waist-hip index according the Cuban tables, values of glucose ³ 5,6 mmol/L and blood pressure ³ 90 percentile (Cuban tables). In an independent way, criteria of HDL-cholesterol and triglycerides were taken into account. The waist-hip index of Cuban tables, the waist circumference suggested by the Latin-American and European Association of Diabetes for study definitions were applied. For comparison of frequencies of metabolic syndrome the Fisher exact test was used.
Results: the frequency of metabolic syndrome with application of Cuban consensus variant was of 9,37 % (21/224). Comparing the above variant with the definitions of Cook, Ford and of the International Federation of Diabetes (using the waist circumference of the Latin-American Association of Diabetes, there was a significant difference between Cook and the International Federation of Diabetes (4,01 %, p= 0,0360; 1,33 %, p= 0,0002, respectively). Comparing the presence of metabolic syndrome of the Cuban consensus variant with Cook (8,48 %; 19/224) and Ford (8,93 %; 20/224) taking into account the waist-hip index of the Cuban tables, it is possible to detect similar frequencies of first degree relatives of persons with type 1 diabetes with metabolic syndrome. On the other hand, we found significant differences comparing the frequencies of metabolic syndrome of the Cuban consensus variant (p= 0,0019), of Cook (p= 0,0053) and of Ford (p= 0,0032) with the definition suggested by the International Federation of Diabetes (2,23 %; 5/224) using the waist-hip index.
Conclusions: our data demonstrate that for the diagnosis of metabolic syndrome we must to use the waist-hip index and not the circumference suggested by the Latin-American Association of Diabetes, still without to present own data of waist-hip circumference of the Cuban population.
Key words: metabolic syndrome, children and adolescents, first-degree relatives of persons with type 1 diabetes, waist-hip index, waist circumference.
INTRODUCCIÓN
El síndrome metabólico (SM) es un complejo de interrelaciones de factores de riesgo para la enfermedad cardiovascular y la diabetes mellitas (DM). Estos factores incluyen: alteración de la glucosa, elevación de la presión arterial, elevación de los niveles de triglicéridos, disminución de los niveles del colesterol de las lipoproteínas de alta densidad (HDL- colesterol) y obesidad (particularmente de tipo central).1
Son varias las definiciones que han sido propuestas para el diagnóstico de SM en los niños y adolescentes. La mayoría están basadas en los criterios propuestos por el Tercer Informe del Panel de Expertos del Programa Nacional de Educación del Colesterol sobre Detección y Tratamiento de la Hipercolesterolemia en los Adultos (NCEP-ATPIII) y la Federación Internacional de Diabetes (IDF) para adultos.2 Sin embargo, algunos elementos como los aún inciertos valores de corte para evaluar los factores de riesgo en la población infantil, y sus variaciones en dependencia del sexo, la edad y el grupo étnico, dificultan la propuesta de una definición universal del SM para niños y adolescentes.3
En Cuba, durante el Primer Consenso Cubano sobre Dislipoproteinemias, en 2005, se establecieron los criterios para el diagnóstico del SM en niños y adolescentes, a partir de modificaciones de la definición correspondiente propuesta por el NCEP-ATPIII,4 que tiene la ventaja de utilizar las tablas cubanas de índice de masa corporal (IMC), índice cintura-cadera (ICC), y tensión arterial (TA) para la edad pediátrica.5
La OMS ha calificado a la obesidad de epidemia mundial del siglo XXI, que se ha convertido en el primer problema de salud pública. Estudios longitudinales sugieren que la obesidad infantil, después de los 3 años de edad, se relaciona con un mayor riesgo de obesidad en la edad adulta, y con un aumento de la morbilidad y mortalidad debido a la persistencia de los trastornos metabólicos asociados, entre los que se encuentran el SM.6
Definir la obesidad en el niño y el adolescente resulta complicado. El punto de corte teórico para esta sería el valor o percentil de IMC a partir del cual el riesgo para la salud comenzase a incrementarse significativamente. Identificar este valor es lo difícil. Tapia Ceballos describe que también se han aceptado el 85 y el 95 percentil para edad y sexo, como puntos de corte para definir el sobrepeso y la obesidad, respectivamente.6 Se trata, no obstante, de límites estadísticos arbitrarios que varían de una población a otra.6
Tanto en niños como en adultos, la obesidad que más se relaciona con complicaciones metabólicas, es la central o abdominal, resultado del depósito de grasa intraabdominal perivisceral.7,8 La simple medida de la circunferencia de la cintura es el mejor indicador de grasa visceral abdominal, y es una condición indispensable para el diagnóstico de SM en la definición de la IDF.9 En niños su incremento ha mostrado estar relacionado con una elevación de la presión arterial, el colesterol total, el colesterol de las lipoproteínas de baja densidad (LDL-c), los triglicéridos (TG), el descenso de lipoproteínas de alta densidad (HDL-c) y la resistencia a la insulina (RI).10-12
La Asociación Latinoamericana de Diabetes (ALAD) como la IDF, en sus criterios que definen el SM, tiene como requisito indispensable la presencia de obesidad abdominal. Esta recomienda que los países latinoamericanos que cuenten con tablas de referencia propias para el perímetro cintura (PC) deberán utilizarlas, y que en caso de no contar con datos nacionales de referencia, se sugiere utilizar los valores de referencias propuestas por ALAD mencionados en la guía.2
Teniendo en cuenta las diferencias existentes entre los diferentes puntos de corte de obesidad abdominal en las diferentes poblaciones, así como la importancia de esta en el diagnóstico de SM, nos preguntamos: ¿qué medida de circunferencia abdominal nos permite detectar mayor cantidad de niños y adolescentes con SM en Cuba? El objetivo de este estudio fue identificar cuál de las mediciones abdominales (ICC y PC) es la más apropiada para el diagnóstico del SM, utilizando diferentes definiciones pediátricas, en familiares de primer grado de personas con diabetes tipo 1 (FPG1).
MÉTODOS
Se realizó un estudio descriptivo transversal que incluyó 224 FPG1 (no diabéticos) registrados en el programa de predicción y prevención de la DM, con edades comprendidas entre 4 y 19 años. De estos, 119 pertenecientes al sexo femenino, y 105 al masculino. La edad promedio fue de 10,11±5,18 años. Los familiares responsables de los niños y adolescentes incluidos en el estudio dieron su consentimiento para la participación en él.
A todos los participantes se les realizó una encuesta previa en la que se recogieron por escrito las variables siguientes: edad, sexo y color de la piel; y además se midieron: peso, talla, TA, PC, perímetro de cadera, ICC e IMC. La TA se tomó 3 veces, en el brazo derecho, con el paciente sentado, con intervalos de 5 min, previo un reposo en silla durante 10 min, utilizando un esfigmomanómetro con manguito de tamaño adecuado para el diámetro del brazo, y se utilizó el valor promedio de las 3 tomas. El PC se determinó con una cinta métrica flexible, con el sujeto colocado de pie, en espiración, tomando el punto medio entre el borde inferior de la última costilla y la espina ilíaca anterosuperior de cada lado; en los casos de abdómenes péndulos, la medición se realizó en decúbito supino, en el punto más prominente del abdomen.13
El perímetro de cadera se tomó con el sujeto en posición de pie, con la cinta métrica flexible totalmente horizontal rodeando la máxima protrusión de los glúteos a nivel del trocánter mayor del fémur a cada lado, que en general coincide con la sínfisis pubiana.13 El ICC fue calculado como PC/perímetro de cadera y el IMC fue calculado como talla en kg/altura en m2.14 Se empleó el ICC de las tablas cubanas, el PC sugerido por la ALAD (perímetro mexicano-americano [PMEXA]) y el perímetro europeo-americano (PEURA) para la comparación de las frecuencias del SM.
Las determinaciones de los análisis bioquímicos se realizaron a cada sujeto en el momento de obtención de la muestra de sangre, luego de aproximadamente 8-12 h de ayuno. Se midieron las concentraciones plasmáticas de glucosa y lípidos (triglicéridos y colesterol ligado a lipoproteínas de alta densidad) en los FPG1.
El consenso cubano (CC), establecido en 2006, tiene en cuenta para el diagnóstico de SM que los pacientes cumplan 3 de los criterios siguientes: ICC ³ 90 percentil o IMC > 97 percentil (según tablas cubanas), glucemia en ayunas ³ 6,1 mmol/L, TG ³ 1,24 mmol/L, HDL-c < 1,03 mmol/L, e hipertensión arterial (HTA) ³ 95 percentil (según tablas cubanas), teniendo en cuenta que el HDL-c bajo y TG altos fueron considerados como un solo criterio.5
En este estudio se determinó la presencia del SM utilizando las definiciones de Ford,15 IDF,17 Cook y la variante del consenso cubano (vCC), en la cual se disminuyeron los puntos de corte para glucemia en ayunas y HTA, además se tomaron de forma independiente los valores de HDL-c y TG. Todos estos criterios diagnósticos se presentan en las tablas 1 y 2.
Tabla 1. Síndrome metabólico. Definiciones y criterios (I)
| Variante consenso cubano | Cook 4 | Ford15 o Tapia-Ceballos16 |
| ICC ³ 90 percentil o IMC> 97 percentil | PC ³ 90 percentil c | PC ³ 90 percentil g |
| Glucemia en ayunas ³ 5,6 mmol/L | Glucemia en ayunas ³ 6,1 mmol/L d | Glucemia en ayunas ³ 5,6 mmol/L*h |
| TG ³ 1,24mmol/L | TG ³ 1,24 mmol/L e | TG ³ 1,24 mmol/L |
| HDL-c < 1,03 mmol/L | HDL-c < 1,03 mmol/L e | HDL-C< 1,03 mmol/L |
| HTA, TAS y TAD ³ 90 percentil | HTA, TAS y TAD ³ 90 percentil f | HTA, TAS y TAD ³ 90 percentil i |
Variante consenso cubano: cumplir 3 o más criterios (HDL-C bajo y TG altos son 2 criterios independientes). Cook, Ford y Tapia-Ceballos: cumplir 3 o más criterios (HDL-c bajo y TG altos son 2 criterios).
a Tablas de IMC e ICC para niños y adolescentes cubanos según edad y sexo; b tablas de TA para niños y adolescentes cubanos según edad, sexo y talla; c National Health and Nutrition Examination Survey (NHANES III:); d Organización Mundial de la Salud (OMS); e Lipid Research Clinics; f National High Blood Pressure Education Program (NHBPEP); g AEP-SENC-SEEDO 2002: Grupo colaborativo español; h American Diabetes Association (ADA); i RICARDIN II: Grupo colaborativo español para el estudio de factores de riesgo cardiovascular en la infancia y adolescencia.
La concentración de glucosa en ayunas se determinó por el método de glucosa oxidasa.18 En relación con los lípidos, se midió colesterol total, triglicéridos y colesterol de las HDL-c mediante la utilización de métodos enzimáticos.19 En relación con las variables cualitativas o categóricas, se utilizaron el chi cuadrado o la prueba exacta de Fisher, en dependencia del tamaño de la muestra. Se consideró que las diferencias eran estadísticamente significativas para una p< 0,05.
RESULTADOS
En este estudio se investigó la presencia de obesidad tomando en cuenta el ICC, el PEURA y el PMEXA (tabla 3), observando que la mayor frecuencia de obesidad era detectada al utilizar el ICC (35,7 %), en comparación con el PEURA (14,3 %) y el PMEXA (9,4 %) (p< 0,0001).
En la figura 1 se muestra la frecuencia de SM utilizando diferentes definiciones del síndrome y distintas medidas de obesidad abdominal (ICC, PMEXA, PEURA) para cada una de estas. Podemos observar que la frecuencia de SM, aplicando la vCC con el ICC como medida de obesidad, resultó de 9,37 % (21/224), y se evidenció una diferencia significativa al compararla con la frecuencia encontrada utilizando las definiciones de Cook y la IDF con PMEXA (4,01 %, 9/224, p= 0,0360 y 1,33 %; 3/224, p= 0,0002 respectivamente) y de la IDF utilizando PEURA (2,23 %; 5/224, p= 0,0019). Al contrario, la comparación de la frecuencia de SM al utilizar la vCC, tomando el ICC como medida de obesidad con la definición de Ford al usar el PMEXA, observamos que existe una tendencia a la significación (4,46 %, 10/224, p= 0,0611). Por otra parte, cuando comparamos la frecuencia de SM aplicando la vCC con PMEXA y PEURA, con la definición de la IDF utilizando estos perímetros, vemos una diferencia significativa (p= 0,0012 vs. SM IDF PMEXA, p= 0,0088 vs. SM IDF PEURA).
Cuando comparamos la vCC con Cook y Ford, teniendo en cuenta el ICC de las tablas cubanas (figura 2), detectamos frecuencias similares de FPG1 con SM, siendo estas de 8,48 %; 19/224 y 8,92 %; 20/224 respectivamente. En cambio, encontramos diferencias significativas cuando comparamos las frecuencias del SM de la vCC, de Cook y de Ford con la definición de la IDF empleando el ICC (2,23 %; 5/224; p= 0,0019, p= 0,0053, p= 0,0032 respectivamente).
Al analizar la frecuencia de algunos de los componentes del SM en los FPG1 resalta la presencia de triglicéridos elevados en los pacientes estudiados (TG ³ 1,24 mmol/L con 53,6 % y TG ³ 1,7 mmol/L con 13,4 %) en relación con el resto de los componentes, seguido por la HTA con un 19,6 % de frecuencia (tabla 4).
Al relacionar los componentes del SM con el ICC de nuestras tablas cubanas, podemos observar la relación directa existente entre un ICC ³ del 90 percentil con la presencia de: triglicéridos elevados (TG ³ 1,24 mmol/L [36,7 %] y TG ³ 1,7 [46,7 %]), HTA (54,5 %) y HDL-c bajo (50,0 %) (tabla 5). Sin embargo, cuando comparamos la presencia de dichos componentes con los PEURA y PMEXA, con respecto a lo encontrado en relación con el ICC, vemos que existen diferencias significativas, sobre todo, con la presencia de TG ³ 1,24 mmol/L (ICC vs. PMEXA, p< 0,0001 y ICC vs. PEURA, p< 0,0023), TG ³ 1,7 mmol/L (ICC vs. PMEXA, p= 0,0251), HTA (ICC vs. PMEXA p= 0,0081), y HDL-c (ICC vs. PMEXA, p= 0,0068 y ICC vs. PEURA, p= 0,0217) (tabla 5).
DISCUSIÓN
La población cubana es especialmente heterogénea, resultado de un importante mestizaje entre una mayoría europea (principalmente españoles) y africanos (oeste de África). Díaz-Horta y otros,20 reportaron una asociación entre la DM 1 y la ancestralidad europea determinada con marcadores genéticos informativos de ascendencia (AIMs de sus siglas en inglés). Teniendo en cuenta que los pacientes incluidos en el presente estudio son FPG1, se supone tengan una predominante ascendencia europea, no obstante, al ver nuestros resultados vemos que, a pesar de la presencia de ancestralidad europea en nuestra población, debemos seguir utilizando el ICC como medida antropométrica en el diagnóstico de obesidad central, y no los PEURA y PMEXA, con los cuales se detectan menos de la mitad de los sujetos con obesidad abdominal que por el ICC de nuestras tablas cubanas. Bosy y otros, aludieron al ICC como un buen criterio de obesidad abdominal,21 lo cual reafirma lo encontrado en nuestra investigación.
En este estudio la frecuencia de SM varía según la definición utilizada. La mayoría de los estudios que tratan el SM en población pediátrica estiman su frecuencia entre un 2,0-9,4 %,22,23 por tanto, al comparar la frecuencia de SM en niños y adolescentes FPG1 utilizando la vCC (9,37 %) con las frecuencias antes descritas por estos autores, podemos observar que es semejante, pero si la comparamos con las reportadas en otros estudios,24-26 vemos que la encontrada en esta investigación supera la citada por estos últimos. Creemos que estos resultados se deben a la disminución de los puntos de corte de algunos de los componentes de la definición del CC que realizamos en esta investigación (glucemia en ayunas ³ 5,6 mmol/L y TA ³ 90 percentil), los cuales se basaron en criterios ya establecidos por otras definiciones, además de la utilización del ICC y/o IMC como medida de obesidad.
Cabrera Rode y otros, en un estudio anterior, encontraron una frecuencia de 5,7 % (11/193) de SM utilizando la definición del CC,27 por lo que, al disminuir los puntos de cortes de algunos de los componentes del SM en los FPG1 al aplicar la vCC, pudimos diagnosticar más individuos con el síndrome (10 sujetos adicionales). La diferencia tan significativa encontrada entre la frecuencia de SM al usar la definición de IDF y el resto de las definiciones utilizadas, en especial la vCC, creemos que está dada por el distinto valor del punto de corte de triglicéridos utilizado por la IDF (1,7 mmol/L), el cual es mucho más alto que en el resto de las definiciones (1,24 mmol/L), lo cual repercute en el decremento de la detección de sujetos con SM.
Cada uno de los componentes del SM es un factor independiente de riesgo cardiovascular. La coexistencia de varios de estos componentes tiene un efecto sinérgico en el riesgo aterogénico.2 La enfermedad cardiovascular es causa principal de muerte en la población adulta, sin embargo el proceso patológico y los factores de riesgo asociados a su desarrollo, se inician tempranamente en la niñez.28 Distintos autores demuestran que la ganancia excesiva de peso en este período, es un determinante de riesgo cardiovascular, que lleva, fundamentalmente, a eventos clínicos adversos en la edad adulta.28,29 Por lo tanto, la identificación de niños con múltiples factores de riesgo es muy importante, ya que la niñez provee una oportunidad única para promover efectos beneficiosos sobre la salud.28,30
De forma general observamos en nuestro estudio que el componente del SM que más se presentó en los sujetos estudiados fue la hipertrigliceridemia, incluso en los pacientes no obesos, siendo este resultado similar a lo encontrado en un estudio realizado en México,31 en el que la prevalencia de dislipidemia en la población estudiada resultó de 38,7 %. Ha sido demostrado que en los pacientes con DM 1 con mal o pobre control glucémico, los niveles de triglicéridos se encuentran elevados, contrariamente a lo observado en los pacientes con DM 1 con óptimo control de su glucemia, en los que los niveles de triglicéridos se encuentran normales o ligeramente disminuidos.32 Lo encontrado en este estudio podría estar dado porque los individuos estudiados son FPG1, que presentan una predisposición a la enfermedad, la hipertrigliceridemia pudiera ser un indicador del comienzo de un trastorno del metabolismo. Estos resultados nos instaron al comienzo de una intervención en los cambios de vida (actividad física y alimentación adecuada) en los FPG1, para contrarrestar la presencia de la concentración elevada de los triglicéridos.
Cuando se evalúa la relación de los componentes del SM con las diferentes medidas antropométricas utilizadas en este trabajo, prevalece la presencia de hipertrigliceridemia en relación con el ICC elevado, lo cual reafirma la relación directa entre la obesidad y la dislipidemia. De forma similar, Revenga y otros mostraron a la hipertrigliceridemia como el componente que más se asoció a la obesidad utilizando el PC.33 De igual manera sucede con la HTA y el HDL-c disminuido, siendo estos el segundo y tercer componente más relacionado con el ICC. En jóvenes hispanos con sobrepeso se mostró un resultado diferente, en el cual el componente que más prevaleció fue el descenso del HDL-c.34
Durante la redacción de los resultados finales de esta investigación es publicado un estudio en el que se establecen percentiles del PC en niños y adolescentes habaneros a partir de los 8 años de edad.35 Por consiguiente, nos propusimos comparar la frecuencia de obesidad abdominal utilizando el PC recientemente publicado, y el ICC de las tablas cubanas para los 138 sujetos con 8 años y más de nuestro grupo de estudio. Como resultado se encontraron frecuencias similares de obesidad central para ambas medidas antropométricas (ICC 36,2 %; 50/138 y PC 40,6 %; 56/138), las cuales diferían de los PC mexicanos y europeos utilizados.
Al tomar como puntos de cortes de obesidad central ³ del 90 percentil para el ICC y el PC, se observó que al utilizarlos de forma independiente se escapaban algunos sujetos con obesidad abdominal en cada una de estas medidas, pero la mayoría de los casos coincidían las 2 mediciones positivas al unísono, lo cual nos demuestra la importancia de utilizar ambas mensuraciones para determinar la obesidad abdominal en este grupo de edades. En este trabajo, teniendo en cuenta que los niños y adolescentes incorporados presentan edades a partir de 4 años, no fue posible el uso del PC cubano, ya que este se estableció a partir de los 8 años de edad.
En conclusión, los resultados de la presente investigación indican que para el diagnóstico del SM debemos utilizar el ICC de las tablas cubanas y no el PC sugerido por la ALAD (PMEXA), así como tampoco el PEURA, si nos guiamos por los resultados encontrados en este trabajo. Recomendamos realizar estudios para establecer los valores de cortes de las mediciones antropométricas de PC para niños y adolescentes de la población cubana desde edades más tempranas. A punto de partida de los resultados de estas investigaciones sería posible establecer nuevas comparaciones entre el PC y el ICC en un mismo grupo de estudio, para emplear ambas mediciones abdominales en la detección de sujetos con SM.
AGRADECIMIENTOS
Los autores desean expresar su agradecimiento por la asistencia brindada en la ejecución de esta investigación a Marisol Hernández, Aydeé Valverde, Darwin Reyes y al Departamento de Bioquímica del Instituto Nacional de Endocrinología.
REFERENCIAS BIBLIOGRÁFICAS
1. Alberti KGMM, Eckel RH, Grundy SM, Zimmet PZ, Cleeman JI, Donato KA, et al. Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation. 2009;120:1 640-5.
2. Rosas Guzmán J, Torres Tamayo M, Calzada León R, Sinay I, Costa Gil J, de Loredo L, et al. Guía ALAD Diagnóstico, control, prevención y tratamiento del síndrome metabólico en pediatría. Revista de la Asociación Latinoamericana de Diabetes. 2009; XVII:16-31.
3. Cruz ML, Goran MI. The Metabolic Syndrome in Children and Adolescents. Curr Diab Rep. 2004;4:53-62.
4. Cook S, Weitzman M, Auinger P, Nguyen M, Dietz W. Prevalence of metabolic syndrome phenotype in adolescents: findings from the Third National Health and Nutrition Examination Survey, 1988-1994. Arch Pediatr Adolesc Med. 2003;157:821-7.
5. Calderin RO, Prieto M, Cabrera E. Síndrome de insulinorresistencia en niños y adolescentes. Rev Cubana Endocrinol [serie en internet]. 2007 [citado 4 de julio de 2011];18(2). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1561-29532007000200007&lng=es&nrm=iso&tlng=es
6. Tapia Ceballos. Síndrome metabólico en la infancia. An Pediatr (Barc). 2007;66(2):159-66.
7. Dobbelsteyn C, Joffres M, MacLean D, Flowerdew G. A comparative evaluation of waist circumference, waist-to-hip ratio and body mass index as indication of cardiovascular risk factors: the Canadian Health Surveys. Int Obes Relat Metab Disord. 2001;25:652-61.
8. Janssen I, Heymsfield S, Allison D, Kotler D, Roos R. Body mass index and waist circumference independently contribute to the prediction of nonabdominal, abdominal subcuaneous, and visceral fat. Am J Clin Nutr. 2002;75:683-8.
9. Maffeis C, Pietrobelli A, Grezzani A, Provera S, Tato L. Waist circumference and cardiovascular risk factors in prepuberal children. Obes Res. 2001;9:179-87.
10. Savva S, Tornaritis M, Savva M, Kourides Y, Panagi A, Silikiotou N, et al. Waist circumference and waist-to-height ratio are better predictors of cardiovascular disease risk factors in children than body mass index. Int J Obes Relat Metab Disord. 2000;24:1453-8.
11. Khoo CM, Liew CF, Chew SK, Tai ES. The impact of central obesity as a prerequisite for the diagnosis of metabolic syndrome. Obesity (Silver Spring). 2007;15:262-9.
12. Alberti KG, Zimmet PZ, Shaw JE. The Metabolic Syndrome-A New Wordlwide Definition from the International Diabetes Federation Consensus. Lancet. 2005;366:1 059-62.
13. Callaway CW, Chumlea WC, Bouchard C, Himes JH, Lohman TG, Martin AD, et al. Circumferences. In: Lohman TG, Roche AF, Martorell R, editors. Anthropometric standardization reference manual. Campaign: Human Kinetics Books; 1991. p. 44-5.
14. Hernández M. El patrón de crecimiento humano y su evaluación. En: Pombo A. Tratado de Endocrinología Pediátrica. Madrid: McGraw-Hill Interamericana; 2002. p. 244-74.
15. Ford ES, Ajan UA, Mokdad AH. The metabolic syndrome and concentrations of C-reactive protein among US. Youth. Diabetes Care. 2005;28:878-81.
16. Tapia Ceballos L, López Siguero JP, Jurado Ortiz A. Prevalencia del síndrome metabólico y sus componentes en niños y adolescentes con obesidad. An Pediatr (Barc). 2007;67:352-61.
17. Zimmet P, Alberti G, Kaufman F, Tajima N, Silink M, Arslanian S, et al. El síndrome metabólico en niños y adolescentes: el consenso de la IDF. Diabetes Voice. 2007;52:29-32.
18. Trinder P. Determination of glucose oxidase with one alternative oxygen acceptor. Ann Clin Biochem. 1969;6:24-7.
19. Barti K, Ziegenhorn J. Methods of enzymatic analysis. J Bermeyer VCH Weinheim, Germany. 1985;VII:134-46.
20. Díaz-Horta O, Cintado A, Fernández-De-Cossio ME, Nazabal M, Ferrer A, Roca J, et al. Relationship of type 1 diabetes to ancestral proportions and HLA DR/DQ alleles in a simple of the admixed Cuban population. Ann Hum Biol. 2010;37:778-88.
21. Bosy A, Geisler C, Onur S, Korth O, Selberg O, Schrezenmeir J and Mûller MJ. Value of body fat mass vs anthropometric obesity indices in the assessment of metabolic risk factors. International Journal of Obesity. 2006;30:475-83.
22. De Ferranti SD, Osganian SK. Epidemiology of paediatric metabolic syndrome and type 2 diabetes mellitus. Diab Vasc Dis Res. 2007;4:285-96.
23. Nelson RA, Bremer AA. Insulin resistance and metabolic syndrome in the pediatric population. Metab Syndr Relat Disord. 2010;8:1-14.
24. Ford E, Giles W, Dietz W. Prevalence of the metabolic syndrome among US adults: findings from the third National and Nutrition Examination Survey. JAMA. 2002;287:356-9.
25. Mills GW, Avery P, McCarthy M, Hattersley AT, Levy JC, Hitman GA, et al. Heritability estimates for beta cell function and features of the insulin resistance syndrome in UK families with anincreased susceptibility to type 2 diabetes. Diabetologia. 2004;47:732-8.
26. Chen W, Bao W, Begum S, Elkasabany A, Srinivasan SR, Berenson GS. Age-related patterns of the clustering of cardiovascular risk variables of syndrome X from childhood to young adulthood in a population made up of black and white subjects: The Bogalusa Heart Study. Diabetes. 2000;49:1 042-8.
27. Cabrera-Rode E, Marichal S, Parlá J, Arranz C, González R, Pérez C, González P, Vera M, Díaz-Horta O. Frequency and characteristics of metabolic syndrome and insulin resistance in the first-degree relatives of persons with type 1 diabetes. Endocrinol Nutr. 2010;57:311-21.
28. Casavalle P, Romano L, Maselli M, Pandolfo M, Ramos M, Caamaño A, et al. Prevalencia de síndrome metabólico según diferentes criterios en niños y adolescentes con sobrepeso y obesidad. ALAD. 2010;XVIII(3):112-9.
29. Steimberger J, Daniels SR. Obesity, Insulin Resistance, Diabetes, and Cardiovascular Risk in Children. Circulation. 2003;107:1 448- 53.
30. Sinaiko AR, Donahue RP, Jacobs DR, Princas RJ. Relation of Weight and Rate of Increase in Weight during Childhood and Adolescence to Body Size, Blood Pressure, Fasting Insulin and Lipids in Young Adults. The Minneapolis Children's Blood Pressure Study. Circulation. 1999;99:1 471-6.
31. Marcos NJ, Núñez GM, Salinas AM, Santos M, Decanini H. Obesidad como Factor de Riesgo para Trastornos Metabólicos en Adolescentes Mexicanos, 2005. Rev Salud Pública. 2007;9(2):180-93.
32. Vergès B. Lipid disorders in type 1 diabetes. Diabetes Metab. 2009;35:353-60.
33. Revenga J, González EM, Bueno G, De Miguel P, Velasco P, Rey JP, et al. Abdominal fat and metabolic risk in obese children and adolescents. J Physiol Biochem. 2009;65(4):415-20.
34. Cruz M, Weigensberg M, Huang T, Ball G, Shaibi G, Goran M. The Metabolic Syndrome in Overweight Hispanic youth and the role of Insulin sensitivity. J Clin Endocrinol Metab. 2004;89:108-13.
35. Esquivel M, Rubén M, González C, Rodríguez L, Tamayo V. Curvas de crecimiento de la circunferencia de la cintura en niños y adolescentes habaneros. Rev Cubana Pediatr. 2011;83:44-55.
Recibido: 29 de mayo de 2011.
Aprobado: 26 de junio de 2011.
Eduardo Cabrera Rode. Instituto Nacional de Endocrinología. Calzada de Zapata y D, El Vedado, municipio Plaza, La Habana, Cuba. Correo electrónico: diabetes@infomed.sld.cu