Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol vol.22 no.3 Ciudad de la Habana sep.-dic. 2011
ARTÍCULOS ORIGINALES
Resistencia a la insulina e historia familiar de diabetes en niños y adolescentes obesos con acantosis nigricans y sin ella
Insulin resistance and family history of diabetes in obese children and with and without acanthosis nigricans
Pedro González Fernández,I Eduardo Cabrera Rode,II María Antonia Oti GilIII
IEspecialista de II Grado en Endocrinología. Máster en Atención Integral al Niño y en Bioética. Investigador y Profesor Auxiliar. Hospital Pediátrico Docente "William Soler". La Habana, Cuba.
IIDoctor en Ciencias Biológicas. Investigador Titular. Instituto Nacional de Endocrinología. La Habana, Cuba.
IIIEspecialista de I Grado en Pediatría. Máster en Atención Integral al Niño. Hospital Pediátrico Docente del Cerro. La Habana, Cuba.
RESUMEN
Introducción: las complicaciones metabólicas más importantes para la morbilidad y mortalidad que se derivan de la obesidad tienen como común denominador la resistencia a la insulina.
Objetivo: determinar la existencia de resistencia a la insulina e historia familiar de diabetes en un grupo de niños y adolescentes obesos con y sin acantosis nigricans.
Métodos: se estudiaron 46 sujetos obesos con y sin acantosis nigricans (21 varones y 25 hembras), con edades entre 4 y 16 años, procedentes de la consulta de endocrinología del Hospital Pediátrico Docente "William Soler", en el período de noviembre de 2006 a febrero de 2007. Se les realizó, además de examen físico y anamnesis, prueba de tolerancia a la glucosa con determinación de glucemia e insulinemia en ayunas y a las 2 h. Se utilizó como criterio de resistencia a la insulina el índice HOMA.
Resultados: la mayoría de los pacientes (36 sujetos) presentaron resistencia a la insulina, independientemente de la presencia o no de acantosis nigricans, que no estuvo relacionada con el grado de obesidad ni con el pliegue tricipital de grasa, pero sí con la historia familiar de diabetes tipo 2. La presencia de acantosis nigricans estuvo relacionada con el grado de obesidad. Se encontró un 13 % de pacientes con criterios de prediabetes.
Conclusiones: la obesidad y la historia familiar de diabetes tipo 2 en los niños y adolescentes se relacionan con la presencia de resistencia a la insulina, independientemente de la presencia de acantosis nigricans.
Palabras clave: obesidad, acantosis nigricans, resistencia a la insulina, diabetes mellitus tipo 2 en niños, prediabetes, historia familiar de diabetes.
ABSTRACT
Introduction: the more important metabolic complications for morbidity and mortality derived from obesity have in common the insulin resistance.
Objective: to determine the insulin resistance and the family history of diabetes in a group of obese children and adolescents with and without acanthosis nigricans.
Methods: forty six obese subjects with and without acanthosis nigricans (21 boys and 25 girls) aged between 4 and 16, from the "William Soler" Teaching Children Hospital were studied from November, 2006 to February, 2007. Also, they underwent a physical examination and anamnesis, a test of glucose tolerance with determination of fasting glycemia and insulinemia and at 12 hours. As criterion of insulin resistance the HOMA index was used.
Results: most of patients (36 subjects) had insulin resistance, independently of the acanthosis nigricans presence, which was neither related to the obesity degree nor the fat tricipital fold, but yes to the family history of type 2 diabetes. The presence of acanthosis nigricans was related to the obesity degree. There was a 13 % of patients with pre-diabetes criteria.
Conclusions: the obesity and the family history of type 2 diabetes in children and adolescents were related to presence of insulin resistance, independently of presence of acanthosis nigricans.
Key words: obesity, acanthosis nigricans, insulin resistance, type 2 diabetes mellitus in children, prediabetes, family history of diabetes.
INTRODUCCIÓN
El incremento de la obesidad infantil es un problema de salud debido a su asociación con enfermedades crónicas del adulto, como son, las enfermedades cardiovasculares, la diabetes mellitus y las dislipidemias, entre otras, amén de que durante la propia niñez comienzan alteraciones como la esteatosis no alcohólica, la apnea durante el sueño, la hipertensión arterial y muchas otras más.1-3 La prevalencia de la obesidad ha variado notablemente en relación con los últimos 20-30 años, y se estima que el porcentaje de niños y adolescentes obesos ha tenido un incremento de casi un 50 %.4-6
Las alteraciones genéticas o endocrinas determinan cerca del 5 % de las causas de obesidad, y el 95 % restante ocurre como consecuencia de factores exógenos o nutricionales favorecidos por una predisposición genética,7 de manera que la población pediátrica tiene un riesgo aproximado del 9 % de desarrollar obesidad, pero si uno de los padres es obeso, el riesgo se incrementa entre 41 y 50 %, y si ambos lo son, aumenta entonces hasta un 69-80 %.8 Existe un número no despreciable de condiciones patológicas que se asocian a la obesidad, pero de todas ellas, la resistencia a la insulina (RI) es la más importante, ya que da inicio, no solo a la diabetes mellitus tipo 2 (DM 2), sino a otros procesos, como el síndrome metabólico, que constituye el mayor riesgo para la mortalidad futura por eventos cardiovasculares prematuros.9,10
Por otro lado, la acantosis nigricans (AN), estrechamente relacionada con la DM 2, ha sido considerada por algunos investigadores como un marcador clínico para reconocer aquellos pacientes obesos de mayor riesgo para desencadenar eventos metabólicos como la DM 2 y el síndrome metabólico entre otros.11 En los últimos 10 años se ha descrito en distintos países un incremento en la incidencia de DM 2 en la niñez y la adolescencia, y ha aumentado su proporción de 4-16 % entre 1982 y 1994, hasta 46 % recientemente.2,12 Esta tendencia va paralela al incremento de la obesidad, la cual ha surgido como un factor de riesgo para el desarrollo precoz de DM 2, entre otros factores prenatales y posnatales.13,14
Dado lo expresado anteriormente, nos propusimos con este trabajo determinar la presencia de RI y su posible relación con la intensidad de la obesidad e historia familiar de DM 2 en un grupo de niños y adolescentes obesos con y sin AN.
MÉTODOS
Se realizó un estudio descriptivo, de corte transversal, en que se estudiaron 46 pacientes obesos (peso corporal para la talla mayor del 20 %) con edades entre 4 y 16 años, que acudieron consecutivamente a la consulta endocrinología del Hospital Pediátrico Docente "William Soler", en el período comprendido entre noviembre de 2006 y febrero de 2007. Se excluyeron del estudio los pacientes con enfermedades crónicas asociadas, o que recibieron tratamiento con corticoesteroides, menores de 4 años y mayores de 16 años de edad, que no tuvieran criterio de obesidad exógena, así como la no aceptación a participar voluntariamente de la investigación.
A todos los pacientes se les realizó la anamnesis, en que se tomaron los datos generales del paciente, historia familiar (de primero y segundo grado) de DM 2 por rama materna y paterna, examen físico que incluyó búsqueda de lesiones de AN, peso, talla y mensuración del pliegue tricipital de grasa, prueba de tolerancia a la glucosa (PTG) en que se tomaron muestras de sangre en ayunas y a las 2 h de la administración de glucosa, y en cada muestra de determinó en plasma glucemia e insulinemia. Se consideró AN la presencia de zonas hiperpigmentadas de aspecto aterciopelado en la base del cuello, axilas o en ambas regiones.
Para la obtención del peso corporal, la talla y los pliegues de grasa se utilizó la metodología diseñada en el estudio de crecimiento y desarrollo humano en Cuba.15 Se consideró como peso ideal el que se encontraba en el 50 % de acuerdo con el sexo y la talla obtenida en el momento de la consulta. Se consideró obesidad el peso mayor al 20 % del peso ideal. Para dichas comparaciones se utilizaron las tablas de peso y talla nacionales.15 La obesidad se clasificó en grados de acuerdo con la fórmula siguiente: (peso real/peso ideal para la talla del niño) x 100, y se expresó en porcentaje.
Grado 1- obesidad ligera: peso corporal entre 120-129 %.
Grado 2- obesidad moderada: peso corporal entre 130-139 %.
Grado 3- obesidad severa: peso corporal entre 140-199 %.
Grado 4- obesidad mórbida: peso corporal superior a 200 %.
La PTG se realizó de acuerdo con las normas de la OMS.16 La concentración de glucosa plasmática se dosificó empleando los métodos de glucosa-oxidasa17 y la concentración de insulina en plasma por el método de radioinmunoensayo (RIA).18 Se tomaron como criterios de trastornos del metabolismo de los carbohidratos los criterios de la American Diabetes Association.19 Se emplearon como criterio de prediabetes los valores de glucemia en ayunas ³ 5,6 mmol/L y < de 7 mmol/L, y tolerancia a la glucosa alterada (TGA) cuando la glucemia en ayunas fue inferior a 7,0 mmol/L, así como glucemia a las 2 h de la sobrecarga oral de glucosa ³ 7,8 mmol/L y £ 11 mmol/L. El índice de RI se determinó de acuerdo con el modelo homeostático Homeostatic Measurements Assessment (HOMA) de Mathews20 (insulina en ayunas µU/mL x glucosa en ayunas mmol/L /22,5). Se consideró como criterio de RI aquellos sujetos que presentaron valores superiores a 3,1.21
Para el análisis estadístico los pacientes se agruparon de acuerdo con la presencia o no de AN, de acuerdo con el grado de obesidad y de acuerdo con el índice HOMA-IR. Se utilizó la estadística descriptiva: media, desviación estándar (DS) y porcentaje (%), así como las pruebas de hipótesis siguientes: prueba de c2, prueba exacta de Fisher, correlación de Pearson y la prueba U de Mann-Whitney, todas con un nivel de significación de p< 0,05. Se utilizó una computadora personal y el paquete estadístico SPCS versión 12. Esta investigación no puso en peligro la vida de los pacientes, y se tomaron en cuenta los aspectos éticos de autonomía, información, seguridad para la salud de los pacientes, confidencialidad y consentimiento informado.
RESULTADOS
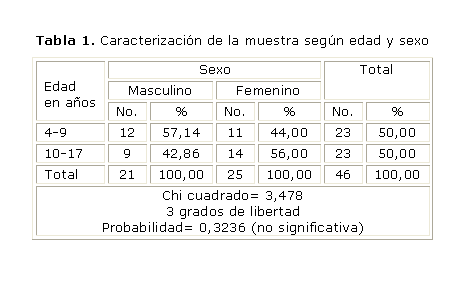
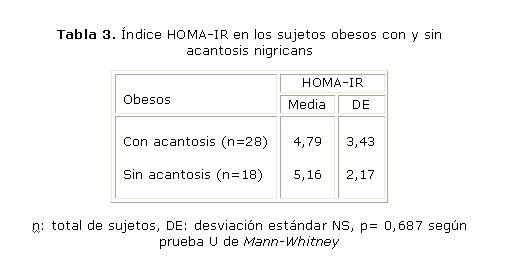
En la tabla 1 se aprecia que la muestra estuvo distribuida por sexos de manera similar, así como los grupos de edades. Para verificar independencia entre edad y sexo, se realizó una prueba no paramétrica de c2, cuya probabilidad no resultó estadísticamente significativa. De los 46 pacientes estudiados, 36 de ellos (21 pacientes con AN y 15 pacientes sin AN) presentaron RI (78 %), lo que representa un porcentaje elevado, sin embargo, no se encontraron diferencias estadísticamente significativas entre el índice HOMA-IR y la AN (tablas 2 y 3).
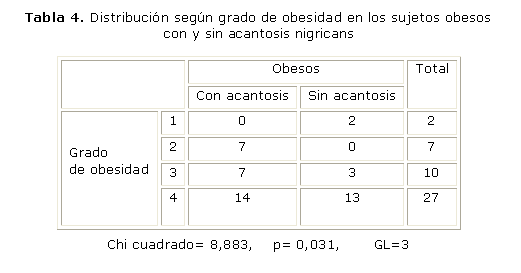
En cuanto al grado de obesidad (tabla 4) y la presencia o no de AN, se hallaron diferencias significativas (p= 0,031 entre la presencia de AN en aquellos pacientes con un grado de obesidad grado 2, 3 y grado 4. Se relacionaron los grados de obesidad y la presencia o no de AN con el valor del índice HOMA-IR, es decir, presencia o no de RI, sin encontrar diferencias entre ellas.
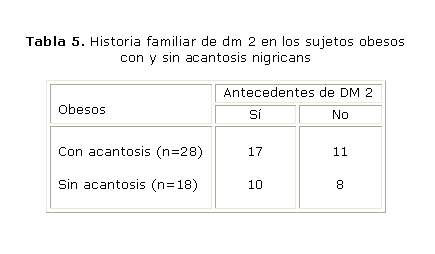
En cuanto a la historia familiar de DM 2, como muestra la tabla 5, no se encontró relación entre esta característica y la presencia o no de AN. Sin embargo, cuando se relacionó con la RI (tabla 6), se halló que el grupo de sujetos con historia familiar de DM 2 presentó una frecuencia mayor de RI en relación con el grupo que no tenía este antecedente, con diferencia estadísticamente significativa entre ambos grupos. La relación entre el pliegue tricipital de grasa y la presencia o no de AN no mostró diferencias significativas.
En cuanto a la presencia de los trastornos del metabolismo de los carbohidratos se encontraron 2 pacientes con AN y 2 pacientes sin AN con glucemia en ayunas alterada (GAA). En relación con la TGA, se hallaron solamente 2 pacientes en el grupo con AN. No se encontró relación estadísticamente significativa en relación con la AN. De manera que, de los 46 pacientes estudiados, solamente 6 de ellos presentaron criterio compatible con prediabetes, lo que representa el 13 % de todos los pacientes estudiados. Debemos añadir que todos los obesos con trastornos del metabolismo de la glucosa mostraron RI, y un 50 % de ellos, historia familiar de DM 2. Ningún sujeto de este estudio hasta el momento desarrolló DM 2.
DISCUSIÓN
Las complicaciones metabólicas más importantes para la morbilidad y mortalidad que se derivan de la obesidad tienen como común denominador la RI,22 de ahí que el objetivo principal de este trabajo fuera determinar la frecuencia de esta alteración en el grupo de niños obesos.
Se ha señalado que la sensibilidad a la insulina en los tejidos en que esta hormona es necesaria para metabolizar la glucosa, está alterada en los sujetos obesos,23 y aunque estos sujetos mantengan la glucemia dentro de parámetros normales, el aumento de la insulinemia, así como su resistencia en dichos tejidos, ocasiona alteraciones que dan lugar a un síndrome conocido como síndrome de RI, síndrome X, o síndrome metabólico, como lo describió Reaven.24
La AN se considera un marcador de RI y es un hallazgo frecuente en más del 90 % de los jóvenes con DM 2.25 Estas lesiones de la piel son consecuencia de una hiperplasia difusa de la lámina espinosa de la piel, que se manifiesta como manchas hiperpigmentadas de aspecto aterciopelado en áreas de pliegues, como son, la base del cuello y axilas, que son las zonas más afectadas frecuentemente.26 Aunque debemos aclarar que la AN no es exclusiva de expresar un trastorno metabólico, pues puede estar presente en otras afecciones, como son, los procesos malignos.27 La importancia endocrinológica de la AN radica en su asociación con RI, el hiperinsulinismo y los hallazgos del síndrome metabólico,28 así como con la DM 2.25 En un estudio realizado en la Universidad de Columbia, New York, se constató la presencia de AN en el 80 % de los niños y adolescentes obesos estudiados.29 Por otra parte, Bonet y otros30 en 74 niños obesos hallaron una frecuencia de 40 % de AN, y cuando la relacionaron con la RI, observaron que los niños con mayor índice de masa corporal (IMC) tenían mayor RI, y cuando la asociaban a la AN aumentaban estas diferencias.
Holst-Schumacher y otros,31 en una muestra de 214 niños de entre 8 y 10 años señalan un 46,7 % de RI. Por otro lado, Cáceres y otros,32 en 61 niños obesos de entre 5 y 19 años, encontraron un 38 % con RI. Felszeghy y otros,33 por su parte, encontraron una elevada frecuencia de RI, al estudiar 113 niños obesos con y sin AN, con predominio en aquellos con AN. Resultados similares han sido hallados por otros autores.26-34
Otros investigadores35,36 han reportado en niños obesos frecuencias tan elevadas de AN como 68 % y 69,6 % respectivamente. Autores como van Vliet y otros,37 en 528 niños y adolescentes de origen multiétnico, obesos y sobrepesos, encontraron un 47 % de RI, la que fue más marcada entre los adolescentes. Por otra parte, Telford y otros38 refieren un índice HOMA mayor en las hembras que en los varones, así como un mayor incremento con la edad, y a diferencia de lo anterior, Aucouturier y otros39 señalan en 66 niños y adolescentes obesos que el valor elevado del índice HOMA se relaciona con la distribución androide de la grasa corporal.
En nuestro país los estudios publicados en relación con RI en niños obesos no son abundantes. En nuestra revisión solamente hallamos una investigación similar a la nuestra en un estudio realizado en el municipio Marianao, a manera de despistaje, en 460 escolares con edades entre 8 y 15 años de edad. En ellos se encontró una prevalencia de obesidad del 15 %. De los sujetos obesos, el 21,7 % presentó criterio de síndrome metabólico. Estos autores señalan una frecuencia de RI de 62 % en los sujetos con obesidad severa, así como que la RI aumentaba con la severidad de la obesidad, aunque no encontraron relación con la historia familiar de DM.40 Esta disparidad de frecuencias de RI en niños obesos se debe a las diferencias de las muestras estudiadas, así como a los criterios que se tomen de RI, no obstante lo anterior, todas las frecuencias reportadas no dejan de ser elevadas, y por ende, preocupantes.
En nuestra serie se presentó RI en 28 pacientes de un total de 46 sujetos estudiados (60 %), lo que, atendiendo a lo reducido de la muestra en comparación con otros estudios, es también elevada y similar a otros investigadores.35,36,40 En este estudio la RI estuvo presente en los sujetos obesos independientemente de la presencia o no de AN, y sin embargo sí estuvo relacionada con el grado de obesidad. Esto coincide con varios investigadores que han hallado que la adiposidad, más que la AN, es el mejor hallazgo clínico de predicción de RI en niños afronorteamericanos, blancos e hispánicos.28,30,40-45
La presencia de RI en la mayoría de nuestros pacientes nos pone en alerta acerca de la probabilidad de que nuestros pacientes pudieran tener otros parámetros metabólicos alterados, y de que no estemos en presencia de una obesidad falsamente considerada por algunos como sin complicaciones durante la niñez y adolescencia, de manera que deben tomarse intervenciones que permitan identificar este tipo de pacientes y tomar acciones para disminuir este riesgo.
Los pliegues cutáneos de grasa procedentes de varios sitios separados, incluyendo al tronco y las extremidades, proporciona una estimación fiable de obesidad y de la distribución regional de la grasa corporal, si las medidas han sido tomadas apropiadamente.46 Sin embargo, las ecuaciones utilizadas deben ser cambiadas de acuerdo con el sexo, la edad, e incluso, al antecedente étnico, ya que la grasa corporal se incrementa con la edad, aun cuando la cifra de estas mensuraciones permanezca constante. Esto significa que el depósito de grasa con la edad ocurre principalmente más en unos que en otros sitios subcutáneos.47,48 El pliegue tricipital, que es el sitio típico que se toma como medida del estado nutricional y considerado como un indicador del porcentaje de grasa total,49 es a menudo difícil de tomar con el calibrador de grasa, por lo que la medida que este nos proporciona puede ser cuestionable. Muchos autores utilizan el IMC como criterio para valorar la intensidad de la obesidad, encontrando relación significativa con la IR.40,43-45
Aunque el uso de pliegue tricipital y su relación con la RI no es tan amplio como otros indicadores de obesidad, autores como McFarlin y otros,50 en un estudio que comprendió 170 niños con edad promedio de 13 años, reportó la existencia de relación significativa entre el pliegue tricipital y el índice HOMA. En nuestro estudio, a pesar de que las determinaciones del pliegue fueron tomadas por el mismo investigador, nuestros resultados no arrojaron relación entre la RI y el pliegue de grasa tricipital, lo cual atribuimos a todo lo mencionado anteriormente, lo que hace que esta medida en niños resulte muy útil para establecer el estado nutricional, pero no para relacionarla con RI a diferencia de los adultos.
Es conocido que la obesidad es un factor de riesgo para la aparición de la DM 2, y que hasta hace unos pocos años se consideraba una enfermedad casi exclusivamente de adultos;2 sin embargo, se ha reconocido que en los últimos 10 años ha constituido una verdadera epidemia en Estados Unidos de América,51 y que se ha extendido a otros países de Europa,52 Asia,53 África54 y Australia.55
La TGA y la GAA son trastornos del metabolismo de los carbohidratos que se consideran estados de riesgo para la aparición de DM 2, e incluso, considerados en la actualidad como estados prediabéticos.56 Estudios en gemelos adultos demostraron entre un 50-76 % de concordancia de DM 2 en gemelos homocigóticos, 37 % en gemelos dicigóticos, y un estimado de herencia para la DM 2 de 26 % y para la TGA de 61 %.57,58
Los hallazgos de alteración del metabolismo de los carbohidratos han sido diversos, dependiendo de las características de las muestras estudias y los diferentes factores que pueden influir, como son, el tiempo de evolución de la obesidad y su intensidad, la presencia de RI, de síndrome metabólico, así como los antecedentes.59-61 Cáceres y otros,32 en 61 sujetos obesos de entre 5 y 19 años de los cuales más de un tercio de ellos tenía criterio de síndrome metabólico y RI, reportaron 42,6 % con TGA, mientras que Shah y otros,62 en 468 niños obesos encontraron 12 % con TGA y 3 pacientes con DM 2. De manera similar, Cambuli y otros,63 al estudiar 535 niños obesos y sobrepesos, hallaron 7 % de GAA y 3 % de TGA, y Novac y otros,64 en 108 niños obesos y sobrepesos, hallaron 21 pacientes con GAA y 5 pacientes con TGA. Contradictoriamente, Guran y otros,26 en un estudio con 160 niños obesos con y sin AN, no hallaron diferencias significas en los resultados de la PTG.
Viggiano D y otros,65 en 415 pacientes obesos en que el 30 % tenía criterio de síndrome metabólico, encontraron 16 % de hiperglucemia en ayunas, mientras que Taha y otros,66 en un número similar de pacientes obesos pero sin considerar el criterio de síndrome metabólico, encontraron solamente un 5 % de GAA. Sin embargo, otros autores como Paoli y otros,67 no encontraron relación entre la obesidad y la hiperglucemia en ayunas. El hecho de que en nuestro grupo hayamos diagnosticado 6 pacientes con estos trastornos, nos pone en alerta, y nos reafirma la consideración de la estrecha relación existente entre obesidad, RI y DM 2.62
La causa de la DM 2 es heterogénea, e incluye factores sociales, de conducta, así como factores de riesgo ambientales, añadidos a un fuerte componente hereditario. Se conoce que el componente genético de la DM 2 está evidenciado por la fuerte herencia de la enfermedad.12,68,69 La historia familiar de DM 2 es importante por su relación con la herencia y el posible hallazgo precoz de elementos de riesgo de DM 2, lo que ha sido reportado por autores como Holst-Schumacher y otros,31 al estudiar 214 niños obesos de entre 8 y 10 años, de los cuales el 73 % tenía historia familiar de DM 2, observando que el 46,7 % tenía RI y 6,5 % TGA, así como 0,5 % con DM 2. De manera similar, Love-Osborne y otros70 encontraron en 85 adolescentes obesos con AN que aquellos sujetos con historia familiar de DM 2 tuvieron mayor probabilidad de presentar GAA y TGA. Noto y otros,71 por su parte, encontraron que la historia familiar de DM 2 estaba asociada con la hipertrigliceridemia y el IMC, pero no con la glucemia en ayunas.
En nuestro país, Argote y otros40 señalan en su estudio un 3 % de obesos con TGA y con DM 2, así como un 4 % con GAA; sin embargo, no encontraron relación significativa entre la RI y la historia familiar de DM 2. Por el contrario, en este trabajo, el 13 % (6/46) de los obesos, presentaron prediabetes, y todos ellos mostraron también RI, además de un 50 % de historia familiar de DM 2. La frecuencia de prediabetes en nuestra investigación en los obesos estudiados fue superior a la del estudio de Argote y otros.40
Un hallazgo importante de nuestro estudio resultó el hecho de que hubo relación entre los antecedentes familiares de 1ero y 2do grado de DM 2 y la presencia de RI. Esto reviste una gran importancia, pues nos permitiría en aquellos sujetos obesos con historia familiar de DM 2, independientemente de que tengan o no presencia de AN, realizar un mayor énfasis en la búsqueda de trastornos del metabolismo de los carbohidratos, y realizar estrategias preventivas no solo para la DM 2 sino también para el síndrome metabólico y sus complicaciones.
Podemos resumir que nuestro estudio apoya la opinión de que la AN, al menos en los niños obesos, no es un elemento de valor para asociarlo con RI, sino que más bien su presencia se relaciona con la intensidad de la obesidad. Por otra parte, la frecuencia de RI es alta en los niños obesos, y por ello es un elemento que merece la pena buscarlo sistemáticamente en este tipo de paciente, y sobre todo, en aquellos niños con historia familiar de DM 2. En conclusión, la presencia de RI es frecuente en los niños y adolescentes obesos, así como la obesidad y la historia familiar de DM 2 en los niños y adolescentes estudiados se relacionan con la presencia de resistencia a la insulina, independientemente de la presencia de acantosis nigricans.
REFERENCIAS BIBLIOGRÁFICAS
1. Fagot-Campagna A. Emergence of type 2 diabetes mellitus in children: epidemiological evidence. J Pediatr Endocrinol Metab. 2000;13:1 395-402.
2. Phillips J, Phillips PJ. Children get type 2 diabetes too. Aust Fam Physician. 2009;38:699-703.
3. Magnusson J. Childhood obesity: prevention, treatment and recommendations for health. Community Pract. 2005;78:147-9.
4. Apovian CM. The causes, prevalence, and treatment of obesity revisited in 2009: what have we learned so far? Am J Clin Nutr. 2010;91:277S-9S.
5. Shepherd A. Obesity: prevalence, causes and clinical consequences. Nurs Stand. 2009;23:51-7.
6. Controlling the Global Obesity Epidemic. World Health Organization Obesity and Overweight Fact Shett [homepage en internet]. 2003 [citado 9 de enero de 2010]. Disponible en: http://www.who.int/nut/obs.htm
7. Peebles R. Adolescent obesity: etiology, office evaluation, and treatment. Adolesc Med State Art Rev. 2008;19:380-405.
8. Bouchard C. Childhood obesity: are genetic differences involved? Am J Clin Nutr [serie en internet]. 2009 [citado 9 de marzo de 2009]. Disponible en: http://www.ajcn.org/content/89/5/1494S.long
9. Lightwood J, Bibbins-Domingo K, Coxson P, Wang YC, Williams L, Goldman L. Forecasting the future economic burden of current adolescent overweight: an estimate of the coronary heart disease policy model. Am J Public Health. 2009;99:2230-7.
10. d'Annunzio G, Vanelli M, Pistorio A, Minuto N, Bergamino L, Lafusco D, et al. Insulin resistance and secretion indexes in healthy Italian children and adolescents: a multicentre study. Acta Biomed. 2009;80:21-8.
11. Romo A, Benavides S. Treatment options in insulin resistance obesity-related acanthosis nigricans. Ann Pharmacother. 2008;42:1 090-4.
12. Peterson K, Silverstein J, Kaufman F, Warren-Boulton E. Management of type 2 diabetes in youth: an update. Am Fam Physician. 2007;76:658-64.
13. Fleischman A, Kron M, Systrom DM, Hrovat M, Grinspoon SK. Mitochondrial function and insulin resistance in overweight and normal-weight children. J Clin Endocrinol Metab. 2009;94:4923-30.
14. Brufani C, Grossi A, Fintini D, Tozzi A, Nocerino V, Patera PI, et al. Obese children with low birth weight demonstrate impaired beta-cell function during oral glucose tolerance test. J Clin Endocrinol Metab. 2009;94:4 448-52.
15. Jordán RJ. Crecimiento humano en Cuba. La Habana: Editorial Científico Técnica; 1975. p. 35-114.
16. Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Follow-up report on the diagnosis of diabetes mellitus. Diabetes Care. 2003;26:3 160-7.
17. Trinder P. Determination of glucose in blood using glucose oxidase with an alternative oxygen acceptor. Ann Clin Biochem. 1969;6:24-7.
18. Arranz C, González RM. Utilización de un método rápido para la separación de la hormona libre y unida en el radioinmunoensayo de insulina. Rev Cubana Invest Biomed. 1988;7:150-6.
19. American Diabetes Association: Standards of Medical Care in Diabetes-2007. Diabetes Care. 2007;30(Suppl):S4-S41.
20. Matthews DR, Hosker JP, Rudenski AS, Nailor BA, Treacher DF, Turner RC. Homeostasis model assessment: insulin resistance and Beta cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia. 1985;28:412-9.
21. Conwell LS, Trost SG, Brown WJ, Batch JA. Indexes of Insulin Resistance and Secretion in Obese Children and Adolescents. Diabetes Care. 2004;27:314-9.
22. Liu BW, Lu Q, Ma CM, Wang SY, Lou DH, Lou XL, et al. Factors associated with insulin resistance and fasting plasma ghrelin levels in adolescents with obesity and family history of type 2 diabetes. Exp Clin Endocrinol Diabetes. 2009;117:600-4.
23. Schuster DP. Changes in physiology with increasing fat mass. Semin Pediatr Surg. 2009;18:126-35.
24. Reaven G. Role of insulin resistance in human disease. Diabetes. 1988;37:1 595-607.
25. Jones LH, Ficca M. Is Acanthosis Nigricans a reliable indicator for risk of type 2 diabetes? J Sch Nurs. 2007;23:247-51.
26. Guran T, Turan S, Akcay T, Bereket A. Significance of acantosis nigricans in childhood obesity. J Paediatr Child Health. 2008;44:338-41.
27. Kleikamp S, Böhm M, Frosch P, Brinkmeier. Acanthosis nigricans, papillomatosis mucosae and "tripe palms" in a patient with metastasized gastric carcinoma. Dtsch Med Wochenschr. 2006;131:1 209-2 313.
28. Kong AS, Williams RL, Smith M, Sussman AL, Skipper B, Hsi AC, et al. RIOS Net Clinicians: acanthosis nigricans and diabetes risk factors: prevalence in young persons seen in southwestern US primary care practices. Ann Fam Med. 2007;5:202-8.
29. Lopez-Alvarenga JC, García-Hidalgo L, Landa-Anell MV, Santos-Gómez R, González-Barranco J, Comuzzie A. Influence of skin color on the diagnostic utility of clinical acanthosis nigricans to predict insulin resistance in obese patients. Arch Med Res. 2006;37:744-8.
30. Bonet B, Viana M, Sánchez-Vera I, Quintanar A, Martínez J, Espino M. Adipose tissue and liver lipid metabolism in obese children: role of the body mass index and the presence of acanthosis nigricans. Diabet Med. 2007;24:1192-8.
31. Holst-Schumacher I, Nuñez-Rivas H, Monge-Rojas R, Barrantes-Santamaría M. Insulin resistance and impaired glucose tolerance in overweight and obese Costa Rican schoolchildren. Food Nutr Bull. 2008;29:123-31.
32. Caceres M, Teran CG, Rodriguez S, Medina M. Prevalence of insulin resistance and its association with metabolic syndrome criteria among Bolivian children and adolescents with obesity. BMC Pediatr. 2008;8:31.
33. Felszeghy E, Káposzta R, Juhász E, Kardos L, Ilyés I. Alterations of carbohydrate and lipoprotein metabolism in childhood obesity-impact of insulin resistance and acanthosis nigricans. J Pediatr Endocrinol Metab. 2009;22:1117-26.
34. Brickman WJ, Huang J, Silverman BL, Metzger BE. Acanthosis nigricans identifies youth at high risk for metabolic abnormalities. Pediatr. 2010;156:87-92.
35. Thivel D, Malina RM, Isacco L, Aucouturier J, Meyer M, Duché P. Metabolic syndrome in obese children and adolescents: dichotomous or continuous? Metab Syndr Relat Disord. 2009;7:549-55.
36. Maisonneuve B, Auclair C, Ali M, Terral D, Deméocq F, Roszyk L, et al. Metabolic abnormalities in obese French children. Arch Pediatr. 2009;16:991-8.
37. van Vliet M, von Rosenstiel IA, Schindhelm RK, Brandjes DP, Beijnen JH, Diamant M. Identifying the metabolic syndrome in obese children and adolescents: do age and definition matter? Curr Clin Pharmacol. 2009;4:233-8.
38. Telford RD, Cunningham RB, Shaw JE, Dunstan DW, Lafferty AR, Reynolds GJ, et al. Contrasting longitudinal and cross-sectional relationships between insulin resistance and percentage of body fat, fitness, and physical activity in children-the LOOK study. Pediatr Diabetes. 2009;10:500-7.
39. Aucouturier J, Meyer M, Thivel D, Taillardat M, Duché P. Effect of android to gynoid fat ratio on insulin resistance in obese youth. Arch Pediatr Adolesc Med. 2009;163:826-31.
40. Argote Parolis A, Fernández Teruel T, Carvajal Martínez F, González Suárez R, Licea Puig ME. Prevalencia y factores asociados al síndrome metabólico en niños y adolescentes obesos del municipio Marianao. Rev Cubana Endocrinol [serie en internet]. 2008 Dic [citado 29 de enero de 2011];19(3). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1561-29532008000300002&lng=es
41. Wang SY, Lou DH, Lou XL, Yin FZ. Factors associated with insulin resistance and fasting plasma ghrelin levels in adolescents with obesity and family history of type 2 diabetes. Exp Clin Endocrinol Diabetes. 2009;117:600-4.
42. Brickman WJ, Binns HJ, Jovanovic BD, Kolesky S, Mancini AJ, Metzger BE. Pediatric Practice Research Group. Acanthosis nigricans: a common finding in overweight youth. Pediatr Dermatol. 2007;24:601-6.
43. Ferreira AP, Nóbrega Ode T, França NM. Association of body mass index and insulin resistance with metabolic syndrome in Brazilian children. Arq Bras Cardiol. 2009;93:147-53.
44. Adam TC, Toledo-Corral C, Lane CJ, Weigensberg MJ, Spruijt-Metz D, Davies JN, et al. Insulin sensitivity as an independent predictor of fat mass gain in Hispanic adolescents. Diabetes Care. 2009;32:2114-5.
45. Strufaldi MW, da Silva EM, Puccini RF. Insulin resistance among Brazilian schoolchildren: association with risk factors for cardiovascular diseases. Acta Paediatr. 2009;98:1646-50.
46. Chang Y, Woo HY, Sung E, Kim CH, Kang H, Ju YS, et al. Prevalence of acanthosis nigricans in relation to anthropometric measures: community-based cross-sectional study in Korean pre-adolescent school children. Pediatr Int. 2008;50:667-73.
47. de Assis MA, Rolland-Cachera MF, de Vasconcelos FA, Bellisle F, Conde W, Calvo MC, et al. Central adiposity in Brazilian schoolchildren aged 7-10 years. Br J Nutr. 2007;97:799-805.
48. Durnin JV, Womersley J. Body fat assessed from total body density and its estimation from skinfold thickness: measurements on 481 men and women aged from 16 to 72 years. Br J Nutr. 1974;32:77-97.
49. Botton J, Heude B, Kettaneh A, Borys JM, Lommez A, Bresson JL, et al. Cardiovascular risk factor levels and their relationships with overweight and fat distribution in children: the Fleurbaix Laventie Ville Sante II study. Metabolism. 2007;56:614-22.
50. McFarlin BK, Johnston CA, Tyler C, O'Connor DP, Strohacker KA, Reeves R, et al. Relation between adiposity and disease risk factors in Mexican American children. J Pediatr Gastroenterol Nutr. 2009;49:450-5.
51. Shaw-Perry M, Horner C, Trevino RP, Sosa ET, Hernandez I, Bhardwaj A. NEEMA: a school-based diabetes risk prevention program designed for African-American children. J Natl Med Assoc. 2007;99:368-75.
52. Ehtisham S, Barrett TG, Shaw NJ. Type 2 diabetes mellitus in UK children: an emerging problem. Diabet Med. 2000;17:867-71.
53. Huang CY, Li HJ, Lo FS, Wang AM, Shih BF, Lin CH, et al. Metabolic disorders in children and adolescents with type 2 diabetes mellitus. Acta Paediatr Taiwan. 2006;47:187-91.
54. Beran D, Yudkin JS. Diabetes care in sub-Saharan Africa. Lancet. 2006;368:1 689-95.
55. Schober E, Waldhoer T, Rami B, Hofer S, Austrian Diabetes Incidence Study Group. Incidence and time trend of type 1 and type 2 diabetes in Austrian children 1999-2007. J Pediatr. 2009;155:190-3.
56. da Silva RC, Miranda WL, Chacra AR, Dib SA. Insulin resistance, beta-cell function, and glucose tolerance in Brazilian adolescents with obesity or risk factors for type 2 diabetes mellitus. J Diabetes Complications. 2007;21:84-92.
57. Poulsen P, Kyvik KO, Vaag A, Beck-Nielsen H. Heritability of type II (non-insulin-dependent) diabetes mellitus and abnormal glucose tolerance: a population-based twin study. Diabetologia. 1999;42:139-45.
58. Medici F, Hawa M, Ianari A, Pyke DA, Leslie RD. Concordance rate for type II diabetes mellitus in monozygotic twins: actuarial analysis. Diabetologia. 1999;42:146-60.
59. Sachdev HP, Osmond C, Fall CH, Lakshmy R, Ramji S, Dey Biswas SK, et al. Predicting adult metabolic syndrome from childhood body mass index: follow-up of the New Delhi birth cohort. Arch Dis Child. 2009;94:768-74.
60. Ode KL, Frohnert BI, Nathan BM. Identification and treatment of metabolic complications in pediatric obesity. Rev Endocr Metab Disord. 2009;10:167-88.
61. Nelson RA, Bremer AA. Insulin resistance and metabolic syndrome in the pediatric population. Metab Syndr Relat Disord. 2010;8:1-14.
62. Shah S, Kublaoui BM, Oden JD, White PC. Screening for type 2 diabetes in obese youth. Pediatrics. 2009;124:573-9.
63. Cambuli VM, Incani M, Pilia S, Congiu T, Cavallo MG, Cossu E, et al. Oral glucose tolerance test in Italian overweight/obese children and adolescents results in a very high prevalence of impaired fasting glycaemia, but not of diabetes. Diabetes Metab Res Rev. 2009;25:528-34.
64. Novac O, Mãtãsaru S, Tãtaru S, Felea D, Cosmescu A, Chiosac AA. Assessment of complications of excess weight in school-age children and adolescents. Rev Med Chir Soc Med Nat Iasi. 2009;113:740-4.
65. Viggiano D, De Filippo G, Rendina D, Fasolino A, D'Alessio N, Avellino N, et al. Study Group. Screening of metabolic syndrome in obese children: a primary care concern. Pediatr Gastroenterol Nutr. 2009;49:329-34.
66. Taha D, Ahmed O, bin Sadiq B. The prevalence of metabolic syndrome and cardiovascular risk factors in a group of obese Saudi children and adolescents: a hospital-based study. Ann Saudi Med. 2009;29:357-60.
67. Paoli M, Uzcátegui L, Zerpa Y, Gómez-Pérez R, Camacho N, Molina Z, et al. Obesity in schoolchildren from Merida, Venezuela: association with cardiovascular risk factors. Endocrinol Nutr. 2009;56:218-26.
68. Adams MH, Lammon CA. The presence of family history and the development of type 2 diabetes mellitus risk factors in rural children. J Sch Nurs. 2007;23:259-66.
69. Unnikrishnan AG, Bhatia E, Bhatia V, Bhadada SK, Sahay RK, Kannan A, et al. Type 1 diabetes versus type 2 diabetes with onset in persons younger than 20 years of age. Ann NY Acad Sci. 2008;1150:239-44.
70. Love-Osborne KA, Nadeau KJ, Sheeder J, Fenton LZ, Zeitler P. Presence of the metabolic syndrome in obese adolescents predicts impaired glucose tolerance and nonalcoholic fatty liver disease. J Adolesc Health. 2008;42:543-8.
71. Noto D, Niglio T, Cefalù AB, Martino E, Fayer F, Mina M, et al. Obesity and the metabolic syndrome in a student cohort from Southern Italy. Nutr Metab Cardiovasc Dis. 2009;19:620-5.
Recibido: 1º de febrero de 2011.
Aprobado: 24 de mayo de 2011.
Pedro González Fernández. Hospital Pediátrico Docente "William Soler". Calle 100 y Perla, reparto Altahabana, municipio Boyeros. La Habana, Cuba. Correo electrónico: gonzalez@infomed.sld.cu