Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol vol.25 no.1 Ciudad de la Habana ene.-abr. 2014
GUÍAS
Guía para el diagnóstico y tratamiento de la osteoporosis
Guidelines for the diagnosis and treatment of osteoporosis
Sociedad Cubana de Endocrinología; Sociedad Cubana de Reumatología. La Habana, Cuba.
Actualización, 2013
Comisión organizadora Grupo de expertos Auspiciadores
Dra. CM. Daysi Navarro Despaigne Dr. Adalberto Infante Amorós Sociedad Cubana de Endocrinología
Dr. CM. Gil Reyes Herrera Dra. Alina Acosta Cedeño Sociedad Cubana de Reumatología
Dra. Dulce Maria Calvo Barbado Dra. Cossette Díaz Socorro Sociedad Cubana de Ginecología y Obstetricia
Dra. Marlene Guibert Toledano Dra. Dania Cardona Garbey Centro de Investigaciones Médico Quirúrgicas (CIMEQ)
Dra. Olga Martínez Colette Hospital «Hermanos Ameijeiras»
Dr. Orlando Nicolau Mena Instituto Nacional de Endocrinología
Dra. Yaquelín González Ricardo
Dra. Tatiana García Borrero
Dra. Zoe Alina González Otero
En la actualidad la esperanza de vida en Cuba para los hombres es de 77 años y 80 para las mujeres. El 18 % de los casi 12 millones de cubanos tiene 60 y más años de edad,1 por lo que es de esperar que la osteoporosis (OP) se identifique como un problema de salud para los cubanos.
Nuestra población posee características que se reconocen como factores protectores de la salud ósea, entre las que se pueden citar, el mestizaje, el hecho de habitar en un país tropical donde brilla el sol todo el año, tener alto grado de satisfacción con la educación, el trabajo y la atención médica. Otra peculiaridad es la carencia de hábitos nutricionales en los que predominen los alimentos ricos en calcio (conocido factor de riesgo para la OP), por lo que a priori no puede tenerse una idea cierta de la frecuencia de la OP en nuestro país.
Desde mediados del siglo XX, como resultado del tratamiento quirúrgico precoz de la fractura de cadera, lo cual, si bien salva de una muerte inmediata a muchos ancianos, no siempre se acompaña de una independencia funcional ni disminuyó la frecuencia de fracturas. A partir de finales de siglo, y en la actualidad, además de mantener esta terapéutica, se iniciaron acciones a fin de: 1) identificar en nuestra población los indicadores necesarios para detectar personas susceptibles de tener fracturas por fragilidad, 2) proveer los recursos tecnológicos y terapéuticos necesarios para lograr estos fines, 3) incrementar la formación de recursos humanos, y 4) comenzar acciones para la prevención primaria de la OP, propuestas destinadas a toda la población, a pesar de vivir en un país con grandes, graves e históricas limitaciones económicas.
Con la presente guía nos proponemos brindar un conjunto de sugerencias destinadas a incrementar la eficiencia y eficacia de los medios diagnósticos, el uso racional de la terapéutica, y así poder brindar una atención médica de óptima calidad, destinada no solo a lograr una rápida recuperación de los pacientes con fracturas con fragilidad, sino, a evitarlas.
La Habana, 10 de febrero de 2013.
«Año 55 de la Revolución».
Guía cubana para el diagnóstico y tratamiento de la OP
Justificación
La elaboración de una guía basada en la evidencia sobre el diagnóstico y tratamiento de la OP se justifica por:
· Envejecimiento de la población cubana (30 % mayores de 50 años).
· Mayor supervivencia femenina que permite que un tercio de la vida de la mujer transcurra en la posmenopausia.
· Alta prevalencia de enfermedades crónicas no trasmisibles que afectan la calidad del hueso.
· Alimentación de la población adulta cubana con alimentos no ricos en calcio.
· Disponer en nuestro país de equipos para el diagnóstico precoz de la OP requiere de métodos/lineamientos para una explotación racional y con calidad de estos.
· El tratamiento de la fractura ósea por OP requiere de equipamiento de elevado costo, de cuidados (ingreso hospitalario) y atención (fisioterapia y ayuda para las labores de la vida cotidiana), lo cual la convierte en una enfermedad de alto costo económico, sin que ello impida el incremento de nuevos pacientes, por tanto, una de las maneras de disminuir los costos, es disminuir su incidencia.
· Escasa y limitada información sobre la OP presentes en el programa de pregrado de Medicina
Por otra parte, la OP es una condición en la que constantemente se producen avances, sobre todo, en lo referente a las drogas utilizadas para mejorar la calidad del hueso, lo que contrasta con la limitación para precisar su eficacia a corto plazo y el tiempo del tratamiento.
Objetivos
El objetivo de esta guía es proporcionar a los profesionales encargados de la atención a personas con OP una herramienta útil para tomar las decisiones diagnósticas y terapéuticas, así como la prevención primaria de la fractura por fragilidad ósea.
A quién va dirigido
A todos los profesionales del Sistema Nacional de Salud, que de una manera u otra, brinda atención al paciente con OP, para que dispongan de una herramienta útil para mejorar la calidad de la atención a estos pacientes, y por tanto, su calidad de vida y la de sus cuidadores.
Metodología (cuadro 1)
· Búsqueda de información actualizada sobre el tema utilizando varias herramientas de búsqueda y bases de datos.
· Revisión de los aspectos más novedosos relacionados con el diagnóstico y tratamiento de las OP.
· Confección de la guía.
Como estrategia de búsqueda se emplearon las fundamentales bases de datos y otros recursos disponibles en Infomed.
Pubmed:
Disponible en: http://www.ncbi.nlm.nih.gov/pubmed
Cochrane disponible en los esenciales de Infomed: http://cochrane.bvsalud.org/portal/php/index.php?lang=es
Otros recursos:
Recurso de síntesis Dynamed disponible en esenciales de Infomed: http://dynaweb.ebscohost.com
Clinical evidence, elaborada por BMJ, análisis de resultados de revisiones sistemáticas y estudios seleccionados por expertos. Disponible en: http://www.clinicalevidence.com/x/index.html
Agencias reguladoras CECMED (Cuba)FDA (USA)AGEMED (España)eMea (Europa) http://www.agemed.es/
CECMED (Cuba): Centro para el control estatal de medicamentos, equipos y dispositivos médicos, FDA (USA): Food and drug administration, AGEMED (España): Grupo de manejo de medicamentos según edad, eMea (Europa): Agencia europea de medicamentos
Herramientas para la búsqueda:
Metabuscador tripdatabase: http://www.tripdatabase.com (permite localizar guías, revisiones sistemáticas y otros).
Descriptores o palabras clave:
· Osteoporosis
· «Bone loss, postmenopausal»
· Postmenopausal bone losses
· Osteoporosis, posmenopausal
· Pharmacological treatment
· Drug therapy
· Intervention: bisphosphonate, denosumab, strontium ranelate, hormone replacement therapy, postmenopausal, estrogen, progestin, progesterona, tibolone, raloxifene, selective estrogen receptor modulators
· Selective estrogens receptor molecule (SERM), human parathyroid hormone (hPTH)
· Outcome: preventive fracture, vertebral fracture, spinal fracture, nonvertebral and hip fractures
Operadores booleanos: AND, OR, NOT, uso de asteriscos (*) para truncamiento de palabras.
Fecha de búsqueda: estudios publicados en los últimos 5 años preferentemente (cuadro 2).
Autor/año Tipo de estudio (diseño) Calidad Población estudiada/tamaño de muestra Intervenciones comparadas Variable primaria de resultado (expresión en valor p, IC, RR, OR, NNT) Conclusión del autor Conclusión del grupo de trabajo
IC: intervalo de confianza, RR: riesgo relativo, OR: odds radio, NNT: número necesario a tratar
Para establecer las recomendaciones se empleó la escala siguiente (cuadros 3 y 4):
Nivel de recomendación (NR) NE Significado
Recomendación A Nivel I Existen pruebas sólidas para la recomendación
Recomendación B Nivel II Hay al menos un estudio aceptable o múltiples estudios con diseño aceptable
Recomendación C Nivel III Existen pruebas limitadas, sin embargo, el grupo de consenso las admite y recomienda la intervención
Recomendación D Nivel IV Se basa exclusivamente en el criterio de los expertos
Nota: en esta guía aparecen para las recomendaciones basadas en NE y NR seguidas del nivel referido mediante las letras de la A a la D en mayúsculas, según appraisal of guidelines for research and evaluation (AGREE). Disponible en: http://www.agreecollaboration.org/trnslations/index.php?lang=es
Nelson H, Helfand MN, Wolf S, Allan JD. Screening for postmenopausal osteoporosis: a summary of the evidence. Ann Intern Med. 2002;137(6):529-41.
NICE Technology Appraisal Recommendations (2003) y Evidence Based Medicine Guidelines (EBM Finland, October 2003).
National Osteoporosis Foundation Issues Guidelines for Osteoporosis Management CME/CE Barclay L National Osteoporosis Foundation. Published online February 21, 2008. Disponible en: http://www.nof.org/
Cada equipo redactó el documento con sus recomendaciones, el que fue discutido el día 10 de diciembre de 2009 como parte de las actividades del Congreso Cubano de Reumatología realizado en el Cimeq. Asistieron 40 profesionales de diferentes especialidades: Endocrinología, Farmacología, Fisiología, Geriatría, Ginecología y Obstetricia, Imaginología, Medicina General Integral, Nutrición, Reumatología y Oncología; procedentes de Santiago de Cuba, Camagüey, Villa Clara, Matanzas, La Habana y Pinar del Río.
CAPÍTULO 1
Introductorio
Introduction
Definición de OP: es una enfermedad esquelética, caracterizada por una resistencia ósea disminuida, que predispone al aumento del riesgo de fractura. La resistencia ósea refleja la integración de la densidad y la calidad ósea, y a su vez, la densidad ósea está determinada por el valor máximo de masa ósea y la magnitud de su pérdida, mientras que la calidad ósea depende de la arquitectura, el recambio óseo, la acumulación de microlesiones y la mineralización1-6 (NE I, NR A).
¿Qué es una fractura por fragilidad?: aquella que se produce ante un trauma mínimo o de bajo impacto, es decir, una caída sin impulso y/o de sus propios pies.7
¿Por qué es necesario realizar el diagnóstico de OP?: por las consecuencias que para los pacientes, la sociedad y la familia origina una fractura por fragilidad, por ello las fracturas de cadera son causa de mortalidad temprana, o de discapacidad, requieren de hospitalización para su consolidación, lo que genera altos costos para la seguridad social. Su frecuencia se incrementa con la edad con peores consecuencias clínicas.4-8
En nuestro país, datos referidos por el doctor Tarragona R, en el I Taller de Composición Corporal y Osteoporosis (Universidad de Ciencias Médicas de La Habana, octubre 2008), la tasa aproximada de fracturas de cadera era de 5,5 x 1 000 habitantes con más de 60 años. Por otra parte, si bien las fracturas vertebrales no siempre requieren de hospitalización para su diagnóstico y tratamiento, pueden ocasionar dolor considerable, pérdida de estatura y cifosis torácica exagerada, que, a largo plazo, podría restringir de manera considerable movimientos como inclinarse, estirarse, o dificultar la dinámica o la funcionalidad de los aparatos cardiovascular, respiratorio y digestivo.
La fractura de Colles es muy frecuente, hasta un 15 % de las mujeres podrían presentarla en el transcurso de la vida. Su tasa de incidencia se incrementa linealmente entre los 45 y 65 años, y luego se estabiliza. Requieren de tratamiento especializado, aunque no siempre de hospitalización. Entre sus complicaciones están la limitación de la motilidad de la muñeca, el acortamiento radial y el dolor crónico. Se consideran como el heraldo de las fracturas por fragilidad.9,10
Las fracturas osteoporóticas tienen también un alto costo psicológico, derivado del dolor, de los cambios en la imagen corporal, y de la limitación de la independencia, lo que podría originar pérdida de la autoestima y cambios en el estado de ánimo.9,10
Una consecuencia poco explorada en nuestro medio, está relacionada con la repercusión de la fractura sobre el medio familiar y el cuidador, no solo por la carga económica que representa el cuidado al paciente, sino por el cambio que en su proyecto de vida deberá realizar el cuidador.
¿Por qué se origina la fragilidad ósea?: no existe un mecanismo único para explicar por qué se origina la fragilidad del hueso. Se reporta que intervienen diversos factores que afectan tanto la calidad como la resistencia del hueso. Entre los primeros se reporta: 1) la geometría y la morfología del hueso, pues, a mayor longitud del eje de la cadera o cuando el ángulo formado por el cuello y la diáfisis femoral es más obtuso, así como cuando las vértebras son pequeñas, existe mayor propensión a sufrir fracturas; 2) las propiedades de los materiales, pues la pérdida de la conectividad entre las trabéculas de la matriz proteica origina menor resistencia que el adelgazamiento de las trabéculas; 3) la capacidad para la reparación de las micro fracturas y la masa ósea. La resistencia ósea depende la masa ósea que se alcanzó durante la adolescencia y de su preservación durante el ciclo de vida. De estos aspectos el de más fácil identificación es la masa ósea.9,10
¿Qué es la masa ósea?: el contenido mineral (calcio, fósforo, magnesio, sodio y potasio dispuestos como cristales de hidroxiapatita) del hueso. La formación de la masa ósea depende de 2 procesos: el modelado óseo, y el remodelado óseo. El primero es responsable del crecimiento longitudinal y las modificaciones del diámetro transversal, se produce desde el nacimiento, y se detiene después de la pubertad. El segundo permite el constante recambio de hueso viejo por hueso nuevo, y dura desde la pubertad hasta el final de la vida.7
En el transcurso de la vida la masa ósea cursa por 3 fases: la primera va desde la etapa fetal hasta los 30 años, mientras la segunda y tercera fases se inician en la tercera y cuarta década respectivamente. La primera fase, a su vez, se divide en 3 etapas: la niñez (se extiende de la séptima semana de vida, hasta aproximadamente los 10 años de vida), es un período crucial para el desarrollo óseo, porque es cuando el esqueleto crece más y logra su casi total osificación. La etapa puberal (desde los 11 años, hasta aproximadamente los 16), y que según el sexo ocurre durante el llamado estallido puberal, que es el tercer ciclo de crecimiento óseo importante que se produce en el ser humano, y en él se adquiere el 30 % del contenido mineral óseo (CMO); y por último, la consolidación ósea o pospuberal, en la que se culmina la osificación, y se adquiere la talla y la masa ósea definitiva. Por tanto, la masa ósea depende del proceso de modelado responsable de la adquisición de la forma y tamaño del hueso, único mecanismo que permite ganar masa ósea
La tasa de acreción de masa ósea durante la niñez es la siguiente:
- Durante los 3 primeros años de vida el hueso incrementa su contenido de calcio 35 %.
- Entre los 4 años a la pubertad incrementa 20 % más.
- Durante la pubertad incorpora 45 % y más, lo que significa que el contenido de calcio del hueso es de 30 g en el feto y 1 200 g al finalizar la pubertad.
Es importante resaltar que el remodelado óseo es el mecanismo pospuberal que mantiene las características mecánicas del esqueleto, permite la sustitución y reparación del tejido óseo deteriorado, interviene en la homeostasis mineral y en el equilibrio ácido básico, y se producen factores de crecimiento que favorecen la función de la médula ósea.
¿De qué elementos depende la masa ósea?
- Pico de masa ósea alcanzado alrededor de los 25 años.
- Capacidad de reposición del durante el proceso del remodelado óseo.
- Acciones o noxas que afecten algún aspecto de la resistencia ósea, lo que incluye afecciones genéticas, estilo de vida, enfermedades y uso de medicamentos, entre otros.
¿Cómo se clasifica la OP?: puede ser9,10 primaria o idiopática, las que, según el momento de la vida en que se diagnostiquen, se denominan:
- OP juvenil, cuando ocurre entre los 8 y 14 años, cursa con remisión espontánea, y no produce deformidad permanente.
- OP idiopática, que ocurre en mujeres premenopáusicas y en hombres jóvenes, a veces la enfermedad es autolimitada.
- OP del embarazo, que ocurre durante el embarazo o la lactancia, y es transitoria.
Secundaria a:
I. Medicamentos
- Uso de glucocorticoides orales o intramusculares durante más de 3 meses.
- Dosis excesivas de tiroxina.
- Inhibidores de la aromatasa.
- Uso prolongado de ciertos anticonvulsivos (fenitoína).
- Heparina.
- Agentes citotóxicos.
- Agonistas o análogos de la hormona liberadora de gonadotropina.
- Anticonceptivos de medroxiprogesterona intramuscular.
- Inmunosupresores (ciclosporina).
II. Trastornos genéticos
• Osteogénesis imperfecta.
• Talasemia.
• Hipofosfatasia.
• Hemocromatosis.
III. Trastornos del balance de calcio
• Hipercalciuria.
• Deficiencia de vitamina D.
IV. Endocrinopatías
• Hipercortisolismos endógenos.
• Insuficiencia gonadal (primaria y secundaria).
• Hipertiroidismo.
• Diabetes mellitus tipo 1.
• Hiperparatiroidismo primario.
V. Enfermedades gastrointestinales
• Enfermedad crónica del hígado (cirrosis biliar primaria).
• Síndromes de mala absorción (enfermedad celiaca, de Crohn).
• Gastrectomía total.
• Gastroenterostomía de Billroth I.
VI. Otros trastornos
• Mieloma múltiple.
• Linfoma y leucemia.
• Mastocitosis sistémica.
• Trastornos nutricionales (anorexia nerviosa).
• Artritis reumatoide.
• Enfermedad renal crónica.
CAPÍTULO 2
Diagnóstico clínico
Clinical Diagnosis
¿Cómo identificar personas con riesgo de OP?
En la OP existen elementos clínicos que posibilitan identificar personas con susceptibilidad para esta. Existen varios cuestionarios que se pueden emplear para decidir solicitar o no una densitometría ósea (cuadro 5). Esos cuestionarios no tienen como objetivo desplazar a la absorciometría dual de rayos X (DXA) como herramienta diagnóstica, pueden ser útiles para investigar grandes poblaciones, y mejoran el rendimiento de la DXA, al incluir en su indicación a aquellos sujetos con alto riesgo de OP y de fractura.
Cuadro 5. Índices clínicos para identificar personas con riesgo de fracturas por fragilidad11-17
| Prueba | Parámetros | Utilidad |
|
Osteoporosis Risk Assesment Instrument (ORAI) | - Edad: |
No útiles en mujeres menores de 55 años |
|
Simple Calculated Osteoporosis Risk Estimation Tool (SCORE) | Raza (5 puntos si no es blanca). |
NR A |
|
National Osteoporosis Foundation (NOF) | 1 punto si edad ≥ 65 años. |
No útiles en mujeres |
| Age, Body Size, No Estrogen (ABONE) | Edad 1 punto ≥ 65 años. | No útiles en mujeres |
| | | |
|
Osteoporosis Index of Risk (OSIRIS) | + 0,2 x peso en kg. |
NR A |
THS: terapia hormonal sustitutiva, APP: antecedentes patológicos personales, APF: antecedentes patológicos familiares, NR A o NR B: nivel de recomendación A o B.
En Cuba no se ha establecido la utilidad de estos cuestionarios, aunque se identificó en mujeres cubanas de edad mediana, a las que se les realizó densitometría en columna lumbar y el color de la piel era blanco, el antecedente familiar de OP y/o fractura, y la posmenopausia fueron los factores que se relacionaron con mayor probabilidad de presentar osteopenia y/o OP) (Díaz Socorro C. Factores relacionados con la densidad mineral ósea en mujeres de edad mediana [tesis]. Facultad "Comandante Manuel Fajardo". Instituto Nacional de Endocrinología. Cuba; 2008). Es consenso recomendar para identificar personas susceptibles de tener OP, aquellas con 2 o más de los elementos clínicos siguientes (NR C) (cuadro 6).
CAPÍTULO 3
Métodos diagnósticos
Diagnostic methods
Estudios por imagen
Para confirmar el diagnóstico de fractura ósea se emplea rayos X simple de la zona a investigar, de manera que en casos de huesos largos se identifique la discontinuidad o línea de fractura. En los casos de fractura vertebrales se sugiere utilizar el Criterio de evaluación semicuantitativa visual desarrollada por Genant, que valora la intensidad de la fractura según la pérdida de altura anterior, media o posterior de la vértebra18 (NE I, NR B).
Grado 0= no fractura
Grado 1 o fractura ligera= a la disminución de la altura, está entre 21 y 25 %
Grado 2 o fractura moderada= cuando la disminución es mayor del 25 %, pero no sobrepasa el 45 %
Grado 3 o fractura severa= cuando la disminución es mayor del 45 %
Para identificar personas susceptibles a tener OP antes de sufrir una fractura ósea por fragilidad, el examen que se considera la regla de oro es la DXA, proceder diagnóstico que consiste en la atenuación que sufre un haz colimado de rayos X al atravesar la región ósea expuesta. Esa atenuación dependerá directamente de la masa ósea, es decir, del CMO que se expresa en g/cm, o como densidad mineral ósea (DMO), expresada en g/cm2. Como resulta difícil a partir de este último parámetro identificar el riesgo de sufrir una fractura por fragilidad, se propuso para su interpretación los conceptos de Score o Puntaje T (hace referencia a la diferencia entre el pico de masa ósea logrado al final de la adolescencia, y la DMO del paciente en el momento del examen). Score Z expresa la diferencia entre el paciente y un control de similar edad, sexo y etnia.19,20 Según la OMS:
DMO normal es aquella cuyo valor del puntaje T está entre -1 y +1.
Osteopenia: cuando el valor del puntaje T está entre -1 y -2,5 desviaciones estándar (DE).
OP: cuando el valor del puntaje T es ³ -2,5 DE.
OP severa: ante T Score > -2,5 DE y fractura ósea.
Por cada DE que disminuye la masa ósea se multiplica entre 1,5 y 2,6 el riesgo de fractura.19 Dado que existen diferentes productores de equipos DXA, cuando se necesite comparar resultados obtenidos entre diferentes equipos, la International Society of Clinical Densitometry (ISCD) aconseja emplear el valor de la DMO y no el valor del puntaje T20 (NR B).
¿Qué regiones anatómicas investigar o evaluar?: se debe evaluar la región en riesgo, de manera general se recomienda estudiar la columna lumbar (L1-L4) la cadera total, y el cuello femoral, y, de no ser posible, se podría estudiar el tercio medio de radio del antebrazo no dominante (NR A).4,6,21,22
¿A quiénes indicar la DXA?: es consenso recomendar para indicar una DXA la presencia de población menor de 60 años, cuando existan al menos 3 factores clínicos de riesgo para OP en hombres y mujeres; o en la población mayor de 60 años de existir, al menos, 2 de estos factores.
¿Qué criterios emplear para interpretar la DXA en mujeres cubanas adultas?: si bien la interpretación del resultado de la DXA es universal, tomando en cuenta que la masa ósea depende, entre otros, de la genética y de la etnia, la ISCD aconseja que en cada país se identifique la concordancia entre el pico de masa ósea que emplea el software utilizado por los fabricantes, con el de la población en estudio.
En la tabla 1 se reporta la concordancia entre la DMO de mujeres cubanas y mujeres hispanas, evaluación realizada con equipos Lunar.23,24
¿Cómo interpretar la DXA en población menor de 40 años, incluyendo población infantil?: en los niños se debe utilizar el puntaje Z con el criterio £ -2 DE para considerar baja masa ósea para su edad, pero no OP (NR B).
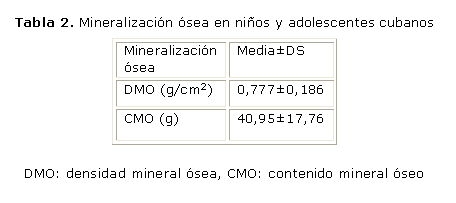
En niños y adolescentes cubanos, con edades entre 8 y 21 años, con residencia permanente en el municipio Plaza de la Revolución de La Habana, se reportaron los valores siguientes de la mineralización ósea de la columna lumbar (tabla 2). Se recomienda utilizar estos valores como criterios de referencia para niños y adolescentes25 (NR D).
¿Cómo interpretar la densitometría en hombres?: según recomendación de la OMS y de la ISCD, en estas personas se deben emplear iguales criterios que en las mujeres si tienen 50 años y más. A edades menores se aconseja utilizar el valor del puntaje Z y considerar como valor de riesgo para mala calidad ósea a valores £ -2 DE.26
¿Existen otros métodos que permiten evaluar la masa ósea?: efectivamente, se dispone de otros métodos por imagen que permiten evaluar la masa ósea, uno de ellos es el ultrasonido de calcáneo (US Cal), que se basa en el paso de ondas ultrasónicas a través del calcáneo (también se utiliza la rótula, o el dedo índice), se expresa como:
- Broadban ultrasound atenuation (BUA): atenuación de la onda ultrasónica.
- Speed of sound (SOS): velocidad del sonido a través del hueso.
- Quantitative ultrasound index (QUI): índice cuantitativo ultrasónico, denominado también índice de consistencia.
- Score o puntaje T.
Es un proceder que emplea equipos portátiles, no necesita de personal especializado para su manejo, no utiliza radiaciones ionizantes. Sus resultados no confirman el diagnóstico de OP. Sus valores de referencia se presentan en la tabla 3.27
Los exámenes de laboratorio se dividen en:4,9,10,28
- Generales o básicos: entre los que se encuentran el hemograma, la velocidad de sedimentación de glóbulos rojos, la glucemia en ayunas, la determinación de creatinina sérica, las transaminasas alanino amino transferasa (TGP) y aspartato amino transferasa (TGO), y las proteínas plasmáticas totales
- Relacionados con el metabolismo óseo: son los denominados marcadores de recambio óseo, que permiten evaluar el proceso de formación y el de resorción ósea. Entre los primeros están la determinación de los niveles plasmáticos de fosfatasa alcalina total y su isoforma ósea, de la osteocalcina, y de los pro-péptidos carboxilo y amino terminal del pro-colágeno tipo 1. Entre los marcadores de resorción se encuentran la determinación del índice calcio/creatinina en orina, así como la hidroxiprolina, la piridinolina y la desoxipiridinolina, el telopéptido carboxiloterminal del colágeno tipo 1, a y b-crosslaps, el telopéptido aminoterminal del colágeno tipo I, los glucósidos de hidroxilisina y la sialoproteína ósea.
La utilidad de estos marcadores reside en su capacidad para identificar precozmente la respuesta a fármacos antiresortivos u osteoformadores.
Entre las pruebas para evaluar el metabolismo óseo también se encuentra la determinación de calcio y fósforo en sangre y orina, así como la determinación de los niveles séricos de 25 hidroxi vitamina D y de paratohormona (PTH).
Los exámenes complementarios para establecer la causa de la OP, dependerán de la probable etiología propuesta, a partir de la historia clínica del paciente. Se proponen relacionados con el metabolismo fosfo cálcico óseo, como son, la determinación de calcio y fósforo en sangre y orina, los niveles séricos de 25 hidroxi vitamina D y de PTH.
CAPÍTULO 4
Tratamiento de la OP
Treatment of OP
¿Qué se entiende por prevención en OP?
Prevención primaria: las acciones se deben iniciar temprano desde que se comienza a formar la masa ósea. Comprenden actividades como: educación sanitaria durante todo el ciclo de vida del humano, dieta que aporte los requerimientos nutricionales de calcio, vitamina D, y sea normoproteica, evitar el sedentarismo, así como evitar el consumo de drogas que afecten al hueso.
Prevención secundaria: incluye las acciones para evitar la pérdida de la masa ósea e impedir los eventos que desencadenen fracturas por fragilidad. Comprende acciones como: la detección precoz y la modificación de factores que aceleran la pérdida de la masa ósea y evitar las caídas.4,9,10,28-38
¿Qué acciones realizar para la prevención primaria y cuándo iniciarlas?34-36
- Divulgar una información correcta, adecuada y asequible sobre la OP mediante el empleo de los medios masivos de difusión, el trabajo educativo de los diferentes profesionales del equipo de salud y las charlas educativas.
- Promover y velar por una adecuada alimentación (fundamentalmente aportar las cantidades de calcio y vitamina D necesarias para lograr una óptima masa ósea) desde la infancia y durante toda la vida, insistir fundamentalmente durante determinados periodos de la vida, como son, la pubertad, los embarazos y los primeros años de posmenopausia.
- Promover la práctica de ejercicios físicos durante todas las etapas del ciclo de vida.
- Desarrollar y/o recuperar hábitos de vida saludables al hueso, sobre todo, en mujeres a partir de los 35 años. Evitar o erradicar consumo de tabaco y/o alcohol, así como detectar de forma precoz la posible aparición de la OP, al identificar personas susceptibles por antecedentes familiares, por la presencia de afecciones, o el consumo de medicamentos que afectan la salud ósea.
¿Qué características debe tener la alimentación para que se considere adecuada para lograr un pico de masa ósea óptimo?
Aquellas que cubran las necesidades diarias de calcio y vitamina D, así como de proteínas de alto valor biológico32-34 (NR A), y evitar el consumo de bebidas que contengan fosfatos (colas), el consumo excesivo de sal, limitar el consumo excesivo de proteína animal (carne roja) (NR B).
Las necesidades diarias de calcio dependen del sexo y la edad, de manera que: entre los 0-6 meses se requiere 400 mg/día, entre 6-12 meses serían 600 mg/día, entre 1-10 años 800 mg/día, y desde los 18 hasta la tercera edad aproximadamente 1 000 mg/día. Se exceptúan las mujeres durante la gestación, y los 5 primeros años de posmenopausia, en que se debe incrementar a 1 200 mg/día.
¿Es posible cubrir las necesidades diarias de calcio con la dieta?
En general una dieta balanceada, normocalórica aporta entre 600 y 900 mg de calcio/día, por lo que se requerirá de un suplemento nutricional de calcio y vitamina D3, cuya cuantía dependerá del aporte de calcio de origen dietético. En nuestro país se dispone para el suplemento de calcio del carbonato de calcio en tabletas de 500 mg. A continuación se muestran las cantidades de calcio (mg/100 g de alimento) de algunos alimentos de consumo habitual por la población cubana (cuadro 7).
Cuadro 7. Cantidades de calcio de algunos alimentos de consumo habitual por parte de la población cubana (mg/100 g de alimento)
| Alimentos | Excelente |
| Leche polvo descremada | 1 257 |
| Ajonjolí | 943 |
| Leche polvo entera | 900 |
| Pescado con espinas | 732 |
| Queso blanco fresco | 717 |
| Queso gouda | 648 |
| Alimentos | Regular |
| Paletica cubierta chocolate | 184 |
| Helado de frutas Coppelia | 166 |
| Yema de huevo | 152 |
| Berro | 151 |
| Helado de vainilla Coppelia | 140 |
| Leche vaca fluida | 120 |
| Yogurt natural | 120 |
| Helado de vainilla Varadero | 104 |
| Helado de vainilla Guamá | 87 |
| Mariscos | 74 |
| Pescado salado | 66 |
| Huevo entero | 56 |
Las necesidades diarias de vitamina D son de 400 UI/día en niños y adolescentes con limitada exposición al sol, y de tener una adecuada exposición al sol serían de 300 UI/día. En los adultos <65 años 400 UI/día, y en los ancianos de 800 UI/día.
¿Qué tipo de actividad física se recomienda para lograr una buena masa ósea?
Durante la niñez y la adolescencia se recomiendan los ejercicios realizados en las escuelas (saltos, carreras, deportes de índole diversa), en otras etapas de la vida deben ser ejercicios aeróbicos, bailar, practicar algún deporte que no sea de fuerza, o caminar según hábitos, gusto y posibilidades reales, durante al menos 30 minutos diarios, es lo aconsejable de manera general34 (NR A). El ejercicio físico bajo orientación por el fisioterapeuta también está indicado en mujeres con fractura de columna, como en aquellas que fueron sometidas a vertebroplastia percutánea (NR A). La actividad física que conlleve amenorrea de debe proscribir29 (NR A).
¿Qué acciones realizar para evitar nuevas fracturas por fragilidad, es decir, para la prevención secundaria?
Será necesario mejorar la resistencia de la masa ósea y evitar las situaciones que desencadenan las fracturas. Para lograr el primer objetivo, además de las acciones generales referidas para la prevención primaria (alimentación adecuada y estilo de vida saludable), se dispone de fármacos que por diversos mecanismos mejoran la masa ósea y evitan la fractura. Para el segundo objetivo es imprescindible el control de aquellos eventos que puedan facilitar la caída, entre los que podemos citar: el uso racional de medicamentos que disminuyen la capacidad de reacción, como los hipotensores, betabloqueadores, diuréticos, hipoglucemiantes, hipnóticos y otros psicofármacos y antihistamínicos; indicar ejercicios que mejoren la fuerza y la coordinación de los músculos paravertebrales; corregir los déficits sensoriales; así como evitar factores ambientales como suelos resbaladizos, escaleras sin barandillas, escalones altos y estrechos, iluminación deficiente, ropa y calzado inadecuado, y animales domésticos sueltos en el hogar.29,35,36
¿Qué criterios se deberán seguir para la selección de los fármacos?
Los fármacos deberán demostrar, como criterios primarios: eficacia y seguridad (relación beneficio-riesgo); y como criterios secundarios: adecuación y costo (relación costo-efectividad.39-44 La selección del fármaco se realizará teniendo en cuenta los aspectos siguientes:
- Edad actual del paciente
- Sexo
- Intensidad del riesgo
- Estado de salud del paciente
- Localización de fractura previa
- Disposición de medicamentos
- Objetivo del tratamiento (prevención primaria ósea secundaria)
¿Cómo establecer la intensidad del riesgo?
Riesgo como probabilidad de que un evento ocurra, en el caso de la OP, es necesario no solo identificar aquellas personas con una masa ósea crítica o susceptible a fracturar, sino, además, identificar los factores relacionados con la fractura.
Para iniciar terapéutica farmacológica se requiere que el paciente tenga un riesgo alto para fractura, lo que significa una probabilidad > de un 20 % de tener una fractura ósea por fragilidad en un plazo de 10 años. En casos de riesgo medio (significa probabilidad entre un 10 y un 20 %), se prescribe terapia no farmacológica, y sobre todo, evitar las caídas.
Existen diferentes métodos para calcular el riesgo. La International Osteoporosis Federation (IOF) recomienda el empleo del factor risk assesment universal (FRAX), que tiene características diferentes según la población de estudio (no existe adaptación para la población cubana). Es por ello que es consenso recomendar utilizar los criterios propuestos por la Sociedad Española de Reumatología:10,45
Riesgo alto (si hay presencia de 2 o más de los factores siguientes):
- Edad > 65 años.
- Peso £ 20 kg/m2.
- Antecedente personal de fractura.
- Antecedente materno de fractura de fémur.
- Uso de corticoides (más de 5 mg/día y un periodo superior a 3 meses).
- Caídas (más de 2 en el último año).
Riesgo moderado (si hay presencia de 2 o menos de los factores siguientes):
- Consumo de tabaco y de alcohol (> de 3 unidades/día).*
- Menopausia precoz (antes 45 años).
- Amenorrea primaria y secundaria.
- Hipogonadismo masculino.
- Enfermedades o fármacos con capacidad de disminuir la densidad mineral ósea: como artritis reumatoide y otras artropatías inflamatorias, enfermedad intestinal inflamatoria, celíaca, mala absorción, anorexia y bulimia,** pacientes con trasplantes sólidos, uso de hidantoínas, retrovirales, etcétera.
- Factores relacionados con las caídas: trastornos de la visión, psicofármacos, accidente cerebrovascular, enfermedad de Parkinson.
*una unidad de alcohol= 8-10 g.
**no tratada constituye riesgo alto.
¿Cuál fármaco emplear?
Según el mecanismo de acción, los fármacos aprobados para el tratamiento de la OP se clasifican como: antirresortivos (entre los que se citan los bisfosfonatos, la terapia hormonal de reemplazo [estrógenos, y moduladores selectivos del receptor estrogénico como el raloxifeno], la calcitonina y el denosumab);46-56 los anabólicos, que favorecen la formación ósea (la paratohormona recombinante en su forma intacta (1-84) o un polipéptido constituido por el fragmento 1-34;56 y los de acción mixta, que desacoplan el remodelado, y reducen la resorción y aumentan la formación (el ranelato de estroncio).57
Según los resultados de ensayos clínicos doble ciego aletorizados (realizados casi todos en población mayor de 65 años),40,45,47,49,50,55,56 para la prevención primaria y secundaria de fracturas por fragilidad en la columna y en la cadera, los bisfosfonatos (alendronato [fosamax] y risedronato de sodio) son los medicamentos de mejor respuesta. De existir intolerancia a los orales, se podrían emplear -por vía parenteral- el ibandronato endovenoso de administración trimestral, o el zoledronato de indicación anual, en estos últimos el nivel de evidencia es menor.
El ranelato de estroncio estaría indicado como fármaco de segunda línea en mujeres con: T Score £ 3,5 DE, con contraindicación o intolerancia para el uso de los bifosfonatos o dificultades para su correcta administración, con múltiples fracturas por fragilidad, y con mala respuesta o fracaso a los bisfosfonatos.
La paratohormona (NR A) se emplearía como fármaco de tercera línea en mujeres con T Score £ 3,5 DE, con contraindicación para el uso de los bifosfonatos y ranelato de estroncio, con múltiples fracturas por fragilidad, y con mala respuesta a otros fármacos. Tanto el ranelato de estroncio como la paratohormona -sean en su forma intacta como teriparatide- están indicados en mujeres con 75 años y más.
La calcitonina (NR C) tendría su indicación exclusiva para el alivio del dolor por fracturas por fragilidad, y en pacientes con hiperparatiroidismo primario. El raloxifeno (NR A) sería para mujeres en etapa temprana de posmenopausia con antecedentes de cáncer de mama y sin síndrome vasomotor severo; mientras el denosumab (NR A) estaría indicado en hombres y mujeres con alto riesgo para fractura con más de 80 años. Los estrógenos no son fármacos indicados para el tratamiento exclusivo de la OP, a pesar de su probada utilidad.58 Los cuadros 8 y 9 presentan resúmenes de los efectos de diferentes medicamentos.
Efectos indeseables de los fármacos empleados como parte de la terapéutica de la OP:
Bisfosfonatos:9,30,31,47 su perfil es más o menos similar para todos. Para los que se administran por vía intravenosa (iv) (pamidronato, ibandronato y zoledronico [Z]) se reporta un síndrome similar a la influenza caracterizado por fiebre, mialgia, artralgia, leucopenia, así como la osteonecrosis maxilar y la fibrilación auricular, ambos con el uso del Z. Para los de administración oral se reporta irritación gastrointestinal, úlcera esofágica y fracturas atípicas. Para el etidronato se reporta hiperfosfatemia y osteomalacia. Cualquier bisfosfonato puede originar potencial hipocalcemia, amento de PTH y rash cutáneo.
Ranelato de estroncio:30,57 puede provocar trastornos digestivos como náuseas y diarreas, disminución del calcio sérico, de la paratohormona, y aumento del fósforo sérico. En la etapa poscomercialización se han reportado 2 muertes por una reacción de hipersensibilidad, infrecuente, pero grave, caracterizada por erupción cutánea, fiebre, afectación de diversos órganos como hígado y riñón, conocida como Drug Rash with Eosinophilia and Systemic Symptoms (DRESS).
Denosumab:9,37 reporta hipocalcemia, infecciones cutáneas, osteonecrosis de mandíbula (al igual que los bisfosfonatos), cataratas o diverticulitis.
Raloxifeno:48,56 ha reportado aumento de la intensidad del síndrome vasomotor, calambres en miembros inferiores, hinchazón, litiasis vesicular y tromboembolismo venoso.
Paratohormonona:56 en este caso, se refieren tos, calambres en miembros, mareos, palpitaciones, enrojecimiento en el sitio de inyección, ligero aumento de la calcemia y la calciuria. También astenia (8,7 %), cefalea (7,5 %), dolor cervical, mareos (10 %), depresión, insomnio y vértigo. También han aparecido trastornos gastrointestinales, como náuseas (8,5 %), constipación, diarreas, dispepsia, vómitos y trastornos de los dientes. El perfil de efectos adversos de paratohormona recombinante (rPTH) parece peor que el de teriparatida, con mayor incidencia de hipercalcemia, y por ello, exige el control periódico del calcio sérico.
Es consenso recomendar, como primera línea de tratamiento para la prevención de nuevas fracturas vertebrales y no vertebrales en mujeres y hombres con más de 65 años y hasta 80 años:
- 1ra opción: alendronato de sodio (70 mg/semanal vía oral). De existir intolerancia a la administracion oral de este fármaco, se aconseja ibandronato de sodio (3 mg endovenoso, con frecuencia trimestral), o ácido zoledronico (4 mg anualmente).
- 2da opción: ranelato de estroncio (2 g/día vía oral).
Para la prevención de nuevas fracturas vertebrales y no vertebrales en mujeres con 80 años y más:
- 1ra opción: ranelato de estroncio (2 g/día vía oral).
- 2da opcion: teriparatide (20 ug/día) o rPTH (100 ug/día vía subcutánea).
Para la prevención de la primera fractura en personas con alto riesgo de fractura:
- Alendronato de sodio (70 mg/semanal vía oral) con independencia de edad y sexo.
¿Qué tiempo indicar los fármacos para la OP?
Debido a que el fármaco no revierte la etiología del proceso, el tiempo a emplearlos constituye uno de los problemas no resueltos en la terapéutica para la OP. Tomando en cuenta el riesgo/beneficio, se considera que los bisfosfonatos no deben utilizarse por un período mayor de 5 años47 (NR B); la PTH durante un periodo que varía entre 18 y 24 meses43 (NR C); mientras que con el denosumab, no se ha establecido el tiempo máximo de su empleo.59
¿Cómo garantizar el éxito del tratamiento?
Depende, entre otros factores, de una adecuada información en OP, con énfasis en el beneficio derivado de cumplir de manera integral las indicaciones médicas (dieta, ejercicios, evitar las caídas), y sobre todo, de la adherencia a la terapéutica, que significa cumplir debidamente con la toma de los medicamentos, pues, resultados de estudios realizados al respecto muestran que el 13 % de los pacientes no inician el tratamiento medicamentoso, y de los que comienzan el tratamiento, solo el 24 % lo mantiene al cabo de 2 años; en cambio, en los que mantienen la adherencia al tratamiento se reduce la tasa de fractura.60-68
¿Cómo evaluar la respuesta al tratamiento?
Desde el punto de vista clínico evitando la presencia de una nueva fractura; no obstante, se dispone de una serie de pruebas diagnósticas a fin de identificar la respuesta del hueso al tratamiento medicamentoso, entre las que están: los marcadores de recambio óseo (péptido de extensión N terminal del pro-colágeno 1 [P1NP] como marcador de formación, y del telopéptido C [CTX] como producto que mide la resorción), marcadores que cambian desde los 3 meses de iniciado el tratamiento fundamentalmente cuando se utilizan los bisfosfonatos y el raloxifeno; y la densitometría (DXA), que se indicará con un intervalo no menor de 13 meses entre estudios.69-72 La variación en la densidad mineral entre 2 determinaciones debe ser mayor que el cambio significativo mínimo. Este tiene diferentes maneras para calcularse, pero, de forma práctica, se plantea deberá ser mayor de 0,05 g/cm2 para la columna lumbar y de 0,04 g/cm2 para la cadera. Es consenso recomendar que cada centro donde se realice DXA deberá calcular el cambio significativo mínimo62-66 (NR A).
Será importante que los familiares colaboren con las modificaciones necesarias en el entorno doméstico (lugar donde con mayor frecuencia ocurren las caídas), a fin de disminuir las barreras que en el domicilio pueden favorecer las caídas: proporcionar calzado adecuado, y/o de accesorios con mejoría del control muscular; explicarle al paciente y familiares cómo realizar las actividades de aseo y de la vida cotidiana (lavado de dientes, baño, carga de paquetes, apoyos, etc.), de manera que no se favorezcan caídas ni fracturas.
No se debe descuidar el chequeo del calcio en sangre y orina, y si hubiera hipercalciuria persistente, determinar los niveles plasmáticos de PTH, y buscar litiasis renal mediante ultrasonido renal (NR B). Igualmente, se debe chequear el índice de creatinina cada 6 meses, durante todo el tiempo que se indiquen bifosfonatos (NR D).
¿Qué fármacos se recomiendan para el tratamiento de la OP en el niño?
Resulta difícil proponer esquema terapéutico, debido a que no se reporta uso en niños de la calcitonina, la PTH. Los diuréticos tiazídicos se utilizan en ciertos tipos de hipercalciuria. La hormona de crecimiento ha mostrado utilidad en los pacientes con deficiencia de esta hormona, el síndrome de Turner y la insuficiencia renal crónica. Los bifosfonatos, y específicamente el pamidronato endovenoso, se reporta como eficaz en la OP en edades pediátricas66-68 (NR D).
Quedan aún cuestiones por resolver como la duración y edad de inicio del tratamiento, las dosis y régimen óptimo, los bifosfonatos más adecuados para la edad, así como los efectos a largo plazo, entre otros. Es consenso recomendar que en niños y adolescentes con afecciones que pueden originar OP, realizar medidas de prevención primaria, y de existir OP, se aconseja definir las opciones terapéuticas según consenso de un grupo multidisciplinario de profesionales y la experiencia reportada al respecto.
¿Qué fármacos se recomiendan para el tratamiento de la OP en el hombre?
En general, los reportes se refieren al aumento de la densidad mineral, y no tienen como objetivo disminuir las fracturas. Las medidas iniciales estarán en relación con la etiología de la OP. Si se identifica hipogonadismo, la elección del tratamiento debe ser enantato de testosterona (100 mg intramuscular cada 3 semanas) (NR B). De los bisfosfonatos, el alendronato de sodio (70 mg/semanal) (NR B) se reporta como útil en la prevención primaria y en secundaria, sin que se establezca el tiempo de duración de la terapia. El risedronato de sodio (35 mg/semanal)26,43,47,59 (NR B) puede ser indicado con igual criterio. En hombres bajo tratamiento con antiandrógenos, por cáncer de próstata, se aconseja el ibandronato. El denosumab se reporta como útil para incrementar la densidad mineral en la columna, la cadera y el trocánter.
¿Cómo tratar el dolor en el paciente con fractura vertebral?
Inicialmente indicar reposo absoluto en cama, y se sugiere que el paciente adopte la posición decúbito lateral con las piernas dobladas (NR B). Otra opción sería el uso de corsé ortopédico, que se empleará constante durante las actividades diarias del paciente, y que deberá ser prescrito por el ortopédico (NR B). Además, prescribir analgésicos cuya selección y dosis dependerán de la intensidad del dolor y las comorbilidades del paciente. La calcitonina vía nasal tiene efecto analgésico potente (NR A). Se solicitará la colaboración de los especialistas expertos del dolor; y no olvidar el apoyo psicológico, necesario para todo paciente con dolor.
¿Cómo tratar la OP en mujeres menores de 65 años?
Si la mujer requiere utilizar terapia estrogénica por otras razones, este tratamiento es además útil para preservar la masa ósea.60-72 En caso de contraindicación para esta terapéutica, estaría indicado el raloxifeno. En caso de mujeres con riesgo moderado para fractura por fragilidad, se sugiere utilizar las isoflavonas de soya,73-76 (NR C) si coexisten manifestaciones del síndrome vasomotor, y en ausencia de estos, prescribir la proteína de selenio calcio (kalsis)77,78 (NR C) (cuadro 10).
¿Cómo realizar la atención integral al paciente con OP?
En la primera consulta se le realizará historia clínica completa que incluya: antecedentes personales y/o familiares de fracturas por fragilidad, características de la nutrición durante todo el ciclo de vida, actividad física con especial referencia a la etapa de la pubertad, hábito tabáquico, características de la vida reproductiva (edad de menarquía, edad de menopausia, número de embarazos y lactancia materna), presencia o no de enfermedades, y uso de medicamentos capaces de afectar la salud ósea.
Examen físico con especial referencia al índice de masa corporal, cambios en la talla, modificaciones de la columna vertebral, entre otros. Con estos elementos de manera individual, o con el empleo del osteorisk, se obtiene un riesgo probable de baja masa ósea, y para su confirmación indicar US Cal.
Segunda consulta: según los resultados del US Cal se indicará o no DXA de columna lumbar y cadera. De no disponer de equipos para realizar US Cal, se indicará la DXA como ya se señaló en otra parte de esta guía, si existieran 3 o más factores de riesgo en el paciente. Si se confirma la OP se indicarán las investigaciones destinadas a identificar sus probables causas, o la presencia de enfermedades que pueden afectar la calidad del hueso.
Tercera consulta: a partir de los resultados de los exámenes complementarios es posible dispensarizar al paciente, y con ello, establecer una probable conducta terapéutica (cuadro 11).
Seguimiento:
En los pacientes de los grupos 1 y 2 se realizarán evaluaciones anuales, mientras que los de los grupos 3 y 4 tendrían seguimiento semestral (salvo que alguna condición del paciente justifique períodos menores). En cada consulta se realizarán: orientaciones educativas, especificas para cada paciente y/o familia encaminadas a identificar sus necesidades de conocimiento o dificultades para realizar el tratamiento, y evitar las caídas; evaluar la evolución de los síntomas clínicos iníciales; verificar la adherencia terapéutica, e identificar probables efectos secundarios de esta; evaluación de los resultados de los análisis complementarios; brindar apoyo emocional y tratamiento para el dolor crónico; así como promover acciones para mejorar la fisiología de la columna vertebral y/o de otras regiones del cuerpo donde hayan ocurrido fracturas.
Para la atención integral al paciente con OP se sugiere deba existir un equipo multidisciplinario, en el cual intervengan, de manera coordinada, como mínimo un coordinador clínico (que puede ser geriatra, endocrinólogo, reumatólogo o un internista), ortopédicos, fisiatras, así como contar la participación, según necesidad, de las redes de psicólogos y trabajadores sociales.
¿Cuáles actividades le corresponderían a los diferentes niveles del Sistema Nacional Salud (SNS) en la atención integral al paciente con OP?
Teniendo en cuenta la necesaria interrelación entre los diferentes niveles del SNS se propone:
- Nivel primario de atención del SNS: realizar las acciones necesarias para lograr (niñez y adolescencia), y preservar la masa ósea acordes con las diferentes etapas del ciclo de vida. Detectar a aquellas personas con riesgo clínico para una baja masa ósea y remitirlas a la instancia correspondiente.
En coordinación con los otros niveles de atención del SNS -y con otras especialidades de la APS- brindar el tratamiento integral que requiere el paciente con riesgo para fractura y/o con fracturas por fragilidad previas, reforzar las acciones educativas dirigidas a pacientes y familiares, así como brindar apoyo emocional a pacientes y familiares.
- Nivel secundario de atención del SNS: confirmar el diagnóstico de OP, proponer las medidas terapéuticas específicas para cada paciente, realizar su control evolutivo, y en coordinación con la APS brindar el tratamiento integral a estos pacientes.
- Nivel terciario del SNS: brindar atención de especialidad, sobre todo, a pacientes con OP secundarias, brindar atención a los niños y mujeres en etapa reproductiva con OP, evaluar la calidad de las acciones diagnósticas y terapéuticas orientadas a pacientes con OP, así como crear una red nacional que permita identificar el impacto de las acciones terapéuticas en el riesgo de OP.
Educación popular en OP
Se propone identificar las necesidades de aprendizaje en la población respecto a la OP, y confeccionar material impreso para distribuir a la población relativo a cómo lograr una buena salud ósea.
Evaluación de la Guía:
A corto plazo (12 meses a partir de su difusión): para evaluación satisfactoria cumplir con el 80 % o más de los aspectos siguientes:
- Difusión de la Guía para su análisis en todos los niveles del SNS cubana, y, fundamentalmente, en las especialidades médicas en las que las personas con OP demandan atención con mayor frecuencia.
- Realizar cursos de al menos 1 por año sobre OP, destinado a los miembros del equipo de salud en la APS.
- Promover campañas publicitarias destinadas a incrementar conocimientos y a estimular una conducta que promueva lograr una salud ósea.
- Promover campañas publicitarias destinadas a la prevención de las caídas.
A mediano plazo (entre 12-24 meses): para evaluación satisfactoria cumplir con el 80 % o más de los aspectos siguientes:
- Identificar los factores relacionados con la calidad del hueso en la población cubana.
- Realizar control de los medicamentos para mejorar la calidad del hueso.
- Promover acciones tendentes a lograr mayor adherencia de los pacientes al tratamiento medicamentoso.
A largo plazo (a partir de 36 meses): disminuir el número de fracturas por fragilidad.
REFERENCIAS BIBLIOGRÁFICAS
1. Minsap. Anuario estadístico [homepage en Internet]; La Habana, 2011 [citado 13 de febrero de 2013]. Disponible en: http://files.sld.cu/dne/files/2012/04/anuario-2011-e.pdf
2. NIH. Consensus Development Panel on Osteoporosis: prevention, diagnostic and therapy. JAMA. 2001:285;785-95.
3. Alfonso Fraga JC. Cuba, características sociodemográficas de las mujeres de edad mediana. En: Artiles L, Navarro D, Manzano BR, eds. Climaterio y menopausia, un enfoque desde lo social. La Habana: Editorial Científico Técnica; 2007. p. 21-37.
4. Lorenzo JA, Canals E, Raisz L. Enfermedad metabólica ósea. En: Kronenberg HM, Melmed S, Polonsjy K, Red Larsen P, eds. Tratado de Endocrinología. 11na edición. Capítulo 28. Madrid: Elsevier; 2010. p. 1373-402.
5. Supervia Caparráas A, Diez Pérez A. Epidemiología de la osteoporosis y de las fracturas. Actualizaciones en Osteoporosis. Madrid: Ergon; 2006. p. 19-34.
6. Navarro Despaigne D. Estrógenos y huesos. En: Artiles L, Navarro D, Manzano BR, eds. Climaterio y menopausia, un enfoque desde lo social. La Habana: Editorial Científico Técnica; 2007. p. 202-15.
7. Díaz López JB, Gómez Alonso C. Concepto de osteoporosis: masa ósea vs. calidad ósea. Actualizaciones en Osteoporosis. Madrid: Ergon; 2006. p. 3-18.
8. Olmos Martínez JM, González Macías J. Nuevos aspectos del remodelado óseo. Actualizaciones en Osteoporosis. Madrid: Ergon; 2006. p. 35-54.
9. Actualización 2011 del Consenso Sociedad Española de Reumatología de Osteoporosis. Reumatol Clin. 2011;7:357-79.
10. Guías 2012 para el diagnóstico, la prevención y el tratamiento de la osteoporosis. Medicina (Buenos Aires). 2013;73:55-74.
11. Sen SS, Rives VP, Messina OD, Morales-Torres J, Riera G, Angulo-Solimano JM, Neto JF, et al. A risk assessment tool (OsteoRisk) for identifying Latin American women with osteoporosis. J Gen Intern Med. 2005;20:245-50.
12. Von Mühlen D, Visby Lunde A, Barrett-Connor E, Bettencourt R. Evaluation of the simple calculated osteoporosis risk estimation (SCORE) in older Caucasian women: the Rancho Bernardo study. Osteoporos Int. 1999;10:79-84.
13. Hiligsmann M, Ethgen O, Richy F, Reginster JY. Utility values associated with osteoporotic fracture: a systematic review of the literature. Calcif Tissue Int. 2008;82:288-92.
14. Rud B, Jensen JE, Mosekilde L, Nielsen SP, Hilden J, Abrahamsen B. Performance of four clinical screening tools to select peri-and early postmenopausal women for dual X-ray absorptiometry. Osteoporos Int. 2005;16:764-72.
15. Gourlay ML, Miller WC, Richy F, Garrett JM, Hanson LC, Reginster JY. Performance of osteoporosis risk assessment tools in postmenopausal women aged 45-64 years. Osteoporos Int. 2005;16:921-7.
16. Salaffi F, Silveri F, Stancati A, Grassi W. Development and validation of the osteoporosis prescreening risk assessment (OPERA) tool to facilitate identification of women likely to have low bone density. Clin Rheumatol. 2005;24:203-11.
17. Koh LK, Sedrine WB, Torralba TP, Kung A, Fujiwara S, Chan SP, et al . A simple tool to identify asian women at increased risk of osteoporosis. Osteoporosis Self-Assessment tool for Asians (OSTA) Research Group. Osteoporos Int. 2001;12:699-705.
18. Farrerons Minguella J, Malouf J. Radiología de la fractura vertebral. Actualización en Osteoporosis. Madrid: Ergon; 2006. p. 29-43.
19. Marshall D, Johnell 0, Wedel H. Meta-analysis of how well measures of bone mineral density predict occurrence of osteoporotic fractures. BMJ. 1996;312:1254-9.
20. Bosnick SL. Densitometry techniques. In: Bone densitometry in clinical practice. Second Edition. Chapter 1. New Jersey: Humana Press; 2004. p. 1-22.
21. Green AD, Colón-Emeric CS, Bastian L, Drake MT, Lyles KW. Does this woman have osteoporosis? JAMA. 2004;292:2890-900.
22. Bosnick SL. Diadnosing osteoporosis. In: Bone densitometry in clinical practice. Second Edition. Chapter 9. New Jersey: Humana Press; 2004. p. 197-215.
23. Santos C. Criterios Normativos de Diagnóstico de la Osteoporosis y la Composición Corporal en Población Cubana según Densitometría de Doble Haz de Fotones [monografía en Internet] [citado 26 de agosto de 2013]. Disponible en: http://www.monografias.com/trabajos16/criterios osteoporosis/criterios osteoporosis.html
24. Santos C, Navarro D, Manzano B. Riesgo relativo de osteoporosis según la densidad mineral ósea en mujeres menopáusicas sanas de la región occidental de Cuba. Rev Esp Nutr Comunitaria. 2010;16:137-46.
25. Granela Cortiñas K, Pérez Gesen C, Carvajal Martínez F, Navarro Despaigne D, Domínguez Alonso E, Díaz Horta O, et al. Mineralización ósea en niños y adolescentes con hipotiroidismo congénito. Rev Cubana Endocrinol. 2011 Ago;22:118-32.
26. Díaz Curiel M. Epidemiología, fisiopatología y diagnóstico de la osteoporosis del varón. En: Actualizaciones en Osteoporosis masculina. Madrid: Ergon; 2011. p. 7-22.
27. Sosa Henríquez M, Gómez de Tejada Romero MJ. Densitometría vs. ultrasonidos en el diagnóstico de la osteoporosis. En: Actualizaciones en Osteoporosis. Madrid: Ergon; 2006. p. 1-17.
28. Santisteban Alba S. Climaterio y osteoporosis. En: Artiles L, Navarro D, Manzano BR, eds. Climaterio y Menopausia, un enfoque desde lo social. La Habana: Editorial Científico Técnica; 2007. p. 313-26.
29. Arrebola A. Prevención general de la osteoporosis: papel de la dieta y del ejercicio. Actualización en osteoporosis. Madrid: Ergon; 2006. p. 43-66.
30. Dirección General de Farmacia y Productos Sanitarios de Madrid. Recomendaciones para la valoración y tratamiento de la osteoporosis primaria en mujeres de la Comunidad de Madrid. Comunidad de Madrid: Conserjería de Sanidad; 2007.
31. Watts NB, Lewiecki EM, Miller PD, Baim S. National Osteoporosis Foundation Clinician's Guide to Prevention and Treatment of Osteoporosis and the World Health Organization Fracture Risk Assessment Tool (FRAX): what they mean to the bone densitometrist and bone technologist. J Clin Densitom. 2008;11:473-7.
32. Consenso 2010 de la Sociedad Norteamericana de Menopausia. Manejo de la osteoporosis en mujeres posmenopáusicas. Revista de Climaterio. 2012;13:139-88.
33. 2012 update of French guidelines for the pharmacological treatment of postmenopausal Osteoporosis. Joint Bone Spine. 2012;79:304-13.
34. Bischoff-Ferrari HA, Willett WC, Wong JB, Giovannucci E, Dietrich T, Dawson-Hughes B. Fracture prevention with vitamin D supplementation: a meta-analysis of randomized controlled trials. JAMA. 2005;11(293):2257-64.
35. Bischoff-Ferrari HA. Which vitamin D oral supplement is best for postmenopausal women? Curr Osteoporos Rep. 2012;10:251-7.
36. Holick MF, Binkley NC, Bischoff-Ferrari HA, Gordon CM, Hanley DA, Heaney RP, et al. Endocrine Society. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2011;96:1911-30.
37. Body J, Bergmann P, Boonen S, Boutsen Y, Bruyere O, Devogelaer JP, et al. Non-pharmacological management of osteoporosis:a consensus of the Belgian Bone Club. Osteoporos Int. 2011;22:2769-88.
38. Hongo M, Itoi E, Sinaki M, Miyakoshi N, Shimada Y, Maekawa S, et al. Effect of low-intensity back exercise on quality of life and back extensor strength in patients with osteoporosis: a randomized controlled trial. Osteoporos Int. 2007;18(1):389-1395.
39. Pérez Edo I. Bisfosfonatos. Actualizaciones en Osteoporosis. Madrid: Ergon; 2007. p. 61-8.
40. Gómez de Tejada Romero MJ, Pérez Cano R. Fármacos antirresortivos II: el tratamiento hormonal sustitutivo, los moduladores selectivos de los receptores estrogénicos y la calcitonina. Actualizaciones en Osteoporosis. Madrid: Ergon; 2007. p. 23-42.
41. Kumar Khajuria D, Razdan R, Mahapatra DR. Drugs for the management of osteoporosis: a review Rev Bras Reumatol. 2011;51:365-82.
42. Pazianas M, Cooper C, Ebetino H, Graham R, Russell G. Long-term treatment with bisphosphonates and their safety in postmenopausal osteoporosis. Therapeutics and Clinical Risk Management. 2010;6:325-43.
43. Salica D, Buceta A, Palacios S, Sánchez A, y grupo investigadores SIBOMM. Consenso Iberoamericano de Osteoporosis SIBOMM 2009. Osteoporosis: Prevención, Diagnóstico y Tratamiento. Rev Arg Osteol. 2010;9:4-44.
44. Jervis R. Osteopenia-osteoporosis. Rev Ecuatoriana de Ginecología y Obstetricia. 2011;XVIII:97-103.
45. Claus-Hermberg H, Bagur A, Messina O, Negri A, Schurman L, Sánchez A. FRAX. Un nuevo instrumento para calcular el riesgo absoluto de fractura a 10 años. Medicina (B Aires). 2009;69:571-5.
46. Fraser LA, Vogt K, Adachi J, Thabane L. Fracture risk associated with continuation versus discontinuation of bisphosphonates after 5 years of therapy in patients with primary osteoporosis: a systematic review and meta-analysis. Therapeutics and Clinical Risk Management. 2011;7:157-66.
47. Watts NB, Diab D. Long term use of bisphosphonates in Osteoporosis. J Clin Endocrinol Metab. 10;95:1555-65.
48. Khosla S, Bilezikian JP, Dempster DW, Lewiecki EM, Miller PD, Neer RM, et al. Benefits and risks of bisphosphonate therapy for osteoporosis. J Clin Endocrinol Metab. 2012;97:2272-82.
49. Orwoll E, Teglbjærg CS, Langdahl BL, Chapurlat R, Czerwinski E, Kendler DL, et al. A randomized, placebo-controlled study of the effects of denosumab for the treatment of men with low bone mineral density. J Clin Endocrinol Metab. 2012;97:3161-9.
50. Wells GA, Cranney A, Peterson J, Boucher M, Shea B, Welch V, et al. Risedronate forthe primary and secondary prevention of osteoporotic fractures in postmenopausal women. Cochrane Database of Systematic Reviews. 2008; Issue 1. Art. No. CD004523.
51. Ettinger B, Black DM, Mitlak BH, Knickerbocker RK, Nickelsen T, Genant HK, et al. Reduction of vertebral fracture risk in postmenopausal women with osteoporosis treated with raloxifene: results from a 3-year randomized clinical trial. Multiple Outcomes of Raloxifene Evaluation (MORE) Investigators. JAMA. 1999;282:637-45.
52. Papapoulos S, Chapurlat R, Libanati C, Brandi ML, Brown, JP Czerwin E, et al. Five years of Denosumab exposure in women with postmenopausal Osteoporosis: Results From the First Two Years of the FREEDOM Extension. JBMR. 2012;27:694-705.
53. Chesnut CH 3rd, Silverman S, Andriano K, Genant H, Gimona A, Harris S, et al. A randomized trial of nasal spray salmon calcitonin in postmenopausal women with established osteoporosis: the prevent recurrence of osteoporotic fractures study. PROOF Study Group. Am J Med. 2000;109:267-76.
54. Lindsay R, Gallagher JC, Kleerekoper M, Pickar JH. Bone response to treatment with lower doses of conjugated estrogens with and without medroxyprogesterone acetate in early postmenopausal women. Osteoporos Int. 2005;16:372-9.
55. Tsai JN, Uihlein AV, Lee H, Kumbhani R, Siwila-Sackman E, McKay EA, et al. Teriparatide and denosumab, alone or combined, in women with postmenopausal osteoporosis: the DATA study randomised trial. Lancet. 2013;6(382):50-6.
56. Finkelstein JS, Wyland JJ, Lee H, Neer RM. Effects of teriparatide, alendronate, or both in women with postmenopausal osteoporosis. J Clin Endocrinol Metab. 2010;95:1838-45.
57. Reginster JY, Seeman E, De Vernejoul MC, Adami S, Compston J, Phenekos C, et al. Strontium ranelate reduces the risk of nonvertebral fractures in postmenopausal women with osteoporosis: Treatment of Peripheral Osteoporosis (TROPOS) study. J Clin Endocrinol Metab. 2005;90:2816-22.
58. Writing Group for the Women's Health Initiative. JAMA. 2002;288:321-33.
59. Egerdie RB, Saad F, Smith MR, Tammela TL, Heracek J, Sieber P, et al. Responder analysis of the effects of denosumab on bone mineral density in men receiving androgen deprivation therapy for prostate cancer. Prostate Cancer Prostatic Dis. 2012;15:308-12.
60. Kanis JA, McCloskey EV, Johansson H, Cooper C, Rizzoli R. European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int. 2013;4:23-57.
61. Silverman SL, Cummings SR, Watts NB; Consensus Panel of the ASBMR, ISCD, and NOF. Recommendations for the clinical evaluation of agents for treatment of Osteoporosis Consensus of an expert panel representing the American Society for Bone and Mineral Research (ASBMR), the International Society for Clinical Densitometry (ISCD), and the National Osteoporosis Foundation (NOF). J Bone Miner Res. 2008;23:159-65.
62. Kanis JA, Gluer CC. An update on the diagnosis and assessment of osteoporosis with densitometry. Committee of Scientific Advisors, International Osteoporosis Foundation. Osteoporos Int. 2000;11:192-202.
63. World Health Organization. Prevention and management of osteoporosis. World Health Organ Tech Rep Ser. 2003;921:1-164.
64. Bosnick SL. Reporting densitometry. In: Bone densitometry in clinical practice. Second Edition. Chapter 12. New Jersey: Humana Press; 2004. p. 267-85.
65. Richy F, Lecart MP, Mawet AM, Paquot B, Reginster JY. Value of bone densitometry for the diagnosis and monitoring of osteoporotic patients: integration with biological and clinical risk factors. Rev Med Liege. 2006 May-Jun;61(5-6):291-300.
66. Goldbloom EB, Cummings EA, Yhap M. Osteoporosis at presentation of childhood all: Management with Pamidronate. Pediatric Hematology and Oncology. 2005;22:543-50.
67. Sebestyen JF, Srivastava T, Alon US. Bisphosphonates use in children. Clin Pediatr Phila. 2012;51:1011-24.
68. Giampiero I, Baroncell B, Bertelloni S, Sodin F, Saggese G. Osteoporosis in children and adolescents. Aetiology and management Review. Pediatr Drugs. 2005;7:295-323.
69. McCombs JS, Thiebaud P, McLaughlin-Miley C, Shi J. Compliance with drug therapies for the treatment and prevention of osteoporosis. Maturitas. 2004;48:271-87.
70. Caro JJ, Ishak KJ, Huybrechts KF, Raggio G, Naujoks C. The impact of compliance with osteoporosis therapy on fracture rates in actual practice. Osteoporos Int. 2004;15:1003-8.
71. Van der Velde N, Stricker BH, Pols HA, Van der Cammen TJ. Risk of falls after withdrawal of fall-risk-increasing drugs: a prospective cohort study. Br J Clin Pharmacol. 2007;63:232-7.
72. Szulc P, Muños P, Duboeuf F, Marchand F, Delmas PB. Bone mineral density predicts osteoporotic fractures in elderly men. The MINOS study. Osteoporos Int. 2005;16:1184-92.
73. McLeod KM, Johnson CS. Identifying women with low bone mass: a systematic review of screening tools. Geriatr Nurs. 2009;30:164-73.
74. Liu J, Ho SC, Su YX, Chen WQ, Zhang CX, Chen YM. Effect of long-term intervention of soy isoflavones on bone mineral density in women: a meta-analysis of randomized controlled trials. Bone. 2009;44:948-53.
75. Martínez A. Terapia de reemplazo o fitoestrógenos. Rev Ecuatoriana de Ginecología y Obstetricia. 2011;XVIII:94-7.
76. Marini H, Minutoli L, Polito F, Bitto A, Altavilla D, Atteritano M. Effects of the phytoestrogen genistein on bone metabolism in osteopenic postmenopausal women a randomized controlled trial. Ann Intern Med. 2007;19(146):839-47.
77. Montero M, Diaz M, Guede D, Caeiro JR, Martinez M, Navarro D, et al. Effects of Kalsis, A Dietary Supplement, on Bone Metabolism in the Ovariectomized Rats. J of Osteoporosis. 2012;Article ID 639427.
78. Navarro D, Triana M. Efectos del kalsis como coadyuvante en el tratamiento de la baja masa ósea (osteopenia) en mujeres de edad mediana. Rev Colombiana de Menopausia. 2010;16:307-18.
BIBLIOGRAFÍA CONSULTADA
- Manejo de la Osteoporosis en Mujeres Posmenopáusicas: Declaración de Postura de la Sociedad Norteamericana de Menopausia, 2006.
- Tratamiento farmacológico de la osteoporosis primaria. Guía Farmacoterapéutica Interniveles de las Islas Baleares. Actualización, 2009.
- Consenso Iberoamericano de Osteoporosis. SIBOMM, 2009.
- Sociedad Navarra de Medicina Familiar y Atención Primaria (SNAMFAP). Documento para el Manejo de la Osteoporosis en la Atención Primaria. Actualización, 2006.
- European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int. 2008;19:399-428.
Recibido: 27 de agosto de 2013.
Aprobado: 16 de diciembre de 2013.
Daysi Navarro Despaigne. Instituto Nacional de Endocrinología. Calle Zapata y D, Vedado, municipio Plaza. La Habana, Cuba. Correo electrónico: dnavarro@inend.sld.cu