Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol vol.26 no.2 Ciudad de la Habana mayo.-ago. 2015
ARTÍCULO ORIGINAL
Asociación entre niveles de testosterona, sensibilidad a la insulina, adiposidad y parámetros lipídicos en hombres
Association between testosterone levels, insulin sensitivity, adiposity and lipid parameters in men
MSc. Aimée Álvarez Álvarez, Dr. Miguel Ángel Marrero Falcón, Dr. Roberto Manuel Gónzalez Suárez, Dr. Pedro Perich Amador, MSc. María Celeste Arranz Calzado, Dra. Emma Domínguez Alonso, Lic. Alina Chapé Puertas, Lic. Silvia Sánchez Leyva, Lic. Janet Rodríguez Acosta
Instituto Nacional de Endocrinología (INEN). La Habana, Cuba.
RESUMEN
Introducción: evidencias sugieren que la testosterona interviene en la regulación del metabolismo de la glucosa y los lípidos.
Objetivo: determinar la relación entre los niveles de testosterona y la sensibilidad a la insulina, la adiposidad y los parámetros del metabolismo lipídico en hombres.
Métodos: estudio transversal y descriptivo en 225 hombres, entre 35 y 60 años, con y sin trastornos de la tolerancia a la glucosa. Se midieron: talla, peso, circunferencias de la cintura y de la cadera. Se realizaron determinaciones de insulina, glicemia, testosterona, colesterol, HDL-colesterol, LDL-colesterol y triglicéridos. Se determinaron índices de sensibilidad y resistencia a la insulina.
Resultados: se encontró una correlación negativa entre los niveles de testosterona y la resistencia a la insulina, y los parámetros de adiposidad explorados (índice de masa corporal, circunferencias abdominal y de la cadera, índice cintura/cadera). El nivel de testosterona fue menor en los sujetos con hipertrigliceridemia. En los sujetos con trastornos de la tolerancia, se encontró un aumento significativo de la frecuencia de obesidad abdominal en presencia de valores bajos de testosterona.
Conclusiones: existe una asociación directa entre los niveles de testosterona y la sensibilidad a la insulina en la población estudiada. La disminución de los niveles de testosterona en presencia de los desórdenes asociados al síndrome metabólico, sugiere la indicación de una evaluación metabólica temprana a los pacientes con hipogonadismo.
Palabras clave: testosterona, sensibilidad a la insulina, resistencia a la insulina, adiposidad.
ABSTRACT
Introduction: evidence suggests that testosterone participates in the regulation of glucose and lipid metabolism.
Objective: determine the relationship between testosterone levels and insulin sensitivity, adiposity and metabolism parameters in men.
Methods: a descriptive cross-sectional study was conducted of 225 men aged 35-60 with and without glucose tolerance disorders. The variables measured were height, weight, and waist and hip circumference. Determinations were made for insulin, glycemia, testosterone, cholesterol, HDL cholesterol, LDL cholesterol and triglycerides. Insulin sensitivity and resistance were also determined.
Results: a negative correlation was found between testosterone levels/insulin resistance and the adiposity parameters considered (body mass index, waist and hip circumference and waist to hip ratio). Testosterone levels were lower in subjects with hypertriglyceridemia. Patients with tolerance disorders showed a significant increase in the frequency of abdominal obesity in the presence of low testosterone values.
Conclusions: a direct relationship was found between testosterone levels and insulin sensitivity in the population studied. Reduced testosterone levels in the presence of disorders associated to metabolic syndrome suggest the need for an early metabolic assessment of patients with hypogonadism.
Key words: testosterone, insulin sensitivity, insulin resistance, adiposity.
INTRODUCCIÓN
Evidencias acumuladas en las últimas 2 décadas sugieren que la testosterona (T), además de su conocido rol en la función reproductiva, interviene en la homeostasis de la glucosa y el metabolismo lipídico;1,2 sin embargo, aún se discute cómo esta hormona ejerce su acción en la regulación de las diferentes vías metabólicas involucradas en el metabolismo de la glucosa y los lípidos.
Estudios realizados con distintos modelos experimentales han mostrado que la T modula la sensibilidad a la insulina (SI), la tolerancia a la glucosa (TG); y que, además, tiene efecto sobre la secreción de insulina de los islotes pancreáticos.3,4 Según un estudio experimental en adipocitos de ratones, la señalización del receptor de andrógenos, no solo protege contra la obesidad visceral inducida por dietas ricas en grasa, sino que regula la acción de la insulina y la homeostasis de la glucosa independiente a la adiposidad.5
En algunos estudios en hombres se establece una relación inversa entre los niveles de T y de insulina basal, independiente de la edad, la obesidad, el índice de masa corporal (IMC) y de los niveles de la proteína transportadora de esteroides sexuales (SHBG).6,7
En los hombres, el hipoandrogenismo se ha asociado con la resistencia a la insulina (RI)8 y algunos importantes desórdenes, como la dislipidemia, la aterosclerosis, las enfermedades cardiovasculares, el síndrome metabólico (SM) y la diabetes.9
Se reporta que los hombres con diabetes tipo 2 (DM 2) tienen niveles de T inferiores a los sujetos sanos de igual peso,10 y que la terapia de reemplazo con T mejora el control metabólico de los pacientes con DM 2.11 En concordancia con esto algunos estudios plantean que la deficiencia de T constituye un elemento predictor de DM 2 y del SM.12-15
Existen controversias en cuanto al rol de la adiposidad y el metabolismo lipídico en la interrelación entre la androgenicidad y la SI. En tal sentido, algunos autores reportan que el IMC media la relación entre los niveles de T y la SI,8 mientras que otros plantean que en los hombres esta relación persiste, aun cuando se controla la adiposidad general.16 Un tercer grupo considera que la T podría modular la SI a través de cambios en los parámetros de la obesidad abdominal en particular, pues se sabe que la T inhibe la actividad de la lipasa lipoproteica,12,14 lo que provoca disminución de la lipogénesis, incremento de la lipolisis de los depósitos de grasa visceral y disminución de la entrada de triglicéridos en los adipositos.17 La T, además, regula la composición corporal, promueve la formación de masa muscular y disminuye la de masa grasa.18 De esta forma, los niveles bajos de T podrían predisponer a la obesidad visceral y provocar una alteración del metabolismo de los ácidos grasos, lo cual, a su vez, promovería la RI.19
Adicionalmente, se reporta que en la interacción entre los bajos niveles de T y la adiposidad visceral, median factores proinflamatorios producidos por el tejido graso visceral, como las citoquinas, las adipoquinas, las interleuquinas, y el factor de necrosis tumoral TNF-alfa, entre otros.20 Estos elementos proinflamatorios propician vías metabólicas que causan un aumento de los ácidos grasos, lo cual incide en el deterioro de la SI.21
Basados en estos antecedentes de la literatura, se propone determinar la relación entre los niveles de T y la SI, la adiposidad, y los parámetros del metabolismo lipídico en hombres con un amplio espectro de TG, que incluye sujetos con tolerancia a la glucosa normal (TGN) y con trastornos de la tolerancia a la glucosa (TTG): tolerancia a la glucosa alterada (TGA) y pacientes con DM 2 de reciente diagnóstico.
MÉTODOS
Se realizó un estudio transversal y descriptivo. Participaron 225 hombres con edades comprendidas entre 35 y 60 años. De ellos, 136 con tolerancia normal a los carbohidratos, supuestamente sanos, sin antecedentes de diabetes en familiares de primer grado, y que no hubieran recibido tratamiento con esteroides o anabólicos; y 89 pacientes con TTG, TGA o DM 2 (con menos de 1 año de evolución, que no hubieran recibido tratamiento con insulina o fármacos orales para el tratamiento de la DM 2, que no presentaran otra enfermedad crónica, y que no hubieran recibido tratamiento con esteroides o anabólicos). Los sujetos aparentemente sanos con TGN se reclutaron en el Banco de Sangre del municipio Plaza, y los sujetos del segundo grupo se reclutaron entre los pacientes que asisten a la consulta externa del Centro de Atención al Diabético (CAD) para su seguimiento, por haber sido diagnosticados anteriormente como pacientes con TGA o con DM 2, según los criterios propuestos por la OMS,22 y de los sujetos que se diagnosticaron durante la realización de este proyecto, en la consulta de clasificación del CAD, como pacientes con DM 2 o con TGA.
A los participantes en el estudio se les determinaron los niveles en ayuna de glucemia, insulina, T, colesterol (col), triglicéridos (tg) y a la mayoría de ellos (n= 215) HDL-colesterol (HDL-c). Se les medió la tensión arterial (TA), y se les realizaron las mediciones de talla, peso, circunferencia de la cintura (Cci) y circunferencia de la cadera (Cca). Se recogió la edad.
A cada sujeto se le tomó una muestra de sangre en ayuna para las determinaciones plasmáticas de insulina y T, y séricas de glicemia, col, tg y HDL-c. El suero y el plasma obtenidos fueron transferidos a tubos rotulados adecuadamente, que se almacenaron a -50 °C en alícuotas hasta la realización del ensayo.
La insulina se determinó por un método de radioinmunoensayo RIA (IZOTOP: Institute of ISOTOPES. Ltd. Budapest), con una sensibilidad de 5 µU/mL y un rango de normalidad de 5-35 µU/mL, con un coeficiente de variación inter e intraensayo de 6,2 y 7,1 % respectivamente.
La T total se determinó por un kit de radioinmunoensayo RIA (IZOTOP: Institute of ISOTOPES. Ltd. Budapest), con una sensibilidad de 0,086 nmol/L, un rango de valores normales para hombres de 10,4-41,6 nmol/L, y un coeficiente de variación inter e intraensayo de 15 y 14,8 % respectivamente.
La glucemia se determinó por el método de la glucosa oxidasa,23 y el col por un método enzimático col oxidasa-peroxidasa.24 En la determinación de tg se utilizó un método enzimático,25 y el HDL-c se determinó por precipitación con fosfotungtato.26 Los valores de LDL-colesterol (LDL-c) se hallaron a partir de las cifras de col total, el HDL-c y lipoproteínas de muy baja densidad (VLDL), según la fórmula siguiente: LDL-c= col total-VLDL-HDL-c.
Se consideró presencia de TGA cuando la glicemia ayuna fue menor de 7,0 mmol/L y la glicemia a las 2 h fue mayor o igual a 7,8 mmol/L y menor de 11,1 mmol/L; y DM 2, cuando la glicemia ayunas fue mayor o igual a 7,0 mmol/L, y a las 2 h mayor o igual a 11,1 mmol/L.22
Se consideró presencia de hipertrigliceridemia cuando los tg alcanzaron cifras mayores a 1,7 nmol/L, HDL-c bajo cuando fue menor de 1,0 nmol/L, obesidad abdominal cuando la Cci fue mayor a 102 cm,27 sobrepeso cuando el IMC fue mayor o igual a 25 y menor de 30, y obesidad general cuando el IMC fue mayor de 30. Se consideró hipertensión arterial (HTA), con niveles de TA sistólica mayores de 130 mmHg y de TA diastólica mayores de 85 mmHg.28
Para la evaluación de la RI se calcularon los índices siguientes:29 insulinemia en ayunas (I0) (uU/L), valor de corte 9,44 uU/L, valores normales 5-35 uU/mL; e índice de RI calculado a partir de los valores iniciales de glucosa e insulina siguiendo el modelo homeostático (HOMA-IR), de acuerdo con la fórmula RI= (insulinemia ayuna [μU/mL] x glucemia ayuna [mmol/L]/22,5); punto de corte 2,6.30 Se consideró RI cuando el índice HOMA-IR fue mayor de 2,6.30
Para la evaluación de la SI se calcularon los índices siguientes: quantitative insulin sensitivity check index, índice cuantitativo de SI (QUICKI). Se calcula: QUICKI= 1/(log insulinemia en ayunas [μU/mL] + log glucemia [mg/dL]). Valor Normal: 0,338-0,403. Valor de corte 0,37,29 y Belfiore0: (2/[insulinemia en ayunas/in insulinemia en ayunas) × (glicemia en ayunas/in glicemia en ayunas]) – 1. Valor normal: 0,87-1,83. Valor de corte 0,87.31 La presencia de SM se definió según los criterios de ATPIII-2001.32
Se determinaron media y desviación estándar de las variables cuantitativas y distribuciones de frecuencia de las variables cualitativas. Se evaluó la asociación entre las variables cuantitativas: T, IMC, Cci, Cca, índice cintura/cadera (ICC), con los índices de SI utilizando los coeficientes de correlación de Pearson y de Spearman. Se realizaron tabulaciones cruzadas de estas variables categorizadas (en normal y patológica), utilizando la prueba chi cuadrado para evaluar la significación estadística de la posible asociación.
Los valores promedio de las variables cuantitativas entre subgrupos conformados según T (categorizada en normal y patológica), y según presencia (o no) de componentes del SM, fueron comparados utilizando la prueba t de Student para muestras independientes. En todos los casos se consideró un nivel de significación estadística de 0,05. Se realizó un análisis de regresión logística para estudiar el efecto de las variables de adiposidad (obesidad abdominal e IMC), del metabolismo lipídico (tg, col, HDL-c) y la gravedad de la tolerancia en el riesgo de tener valores bajos de T.
RESULTADOS
En la tabla 1 se muestran las características clínicas, antropométricas, bioquímicas y hormonales de la muestra total del estudio y estratificada según el nivel de T. De la población estudiada, el 60 % tenía TGN (n= 136) y el 40 % tenía TGA o DM 2 (n= 89). El IMC varió en el rango de 18,8 a 39,71 Kg/m2. Los niveles de T abarcaron un amplio rango entre 1,49 y 35,00 nmol/L. El 45,5 % de la población del estudio tuvo cifras de T entre 8,4 y 15,0 nmol/L. El nivel de T fue menor en los sujetos con trastornos de la tolerancia: TGA o DM 2, que en los sujetos con TGN (12,35 ± 6,32 vs. 14,24 ± 6,07 nmol/L; p< 0,05).
La muestra objeto de estudio se estratificó en 2 subgrupos atendiendo a los niveles de T (tabla 1). Se utilizó un valor de corte para la T de 8,4 nmol/L, determinado anteriormente33 en una submuestra del grupo de sujetos sin TGA que no tuvieran ninguno de los trastornos metabólicos explorados en el estudio (trastornos de la tolerancia, hipercolesterolemia, hipertrigliceridemia, HDL-c bajo, RI, HTA).
Los sujetos con niveles de T inferiores a 8,4 nmol/L tuvieron valores más altos de todos los parámetros metabólicos estudiados, y esta diferencia alcanzó significación estadística para la circunferencia abdominal, la Cca, el ICC y el IMC, con respecto a los sujetos con niveles de T iguales o superiores a 8,4 nmol/L.
Se examinó la relación de la concentración de T con la presencia de desórdenes asociados al SM (tabla 2). Los niveles de T fueron significativamente menores en los sujetos con TGA y DM 2, con obesidad abdominal (Cci> 102 cm), y con hipertrigliceridemia (tg> 1,7 nmol/L). La diferencia para los grupos con y sin SM tuvo una significación marginal de p= 0,052.
El análisis de correlación entre los niveles de T y la SI y la RI mostró una asociación directa entre los niveles de T y la SI, expresada a través de los índices Belfioreo y QUICKI (coeficientes de correlación de Pearson= 0,156, p< 0,05 y 0,141, p< 0,05, respectivamente), e inversa con la RI expresada a través de los índices HOMA-IR y de insulina en ayunas (I0) (coeficientes de correlación de Pearson= - 0,149, p< 0,05 y -0,173, p< 0,01, respectivamente).
Se exploró la relación entre la T y los parámetros de adiposidad (IMC, Cci, Cca, ICC) y del metabolismo lipídico (col, tg, HDL-c, LDL-col) mediante un análisis de correlación. Se encontró una relación inversa estadísticamente significativa entre la T y el IMC: coeficiente de correlación (CC= -0,275; p< 0,01), la circunferencia abdominal (CC= -0,259; p< 0,001), la circunferencia de cadera (CC= -0,231; p< 0,001) y el ICC (CC= -0,177; p< 0,001). La T mantuvo una débil relación inversa con los niveles de col, tg, HDL-c, y directa con el LDL-c; sin embargo, estas asociaciones no alcanzaron significación estadística (CC= -0,051, -0,128, -0,055 y 0,050 respectivamente).
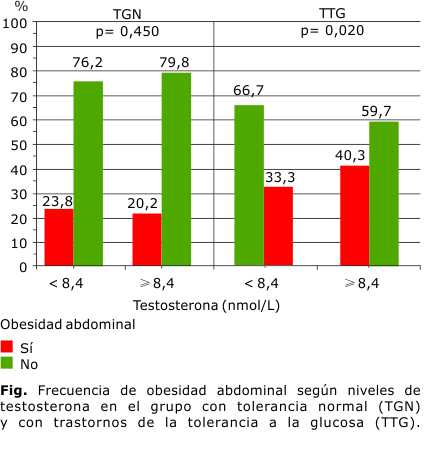
Teniendo en cuenta la asociación encontrada anteriormente entre los niveles de T con la SI y la RI, y de la T con los parámetros de adiposidad, se exploró la frecuencia de obesidad abdominal en la muestra estratificada, según los niveles de T en la población total (tabla 3) y en la población subdividida según la gravedad de la tolerancia a la glucosa (Fig.).
En el análisis de la población total se encontró un aumento significativo de la frecuencia de obesidad abdominal en el grupo de sujetos con valores bajos de T (< 8,4 nmol/L), con respecto al grupo con valores normales (≥ 8,4 nmol/L) (47,9 % vs. 27,3 %; p< 0,01). En el grupo de sujetos con TNG, la frecuencia de obesidad abdominal fue similar en el grupo de sujetos con niveles bajos de T y en el grupo con niveles normales de esta hormona (23,8 % vs. 20,2 %; p> 0,05), mientras que en la población con trastornos de la tolerancia (TGA y DM 2), la frecuencia de obesidad abdominal fue significativamente mayor en los sujetos con niveles bajos de T, que en los sujetos con niveles normales de T (66,7 % vs. 40,3 %; p< 0,05) (Fig.). Se utilizó la prueba de chi cuadrado, y se consideró nivel de significación para p< 0,05.
Finalmente se realizó un análisis de regresión logística para estudiar el efecto de las variables de adiposidad (obesidad abdominal e IMC), del metabolismo lipídico (tg, col, HDL-c) y la gravedad de la tolerancia en el riesgo de tener valores bajos de T. Para este análisis se consideró a la T categorizada como variable dependiente, y al resto como variables independientes. Dentro de ellas se incluyó la edad como variable cuantitativa, y la gravedad de la tolerancia (TGN y TTG), el IMC, el col, HDL-c, los tg y la obesidad abdominal como variables cualitativas (categorizadas). Se encontró que la presencia de obesidad abdominal incrementa el riesgo de tener niveles bajos de T (menores de 8,4 mmol/L) en 2,2 veces, controlando al resto de las variables (exponencial de B= 2,10; p= 0,070).
DISCUSIÓN
Este estudio tuvo como particularidad la inclusión de sujetos con un amplio espectro de la TG. Se encontró que la población con TGA o DM 2 presentó valores menores de T, que la población con TGN (12,35 ± 6,32 vs. 14,24 ± 6,07 nmol/L; p< 0,05), en coincidencia con resultados de otros autores, que han reportado niveles séricos de T significativamente inferiores en pacientes con DM 2 con respecto a sujetos sanos.12,16 Los pacientes con TTG (TGA y DM 2) escogidos para el estudio tenían menos de 1 año de evolución, lo cual sugiere que la disminución en los niveles de T cursa con el inicio de los trastornos de la tolerancia. En concordancia con esto, Ding y otros plantean que los hombres con niveles normales bajos de T (niveles inferiores al 25 percentil del rango normal para la T), tienen un incremento en el de riesgo de desarrollar DM 2.16
Para la evaluación de los vínculos entre la T, la SI y la RI se utilizaron índices de sensibilidad y de resistencia. Los resultados encontrados demostraron una correlación positiva entre la T y la SI, y negativa con la RI en la población total estudiada, lo cual coincide con lo encontrado por otros autores.8
Los valores de T fueron sistemáticamente menores en presencia de casi todos los desórdenes asociados al SM (HTA, obesidad abdominal, hipertrigliceridemia, RI, TGA o DM 2), a excepción del HDL-c bajo, y esta diferencia cobró significación estadística en presencia de la obesidad abdominal, la hipertrigliceridemia y los TTG, con respecto a los grupos sin estos trastornos. Estos resultados se corresponden con los reportes de algunos estudios epidemiológicos, en los que se ha constatado una alta prevalencia de niveles bajos de T en hombres con SM,16,34 y sugieren la realización de un estudio metabólico a los pacientes hipogonádicos desde el momento del diagnóstico.
En este estudio la presencia de HDL-c bajo fue el único trastorno metabólico explorado que no se asoció a una disminución de los niveles de T. El efecto de la T sobre el HDL-c es complejo, y está mediado por mecanismos dependientes e independientes del receptor de andrógenos.20 Los datos actuales acerca de esta relación son controversiales. En estudios transversales con hombres sanos y con DM 2 se ha reportado una relación positiva.35,36 Un metanálisis para evaluar el efecto de la terapia de reemplazo mostró que la T no tiene efectos importantes sobre los niveles de HDL-c,37 mientras que algunos autores plantean que la T facilita el transporte reverso del col.38
La asociación inversa encontrada entre la T y los parámetros de adiposidad estudiados, está en concordancia con lo reportado en la literatura.21,39 Se ha reportado que la deprivación androgénica produce un aumento de la adiposidad y la RI,40 mientras que, de manera general, la terapia de reemplazo con T disminuye la adiposidad y mejora la SI en pacientes con DM 2.41,42 O sea, existe una relación bidireccional y reversible entre la deficiencia de andrógenos y la adiposidad, y entre la deficiencia de andrógenos y la RI.
La asociación entre el hipogonadismo y la obesidad abdominal claramente manifiesta en la población con TGA o DM 2, y no en la población con TGN, es el principal hallazgo de este estudio. Este resultado plantea la interrogante sobre el significado patogénico de la diferencia de este vínculo entre los bajos niveles circulantes de T, y el aumento de los valores de la Cci entre los sujetos con y sin TTG. El diseño del presente estudio no permite responder esta interrogante, pero sugiere considerar que esta asociación encontrada entre los niveles de T circulante, con la Cci, podría ser el factor patogénico fundamental que vincula al hipogonadismo, la adiposidad abdominal y los TTG, posiblemente por medio de los trastornos de la SI.
En este estudio se encontró, además, que la frecuencia de individuos con niveles bajos de la hormona y obesidad abdominal, casi duplicaba a aquellos con valores normales de T, con diferencia estadísticamente significativa, lo que corresponde con lo anteriormente discutido. Además, mediante el análisis de regresión logística se puso de manifiesto la relación entre la obesidad abdominal y los niveles bajos de T, que se manifiesta en el aumento de riesgo de tener niveles bajos de T en presencia de obesidad abdominal, cuando se controlan las variables que pudieran incidir en esta interrelación: edad, IMC, gravedad de la tolerancia a la glucosa, los niveles de col, los tg y de HDL-c.
La obesidad, particularmente el fenotipo abdominal, un precursor del SM, enfermedad cardiovascular y DM 2, se ha convertido en uno de los problemas de salud pública más significativo en el mundo. En presencia de la obesidad abdominal los niveles de T en sangre y su ritmo de producción se encuentran disminuidos, y la actividad del eje hipotálamo-hipófiso-adrenal se encuentra elevada.43-45
Es conocido que los individuos con obesidad abdominal tienen mayor resistencia al efecto antilipolítico de la insulina, lo que incrementa la liberación de ácidos grasos libres al hígado. En trabajos realizados se ha demostrado que la grasa visceral se correlaciona positivamente solo con el aumento de la gluconeogénesis, pero no de la glucogenolisis. Esta observación se corresponde con el concepto de que el aumento en la liberación de ácidos grasos libres al hígado por el tejido graso hipertrofiado, aumenta la gluconeogénesis, y causa resistencia a la insulina hepática.46,47
Adicionalmente existen evidencias que sugieren una asociación entre los niveles séricos de T y la función mitocondrial. De manera que la deficiencia de T contribuye directamente a la ineficiente utilización de energía en sujetos con aumento de la RI.8,48
Se ha reportado que en ratones castrados el tratamiento con T restaura la fosforilación oxidativa y la vía de la ubiquinona.49 Algunos autores consideran que la regulación que ejerce la T sobre la función mitocondrial y la eficiencia del metabolismo energético, podría proteger del desbalance energético celular, que a la larga, propicia una elevación crónica de la glucosa y una acumulación de lípidos que podría mediar la RI.20
En conclusión, los resultados de la presente investigación permiten afirmar que existe, en la población estudiada, una asociación directa entre los valores de T y la SI, e inversa con la adiposidad, y que la disminución de los niveles de T encontrados en presencia de los desórdenes asociados al SM, en conjunto con la relación inversa entre la T y la RI, que es un factor de riesgo común para las enfermedades cardiovasculares, la DM 2 y el SM, justifican la indicación de una evaluación metabólica temprana a los pacientes con hipogonadismo.
El vínculo entre la T con la DM 2 y el SM está modulado por los trastornos de la secreción de insulina, factor que no se ha tratado en este estudio, y que constituye una limitación de este.
REFERENCIAS BIBLIOGRÁFICAS
1. Corona G, Forti G, Maggi M. Why can patients with erectile dysfunction be considered lucky? The association with testosterone deficiency and metabolic syndrome. Aging Male. 2008;11(4):193-9.
2. Jones TH. Clinical physiology of testosterone. Testosterone deficiency in men. New York: Oxford University Press Inc.; 2008. p. 9-21.
3. Álvarez A, Díaz E, Huguez B, González RM. Glucemia, insulinemia y secreción de insulina en ratas hipoandrogenizadas e hiperandrogénicas. Rev Cubana Endocrinol. 1999;10(2):133-9.
4. Álvarez A, Díaz E, Castells EM, Huguez B, González RM. Glucemia, insulinemia y secreción de insulina en ratas prepúberes hiperandrogenizadas e hiperestrogenizadas. Rev Cubana Endocrinol. 2001;12(1):15-21.
5. McInnes KJ, Smith LB, Hunger NI, Saunders PT, Andrew R, Walker BR. Deletion on the androgen receptor in adipose tissue in male mice elevates retinol binding protein 4 and reveals independent effects on visceral fat mass and on glucose homeostasis. Diabetes. 2012;61(5):1072-81.
6. Tsai EC, Matsumoto AM, Fujimoto WY, Boyko EJ. Association of bioavailable, free, and total testosterone with insulin resistance, influence of sex hormone-binding globulin and body fat. Diabetes Care. 2004;27:861-8.
7. Kupelian V, Hayes FJ, Link CL, Rosen R, McKinlay JB. Inverse Association of Testosterone and the Metabolic Syndrome in Men is Consistent across Race and Ethnic Groups. Journal of Clinical Endocrinology & Metabolism. 2008;93:3403-10.
8. Pitteloud N, Hardin M, Dwyer AA, Hardin M, Lee H, Eriksson KF, et al. Increasing insulin resistance is associated with a decrease in Leyding cell testosterone secretion in men. J Clin Endocrinol Metab. 2005;90:2636-41.
9. Madalena CH, Stella V, Petroni A, Aloisi AM. Impact of testosterone on body fat composition. Review article. J Cell Physiol. 2012;227(2):3744-8.
10. Corona G, Monami M, Rastrelli G, Aversa A, Sforza A, Lenzi A, et al. Type 2 diabetes mellitus and testosterone: a meta-analysis study. Int J Androl. 2011;34:528-40.
11. Jones TH, Arver S, Behre HM, Buvat J, Meuleman E, Moncada I, et al. Testosterone replacement in hypogonadal men with type 2 diabetes and/or metabolic syndrome (the TIMES 2 study). Diabetes Care. 2011;34:828-37.
12. Saad F, Gooren L. The role of testosterone in the metabolic syndrome: a review. J Steroid Biochem Mol Biol. 2009;114(1-2):40-3.
13. Laaksonen DE, Niskanen L, Punnonen K, Nyysonen K, Tuomanen TP, Valkonen VP, et al. Testosterone and sex hormone-binding globulin predict the metabolic syndrome and diabetes in middle-aged men. Diabetes Care. 2004;27:1036-41.
14. Khaw KT, Chir MBB, Dowsett M, Folkerd E, Binghan SH, Wareham N, et al. Endogenous Testosterone and Mortality Due to All Causes, Cardiovascular Disease, and Cancer in Men. American Heart Association. 2007;116:2694-701.
15. Singh SK, Goyal R, Pratyush DD. Is hypoandrogenemia a component of metabolic syndrome in males? Exp Clin Endocrinol Diabetes. 2011;119:30-5.
16. Ding ER, Song Y, Malik V, Liu S. Sex differences of endogenous sex hormones and risk of type 2 diabetes. JAMA. 2006;295:1288-99.
17. Singh AB, Hsia S, Alaupovic P. The effects of varying doses of T on insulin sensitivity, plasma lipids, apolipoproteins, and C-reactive protein in healthy young men. J Clin Endocrinol Metab. 2002;87:136-43.
18. Singh R, Artaza JN, Taylor WE, González-Cadavid NT, Bhasin S. Androgens stimulate myogenic differentiation and inhibit adipogenesis in C3H 10T1/2 pluripotent cells through an androgen receptor-mediated patway. Endocrinology. 2003;144:5081-8.
19. Álvarez A, González RM, Marrero MA. Papel de la testosterona y el cortisol en el síndrome metabólico y la diabetes tipo 2. Rev Cubana Endocrinol. 2010;21(1):80-90.
20. Rao PT, Kelly DM, Jones TH. Testosterone and insulin resistance in metabolic syndrome and T2DM in men. Nature Reviews Endocrinology. 2013;9:479-93.
21. Wang CH, Jackson G, Jones TH, Matsumoto AM, Nehra A, Perelman MA, et al. Low testosterone associated with obesity and the metabolic syndrome contributes to sexual dysfunction and cardiovascular disease risk in men with type 2 diabetes. Diabetes Care. 2011;34(7):1669-75.
22. WHO. Diabetes Mellitus and its complications. Report of a WHO consultation. Part 1: Diagnosis and classification of the Diabetes Mellitus. World Health Organization Department of Non-communicable Disease Surveillance. Geneva; 1999.
23. Barham D, Trinder P. Glucosa GOD-PAP. Analyst. 1972;97:142-5.
24. Schettler G, Nüssel E. Cholesterol CHOP-PAP. Arb Med Loz Med Präv Med. 1975;10:25.
25. Schettler G, Nüssel E. Triglycerides liquicolor GPO-PAP. Arb Med Loz Med Präv Med. 1975;10:35.
26. Lópes-Virella M, Stone MF, Ellis S. Cholesterol determinations in HDL separated by three different methods. Clin Chem. 1977;23:882-5.
27. Díaz Sánchez ME. Manual de Antropometría para el Trabajo de Nutrición. La Habana: Instituto de Nutrición e Higiene de los Alimentos; 1992. p. 13-4.
28. IDF. Clinical Guidelines Task Force. Global Guidelines for type 2 Diabetes: recommendations for standard, comprehensive, minimal care. Diabetic Medicine. 2006;23:579-93.
29. Matthews DR, Husker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. Homeostasis model assessment: insulin resistance and Beta cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia. 1985;28:412-9.
30. Arranz C, Rodríguez B, Álvarez Á, Reyes A, de Dios R, González R. Valores de referencia para el índice de resistencia a la insulina del modelo homeostático (RIHOMA) estimado a partir de los resultados de una muestra mixta hospitalaria. Revista de la Asociación Latinoamericana de Diabetes. 2007;XV:121.
31. Belfiore F, Iannello S, Volpicelli G. Insulin sensitivity indices calculated from basal and OGTT-induced insulin, glucose, and FFA levels. Mol Genet Metab. 1998;63:134-41.
32. Executive Summary of the Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). JAMA. 2001;285:2486-97.
33. Álvarez A, Arranz C, Marrero MA, González RM, Perich P, Chapé A, et al. Valores de referencia para el Cortisol, Testosterona y del índice Cortisol/Testosterona en sujetos con tolerancia a la glucosa normal. Revista de la Asociación Latinoamericana de Diabetes. 2007;XV(3):120.
34. Kapoor D, Aldrech H, Clark S, Channer KS, Jones TH. Clinical and biochemical assessment of hypogonadism in men with type 2 diabetes: correlations with bioavaible testosterone and visceral adiposity. Diabetes Care. 2007;30:911-7.
35. Van Pottelberg I, Braeckman L, De Bacquer D, De Bacquer G, Kaufman JM. Differential contribution of testosterone and estradiol determination of cholesterol and lipoprotein profile in healthy middle-aged men. Atherosclerosis. 2003;166:95-102.
36. Stanworth RD, Kapoor D, Channer KS, Jones TH. Dyslipidaemia is associated with testosterone, oestradiol and androgen receptor CAG repeat polymorphism in men with type 2 diabetes. Clin Endocrinol. 2011;74:624-30.
37. Isidori AM, Giannetta E, Greco EA, Gianfrilli D, Bonifacio V, Isidori A, et al. Effects of testosterone on body composition, bone metabolism and serum profile in middle-aged men: a meta-analysis. Clin Endocrinol. 2005;63:280-93.
38. Langer C, Gansz B, Goepfert C, Engel T, Uehara Y, Jansin H, et al. Testosterone up-regulates scavenger receptor BI and stimulates cholesterol efflux from macrophages. Biochem Biophys Res Commun. 2002;296:1051-7.
39. Hofstra J, Loves S, van Wageningen B, Ruinemans-Koerts J, Janssen I, de Boer H. High prevalence of hypogonadotropic hypogonadism in men refered for obesity treatment. Neth J Med. 2008;66:103-9.
40. Smith MR, Lee H, Natham DM. Insulin sensitivity during combined androgen blockade for prostate cancer. J Clin Endocrinol Metab. 2006;9:1305-8.
41. Kapoor D, Goodwin E, Channer E, Jones TH. Testosterone replacement therapy improves insulin resistance, glycaemic control, visceral adiposity and hypercholesterolaemia in hypogonadal men with type 2 diabetes. Eur J Endocrinol. 2006;154:899-906.
42. Corona G, Monami M, Rastrelli G, Aversa A, Tishova Y, Saad F, et al. Testosterone and metabolic syndrome: a meta-analysis study. J Sex Med. 2011;8:272-83.
43. Rosmond R. Role of stress in the pathogenesis of the metabolic syndrome. Psychoneuroendocrinology. 2005;30:1-10.
44. Pasquali R. Obesity and androgens: facts and perspectives. Fertil Steril. 2006;85:1310-40.
45. Pasquali R, Vicennati V, Gambineri A, Pagotto U. Sex-dependent role of glucocorticoids and androgens in the pathophysiology of human obesity. International Journal of Obesity. 2008;32:1764-79.
46. Gastaldelli A, Cusi K, Pettiti M, Hardies J, Miyazaki Y, Berria R, et al. Relationship between hepatic/visceral fat and hepatic insulin resistance in nondiabetic and type 2 diabetic subjects. Gastroenterology. 2007;133:496-506.
47. Miyazaki Y, DeFronzo RA. Visceral fat dominant distribution in male type 2 diabetic patients is closely related to hepatic insulin resistance, irrespective of body type. Cardiovascular Diabetology. 2009;8:44.
48. Yialamas MA, Dwyer AA, Hanley E. Acute sex steroid withdrawal reduces insulin sensitivity in healthy men with idiopathic hypogonadotropic hypogonadism. J Clin Endocrinolol Metab. 2007;92:4254-9.
49. Ibebunjo C, Eash JK, Li C, Ma Q, Glass DJ. Voluntary running, skeletal muscle gene expression, and signalling inversely regulated by orchidectomy and testosterone replacement. Am J Physiol Endocrinol Metab. 2011;300:E327-E340.
Recibido: 11 de noviembre de 2014.
Aprobado: 5 de febrero de 2015.
Aimée Álvarez Álvarez. Instituto Nacional de Endocrinología (INEN). Calle Zapata y D, Vedado, municipio Plaza de la Revolución. La Habana, Cuba. Correo electrónico: aimee@inend.sld.cu