Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol vol.28 no.3 Ciudad de la Habana set.-dic. 2017
REVISIÓN BIBLIOGRÁFICA
Fragmentación del ADN espermático e infertilidad masculina
Fragmentation of sperm DNA and male infertility
Bertha Victoria Rodríguez Pendás
Instituto Nacional de Endocrinología. La Habana, Cuba.
RESUMEN
La integridad del ADN de los espermatozoides, es un indicador importante de la fertilidad, se utiliza como una variable adicional para evaluar, junto al espermograma, la calidad de una muestra seminal. En el presente trabajo se describen algunos aspectos de interés relacionados con la fragmentación del ADN espermático, cuya etiología es multifactorial y está relacionada con factores intrínsicos, como el empaquetamiento anormal de la cromatina durante la espermiogénesis, la apoptosis defectuosa antes de la eyaculación y la producción excesiva de especies reactivas del oxígeno; y con factores extrínsecos, como son los cambios en los hábitos de vida, la exposición a agentes tóxicos, así como la edad avanzada. La fragmentación está asociada al deterioro de las variables seminales, además afecta la fertilidad natural y la realizada por tratamientos de reproducción asistida, por lo que la implementación en los laboratorios de Andrología, de la tecnología para detectar si el ADN de los espermatozoides está íntegro o fragmentado, incorpora un nuevo conocimiento en el estudio de los hombres con trastornos de fertilidad, lo que contribuye a mejorar el diagnóstico y pronóstico de la infertilidad masculina. Para realizar este trabajo se revisaron 122 artículos, de los cuales 84 cumplieron con los criterios de calidad esperados. La búsqueda se realizó a través de los buscadores habituales.
Palabras clave: fragmentación del ADN espermático; calidad espermática; infertilidad; espermatozoide; factor masculino.
ABSTRACT
Sperm DNA´s integrity is an important indicator of fertility and it is used as an additional variable to evaluate the quality of a seminal sample, together with the spermogram. This paper describes some interesting aspects related to the fragmentation of sperm DNA, whose etiology is multifactorial and is related to intrinsic factors, such as the abnormal packing of chromatin during spermiogenesis, defective apoptosis before ejaculation, and the excessive production of oxygen´s reactive species; and with extrinsic factors, such as changes in life habits, exposure to toxic agents, as well as aging. Fragmentation is associated with the deterioration of seminal variables, it also affects natural fertility and that produced by assisted reproduction treatments, so the implementation in the andrology laboratories of the technology to detect if the DNA of the sperm is intact or fragmented incorporates a new knowledge in the study of men with fertility disorders, which contributes to improve the diagnosis and prognosis of male infertility. To carry out this work, 122 articles were reviewed, of which 84 met the expected quality criteria. The search was made through the usual search engines.
Keywords: sperm DNA´s fragmentation; sperm quality; infertility; spermatozoon; male factor.
INTRODUCCIÓN
La infertilidad, que continúa en aumento, afecta del 15 al 20 % de las parejas en edad reproductiva, y está demostrado que el factor masculino puede estar involucrado en la mitad de los casos.1 El análisis del semen es el examen de laboratorio más importante en el estudio del varón infértil, para lo cual la OMS establece una serie de variables que se analizan como proceder de rutina, en un laboratorio básico de Andrología.2 Este análisis, conocido como espermograma, se utiliza para el diagnóstico de la infertilidad masculina, y aunque ofrece información esencial sobre las variables básicas del semen, no detecta alteraciones funcionales del espermatozoide, por lo que no tiene valor predictivo absoluto de fertilidad,3 de aquí que alrededor del 15 % de los hombres infértiles presentan variables de calidad del semen dentro de los valores normales.4
Este hecho indica que pueden existir otros factores que inciden en los problemas de infertilidad, y que no son detectados por el espermograma,5 entre estos, además de los defectos en la membrana del espermatozoide, factores medioambientales, genéticos y tóxicos, también se menciona la fragmentación del ácido desoxirribonucleico (ADN) espermático.6
Durante los últimos años se han realizado numerosas investigaciones en el área molecular, incorporando nuevos procedimientos que puedan aportar al diagnóstico del factor masculino.7 Dentro de estos, el estudio de la integridad nuclear del ADN del espermatozoide toma especial relevancia en la evaluación de la capacidad funcional de los espermatozoides, por el papel que se le otorga al ADN en el momento de producir la descendencia.8
La infertilidad masculina, continúa siendo una patología problemática,9 por lo que la posibilidad de introducir en la Andrología, ensayos que aporten al diagnóstico y pronóstico de los varones con problemas reproductivos, ayudaría a resolver algunas interrogantes que todavía aparecen en el estudio de las parejas que consultan por infertilidad.10
El propósito de este trabajo de revisión, es describir algunos aspectos de interés, relacionados con la alteración en la integridad del ADN espermático, su asociación con la calidad seminal y la infertilidad masculina, además resaltar la necesidad de incluir este marcador, en complementación con el análisis de las variables del semen, en el estudio del factor masculino.
La búsqueda de la información se realizó a través de algunas bases de datos y de los buscadores PubMed y Google, utilizando la combinación de los descriptores fragmentación de ADN espermático, calidad espermática e infertilidad masculina. Se revisaron 122 artículos y se seleccionaron 84, teniendo en cuenta la asociación entre los descriptores mencionados y el aporte de cada uno, dentro de cada temática descrita en este trabajo, en el período de marzo a julio de 2016.
DESARROLLO
ADN espermático
La transferencia de la molécula de ADN íntegra e intacta desde el espermatozoide al óvulo, es esencial para conseguir la gestación de un individuo normal.11 Cuando ocurren interrupciones en las cadenas simples o dobles del ADN, que alteran la transmisión, conservación o expresión de la información genética, se produce la fragmentación, y en dependencia del tipo de daño y la capacidad reparadora del ovocito, así será la probabilidad de que se produzca un embarazo a término.12
Esta interacción entre daño producido y capacidad reparadora del ovocito, explica las diferentes correlaciones informadas sobre el tipo de daño detectado y la capacidad de fertilización, ya que sujetos con el mismo valor de fragmentación pueden tener diferente pronóstico de fertilidad, en dependencia de la eficacia de los procesos de reparación.13 Además, el hecho de que los espermatozoides presenten poco daño en el ADN, posibilita éxitos en la fertilización, por lo que se sugiere que el valor de fragmentación puede ser predictivo de concepción.10
En cualquier etapa del proceso de espermatogénesis se puede producir un daño en el ADN espermático.14 En los mecanismos por los cuales se produce pueden intervenir varios factores, y pueden estar relacionados con el empaquetamiento anormal de la cromatina durante la espermiogénesis, la apoptosis defectuosa antes de la eyaculación, así como la producción excesiva de especies reactivas de oxígeno.15
Además de esos factores, existen otros, como los hábitos de vida, los factores medioambientales y genéticos, los procesos patológicos, las especies reactivas del oxígeno (ERO), etc., que también se relacionan con la alteración de la integridad del ADN, 16,17 y se representan en la figura.
En el estudio del varón infértil, deben controlarse estos factores de riesgo, por ser el daño postesticular la principal causa de fragmentación y declinación de la capacidad fértil del varón.13 Al respecto algunos estudios informan que los espermatozoides eyaculados presentan una alteración del ADN significativamente mayor que los espermatozoides testiculares, sugiriendo que en aquellos hombres, con un elevado índice de fragmentación en el ADN espermático e involucrados en técnicas de reproducción asistida (TRA), el proceder se realice seleccionando los espermatozoides testiculares, lo cual puede aumentar las tasas de embarazo.18,19 Además, la afectación de todos los factores sobre la estabilidad del ADN espermático, no solo es importante en el estudio de parejas infértiles con factor masculino alterado, sino también en la infertilidad masculina idiopática,20 en pacientes con fallos repetidos en TRA,21 en abortos a repetición22 y en pacientes de edad avanzada que se consultan por infertilidad.23
Relación de algunos factores con la fragmentación del ADN de los espermatozoides
La literatura destaca con mayor influencia el tabaquismo, la edad paterna avanzada, las sustancias químicas tóxicas para el organismo y los procesos patológicos e infecciosos, entre otros.
Con relación al tabaquismo se informa un marcado efecto en detrimento de la integridad del ADN de los espermatozoides, lo cual está directamente correlacionado con la cantidad de cigarrillos al día y la duración del acto.24 Un estudio realizado, para evaluar el efecto del tabaquismo en la función espermática, comparando hombres no fumadores y sujetos fumadores normozoospérmicos, demostró un alto porcentaje de ADN espermático fragmentado en estos últimos comparado con el grupo control, resultado que estuvo asociado a un estado inflamatorio de las glándulas accesorias, lo que provoca alteración en la calidad de la función espermática, caracterizada por decrecimiento de la integridad del acrosoma y la actividad mitocondrial, que incrementa la fragmentación del ADN nuclear.25 Aunque gran parte de las investigaciones realizadas a este efecto, evidencian la afectación del tabaquismo en la integridad del ADN espermático, no tratan con profundidad los posibles mecanismos a través de los cuales se producen las alteraciones genéticas y epigenéticas en la función reproductiva masculina, y se recomienda por algunos autores, analizar estos tópicos con más detalles en investigaciones futuras.26
Otros estudios, indican el aumento de daño en el ADN nuclear de los espermatozoides en relación con el aumento de la edad paterna. Al respecto se ha encontrado en sujetos que se consultan por infertilidad, un porcentaje de fragmentación mayor, en aquellos hombres con edades por encima de 40 años, comparados con los de menor edad, lo cual podría explicar la reducción de la fertilidad en los sujetos mayores, sometidos a tratamientos por infertilidad.27,28
En otra investigación en la que se evaluó la prevalencia del daño en hombres jóvenes y mayores normozoospérmicos, el índice de fragmentación (IF) fue positivamente correlacionado con la edad paterna (p< 0,001). Además, la prevalencia de altos niveles de daño (> 30 % IF) fue significativamente más alto en los hombres mayores (≥ 40 años), comparados con sujetos jóvenes (< 40 años), todos normozoospérmicos (17 y 3 % respectivamente, p< 0,001).29 De estos estudios se puede inferir que el análisis convencional del semen puede fallar al detectar defectos en la espermatogénesis en hombres mayores, por lo que en parejas infértiles con edad paterna avanzada y variables del semen normal, debe considerarse el estudio de la integridad del ADN de los espermatozoides, como parte de la evaluación de la pareja.
Otro de los factores más estudiados son las sustancias químicas dañinas para la salud reproductiva, que en el caso de los hombres alteran directamente a los espermatozoides, y se relacionan con la fragmentación del ADN espermático y la calidad seminal.30
Una investigación realizada en un grupo de hombres con exposición ocupacional a ciertos pesticidas (organofosfatos [OP] y carbamato [CB]), en relación con otro grupo no expuesto, con una evidencia de exposición de 88,5 % a las sustancias utilizadas, se encontró un incremento significativo del IF espermático y decrecimiento en los valores de algunos indicadores de calidad seminal (concentración, morfología y vitalidad espermática).31
En otro estudio en el que se involucraron hombres agricultores y un grupo control, de diferentes edades (18-29, 30-37 y 38-60 años), para investigar la afectación de la exposición ocupacional a ciertos pesticidas en la salud reproductiva, se evidenció una alteración significativa en el IF del ADN y disminución de algunas variables del semen; además, los resultados obtenidos en los grupos de edades también mostraron diferencias significativas para el IF entre el grupo control y el expuesto, y fue este último entre 18-29 años el que presentó la mayor alteración en todas las variables estudiadas.32
Por otra parte, la utilización de bisfenol A, un químico industrial con altos volúmenes de producción y encontrado en numerosos productos de consumo, se relaciona negativamente con la calidad espermática y con afectaciones en la integridad del ADN espermático, de los hombres involucrados en el consumo,33,34 lo que confirma el impacto potencial de estas exposiciones en la función reproductiva masculina, por el daño que causan en la cromatina espermática y en las variables de calidad del semen. De aquí la necesidad de prevenir y reducir estas exposiciones en los hombres con riesgo, con especial atención, en aquellos que desde temprana edad están sometidos a estos tóxicos, que pueden comprometer su capacidad reproductiva y conducir a trastornos de su fertilidad futura.
La fragmentación del ADN de los espermatozoides también está relacionada con algunos procesos patológicos, y uno de los más estudiados es el varicocele,35,36 que puede provocar un alto nivel de daño al espermatozoide por el efecto oxidante que esta condición clínica produce, lo que genera una fuente de ERO muy intensa y continua, que conduce a la pérdida de la integridad del ADN espermático.37,38
La asociación del varicocele con la afectación en la integridad del ADN de los espermatozoides y deterioro de la calidad espermática, incrementa el riesgo de infertilidad, por lo que el estudio del ADN espermático debe tenerse en cuenta al valorar las muestras seminales de pacientes con varicocele clínico.39 Estos sujetos, muestran IF espermática basal más altos que los individuos sin esta patología, con mayor tendencia a presentar índices de espermatozoides degradados (subpoblación de espermatozoides con ADN fragmentado) muy elevados, del orden de dos veces mayor que el observado en otros cuadros clínicos.40
Otro de los factores a los que se les ha prestado especial atención en los últimos tiempos, por los daños que produce en el tracto genital que genera secuelas que conducen a la infertilidad, son las infecciones de transmisión sexual (ITS).41 Las infecciones seminales, por ciertas especies de microorganismos, incrementan el IF del ADN espermático, afectan la fertilidad en unos casos, y en otros, comprometen la implantación del embrión y el desarrollo del embarazo.42,43
Al respecto, estudios previos han informado un incremento en los niveles de fragmentación, al coincubar espermatozoides con cuerpos elementales de Clamydia trachomatis.44 Trabajos más recientes encontraron en individuos con infección genitourinaria, ocasionada por esta bacteria y además Mycoplasmas, un aumento significativo de espermatozoides con ADN fragmentado, a pesar de que la infección no afectó ninguna variable de calidad del semen.45,46
Estos estudios demuestran, una vez más, la necesidad de realizar otros estudios además del espermograma en pacientes con trastornos de fertilidad, lo cual se intenta resaltar con este trabajo de revisión, y aunque el origen y los mecanismos responsables del daño en el ADN de los espermatozoides no han sido completamente aclarados, es evidente que la infección por las bacterias mencionadas puede causar fragmentación.
Otra investigación, que relaciona la infección por Mycoplasma genitalium y Ureaplasma urealitycum con los trastornos reproductivos, demuestra la asociación de estos patógenos con un incremento en el IF, e indica que los trastornos en la infertilidad masculina causados por ciertas especies de bacterias pudieran estar mediadas por el impacto que provocan sobre la integridad del ADN espermático.47
Con relación a algunos virus, la literatura presenta resultados contradictorios. Por un lado se informa que el virus papiloma humano (HPV) tipo 16 y 31, incrementa el estrés oxidativo en el sistema reproductivo, que provoca un daño agresivo a los espermatozoides, con alteraciones en la integridad del ADN y las variables seminales.48,49 Sin embargo, estudios recientes no apoyan la hipótesis de que los espermatozoides de muestras de semen positivas a HPV, exhiban incremento en la fragmentación del ADN espermático,50,51 para lo cual se necesitan más investigaciones, que puedan dilucidar entre estos resultados.
Metodologías para evaluar fragmentación del ADN espermático
Dentro de las más utilizadas se describen aquellas para detectar las rupturas, tanto de cadena sencilla como de cadena doble y las que miden la capacidad de la cromatina, y en particular, del ADN para desnaturalizarse, frente a determinados tratamientos.40,52-54
Algunas de estas tecnologías, representadas en el cuadro, son complejas de realizar, y requieren de equipamiento especializado, y aunque algunas aparecen comercializadas como juego de reactivos, no son disponibles a la mayoría de los laboratorios de Andrología, por lo que no aparecen como proceder de rutina en los manuales editados por la OMS para el estudio seminal55 (cuadro).
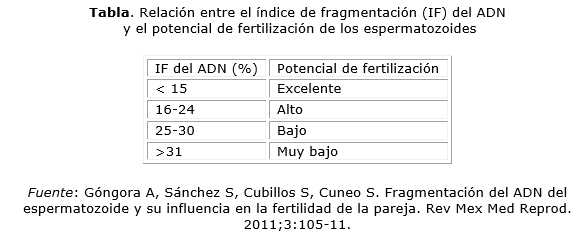
La fragmentación del ADN espermático, se define como el porcentaje de espermatozoides con el ADN fragmentado, con respecto al total de los espermatozoides analizados, y los valores se informan como IF.56 Este se utiliza como un factor pronóstico independiente de fertilidad, y muestra estrecha relación con el potencial de fertilización del espermatozoide,57 representado en la tabla.
Los resultados se presentan mostrando diferentes categorías estadísticas del potencial de fertilización, donde el IF representa el % de espermatozoides que contienen ADN dañado, y el umbral estadísticamente significativo para la infertilidad se establece a partir de 30 %. La literatura demuestra que una fragmentación del ADN > 30 % correlaciona negativamente con trastornos en la fertilidad masculina.
Fragmentación del ADN espermático y variables del semen
La fragmentación de ADN está relacionada con alteraciones en las variables de calidad del semen, pues se encuentra mayor daño del ADN nuclear en hombres con variables seminales alteradas, que en los hombres con semen normal, lo que conlleva a posibles problemas reproductivos.58 Un número importante de estudios informan una relación inversa entre el IF y la concentración, movilidad, vitalidad y morfología espermática.59
Al respecto, un estudio realizado en un grupo de hombres seleccionados en relación con su historia de fertilidad, para investigar la posible relación entre los parámetros convencionales del semen y la fragmentación del ADN, demostró una correlación inversa entre este último parámetro y la concentración espermática, la movilidad progresiva, y la morfología normal en hombres infértiles (p< 0,05), a diferencia de lo encontrado en el grupo de hombres fértiles.60
Con relación a la concentración espermática se informan correlaciones negativas entre esta variable y el IF del ADN de los espermatozoides involucrados, y se enfatiza en la necesidad de utilizar este ensayo como complemento en el análisis del semen.10,61
La movilidad espermática es una de las principales variables implicadas en la capacidad fertilizadora del espermatozoide. Con relación a este aspecto se informa que los espermatozoides que han sufrido daño en el ADN durante su trayectoria desde el testículo hasta ser eyaculados, experimentan reducción de su motilidad,62 y trabajos recientes establecen que la ausencia de movilidad, e incluso, la movilidad alterada, está asociada a defectos del ADN espermático.63
Con respecto a estas variables espermáticas, Mónica y otros, también encontraron una fragmentación aumentada en muestras con concentración y movilidad disminuidas, situación que se hace más evidente cuando se combinan varios parámetros de calidad del semen y se comparan con muestras normozoospérmicas.64
La morfología espermática, considerada por algunos clínicos como el índice predictor de la fertilidad masculina, también se relaciona con la integridad del ADN espermático.17,65 Las rupturas de las cadenas de ADN son correlacionadas con numerosas formas anormales, de la cabeza y cola de los espermatozoides, y se informa una diferencia significativa entre la cantidad de anomalías morfológicas y las muestras de espermatozoides con alto y bajo grado de fragmentación, donde el porcentaje de cabezas amorfas, y en general, las anomalías de cabeza, son significativamente mayores, en las muestras con elevado grado de fragmentación de ADN.66,67
Además, en hombres infértiles con alteraciones morfológicas y daño en el ADN de los espermatozoides, se establece que el daño es más obvio en los sujetos con variables seminales por debajo de los valores de normalidad,68 los cuales presentan bajo o ningún pronóstico de fertilización.
Las afectaciones en la viabilidad espermática están asociadas con un alto IF, lo cual está relacionado con la infertilidad del factor masculino.69 Un estudio reciente demostró que para valores de viabilidad ≤ 50 % (n= 301) el IF fue ≥ 30 % para el 95 % de las muestras; y en los casos en que los valores de viabilidad eran ≥ 75 % (n= 1 736), entonces el IF era ≤ 30 % para el 95 % de los pacientes, postulando que en algunos hombres el ensayo de viabilidad espermática puede predecir el IF.70
Otro aspecto de interés en el análisis seminal es la presencia de leucocitos en el semen, que cuando superan el valor normal (leucocitospermia), pueden afectar la calidad seminal. Uno de los mecanismos por los que se trata de explicar este hecho, es la posible contribución de estas células a la aparición de condiciones que favorecen el estrés oxidativo,71 como resultado de la presencia de ERO,72 que son primariamente producidas por leucocitos, incluso, a bajos niveles de estos en el semen, lo que provoca un incremento significativo en el daño del ADN de los espermatozoides.73,74
Al respecto, un estudio encontró la posible relación entre el desbalance del estrés oxidativo, causado por aniones superóxido en los eyaculados, con la presencia de espermatozoides con ADN fragmentado, y altas concentraciones de leucocitos,75 y otro informó que la concentración de leucocitos en semen está directamente relacionada con alteraciones en la cromatina de espermatozoides maduros e inmaduros.76
Además de lo descrito, también existe un grupo importante de sujetos sin alteraciones en la calidad espermática, que muestran altos niveles de ERO y aumento en los niveles de fragmentación del ADN espermático, lo cual está relacionado con la infertilidad de origen desconocido.4 En estos casos, la determinación de la integridad del ADN de los espermatozoides, proporciona información adicional que ayuda al diagnóstico y pronóstico de la infertilidad idiopática masculina.20,77,78
ADN espermático y reproducción asistida
La integridad del ADN espermático es necesaria no solo para la fertilidad natural. Una parte importante de las investigaciones está relacionada con las TRA,21 por el riesgo que implica la transmisión de defectos genéticos a la descendencia,79 y por el daño iatrogénico que puede introducirse al ADN de los espermatozoides, como resultado de los procederes de laboratorio que estas técnicas llevan implícitas.80
En los resultados de las tecnologías de alta y baja complejidad, las alteraciones en el ADN espermático están relacionadas con la disminución en los índices de fertilización e implantación, embarazos y nacidos vivos,81 calidad y salud del embrión, del feto, e incluso, de la descendencia;82 además, con los abortos a repetición, que hasta ahora estaban informados como de causa desconocida.83
Al éxito de las TRA debe atribuírsele una notable e importante contribución del factor masculino, con especial precaución en los hombres normozoospérmicos involucrados, porque a pesar de estos presentar los indicadores de calidad seminal dentro de los valores normales, los espermatozoides de estos sujetos pueden tener alteraciones en la integridad de la cromatina espermática,10,84 y esto debe ser previamente determinado antes de aplicar cualquier metodología de reproducción asistida.
CONSIDERACIONES FINALES
La fragmentación en el ADN de espermatozoides es considerada como posible causa potencial de infertilidad masculina, y su detección se utiliza actualmente como una variable adicional que ayuda a evaluar la calidad de una muestra seminal. A pesar del conocimiento que poseen nuestros especialistas en reproducción humana, sobre la importancia de la integridad del ADN espermático para lograr fertilidad, unido al elevado número de sujetos que se consultan por infertilidad, incluso de causa desconocida, todavía en nuestro medio no se ha incorporado esta tecnología en la mayoría de los laboratorios que brindan servicio de Andrología. Esta dificultad está dada, por una parte, por no disponer de las metodologías para esta determinación; y por otra, porque en el estudio de la pareja infértil se continúa priorizando a la mujer, se le resta importancia al factor masculino, en especial, a las contribuciones genéticas de los espermatozoides en la fertilidad de la pareja.
Precisamente, no disponer de una metodología para realizar estudios de fragmentación del ADN espermático en los pacientes que se consultan por infertilidad en nuestra institución, contribuye a que este trabajo tenga como limitación la no presentación de resultados propios, con los cuales realizar análisis de comparación con otros estudios y enriquecer la discusión de este documento.
La necesidad de realizar este ensayo toma mayor importancia, cuando en los últimos años se ha extendido a nivel nacional la reproducción asistida de baja y alta complejidad, que obvia el proceso de selección natural de espermatozoides, realiza procederes de manipulación espermática que provocan algún tipo de estrés en las células espermáticas, lo cual puede inducir daños en el ADN espermático, y afectar el resultado de las diferentes etapas del proceso.
Con este trabajo de revisión se resalta la importancia del estudio de la fragmentación del ADN espermático en la evaluación de la capacidad funcional de los espermatozoides, que, junto con el estudio de calidad del semen, contribuye a mejorar el diagnóstico y pronóstico de la infertilidad masculina.
REFERENCIAS BIBLIOGRÁFICAS
1. Shulte R. Factor masculino en la infertilidad. J Assist Reprod Genet. 2010;27:3-12.
2. De Jonge C. Semen analysis: looking for an upgrade in class. Fertil Steril. 2012;97:260-6.
3. Wang C, Swerdloff R. Limitations of semen analysis as a test of male fertility and anticipated needs from newer tests. Fertil Steril. 2014;102:1502-7.
4. Hamada A, Esteves S, Nizza M, Agarwal A. Unexplained male infertility: diagnosis and management. Int Braz J Urol. 2012;38:576-94.
5. Stahl C, Cogan A, Mehta A, Bolyakov D, Paduch M, Goldstein M. Concordance among sperm deoxyribonucleic acid integrity assays and semen parameters. Fertil Stertil. 2015;104:56-61.
6. Ioannou D, Miller D, Griffin D, Tempest H. Impact of sperm DNA chromatin in the clinic. J Assist Reprod Genet. 2016;33:157-66.
7. Omran H, Bakhiet M, Dashti M. DNA integrity is a critical molecular indicator for the assessment of male infertility. Mol Med Rep. 2013;7:1631-5.
8. Quintero G, Bermúdez R, Castillo J. Infertilidad masculina y fragmentación del ADN espermático:un problema actual. Rev Especializada en Ciencias Quimico-Biológicas. 2015;18:144-51.
9. Segura A. A propósito de la medicina reproductiva. Rev Int Androl. 2014;12:45-6.
10. Hosseinifar H, Sabbaghian M, Chehrazi M, Modarresi T, Alipour F, Sadighi G, et al. Assessment of deoxyribonucleic acid fragmentation index, testicular volume, semen parameters, and hormone profile in gonadotropin-treated men with a hypogonadotropic hypogonadism. Urol. 2013;82:1291-5.
11. Wiweko B, Utami P. Predictive value of sperm deoxyribonucleic acid (DNA) fragmentation index in male infertility. Basic Clin Androl. 2017;27:1-7.
12. Agarwal A, Majzoub A, Esteves S, Ko E, Ramasamy R, Zini A. Clinical utility of sperm DNA fragmentation testing: practice recommendations based on clinical scenarios. Transl Androl Urol. 2016;5:935-50.
13. González C, Gosálvez J, Roy R. Types, causes, detection and repair of DNA fragmentation in animal and human sperm cells. Int J Mol Sci. 2012;13:146-52.
14. Muratori M, Tamburrino L, Marchiani S, Cambi M, Olivito B, AzzariC, et al. Investigation on the Origin of Sperm DNA Fragmentation: Role of Apoptosis, Immaturity and Oxidative Stress. Mol Med. 2015;21:109-22.
15. Wright C, Milne S, Leeson H. Sperm DNA damage caused by oxidative stress: modifiable clinical, lifestyle and nutritional factors in male infertility. Reprod Biomed Online. 2014;28:684-703.
16. Skakkebaek N, Rajpert E, Buck G, Toppari J, Andersson A, Eisenberg M, et al. Male reproductive disorders and fertility trends: influences of environment and genetic susceptibility. Physiol Rev. 2016;96:55-97.
17. Evgeni E, Charalabopoulos K, Asimakopoulos B. Human Sperm DNA Fragmentation and its Correlation with Conventional Semen Parameters. J Reprod Infertil. 2014;15:2-14.
18. Greco E, Scarselli F, Iacobelli M, Rienzi L, Ubaldi F, Ferrero S, et al. Efficient treatment of infertility due to sperm DNA damage by ICSI with testicular spermatozoa. Hum Reprod. 2005;20:226-30.
19. Kovac J, Lipshultz L. Use of testicular sperm to combat the negative effects of DNA fragmentation. Asian J Androl. 2016;18:434.
20. Mayorga B, Cardona W, Cadavid A, Camargo M. Evaluación de los parámetros funcionales espermáticos en individuos infértiles normozooespérmicos. Act Urol Esp. 2013;37:124-9.
21. Lewis S, Aitken R, Conner S, Luliis G, Evenson D, Henkel R, et al. The impact of sperm DNA damage in assisted conception and beyond: recent advances in diagnosis and treatment. Reprod Biomed Online. 2013;27:325-37.
22. Khadem N, Poorhoseyni A, Jalali M, Akbary A, Heydari S. Sperm DNA fragmentation in couples with unexplained recurrent spontaneous abortions. Androl. 2014;20:120-7.
23. Johnson S, Dunleavy J, Gemmell N Nakagawa S. Consistent age-dependent declines in human semen quality: a systematic review and meta-analysis. Ageing Res Rev. 2015;19:22-33.
24. Yu B, Qi Y, Liu D, Gao X, Chen H, Bai C, et al. Cigarette smoking is associated with abnormal histone-to-protamine transition in human sperm. Fertil Steril. 2014;101:51-7.
25. Antoniassi M, Intasqui P, Camargo M, Zylbersztejn D, Carvalho V, Cardozo K, et al. Analysis of the functional aspects and seminal plasma proteomic profile of sperm from smokers. BJU Int. 2016;118:814-22.
26. Harlev A, Agarwal A, Ozgur S, Shetty A, du Plessis S. Smoking and Male Infertility: An Evidence-Based Review. World J Mens Health. 2015;33:143-60.
27. Horta F, Madariaga M, Garcia A, Harte S, Smith R. Aumento del daño en el DNA espermático en varones mayores de 40 años. Rev Med Ch. 2011;139:306-12.
29. Das M, Al-Hathal N, San-Gabriel M, Phillips S, Kadoch I, Bissonnette F, et al. High prevalence of isolated sperm DNA damage in infertile men with advanced paternal age. J Assist Reprod Genet. 2013;30:843-8.
30. Schagdarsurengin U, Western P, Steger K, Meinhardt A. Developmental origins of male subfertility: role of infection, inflammation, and environmental factors. Semin Immunopathol. 2016;38:765-81.
31. Jamal F, Haque Q, Singh S, Rastogi S. The influence of organophosphate and carbamate on sperm chromatin and reproductive hormones among pesticide sprayers. Toxicol Ind Health. 2016;32:1527-36.
33. Goldstone A, Chen Z, Perry M, Kannan K, Louis G. Urinary bisphenol A and semen quality, the LIFE Study. Reprod Toxicol. 2015;51:7-13.
34. Alarcón L, Hauser R, Gaskins A. Effects of bisphenol A on male and couple reproductive health: a review. Fertil Steril. 2016;106:864-70.
35. Majzoub A, Esteves S, Gosálvez J, Agarwal A. Specialized sperm function tests in varicocele and the future of andrology laboratory. Asian J Androl. 2016;18:205-12.
36. Cho C, Esteves S, Agarwal A. Novel insights into the pathophysiology of varicocele and its association with reactive oxygen species and sperm DNA fragmentation. Asian J Androl. 2016;18:186-93.
37. Ni K, Steger K, Yang H, Wang H, Hu K, Zhang T, et al. A comprehensive investigation of sperm DNA damage and oxidative stress injury in infertile patients with subclinical, normozoospermic, and astheno/oligozoospermic clinical varicocele. Androl. 2016;45:816-24.
38. Esteves S, Gosálvez J, López C, Núñez R, Caballero P, Agarwal A, et al. Diagnostic accuracy of sperm DNA degradation index (DDSi) as a potential noninvasive biomarker to identify men with varicocele-associated infertility. Int Urol Nephrol. 2015;47:1471-7.
39. Peluso G, Palmieri A,Cozza P, Morrone G, Verze P, Longo N, et al. The study of spermatic DNA fragmentation and sperm motility in infertile subjects. Arch Ital Urol Androl. 2013;85:8-13.
40. Cortés E, Dávila M, Fernández J, López C, Aragón A, Urbina L, et al. DNA damage in spermatozoa from infertile men with varicocele evaluated by sperm chromatin dispersion and DBD-FISH. Arch Gynecol Obstet. 2016;293:189-96.
41. Fraczek M, Hryhorowicz M, Gill K, Zarzycka M, Gaczarzewicz D, Jedrzejczak P, et al. The effect of bacteriospermia and leukocytospermia on conventional and nonconventional semen parameters in healthy young normozoospermic males. J Reprod Immunol. 2016;118:18-27.
42. Zeyad A, Hamad MF, Hammadeh ME. The effects of bacterial infection on human sperm nuclear protamine P1/P2 ratio and DNA integrity. Androl. 2017;00:e12841.
43. Zhang Q, Xiao Y, Zhuang W, Cheng B, Zheng L, Cai Y, et al. Effects of biovar I and biovar II of Ureaplasma urealyticum on sperm parameters, lipid peroxidation, and deoxyribonucleic acid damage in male infertility. Urol. 2014;84:87-92.
44. Satta A, Stivala A, Garozza A, Morello A, Perdichizzi A, Vicari E, et al. Experimental Chlamydia trachomatis infection cause apoptosis in human sperm. Hum Reprod. 2006;21:134-7.
45. Gallegos G, Ramos B, Santiso R, Goyanes V, Gosalvez J, Fernandez J. Sperm DNA fragmentation in infertile men with genitourinary infection by Chlamydia trachomatis and Mycoplasma sp. Fertil Steril. 2008;90:328-34.
46.
47. Qing L, Song Q, Feng J, Li H, Liu G, Jiang H. Prevalence of Chlamydia trachomatis, Neisseria gonorrhoeae, Mycoplasma genitalium and Ureaplasma urealyticum infections using a novel isothermal simultaneous RNA amplification testing method in infertile males. Ann Clin Microbiol Antimicrob. 2017;16:45-51.
48. Connelly D, Chan P, Patton W, King A. Human sperm deoxyribonucleic acid fragmentation by specific types of papillomavirus. Am J Obstet Gynecol. 2001;184:1068-70.
49. Garolla A, Pizzol D, Foresta C. The role of human papillomavirus on sperm function. Curr Opin Obstet Gynecol. 2011;23:232-7.
50. Kaspersen M, Bungum M, Fedder J, Bonde J, Larsen P, Ingerslev H, et al. No increased sperm DNA fragmentation index in semen containing human papillomavirus or herpesvirus. Andrology. 2013;1:361-4.
51. Cortés E, Dávila M, Fernández J, de la O L, Garza M, Eguren R, et al. The presence of human papillomavirus in semen does not affect the integrity of sperm DNA. Androl. 2016;00:e12774.
52. Evenson D. The Sperm Chromatin Structure Assay (SCSA®) and other sperm DNA fragmentation tests for evaluation of sperm nuclear DNA integrity as related to fertility. Anim Reprod Sci. 2016;169:56-75.
53. Cui Z, Zheng D, Liu Y, Chen L, Lin D, Feng L. Diagnostic Accuracies of the TUNEL, SCD, and Comet Based Sperm DNA Fragmentation Assays for Male Infertility: a Meta-analysis Study. Clin Lab. 2015;61:525-35.
54. Cortés E, Dávila M, López C, Fernández J, Gosálvez J. Evaluación del daño en el DNA espermático. Actas Urol Esp. 2007;31:120-31.
55. World Health Organization. Laboratory manual for the examination of human semen and sperm-cervical mucus interaction. 4th ed. Cambridge: Cambridge University Press; 2010.
56. Blanco A, Ramis J, Aulesa C, Gris J. Estudio para la valoración del índice de fragmentación del ADN espermático en una población de pacientes del servicio de esterilidad. Rev Iberoam Fertil Reprod Hum. 2011;28:55-9.
57. Góngora A, Sánchez S, Cubillos S, Cuneo S. Fragmentación del ADN del espermatozoide y su influencia en la fertilidad de la pareja. Revista Mexicana de Medicina de la Reproducción. 2011;3:105-11.
58. Durmaz A, Dikmen N, Gündüz C, Göker E,Tavmergen E. Fluctuation of "sperm DNA integrity" in accordance with semen parameters, and it's relationship with infertility. J Assist Reprod Genet. 2014;31:1665-71.
59. Evangelini E, Konstantinos C, Byron A. Human Sperm DNA Fragmentation and its Correlation with Conventional Semen Parameters. J Reprod Infertil. 2014;15:2-14.
60. Evgeni E, Lymberopoulos G, Gazouli M, Asimakopoulos B. Conventional semen parameters and DNA fragmentation in relation to fertility status in a Greek population. Eur J Obstet Gynecol Reprod Biol. 2015;188:17-23.
61. Boushaba S, Belaaloui G. Sperm DNA fragmentation and standard semen parameters in algerian infertile male partners. World J Mens Health. 2015;33:1-7.
62. Simon L, Lewis S. Sperm DNA damage or progressive motility: which one is the better predictor of fertilization in vitro? Systems Biol Reprod Medic. 2011;57:133-8.
63. Liu D, Liu M. Clinical value of sperm DNA damage should be assessed in motile sperm fraction rather than whole ejaculated sperm. Fertil Steril. 2013;99:367-71.
64. Dorado M, Migueles B, González M, Hebles M, Aguilera L, Sánchez P, et al. Relación entre los parámetros seminales y la fragmentación del ADN espermático. Rev Int Androl. 2008;6:14-7.
65. Skoworonek F, Casanova G, Alciaturi J, Capurro A, Cantu L, Montes J, et al. DNA sperm damage correlates with nuclear ultrastructural sperm defects teratozoospermic men. Androl. 2011;19:1439-44.
66. Eskandari N, Tavalaee M, Zohrabi D, Nasr-Esfahani M. Association between total globozoospermia and sperm chromatin defects. Andrologia. 2017;00:e12843.
67. Daris B, Goropevsek A, Hojnik N, Vlaisavljević V. Sperm morphological abnormalities as indicators of DNA fragmentation and fertilization in ICSI. Arch Gynecol Obstet. 2010;281:363-7.
68. Binsaleh S, Al R, Madbouly K, Isa A, Abu B. Evaluation of sperm DNA damage in men from infertile Saudi couples. J Reprod Med. 2015;60:135-40.
69. Portella J, López R, Noriega L, Guzmán L. Modelo predictivo de fragmentación de ADN espermático usando parámetros evaluados en un espermatograma. Rev Per Ginecol Obstet. 2014;60:21-8.
70. Samplaski M, Dimitromanolakis A, Lo K, Grober E, Mullen B, Garbens A, et al. The relationship between sperm viability and DNA fragmentation rates. Reprod Biol Endocrinol. 2015;13:42-7.
71. Mupfiga C, Fisher D, Kruger T, Henkel R. The relationship between seminal leukocytes, oxidative status in the ejaculate, and apoptotic markers in human spermatozoa. Syst Biol Reprod Med. 2013;59:304-11.
72. Du Plessis S, Agarwal A, Turda E. Contemporary evidence on the physiological role of reactive oxygen species in human sperm function. J Assist Reprod Genet. 2015;32:509-20.
73. Agarwal A, Mulgund A, Alshahrani S, Assidi M, Abuzenadah A, Sharma R, et al. Reactive oxygen species and sperm DNA damage in infertile men presenting with low level leukocytospermia. Reprod Biol Endocrinol. 2014;19:126-33.
74. Lobascio A, De Felici M, Anibaldi M, Greco P, Minasi M, Greco E. Involvement of seminal leukocytes, reactive oxygen species, and sperm mitochondrial membrane potential in the DNA damage of the human spermatozoa. Androl. 2015;3:265-70.
75. Iommiello V, Albani E, Di Rosa A, Marras A, Menduni F, Morreale G, et al. Ejaculate oxidative stress is related with sperm DNA fragmentation and round cells. Int J Endocrinol. 2015;(2015):321901. doi: 10.1155/2015/321901.
76. Moskovtsev S, Willis J, White J, Mullen J. Leukocytospermia: relationship to sperm deoxyribonucleic acid integrity in patients evaluated for male factor infertility. Fertil Steril. 2007;88:737-40.
77. Aktan G, Doğru S, Küçükgergin C, Kadıoğlu A, Ozdemirler G, Koçak N. Mystery of idiopathic male infertility: is oxidative stress an actual risk? Fertil Steril. 2013;99:1211-5.
78. Mayorga B, Camargo M, Cadavid A, du Plessis S, Cardona W. Are oxidative stress markers associated with unexplained male infertility? Androl. 2017;49(5):e12659.
79. Hotaling J, Carrell D. Clinical genetic testing for male factor infertility: current applications and future directions. Androl. 2014;2:339-50.
80. Rougier N, Uriondo H, Papier S, Checa M, Sueldo C, Alvarez C. Changes in DNA fragmentation during sperm preparation for intracytoplasmic sperm injection over time. Fertil Steril. 2013;100:69-74.
81. Simon L, Proutski I, Stevenson M, Jennings D, McManus J, Lutton D, et al. Sperm DNA damage has a negative association with live-birth rates after IVF. Reprod Biomed Online. 2013;26:68-78.
82. Agarwal A, Cho C, Esteves S. Should we evaluate and treat sperm DNA fragmentation? Curr Opin Obstet Gynecol. 2016;28:164-71.
83. Zidi I, Hajlaoui A, Mougou S, Kammoun M, Meniaoui I, Sallem A, et al. Relationship between sperm aneuploidy, sperm DNA integrity, chromatin packaging, traditional semen parameters, and recurrent pregnancy loss. Fertil Steril. 2016;105:58-64.
84. Alkhayal A, San Gabriel M, Zeidan K, Alrabeeah K, Noel D, McGraw R, et al. Sperm DNA and chromatin integrity in semen samples used for intrauterine insemination. J Assist Reprod Genet. 2013;30:1519-24.
Recibido: 1º de julio de 2017.
Aprobado: 27 de septiembre de 2017.
Bertha Victoria Rodríguez Pendás. Instituto Nacional de Endocrinología. Calle Zapata y D, Vedado, municipio Plaza de la Revolución. La Habana, Cuba. Correo electrónico: berthapendas@infomed.sld.cu