Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol vol.29 no.3 Ciudad de la Habana set.-dic. 2018
ARTÍCULO ORIGINAL
Hiperandrogenismo y trastornos metabólicos en mujeres con síndrome de ovario poliquístico
Hyperandrogenism and metabolic disorders among women with polycystic ovary syndrome
Rubén González Tabares1
Amaika Díaz León1
Leydiana Trimiño Galindo1
Adalberto Suárez González1
Layanis Guardarrama Linares1
Frank Abel Acosta González1
1Hospital Militar Docente "Dr. Mario Muñoz Monroy". Matanzas, Cuba.
RESUMEN
Introducción: El síndrome de ovario poliquístico es el trastorno ovulatorio más frecuente en la mujer de edad reproductiva. Se asocia a trastornos metabólicos que pudieran tener relación con el hiperandrogenismo.
Objetivo: Identificar los trastornos metabólicos en mujeres portadoras de síndrome de ovario poliquístico y su relación con el hiperandrogenismo.
Métodos: Se realizó un estudio transversal, descriptivo, de diciembre 2016 a junio 2017 en el Centro de Reproducción Asistida de Baja Tecnología de Matanzas. Fueron incluidas todas las mujeres que asistieron a la consulta de infertilidad, que cumplieran los criterios de Rotterdam para el diagnóstico de síndrome de ovario poliquístico (n = 38). Se recolectaron los datos generales, antecedentes patológicos personales y examen físico. Se realizó prueba de tolerancia a la glucosa, se determinaron los valores de hormona folículo estimulante, hormona luteinizante, prolactina, testosterona, insulina, glucemia, hemoglobina glucosilada, triglicéridos, colesterol total, colesterol de lipoproteína de alta densidad, creatinina y ácido úrico. Se calculó el HOMA-IR y se identificaron las portadoras de síndrome metabólico. Para el análisis estadístico se crearon 2 grupos: uno con hiperandrogenismo (n = 17) y otro sin hiperandrogenismo (n = 21).
Resultados: Los trastornos metabólicos fueron frecuentes en toda la serie. Las pacientes con hiperandrogenismo tuvieron mayor frecuencia de obesidad (82,4 %; p = 0,013), circunferencia abdominal ≥ 88 cm (94,1 %; p = 0,005), tolerancia a la glucosa alterada (41,2 %; p = 0,001) e hiperuricemia (17,6 %; p = 0,045).
Conclusiones: Los trastornos metabólicos fueron frecuentes en este grupo de pacientes. Las portadoras de hiperandrogenismo tuvieron trastornos metabólicos más marcados que las no hiperandrogénicas, sobre todo tolerancia a la glucosa alterada e hiperuricemia, probablemente mediados por la obesidad.
Palabras clave: síndrome del ovario poliquístico; hiperandrogenismo; obesidad; síndrome metabólico.
ABSTRACT
Introduction: Polycystic ovary syndrome is the most common ovulatory disorder among women of childbearing age. It is associated to metabolic disorders which might in turn be related to hyperandrogenism.
Objective: Identify the metabolic disorders among women with polycystic ovary syndrome and their relationship to hyperandrogenism.
Methods: A cross-sectional descriptive study was conducted at the Low-Technology Assisted Reproduction Center in Matanzas from December 2016 to June 2017. The study included all the women attending infertility consultation who met the Rotterdam criteria for polycystic ovary syndrome diagnosis (n = 38). General data and information on personal pathological antecedents were collected and physical examination performed. The glucose tolerance test was applied and determination was made of values for follicle-stimulating hormone, luteinizing hormone, prolactin, testosterone, insulin, glycemia, glycated hemoglobin, triglycerides, total cholesterol, high-density lipoprotein cholesterol, creatinine and uric acid. HOMA-IR was estimated and metabolic syndrome carriers were identified. Two groups were formed for statistical analysis: one with hyperandrogenism (n = 17) and one without hyperandrogenism (n = 21).
Results: Metabolic disorders were common across the series. Patients with hyperandrogenism had a higher frequency of obesity (82.4 %; p = 0.013), waist circumference ? 88 cm (94.1 %; p = 0.005), impaired glucose tolerance (41.2 %; p = 0.001) and hyperuricemia (17.6 %; p = 0.045).
Conclusions: Metabolic disorders were common in this group of patients. Hyperandrogenism carriers had more marked metabolic disorders than non-carriers, particularly as concerns impaired glucose tolerance and hyperuricemia, probably mediated by obesity.
Keywords: polycystic ovary syndrome; hyperandrogenism; obesity; metabolic syndrome.
INTRODUCCIÓN
El síndrome de ovario poliquístico (SOP), también denominado hiperandrogenismo ovárico funcional o anovulación crónica hiperandrogénica, es una disfunción endocrina metabólica de alta prevalencia. Es la causa más común de hiperandrogenismo (HA), cuya incidencia depende de los criterios que se utilicen para su diagnóstico y del lugar donde se realice el estudio.1 Se estima que está presente en el 75 % de las mujeres hirsutas y su frecuencia aumenta con la edad y el peso corporal. El trastorno se manifiesta desde la infancia, su etiología es incierta y provoca signos y síntomas variados. Entre ellos, destacan las irregularidades menstruales e infertilidad por anovulación crónica, las manifestaciones clínicas de HA como hirsutismo o acné, así como el aspecto poliquístico de los ovarios en el estudio ultrasonográfico.2
Frecuentemente las mujeres con SOP presentan resistencia a la insulina (RI) e hiperinsulinemia compensatoria, fenómeno que se observa aun cuando tengan un peso normal.3 Este fenómeno influye en la fisiopatología y consecuencias metabólicas del síndrome a largo plazo: prediabetes (PD) y diabetes mellitus tipo 2 (DM 2); síndrome metabólico (SM), obesidad, dislipidemia, hígado graso no alcohólico y riesgo cardiovascular aumentado.4
Diversos criterios se han empleado para definir el síndrome, todos incluyen alguna combinación de oligo-anovulación, HA y morfología de ovario poliquístico (MOP).5,6,7,8 Las combinaciones que requieren HA identifican los fenotipos con trastornos reproductivos y metabólicos más severos.
El objetivo es identificar los trastornos metabólicos en mujeres portadoras de síndrome de ovario poliquístico y su relación con el hiperandrogenismo.
MÉTODOS
Se realizó un estudio transversal y descriptivo, en el Centro de Reproducción Asistida de Baja Tecnología de Matanzas, en el periodo de diciembre de 2016 a junio de 2017. Fueron incluidas, previo consentimiento informado, todas las pacientes que acudieron a la consulta de infertilidad y cumplieron los criterios de Rotterdam para el diagnóstico de SOP.5 Se excluyeron las pacientes que llevaban tratamiento con metformina o inductores de la ovulación, además aquellas que no completaron el estudio.
Se recolectaron los datos generales. Del examen físico se recopiló: peso, talla, circunferencia abdominal (CA), índice de hirsutismo, acantosis nigricans, tensión arterial sistólica (TAS) y diastólica (TAD). Se utilizaron el peso y la talla para calcular el índice de masa corporal (IMC) e identificar el estado nutricional, según criterios de la OMS.
A cada paciente se le realizó una prueba de tolerancia a la glucosa oral (PTG), entre el tercero y el quinto día del ciclo menstrual o posterior a la administración de progesterona 50 mg, 1 ámpula diaria durante 3 días, si tenía más de 3 meses sin menstruación. En la primera muestra fueron determinados los valores de hormona folículo estimulante (FSH), hormona luteinizante (LH), prolactina (PRL), testosterona total, insulina, glucemia, hemoglobina glucosilada (HbA1c), triglicéridos (TAG), colesterol total, colesterol de lipoproteína de alta densidad (HDLc), creatinina y ácido úrico. En la segunda muestra solo se determinó glucemia. Se calculó el valor de colesterol de lipoproteína de baja densidad (LDLc) con la ecuación de Friedewald, a partir de los valores de colesterol total, HDLc y TAG.
Los estudios hormonales se realizaron en contador de radiaciones gamma de fabricación nacional. El principio del ensayo fue inmunorradiométrico (IRMA) en fase sólida para LH, FSH, PRL e insulina y radioinmunoanálisis (RIA) para testosterona. El resto de los analitos se determinaron en equipo Hitachi 902.
A todas las pacientes se les realizó ultrasonido transvaginal, y se consideró que tenían MOP si cumplían los criterios ultrasonográficos expuestos en el consenso de Rotterdam.
Cada paciente se clasificó según el fenotipo de SOP que padecía: A, las que tenían anovulación crónica + HA + MOP; B, las portadoras de anovulación crónica + HA; C, las que tenían HA + MOP; y D, quienes presentaron anovulación crónica + MOP.
Se diagnosticó el SM usando los criterios del Tercer Panel de Atención del Adulto (ATP III). Se calculó el índice de RI (HOMA-IR) según el modelo homeostático de Matthews, y se tomó como valor de corte 3,22. El valor de glucemia en ayunas ≥ 5,6 mmol/L y < 7,0 mmol/L se definió como glucemia en ayunas alterada (GAA). La glucemia en la segunda hora de la PTG ≥ 7,8 mmol/L y < 11,1 mmol/L se consideró tolerancia a la glucosa alterada (TGA).
Como HA se consideró un índice de hirsutismo de Ferriman y Gallway mayor de 7 puntos y/o testosterona total ≥ 4,6 nmol/L. La serie se dividió en 2 grupos de comparación: las que tenían HA (n = 17) y las que no (n = 21). La información se recolectó en una planilla de recogida de datos y fue almacenada en formato digital en paquete estadístico SPSS 20.0 ® sobre Windows 10 ®.
Para identificar asociación entre variables cualitativas se utilizó chi cuadrado. Dado que la serie no tenía una distribución normal, para la comparación de variables cuantitativas se empleó la prueba no-paramétrica para 2 muestras independientes U de Mann-Whitney. Todas usaron intervalo de confianza del 95 %. Los resultados se presentan en tablas.
RESULTADOS
La serie estuvo constituida por 38 pacientes, de 19 a 39 años, del sexo femenino. La tabla 1 muestra que el trastorno metabólico más frecuente fue el HDL colesterol bajo, el cual se encontró en 81,6 % de estas pacientes. Se evidenció alta frecuencia de obesidad, sobre todo central. Llama la atención la elevada frecuencia del SM (42,1 %), así como de sus componentes. Se comprobó que aproximadamente 1 de cada 3 tenía HOMA-IR superior al valor de corte que se estableció para RI.
Al comparar los 2 grupos de pacientes, con y sin HA, no se encontraron diferencias estadísticamente significativas en cuanto a las frecuencias de acantosis nigricans, GAA, HDL < 1,3 mmol/L, TAG ≥ 1,7 mmol/L, TA ≥ 130/85 mmHg, SM y HOMA-IR. Sin embargo, en las pacientes con HA fueron más frecuentes la obesidad, CA ≥ 88 cm, TGA, e hiperuricemia.
La comparación de las variables clínicas y de laboratorio según la presencia o no de HA (tabla 2), corroboró que los valores de peso, IMC, circunferencia abdominal, glucemia a las 2 h de la PTG y ácido úrico fueron mayores, de forma estadísticamente significativa, en el grupo de pacientes con HA. Como es obvio, los valores de testosterona también son mayores en este grupo. En el resto de las variables estudiadas no se detectaron diferencias. Se debe señalar que las variables correspondientes al metabolismo de los carbohidratos -dígase insulina en ayunas, HbA1c y HOMA-IR- tuvieron valores más altos en las pacientes hiperandrogénicas, sin alcanzar significación estadística.
Tabla 2. Variables clínicas y de laboratorio según la presencia de hiperandrogenismo
| Variable | Hiperandrogenismo | Sig. | |
| Sí | No | ||
| Edad (en años) | 27 (19-39) | 28 (21-35) | 0,542 |
| Edad de menarquia (en años) | 12 (8-14) | 12 (9-17) | 0,642 |
| Peso (en kg) | 83,0 (54,5-124,0) | 71,0 (48,0-109,0) | 0,009 |
| Talla (en m) | 160,2 | 158,5 | 0,383 |
| IMC (kg/m2) | 34,2 | 27,6 | 0,018 |
| Circunferencia abdominal | 104,5 | 91,5 | 0,029 |
| TA sistólica (mmHg) | 108 (88-148) | 108 (82-142) | 0,750 |
| TA diastólica (mmHg) | 72 (48-100) | 72 (46-98) | 0,685 |
| FSH (mUI/mL) | 4,52 (2,83-6,60) | 4,58 (2,23-9,97) | 0,706 |
| LH (mUI/mL) | 8,80 (1,58-17,10) | 4,82 (1,99-36,70) | 0,685 |
| PRL (µUI/mL) | 273,0 | 307,0 | 0,367 |
| Testosterora (nmol/L) | 5,67 (2,90-11,10) | 2,81 (0,85-3,97) | 0,000 |
| Insulina (µUI/mL) | 12,5 (8,23-36,69) | 10,9 (5,60-33,70) | 0,060 |
| Glucemia en ayunas (mmol/L) | 5,2 (4,1-5,8) | 5,0 (3,80-6,4) | 0,281 |
| Glucemia 2 h PTG (mmol/L) | 7,0 (4,7-9,8) | 5,8 (4,4-7,1) | 0,009 |
| HbA1c (%) | 5,2 (4,5-7,2) | 4,9 (3,9-6,3) | 0,073 |
| Triglicéridos (mmol/L) | 1,21 (0,71-3,19) | 1,16 (0,49-3,43) | 0,561 |
| Colesterol total (mmol/L) | 4,5 (3,4-7,3) | 4,6 (3,6-6,2) | 0,706 |
| HDL colesterol (mmol/L) | 0,97 (0,70-1,32) | 1,07 (0,67-2,21) | 0,268 |
| LDL colesterol (mmol/L) | 3,11 (2,07-5,61) | 3,03 (1,76-4,90) | 0,308 |
| Creatinina (µmol/L) | 75,0 (55,0-95,0) | 65,0 (52,0-96,0) | 0,136 |
| Ácido úrico (µmol/L) | 314,0 | 228,0 | 0,000 |
| HOMA-IR | 2,87 (1,61-8,11) | 2,29 (1,21-7,79) | 0,068 |
IMC: índice de masa corporal, TA: tensión arterial, FSH: hormona folículo estimulante, LH: hormona luteinizante, PRL: prolactina,
HDL: lipoproteína de alta densidad, LDL: lipoproteína de baja densidad, HbA1c: hemoglobina glucosilada.
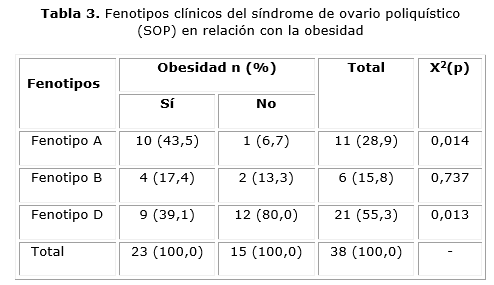
Se constató que la obesidad era más frecuente en los fenotipos A y D (tabla 3) del SOP, o sea aquellos en los que interviene la MOP en el ultrasonido como criterio diagnóstico.
DISCUSIÓN
La distribución etaria del grupo se debe al proceso de inclusión, ya que esta es una serie de casos continuos, que asistieron a consulta de infertilidad, con disfunción ovulatoria. Por ese mismo motivo no se encuentran pacientes con el fenotipo C del SOP (HA clínico y/o bioquímico + MOP), ya que este fenotipo es ovulatorio. Esta circunstancia, asociado a que no es un estudio epidemiológico, es la causa de que el grupo hiperandrogénico represente solamente el 44,7 % de la serie.
La frecuencia de HTA (26,3 %) es similar a la prevalencia en la población cubana para los grupos etarios que incluyen a estas pacientes (de 19 años a 24 años, y de 25 años a 59 años), según el Anuario Estadístico de Salud de 2016, y no se encontró que el HA tuviera relación con la hipertensión. 9 Sin embargo, otros autores10 han encontrado que las mujeres con SOP clásico (entiéndase con hiperandrogenismo) y obesidad tienen frecuentemente trastornos de la TA no diagnosticados, que ocasionan repercusión en órganos diana. Esto, además, partiendo en el mismo estudio de comparaciones de pacientes con y sin SOP, incluso, hombres.
En este trabajo se apreció relación entre el hiperandrogenismo y el metabolismo de los carbohidratos, a expensas de la TGA, aunque no se constató con la GAA. Ha sido planteado que el desarrollo de niveles elevados de glucosas en estas pacientes, es evidencia de la incapacidad de las células beta pancreáticas para compensar la RI.
Otros autores han encontrado relación entre valores de glucemia e insulina en ayunas con el sobrepeso y la obesidad en pacientes portadoras de SOP.11 Sin embargo, no se pudo probar que las pacientes con HA tuvieran mayor frecuencia de RI; aunque tenían HOMA-IR mayor que el grupo no hiperandrogénico, la diferencia no alcanzó significación estadística. Se debe tener en cuenta que, independientemente del fenotipo de SOP, se consideran estas mujeres como grupo de riesgo para disglucemia y DM 2.12
Se considera que las pacientes con SOP tienen edad de la menarquia más temprana que el resto de la población.13 En este estudio no se pudo demostrar diferencia en cuanto a la edad de la menarquia influida por la presencia o no de HA.
El impacto de la obesidad sobre la expresión clínica del SOP tiene gran influencia en los trastornos metabólicos que le acompañan. El envejecimiento incrementa la RI en mujeres obesas con el síndrome, sin embargo, no ocurre así en mujeres delgadas y sobrepeso. Debido a que los andrógenos y el IMC se asocian positivamente con el HOMA-IR y que los andrógenos declinan con los años, se cree que si estas mujeres no se hacen obesas pueden exhibir mejor perfil metabólico durante la vida reproductiva.14 A su vez, las que tienen el síndrome clásico y sobrepeso u obesidad, desarrollan más frecuentemente HTA.10 Además, en adolescentes se ha visto que el mayor predictor para GAA es el IMC y no el SOP.15 La obesidad probablemente no sea la causa del SOP, sin embargo exacerba las manifestaciones fenotípicas, especialmente los factores de riesgo cardiovascular.16 En esta serie el grupo con HA tuvo mayor frecuencia de obesidad y CA de riesgo cardiovascular, que el que no tenía HA. A su vez, la relación encontrada entre la obesidad y el fenotipo, muestra que usar los criterios de Rotterdam produce la inclusión de pacientes obesas con anovulación crónica que desarrollan características imagenológicas propias del SOP.
La RI es otro trastorno metabólico frecuentemente asociado con el SOP, se encontró en 36,8 % de la serie. El SM se vio en 42,1 %, cifras similares se han encontrado en estudios provenientes de otros países. En investigaciones brasileras se ha diagnosticado entre el 32,7 y el 44,6 % de las mujeres con SOP, siempre en alta correlación con el IMC. 17,18 Sin embargo, no se ha logrado establecer relación de causalidad entre el SM y el HA. En una investigación de Benevides et al.,19 el análisis multivariado no reveló contribución de los andrógenos al desarrollo del SM en las mujeres con SOP. No obstante, en un metaanálisis de Yang et al.20 que incluyó 9 556 mujeres con SOP, de 32 estudios observacionales, encontraron diferencias significativas en la incidencia de SM, RI, colesterol total y HDL colesterol en pacientes con o sin HA.
Los niveles elevados de ácido úrico en el grupo con HA deben estar relacionados con el mayor IMC de estas pacientes. En estudios en los que se ha comparado los niveles de ácido úrico en pacientes con y sin SOP, pareadas según IMC, no se ha encontrado diferencias estadísticamente significativas entre grupos.21,22
Estos hallazgos son consistentes con el concepto de que el exceso de andrógenos es responsable de la mayoría de las manifestaciones reproductivas del síndrome. El HA ovárico produce las manifestaciones cutáneas y morfológicas del SOP. Las altas concentraciones intraováricas de andrógenos aumentan el reclutamiento de folículos primordiales dentro del pool de folículos antrales y preantrales, lo que deteriora la selección del folículo dominante. Estos efectos pueden ser responsables de la aparición de la poliquistosis ovárica, del agrandamiento ovárico, el engrosamiento capsular, la hiperplasia de la teca y el estroma y la luteinización.23 Mientras tanto, las manifestaciones metabólicas son más severas en los fenotipos hiperandrogénicos, exacerbadas por el aumento del peso corporal. De hecho, los factores de riesgo para el desarrollo de intolerancia a la glucosa en mujeres con SOP incluyen los antecedentes familiares de diabetes, edad, obesidad y, especialmente, la distribución centrípeta de la grasa corporal. Un mecanismo que pudiera justificar este fenómeno es que los niveles elevados de insulina suprimen la producción hepática de proteína de unión a hormonas sexuales (SHBG, siglas en inglés). Tanto la obesidad como la RI conducen a la reducción de SHBG y mayores niveles de andrógenos biodisponibles circulantes. Además, el tejido adiposo es una fuente de aromatización periférica que aumenta los niveles de estrógenos a partir de andrógenos, conduciendo a la secreción inapropiada de gonadotropinas, así como a la estimulación endometrial sin oposición de progesterona.6
En conclusión, los trastornos metabólicos son frecuentes en este grupo de pacientes. Las portadoras de hiperandrogenismo tienen trastornos metabólicos más marcados que las no hiperandrogénicas, sobre todo TGA e hiperuricemia, probablemente mediados por la obesidad.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses en la realización del estudio.
REFERENCIAS BIBLIOGRÁFICAS
1. Bozdag G, Mumusoglu S, Zengin D, Karabulut E, Yildiz BO. The prevalence and phenotypic features of polycystic ovary syndrome: a systematic review and meta-analysis. Hum Reprod. 2016;31(12):2841-55.
2. Sir PT, Preisler RJ, Magendzo NA. Síndrome de ovario poliquístico. diagnóstico y manejo. Revista Médica Clínica Las Condes [Internet]. 2013;24(5). Acceso: 12/09/2017. Disponible en: http://www.sciencedirect.com/science/article/pii/S0716864013702293
3.García García Y, Monteagudo Peña G, Padrón Durán RS, González Suárez R. Evaluación de la sensibilidad a la insulina en el síndrome de ovarios poliquísticos. Rev Cubana Endocrinol [Internet]. 2009;20(3):131-140. Acceso: 14/10/2017. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1561-29532009000300006&nrm=iso
4. Anderson SA, Barry JA, Hardiman PJ. Risk of coronary heart disease and risk of stroke in women with polycystic ovary syndrome: a systematic review and meta-analysis. International journal of cardiology [Internet]. 2014;176(2). Acceso: 14/10/2017. Disponible en: http://www.sciencedirect.com/science/article/pii/S0167527314011668
5. The Rotterdam ESHRE/ASRM-sponsored PCOS consensus workshop group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS). Hum Reprod [Internet]. 2004;19(1). Acceso: 11/09/2017. Disponible en: http://humrep.oxfordjournals.org/content/19/1/41.full.pdf+html
6. Azziz R, Carmina E, Dewailly D. The Androgen Excess and PCOS Society criteria for the polycystic ovary syndrome: the complete task force report. Fertility and Sterility [Internet]. 2009;91(2):456-488. Acceso: 22/07/2017. Disponible en: http://www.sciencedirect.com/science/article/pii/S0015028208013927?via%3Dihub
7. Conway G, Dewailly D, Diamanti-Kandarakis E, Escobar-Morreale HF, Franks S, Gambineri A, et al. The polycystic ovary syndrome: a position statement from the European Society of Endocrinology. European Journal of Endocrinology [Internet]. 2014;171(4). Acceso: 22/07/2017. Disponible en: http://www.eje-online.org/content/171/4/P1.full.pdf
8. Dumesic DA, Oberfield SE, Stener-Victorin E, Marshall JC, Laven JS, Legro RS. Scientific Statement on the Diagnostic Criteria, Epidemiology, Pathophysiology, and Molecular Genetics of Polycystic Ovary Syndrome. Endocrine Reviews [Internet]. 2015;36(5). Acceso: 25/06/2017. Disponible en: http://dx.doi.org/10.1210/er.2015-1018
9. Ministerio de Salud Pública Dirección de Registros Médicos y Estadísticas de Salud. Anuario Estadístico de Salud 2016. La Habana 2017. Acceso: 15/10/2017.Disponible en: http://files.sld.cu/dne/files/2017/04/Anuario_Estad%C3%ADstico_de_Salud_e_2016_edici%C3%B3n_2017.pdf
10. Luque Ramírez M, Martí D, Fernández Durán E, Alpañés M, Álvarez Blasco F, Escobar Morreale HF. Office Blood Pressure, Ambulatory Blood Pressure Monitoring, and Echocardiographic Abnormalities in Women With Polycystic Ovary Syndrome. Role of Obesity and Androgen Excess. Hypertension [Internet]. 2014;63(3). Acceso: 192/10/2017.Disponible en: http://hyper.ahajournals.org/content/hypertensionaha/63/3/624.full.pdf
11. Mahmoud MI, Habeeb F, Kasim K. Reproductive and biochemical changes in obese and non obese polycystic ovary syndrome women. Alexandria Journal of Medicine [Internet]. 2015;51(1). Acceso: 23/12/2017. Disponible en: http://www.sciencedirect.com/science/article/pii/S2090506814000311
12. American Diabetes Association. Classification and Diagnosis of Diabetes. Diabetes Care [Internet]. 2017;40(sup 1). Acceso: 20/10/2017. Disponible en: http://care.diabetesjournals.org/content/diacare/40/Supplement_1/S11.full.pdf
13. Spritzer PM. Polycystic ovary syndrome: reviewing diagnosis and management of metabolic disturbances. Arquivos Brasileiros de Endocrinologia e Metabologia [Internet]. 2014;58(2). Acceso: 23/09/2017.Disponible en: http://www.scielo.br/pdf/abem/v58n2/0004-2730-abem-58-2-0182.pdf
14. Livadas S, Kollias A, Panidis D, Diamanti-Kandarakis E. Diverse impacts of aging on insulin resistance in lean and obese women with polycystic ovary syndrome: evidence from 1345 women with the syndrome. European journal of endocrinology [Internet]. 2014;171(3). Acceso: 19/10/2017. Disponible en: http://www.eje-online.org/content/171/3/301.abstract
15. Javed A, Lteif AN, Kumar S, Simmons PS, Chang AY. Fasting Glucose Changes in Adolescents with Polycystic Ovary Syndrome Compared To Obese Controls: A Retrospective Cohort Study. Journal of Pediatric and Adolescent Gynecology [Internet]. 2015;28(6). Acceso: 20/10/2017. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4526446/
16. Legro RS. Obesity and PCOS: implications for diagnosis and treatment. Seminars in reproductive medicine [Internet]. 2012;30(6). Acceso: 14/10/2017. Disponible en: https://www.thieme-connect.com/products/ejournals/pdf/10.1055/s-0032-1328878.pdf
17. Romanowski MD, Parolin MB, Freitas ACT, Piazza MJ, Basso J, Urbanetz AA. Prevalence of non-alcoholic fatty liver disease in women with polycystic ovary syndrome and its correlation with metabolic syndrome. Arquivos de Gastroenterologia [Internet]. 2015;52. Acceso: 18/10/2017. Disponible en: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0004-28032015000200117&nrm=iso
18. Pinto de Ávila MA, Vasconcellos Bruno R, Cuiabano Barbosa F, Cupertino de Andrade F, Cardoso de Oliveira e Silva A, Egídio Nardi A. Polycystic ovary syndrome: implications of metabolic dysfunction. Revista do Colégio Brasileiro de Cirurgiões [Internet]. 2014;41. Acceso: 19/10/2017. Disponible en: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0100-69912014000200106&nrm=iso
19. Benevides Rehme MF, Pontes AG, Corrente JE, Gonçalves Franco J, Pontes A. Contribuição do hiperandrogenismo para o desenvolvimento de síndrome metabólica em mulheres obesas com síndrome dos ovários policísticos. Revista Brasileira de Ginecologia e Obstetrícia [Internet]. 2013;35. Acceso: 15/10/2017. Disponible en: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0100-72032013001200006&nrm=iso
20. Yang R, Yang S, Li R, Liu P, Qiao J, Zhang Y. Effects of hyperandrogenism on metabolic abnormalities in patients with polycystic ovary syndrome: a meta-analysis. RB&E [Internet]. 2016;14. Acceso: 02/10/2017. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC5069996/
21. Anttila L, Rouru J, Penttila T, Irjala K. Normal serum uric acid concentrations in women with polycystic ovary syndrome. Hum Reprod. 1996;11(11):2405-7.
22. Luque Ramirez M, Alvarez Blasco F, Uriol Rivera MG, Escobar Morreale HF. Serum uric acid concentration as non-classic cardiovascular risk factor in women with polycystic ovary syndrome: effect of treatment with ethinyl-estradiol plus cyproterone acetate versus metformin. Hum Reprod. 2008;23(7):1594-601.
23. Rosenfield RL. The Polycystic Ovary Morphology-Polycystic Ovary Syndrome Spectrum. Journal of Pediatric and Adolescent Gynecology [Internet]. 2015;28(6). Acceso: 08/10/2017. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4387116/pdf/nihms625734.pdf
Recibido: 22 de marzo de 2018.
Aprobado: 11 de julio de 2018.
Autor para la correspondencia. Rubén González Tabares. Hospital Militar de Matanzas. Km 109, Carretera Central, Gelpis. Matanzas, Cuba. Correo electrónico: rubengt@infomed.sld.cu