Introducción
La vitamina D, incluida en el grupo de vitaminas liposolubles,1 es una de las vitaminas más antiguas, presente en las formas de vida primitiva y que ha perdurado hasta nuestros días.2 Se considera más que una vitamina, una prohormona a la cual se le atribuyen múltiples e importantes funciones que van más allá de su rol preponderante en la homeostasis cálcica.3
En 1921, McCollum identificó una sustancia presente en ciertas grasas que podía prevenir el raquitismo. Fue el descubrimiento de la cuarta vitamina y por eso se denomina Vitamina D (VD). A partir de 1930 se suplementaron diversos alimentos en EE. UU. y Europa. Al culminar la II Guerra Mundial este proceso no se monitorizó adecuadamente, lo que causó un brote de intoxicación por VD en niños y jóvenes, que llevó a prohibir su uso como suplemento en los alimentos lácteos en la mayoría de los países europeos. En la actualidad, solo algunos de estos alimentos están suplementados con vitamina D.1
La acción más importante y estudiada de la vitamina D se relaciona con el metabolismo mineral óseo y su deficiencia mantenida origina el raquitismo en el niño y la osteomalacia en el adulto. En la actualidad, en países industrializados, la protección solar con el objetivo de prevenir el cáncer de piel (melanoma) se asocia con un resurgimiento de estados carenciales de la VD, sobre todo cuando coexisten factores como: prematuridad, ser hijo de madre con déficit importante de VD, lactancia materna exclusiva por más de 3-6 meses sin suplementación, tener la piel oscura, seguir dietas vegetarianas estrictas, poca actividad al aire libre (exposición solar inadecuada), sedentarismo, obesidad y uso de medicamentos que alteran el metabolismo fosfocálcico.3
En los últimos años se ha reportado un interés creciente en el metabolismo y fisiología de la VD así como sus efectos extraóseos, pues diversas enfermedades como el cáncer, la esclerosis múltiple, la diabetes mellitus tipo 2, la enfermedad inflamatoria intestinal, enfermedades autoinmunes, la hipertensión arterial y ciertas enfermedades cardiovasculares podrían relacionarse con concentraciones séricas bajas de la vitamina.4
El propósito del presente artículo es actualizar conocimientos relativos con las funciones extraesqueléticas de la hormona VD y su relación con algunas enfermedades a partir de información actualizada.
Métodos
Se utilizó como buscador de información científica Google Académico y las bases de datos PubMed, SciELO y otras páginas web, en general. Se emplearon como palabras clave: vitamina D, acciones extraesqueléticas, reproducción, sistema cardiovascular, cáncer, sistema inmune, diabetes mellitus, tiroides, resistencia a la inulina.
Se incluyeron artículos completos publicados últimos 10 años de autores cubanos e internacionales que incluyeron: ensayos clínicos, editoriales, metaanálisis, guías clínicas, ensayos clínicos controlados, revisiones sistemáticas
Se revisaron 101 artículos, de los cuales cumplieron los criterios de selección 74 (73 %).
Síntesis y fisiología
La vitamina D se obtiene fundamentalmente a través de su síntesis en la piel a partir del 7-dehidrocolesterol, por acción de los rayos ultravioleta B (UVB) dando lugar al colecalciferol. Otra fuente de obtención de Vitamina D es la dieta en forma de colecalciferol y ergocalciferol, aunque la incorporación a través de la misma es limitada dado que existen pocos alimentos ricos en vitamina D, entre los que se citan: salmón, caballa, sardina, aceite de hígado de bacalao, atún, yema de huevo, hongos; los que aportan solo un 10 % de VD.5,6
La vitamina D, que proviene tanto de la síntesis cutánea como de la ingesta, sufre una hidroxilación en el hígado por la enzima 25-hidroxilasa (CYP2R1 o CYP27A1), perteneciente a la familia de los citocromos P450, para convertirse en 25 (OH)-D (calcidiol). Este metabolito constituye el índice más confiable de estado global de la VD 7 y, aunque es hasta cinco veces más potente que el calcitriol, no es activa a concentraciones fisiológicas.3,5
El paso final de la activación ocurre en el túbulo renal, mediante un proceso llevado a cabo por acción de la enzima 1α- hidroxilasa (CYP27B1), donde el 25(OH)-D es de nuevo hidroxilado dando lugar al 1,25 (OH) vitamina D3 (calcitriol), que es el metabolito biológicamente activo.5) Cuando la síntesis de 1,25 (OH) vitamina D3 es suficiente, la 25(OH)-D se transforma a nivel renal en el metabolito inactivo.
Mecanismo de acción
La VD, en su forma activa, realiza sus acciones a través del receptor de vitamina D (VDR), el cual es miembro de la familia de receptores hormonales nucleares esteroideos/tiroideos. En la célula diana, la vitamina D3 (VD3) se une se une al VDR, el cual sufre cambios conformacionales en su estructura tridimensional y se transporta al núcleo, donde se heterodimeriza con el receptor del ácido retinoico (RXR). El complejo VDR/RXR formado tiene la capacidad de unirse a regiones promotoras del ADN y así regular la transcripción génica (efecto genómico). La VD3 también puede unirse a los VDR que están ubicados a las caveolas de la membrana plasmática dando lugar a la activación de segundos mensajeros que pueden producir respuestas rápidas en minutos o segundos (efecto no genómico).6,8
La VD, en su forma biológicamente activa, actúa como un factor de transcripción al unirse con los VDR ampliamente expresados en muchos tejidos, regulando un gran número de genes implicados en la homeostasis del calcio, metabolismo óseo, la diferenciación y la proliferación celular. Su principal acción biológica es estimular el transporte activo de calcio y fósforo a través del intestino.9
Numerosos estudios realizados y reportados en los últimos 20 años destacan el importante papel de la vitamina D, no solo sobre el metabolismo mineral, sino también sus efectos extraesqueléticos, cada vez más conocidos.1,5
Las funciones extraesqueléticas atribuidas a la VD parten no solo del descubrimiento de los VDR, también de la expresión de la enzima 1α-hidroxilasa en diferentes tejidos del organismo.10
El VDR presenta una amplia distribución orgánica y está identificado en todas las células nucleadas en diferentes proporciones. Las pocas células que no expresan este receptor son los eritrocitos, los miocitos bien diferenciados y las células de Purkinje del cerebelo. Los tejidos que expresan mayor densidad son el tracto gastrointestinal, el hueso y el riñón; moderada expresión en la piel, cerebro, gónadas, colon, células β de los islotes pancreáticos, próstata, músculo esquelético, adipocitos, glándula tiroides y linfocitos T y B. La expresión hepática es mínima.5,8
Por otro lado, la enzima 1α-hidroxilasa, además, de su expresión en las células de los túbulos renales proximales, según últimos reportes bibliográficos,5,11,12 también se expresa en otros sitios como placenta, células monomacrofágicas, monocitos, células T activadas, próstata, mama, colon, corazón, pulmón, cerebro, epidermis, células β pancreáticas y células paratiroideas.
Todo esto ha generado la descripción de un gran número de efectos de la vitamina D en diferentes tejidos y en diversos procesos fisiológicos. Este interés está dado por su capacidad para realizar acciones no genómicas (rápidas) y genómicas (lentas) que se reflejan en el grupo de actividades clásicas (en hueso, riñón e intestino) y las llamadas actividades no clásicas, que no se relacionan con el metabolismo del calcio y fósforo y sí con la actividad antitumoral (colon, próstata, mama, leucemias, carcinoma de células escamosas), reparación del ácido desoxirribonucleico (DNA), control de la apoptosis, estrés oxidativo, inmunomodulación, adhesión celular y metabolismo y otras funciones aún por esclarecer.4) Aunque los estudios no son concluyentes, los mismos proponen una relación entre niveles bajos de la vitamina y algunas enfermedades crónicas, autoinmunes, infecciosas y oncológicas.1,5,9
Acciones extraesqueléticas de la vitamina D
Sistema reproductor
El VDR se localiza a nivel del tejido reproductivo, central y periférico, tanto en hombres como en mujeres. En el aparato reproductor masculino se encuentra en el epidídimo, túbulos seminíferos, células de Sertoli y Leydig, espermatozoides, próstata y vesículas seminales.13 En hombres también se ha estudiado la expresión de las enzimas involucradas en la síntesis de vitamina D, las cuales se expresan en tejidos reproductivos (vesículas seminales, testículos, epidídimo, próstata, células Leydig, espermátidas elongadas, espermatocitos, espermatogonias y espermatozoides).12)
Varios han sido los estudios realizados basados en los efectos de la vitamina D en la reproducción masculina.14,15 De estos se puede deducir que los niveles de VD3 influyen positivamente en la espermatogénesis, maduración y movilidad de los espermatozoides14 y que existe una correlación positiva entre niveles de VD3 y de hormona antimüleriana (HAM).15 Por otro lado los niveles séricos de VD3 también influyen positivamente con los de testosterona y su biodisponibilidad, apreciándose un aumento de la testosterona tras la suplementación de la VD3.16,17) A pesar de estos todos estos resultados, otros estudios sugieren más evidencia para demostrar si este aumento pudiera mejorar las opciones reproductivas.18
Por otro lado, en mujeres, el VDR se halla en los ovarios, células epiteliales de las trompas, endometrio y en la placenta.19 Mientras tanto, el gen que codifica la enzima 1α-hidroxilasa (CYP27B1) se expresa también en la placenta humana y el ovario.20
Grundmann y otros21 reportaron evidencias relacionadas con posibles resultados adversos relacionados con el estatus deficiente de VD3 y reducción de la fertilidad y riesgo incrementado de pobres resultados perinatales, como hipertensión, parto pretérmino, vaginosis bacteriana gestacional y diabetes gestacional.
Jukic y otros22 encontraron una relación inversa entre niveles de VD3 y FSH urinario, además que la deficiencia de vitamina D se corresponde con altos niveles de FSH y bajos de HAM, lo que indica una baja reserva ovárica. Entonces, bajos niveles de VD3 pudieran predisponer a una baja reserva ovárica y, por consiguiente, a una menopausia precoz.
Varios estudios realizados en pacientes con síndrome de ovarios poliquísticos (SOP) han demostrado una asociación inversa entre niveles de vitamina D, resistencia a la insulina y obesidad.23 La relación entre VD3 y el fenotipo SOP viene respaldada por las implicaciones entre los mecanismos de deficiencia de vitamina D y la resistencia a la insulina, inflamación, dislipidemia y obesidad que se encuentran comúnmente en el SOP.24
Pal y otros,25 en un estudio retrospectivo en el que se evaluaron los niveles de 25 (OH)-D en mujeres con SOP, se encontró que la probabilidad de tener ovulación tras tratamiento fue significativamente menor en aquellas con deficiencia de vitamina D, en comparación con las que tenían niveles de 25 (OH)-D mayores de 20 ng/mL (p = 0,006); que la probabilidad de nacidos vivos se incrementaba a medida que lo hacían los niveles de 25 (OH)-D (por cada 1 ng/mL de aumento de 25 [OH]-D aumenta la probabilidad de nacidos vivos en un 2 %, OR = 1,02); y que las probabilidades de aborto disminuían a medida que aumentaban los niveles de vitamina D (un nivel de 25 [OH]-D ≥ 38 ng/mL se asoció con un 82 % menos de probabilidades de aborto en comparación con niveles inferiores, OR = 1,18).
Por otro lado, la relación entre VD y los resultados de fertilización in vitro (FIV), evaluada en múltiples estudios, muestran resultados contradictorios en cuanto a índices de implantación, de embarazos por embrión transferido y niveles de la hormona.26
Sistema cardiovascular
Se han descrito varios efectos protectores de la VD para el sistema cardiovascular, entre los que se mencionan la regulación del sistema renina-angiotensina-aldosterona, el efecto directo sobre el endotelio vascular, la disminución de la concentración sérica de hormona paratiroidea y la disminución de citocinas inflamatorias.27 Estos efectos pudieran estar en relación con la presencia del VDR y de la enzima 1α-hidroxilasa en los tejidos cardiovasculares. Modelos experimentales que carecen de VDR destacan su actividad tejido-específica.28
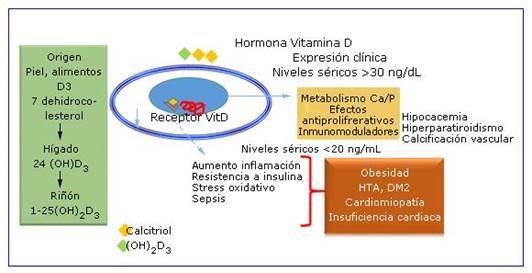 Fuente: Daysi Navarro Despaigne.
Fuente: Daysi Navarro Despaigne.Fig. 1 Hormono síntesis de la Vitamina D, mecanismo de acción (genómico) y efectos clínicos cardiovasculares de los niveles plasmáticos de vitamina D.
La VD aumenta la síntesis de una proteína de la matriz que inhibe la calcificación vascular, de manera que su déficit se asocia a mayor esclerosis de la pared vascular. Por otra parte, la vitamina D actúa como inhibidor de citocinas inflamatorias, incluyendo el factor de necrosis tumoral alfa (TNFα), que ha sido relacionada con la rigidez arterial, y produce aumento de la interleucina (IL) 10, citocina antiinflamatoria. El déficit también conlleva a la activación del sistema renina-angiotensina-aldosterona y la consiguiente predisposición a hipertensión arterial e hipertrofia del ventrículo izquierdo. El déficit de VD se asocia además al aumento de la PTH, lo que se relaciona con la insulinorresistencia, la hipertensión y la inflamación.29
Aunque la evidencia es limitada, está descrito un vínculo entre concentraciones bajas de 25(OH)-D en la infancia y el incremento del grosor de la pared de la íntima media carotidea en la adultez. El estudio de Asghari y otros30 concluye que podría existir una correlación directa entre niveles insuficientes de VD y aterosclerosis subclínica en adolescentes obesos, aunque otras investigaciones son necesarias definir la posibilidad que la PTH contribuya de forma independiente, de la 25(OH)-D en el proceso aterosclerótico.
Otras investigaciones observacionales reportan aumento significativo del riesgo vascular solo en pacientes con cifras de 25(OH)-D inferiores a 15 ng/mL. El beneficio del tratamiento con VD se observó fundamentalmente en los pacientes que alcanzaron concentraciones de 25(OH)-D de 30-40 ng/mL.31
Según la USPSTF (U.S. Preventive Services Task Force)32 no hay evidencias de que el cribado del déficit de vitamina D en adultos asintomáticos sea beneficioso por el momento. Por otro lado, el estudio de Manson JE y otros33 ratifica que la suplementación con VD no da lugar a una menor incidencia eventos cardiovasculares, comparados con la administración de placebo.
Vitamina D y cáncer
Se sabe que la vitamina D regula la expresión genética en procesos celulares como apoptosis, proliferación y diferenciación celular y modulación de la respuesta inmune del huésped, efectos que podrían estar directa o indirectamente relacionados con el cáncer.1
Los VDR juegan un importante papel en la regulación de ciertos genes implicados en la génesis celular (por ejemplo, la inducción de genes supresores de tumores p53 y p21), lo que le confiere un potencial efecto anticancerígeno.20 La inhibición de la proliferación celular por la VD3 es debida a la capacidad de producir parada del ciclo celular en la fase G0/G1, a través de la alteración de reguladores del ciclo celular como las ciclinas, las quinasas dependientes de las ciclinas (CDK) o los inhibidores quinasa dependientes de ciclina.33
Los efectos de la hormona sobre el crecimiento y diferenciación varían con el tipo de tejido, por ejemplo, inhibe la diferenciación de los linfocitos B35 y la promueve en queratinocitos;36 tiene efectos antiproliferativos en algunas células neoplásicas y en otras favorece su crecimiento.37
Estudios epidemiológicos han asociado el estatus de VD con el riesgo y grado de mortalidad de varios tipos de cánceres38 y se ha demostrado una asociación entre bajos niveles de 25(OH)-D sérico y un aumento en el riesgo de cáncer de colon,39 mama40 y próstata.41
Según LeFevre, aún no se cuenta con evidencia o pruebas suficientes de que la suplementación con vitamina D prevenga la incidencia de cáncer o las fracturas en adultos que viven en comunidad.32
El estudio realizado por Manson y otros también ratifica que la suplementación con VD no da lugar a una menor incidencia de cáncer invasivo, comparados con la administración de placebo.33
Sistema immune
Desde la década de los ochenta del pasado siglo, se conoce que la VD3 tiene un papel relevante en la modulación de la respuesta inmune, contribuyendo a la autotolerancia y mejorando la respuesta inmune innata contra microorganismos.2,42
Al encontrarse el VDR presente en varias células del sistema inmune, la unión de la 1,25(OH) vitamina D3 al receptor induce: mejoría de la fagocitosis, disminución de la expresión del complejo principal de histocompatibilidad clase II DR en las células dendríticas; disminución de la expresión y respuesta a moléculas coestimuladoras que regulan su maduración y migración, bloqueando su diferenciación final; inducción a la madurez de la célula natural killer (NK) y de células TCD4+CD25+Foxp3+ (célula T reguladora) capaces de mediar la tolerancia inmune y, por consecuencia, disminuye el desarrollo de trastornos autoinmunes; disminución de la diferenciación y proliferación de linfocitos B a células plasmáticas y apoptosis de las mismas.43
Respecto a su acción sobre las citocinas inflamatorias, disminuye la producción de las tipo proinflamatorias: IL-17A, IL-17F, IL-22, IL-23, IL-12, IL-2, IL-6, TNFα y de interferón ɤ (IFN ɤ); al mismo tiempo que incrementa la producción de las citocinas antiinflamatorias: IL-10 y factor de crecimiento transformante beta (TGFβ).44
Por otro lado, el calcitriol estimula la diferenciación y activación de macrófagos y promueve su acción antimicrobiana, la quimiotaxis y la fagocitosis y estimula la producción local de defensinas, proteínas clave en las defensas antimicrobianas, como se ha documentado en numerosas enfermedades infecciosas, particularmente la tuberculosis.44,45
Se ha propuesto que la VD, al ser un secoesteroide, puede disminuir la respuesta inmunológica de forma similar a los esteroides. Estudios clínicos, epidemiológicos y experimentales muestran su papel potencial en el desarrollo y perpetuidad de diversas enfermedades autoinmunes, como lupus eritematoso sistémico, diabetes mellitus tipo1 (DM1), esclerosis múltiple, artritis reumatoide y enfermedades autoinmune del tiroides.46,47,48
En cuanto a la relación de la deficiencia de la VD en la autoinmunidad de los islotes pancreáticos y la progresión de la enfermedad en la diabetes autoinmune, Infante y otros comentaron que en ratones NOD ha sido demostrado que la deficiencia de vitamina D en etapas tempranas de la vida conduce a una alta incidencia y aparición temprana de la diabetes.49
En varios estudios observacionales en humanos se muestra que individuos con diagnóstico reciente y establecido de DM1 exhibieron bajos niveles de 25(OH)-D de forma significativa comparado con controles sanos.50,51,52) Norris y otros53 demostraron que niveles más altos de 25(OH)-D en suero estaban asociados con más bajo riesgo de autoinmunidad de islotes en niños con riesgo genético incrementado para DM1. Por el contrario, Cadario y otros54 no encontraron asociación entre niveles de 25(OH)-D al nacimiento y riesgo de desarrollo de DM1 hasta los 10 años de edad.
Con respecto a los trastornos tiroideos autoinmunes, algunos estudios han mostrado que un bajo nivel de VD puede aumentar el riesgo de enfermedad de Graves (EG), así como de tiroiditis de Hashimoto (TH).46,47 Sin embargo, en humanos sanos, solo pocos datos ambiguos están disponibles sobre los efectos de los niveles de la vitamina D en la función tiroidea.55
Modelos animales que usan ratones previamente sensibilizados con tiroglobulina porcina mostraron que dosis subóptimas de VD disminuyen efectivamente la gravedad de la inflamación de la tiroides, en comparación con los ratones de control.56
En animales modelos de EG, en que los ratones fueron inmunizados con adenovirus, que codifica la subunidad α del receptor de tirotropina, la deficiencia de VD se correlacionó con persistencia de hipertiroidismo, lo que sugiere que esta vitamina puede regular la función tiroidea.57
Varios estudios observacionales (retrospectivo y de casos y controles) en humanos han detectado menores niveles de 25(OH)-D en la población estudiada y, en consecuencia, una mayor prevalencia de deficiencia de 25(OH)-D en enfermedades tiroideas autoinmunes, en comparación con los controles.58,59
La evidencia de una correlación negativa con el volumen tiroideo, duración y gravedad del hipotiroidismo, con los niveles de anticuerpos, apoyan la hipótesis que la deficiencia de la vitamina podría desempeñar un papel en la patogénesis/progresión del hipotiroidismo.60 Como evidencia adicional, Khare y otros encontraron que los niveles en suero de 25(OH)-D fueron más bajos en pacientes con anticuerpos anti-TPO positivo que en controles.61
A pesar de los resultados preclínicos alentadores sobre los efectos de la suplementación con vitamina D, ensayos de intervención muestran resultados negativos.62 Serían necesarios ensayos clínicos aleatorizados para obtener suficiente evidencia sobre el tema.
Vitamina D y resistencia a la insulina
Existe evidencia que destaca el rol fundamental que desempeña la vitamina D en la secreción normal de insulina.63) La misma ha sido relacionada con la patogénesis de la resistencia a la insulina, ya que puede influir en la acción de esta, pues estimula la expresión de su receptor y mejora la respuesta del transportador de glucosa a la insulina.
Berridge64) y Rammos y otros65 han descrito que el déficit de VD influye en la resistencia a la insulina a través del aumento en la formación de especies reactivas de oxígeno (ERO), por incremento de los ácidos grasos libres y la acción en el sistema renina-angiotensina-aldosterona. Se plantea que la deficiencia de la hormona produce un incremento en la síntesis de renina-angiotensina II, lo que incrementa la producción de especies reactivas de oxígeno (ERO), que activan la NADPH oxidasa y las proteínas G de alto y bajo peso molecular, las que, a su vez, inhiben el receptor de insulina por la fosforilación del sustrato del VDR. Las ERO inhiben el inositol trifosfato cinasa y la cinasa de treonina, que interrumpen el trasporte de glucosa por el GLUT 4, esto genera resistencia periférica a la insulina.
La inflamación asociada con la obesidad también contribuye a la aparición de resistencia a la insulina. Gran parte de la inflamación es impulsada por los macrófagos, en la que citoquinas, como la IL6 y el TNFα (relacionadas anteriormente con enfermedades autoinmunes y enfermedad cardiovascular), desempeñan un papel importante en el desarrollo de resistencia a la insulina e inducen la apoptosis de las células β.64,66 Esta inflamación sistémica asociada con la diabetes tipo 2 (DM2), mediada por citoquinas, puede ser modulada por los efectos de la vitamina D. El secuestro de VD postulado en el exceso de tejido adiposo reduce su biodisponibilidad,67,68 por lo que la deficiencia de la vitamina contribuye, tanto a la resistencia inicial a la insulina, como a la aparición posterior de diabetes causada por la muerte de las células β.68
Acosta y otros69 encontraron una correlación inversa significativa (p = 0,039) entre los niveles de vitamina D y la circunferencia de la cintura (CC) aumentada en mujeres (a niveles más bajos de vitamina D, mayor CC) y asociación significativa entre los niveles de glucemia y vitamina D. Estos resultaron coinciden con los mostrados en un estudio realizado en Corea, donde describieron que niveles más elevados de VD en suero se asociaron con un menor riesgo de diabetes en adultos coreanos, lo que sugiere el papel de la VD en la patogénesis de la diabetes.70 Sin embargo, otros estudios no establecen claramente esta relación.71,72
En cuanto a la suplementación de vitamina D para la prevención de DM2, en el estudio Women’s Health Initiative (WHI)73 y en el análisis secundario del estudio RECORD74 no se observó efecto en la incidencia de diabetes con suplementos de la hormona. Por lo tanto, se necesitan más estudios para determinar una relación entre ambas condiciones y evaluar la suplementación de vitamina D sobre la incidencia de la enfermedad.
Conclusiones
Desde el punto de vista fisiológico existe evidencia del efecto extraóseo de la hormona vitamina D y de la influencia biológica desfavorable cuando presenta bajos niveles. A pesar de que no existe suficiente evidencia relativa al efecto beneficioso de la suplementación con esta hormona, se plantea la necesidad de recomendar un aporte cotidiano que supla los requerimientos necesarios según la edad y el sexo.














