Introducción
El páncreas ectópico es la segunda anomalía congénita pancreática más frecuente después del páncreas divisum. Fue descrito por primera vez en 1729 por Schultz y se define como la presencia de tejido pancreático que carece de comunicación anatómica o vascular con el cuerpo principal del páncreas. La localización más frecuente es en el estómago (25 - 38 %), seguido de duodeno, yeyuno e íleon. El 40 % de los casos son sintomáticos y es más frecuente su presentación en varones en torno a la 5ª y 6ª década de la vida.1,2
La incidencia estimada oscila entre 0,5 % y 13,7 %.3 Existen varias teorías sobre su posible origen embriológico, pero la más aceptada es la alteración en la migración celular durante el desarrollo de las vesículas embrionarias que se encuentran en íntimo contacto con la parte distal del estómago y duodeno.4
La mayoría de los casos son asintomáticos. Sin embargo, este tejido puede sufrir los mismos procesos que una glándula pancreática nativa. Los síntomas más frecuentes son epigastralgia, dispepsia, sensación de plenitud y pirosis. La hemorragia, inflamación aguda, crónica y formación de pseudoquistes es poco frecuente y el índice de malignización del 1,8 %.5
La mayoría de los carcinomas que se originan en el páncreas ectópico son adenocarcinomas o carcinomas anaplásicos. Otros casos descritos son neoplasias mucinosa papilar intraductal, cistoadenocarcinomas o insulinomas. En estos casos, el hallazgo radiológico no es específico y el diagnóstico definitivo se obtiene tras la cirugía. En algunos casos está descrito como una hipoglucemia, sin necesidad de que se trate de un insulinoma.6
El diagnóstico de páncreas ectópico es difícil por radiología, por lo que su confirmación se realiza por el estudio histológico una vez realizada la cirugía o el estudio endoscópico. Por lo anteriormente expuesto, los autores se propusieron presentar un caso de páncreas ectópico diagnosticado a través de un estudio histológico tras realizada la cirugía.
Presentación del caso
Mujer de 39 años, remitida a consulta de Endocrinología por cuadro clínico compatible con hipoglucemia. Como antecedentes personales había sido intervenida de carcinoma de cérvix unos años antes y no presentaba ninguna otra enfermedad ni antecedentes familiares de interés. En la anamnesis realizada, refería episodios tras las comidas que consistían en sensación de dolor y distensión abdominal, acompañados de temblor, sudoración y cefalea, con mejoría tras la ingesta de hidratos de carbono de absorción rápida. En uno de esos episodios (1 hora tras la ingesta de un bocadillo de jamón), se le realizó por parte del servicio de urgencias glucemia capilar con un resultado de 48 mg/dL (2,66 mmol/L). En la exploración física presentaba un peso de 65 kg y una talla de 1,63 cm. Ausencia de dolor abdominal a la palpación, sin masas ni megalias.
Se solicitó analítica inicial, sin datos de insuficiencia suprarrenal (cortisol basal 5,80 μg/dL (6,2 - 19,4), cortisol 30 minutos tras estimulación con ACTH (hormona adrenocorticotropa), 18,40 μg/dL y cortisol 60 minutos tras ACTH 22,70 μg/dL. Los niveles de insulina y péptido C estaban dentro de la normalidad para el valor de glucemia en ese momento: glucemia; 87 mg/dL (74 - 106), péptido C; 1,5 ng/mL (1,1 -4,4), μg/dL. Otros resultados fueron: insulina; 5,58 mU/L (3 - 25), hemoglobina glucosilada; A1c 5,5 % (4 - 5,6), glucemia media estimada; 111,15 mg/dL, índice de resistencia a la insulina (HOMA-RI); 1,20 (1 - 3,8) y función de células beta (HOMA-B); 83,70 (85 - 115). Se realizó test de ayuno durante 72 horas y se descartó hiperinsulinismo endógeno (insulina <3 microU/mL), péptido C <0,2 nmol/L) con incremento de glucemia inferior a 25 mg/dL (1,2 mmol/L) tras 1mg de glucagón.
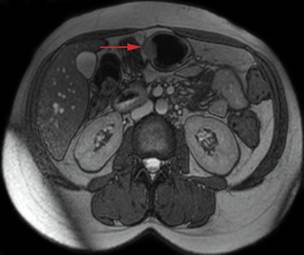
En la resonancia nuclear magnética (RNM) se objetivó una lesión de 17 mm, hipervascularizada, aparentemente submucosa en la curvatura mayor del cuerpo-antro gástrico, sugerente de tumor del estroma gastrointestinal o GIST (Fig. 1). Dado el contexto clínico de la paciente, se indicó una ecoendoscopia para descartar insulinoma extrapancreático.
En la ecoendoscopia, se observó en cuerpo bajo-antro gástrico hacia curvatura mayor, una lesión subepitelial, hipoecogénica, hipervascularizada, bien delimitada de 18 mm en su eje mayor. Se realizó la punción aspiración con aguja fina (PAAF), con un diagnóstico de hallazgos sugestivos de neoplasia neuroendocrina e inmunohistoquímica positiva para sinaptofisina. La inmuhistoquímica para insulina no fue valorable por escasez de material.
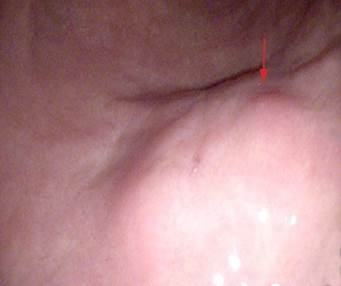
Se repitió la endoscopia que mostró una lesión submucosa gástrica (Fig. 2) y se tomaron muestras para Anatomía Patológica. El resultado anatomopatológico fue un acúmulo submucoso y otro a nivel de la mucosa, de tejido pancreático heterotópico/ectópico, constituido de forma predominante por nódulos de páncreas exocrino con formación de acinos y estructuras ductales. A nivel microscópico se identificaron varios grupos de células de morfología plasmocitoide, con empalizadas nucleares y formación de rosetas sin atipia citológica marcada.
Debido a los síntomas de la paciente, a pesar de las medidas dietéticas, se decidió por la cirugía mediante gastrectomía parcial. Procedimiento que transcurrió sin complicaciones. La anatomía patológica mostró una lesión nodular tumoral benigna (2,5 cm), constituida por tejido pancreático heterotópico, con presencia de páncreas exocrino con acinos. Páncreas endocrino con presencia de islotes de Langerhans y componente epitelial con ductos. Afectación desde la submucosa hasta la subserosa, con una pared muscular propia con hiperplasia muscular en relación a la heterotopía pancreática. La mucosa gástrica mostraba inflamación crónica leve con escasos folículos linfoides.
Tras la cirugía la paciente se encuentra clínicamente asintomática y no ha vuelto a presentar ningún episodio similar a los previos, por lo que la causa más probable de su hipoglucemia tras la ingesta de comida podría deberse a la liberación precoz de insulina de su páncreas ectópico en estómago.
Desarrollo
Como se citó anteriormente, el páncreas ectópico es una entidad clínica poco frecuente, cuya localización más habitual suele ser la capa submucosa en el caso del estómago, aunque en otras ocasiones puede asentar en la muscular (17 %), o en la serosa (10 %).1) En el caso de esta paciente, la lesión afectaba a todas las capas del estómago. Aunque la mayoría de los casos suelen ser asintomáticos, el tejido puede sufrir los mismos procesos que una glándula pancreática nativa.
La clasificación más aceptada según la histología, es la de Heinrich, modificada por Gaspar y Fuentes y se divide en cuatro subtipos:7
Tipo I: Presencia de todos los elementos de una glándula pancreática normal (acinos, ductos e islotes). Es el más frecuente y coincide con el tipo que presenta este caso clínico.
Tipo II: Sólo presenta ductos pancreáticos.
Tipo III: Sólo presenta tejido acinar.
Tipo IV: solo islotes (páncreas endocrino).
El diagnóstico diferencial se plantea con otras lesiones de localización submucosa como los GIST, pero también linfomas, tumores carcinoides o incluso tumor gástrico.8
No existe consenso con respecto a indicaciones en el manejo de lesiones pequeñas y asintomáticas, por lo que se recomienda individualizar cada caso teniendo en cuenta el tamaño, la localización y el tipo histológico. Por debajo de 2 cm se puede realizar abordaje y extirpación por vía endoscópica (riesgo de sangrado, perforación e infección). No debe realizarse este tipo de intervención cuando está afectada la capa muscular como es el caso de esta paciente.9,10
En pacientes sintomáticos o con lesiones mayores de 3 cm se recomienda cirugía con extirpación de la lesión.11
Conclusiones
La presencia de páncreas ectópico es una entidad poco frecuente, pero a tener en cuenta en pacientes con clínica de hipoglucemia, una vez descartadas otras causas. No existe consenso con respecto a indicaciones en el manejo de lesiones pequeñas y asintomáticas, por lo que se recomienda individualizar cada caso teniendo en cuenta el tamaño, la localización y el tipo histológico.